2022 Volume 71 Issue J-STAGE-1 Pages 145-174
2022 Volume 71 Issue J-STAGE-1 Pages 145-174
泌尿器は,体内を循環してきた血液を濾過し,不要な老廃物を尿として身体から除去するための経路であり,腎臓,尿管,膀胱および尿道をいう。下部の泌尿器の解剖学的構造(大きさと位置)は,女性と男性で異なっている。腎臓の疾患では,糸球体腎炎,腎硬化症,ネフローゼ症候群,腎盂腎炎,腎癌などの他に,糖尿病や膠原病などのように全身性疾患の症状として病態を示すことがある。尿路系では,膀胱炎,前立腺炎などの炎症性疾患の他,悪性腫瘍が見られるが,組織型では尿路上皮癌が多い。尿路上皮細胞は炎症を起因とする化生や反応性の核腫大が生じる。腫瘍性病変では内腔側に突出する乳頭状発育や基底膜を超えた浸潤性増殖を示す。
Organs of the urinary system include the kidneys, urinary tract, urinary bladder, and urethra. Urinary organs filter blood that circulates throughout the body and serve as the pathway for metabolic wastes to be removed from the body through urination. The anatomical structures (size and position) of the organs in the lower part of the urinary system differ between men and women. Renal diseases include glomerular nephritis, nephrosclerosis, nephrotic syndrome, pyelonephritis, and renal cancer. Some renal diseases have symptoms of systemic diseases, such as diabetes and collagen disease. Diseases of the urinary tract include inflammatory diseases, such as cystitis and prostatitis, and malignant tumor. The number of cases of urinary tract epithelial tumor is high in terms of the tissue type of cancer. The urinary tract epithelial cells undergo metamorphosis resulting from inflammation and reactive swelling of the nucleus. Tumor lesions exhibit adluminal papillary growth and infiltrative growth piercing a basal lamina.
膀胱は左右腎臓よりそれぞれの尿管を通り蠕動運動によって運ばれてきた尿をため,これを排泄する嚢で,大きさ・形は蓄える尿量によって変化する。膀胱は,骨盤内において上方は腹膜で覆われ,前方で恥骨結合と接し,男性では後方にて直腸,下方にて前立腺と,女性では後方にて子宮と接する。
2) 肉眼的所見膀胱は,膀胱頸部,三角部,後壁,左右側壁,頂部,前壁に部位を分ける。膀胱頂部では胎生期の尿膜管の遺残が臍に向かって伸び肉眼で線状に観察される。三角部では左右尿管がそれぞれ開口し,膀胱頸部側で内尿道口が開口し,この3点を結ぶ位置を膀胱三角といい,癌の好発部位として知られる。膀胱粘膜面は肉眼的に多数の不規則な粘膜ヒダを備えるが,膀胱三角では平坦でヒダを欠いている。
3) 組織学的所見組織構造は尿管同様に粘膜層(尿路上皮),粘膜固有層,筋層,漿膜から構成される(Figure 8.1)。

粘膜層(尿路上皮),粘膜固有層,筋層,漿膜から構成される。
粘膜層は尿路上皮細胞で,基底膜に足場を接した形で垂直方向に極性を持って細胞が折り重なる。最表層の細胞は,被蓋細胞Deckzellenと呼ばれ,タイトジャンクションで閉ざされ,扁平に広がる豊富な細胞質がエオジンに好染する(Figure 8.2)。基底膜に向かって細長い突起を伸ばし,細胞骨格のサイトケラチン(CK)はCK20とCK18が発現する。核は濃縮状から膨化した類円形と多彩なものの,核細胞質比(N/C比)は低い。被蓋細胞の下は,4~5層の中間型細胞とそれに続く1層の基底細胞で構成される。中間型細胞の核は類円形核で,正常でも核小体やコーヒー豆様の核溝を持つことが多い。免疫染色は,CK18が陽性を示す。基底膜に近くなるに従い小型で淡明な細胞質となり,電子顕微鏡ではトノフィラメントが観察され,デスモゾームの結合が見られる。基底細胞の免疫染色はCK5/6, 14, 17が陽性を示す。粘膜固有層は,膠原線維に弾性線維をまじえ,毛細血管が発達する。筋層は主に平滑筋で,尿管より厚く発達し内縦,中輪,外縦の3層であるが互いに移行しあう構造である1)。
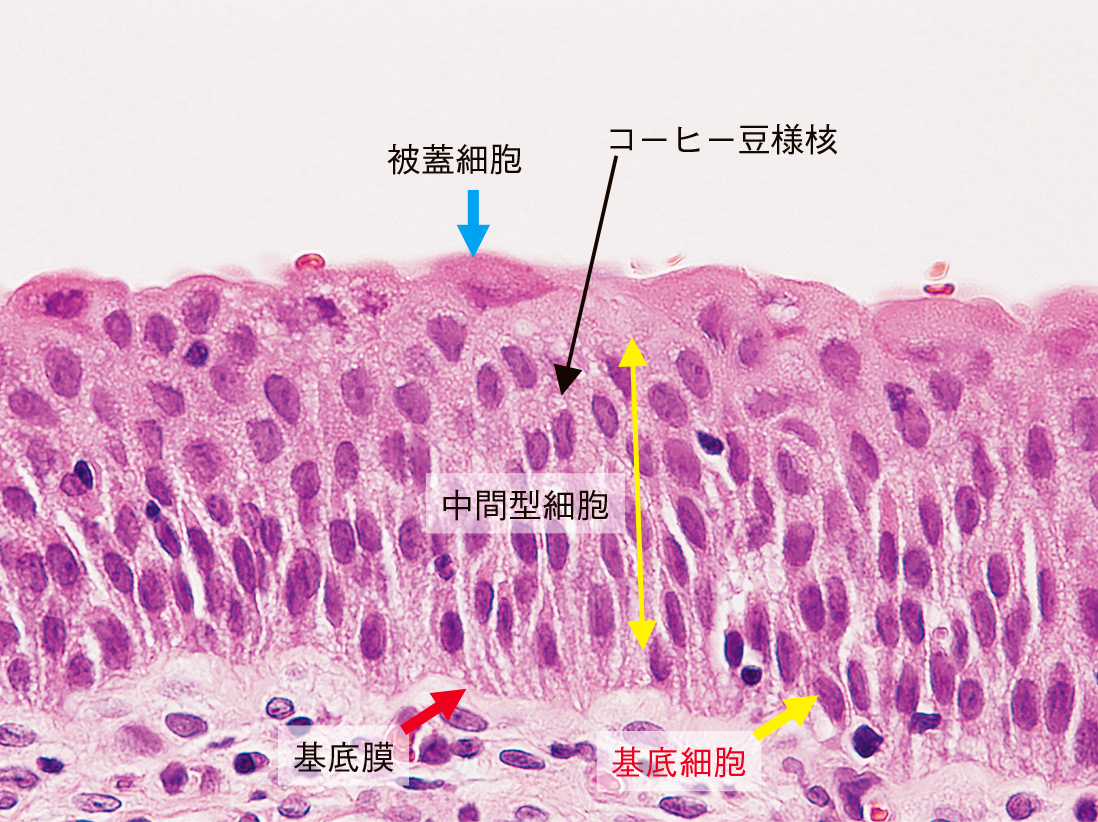
尿路上皮は上から被蓋細胞,中間型細胞,基底細胞で構成され,すべて基底膜に足場を形成している。
膀胱の内尿道口に始まり,男性の尿道は15~20 cmの長さで壁内部,前立腺部,膜性部(カウパー腺開口),海綿体部に分けられる。女性の尿道は約4 cmの長さで,膣の前方を下走し,膣前庭部に外尿道口に至る。
2) 肉眼的所見粘膜は縦走するヒダを持ち,男性では前立腺部までがヒダを持つ。
3) 組織学的所見男性の粘膜上皮は,前立腺部で丈の低い尿路上皮(Figure 8.3),膜性部から海綿体部までは多列円柱上皮,尿道舟状窩から外尿道口で重層扁平上皮になる。女性では,大部分が重層扁平上皮で多列円柱上皮が混在する2)。

尿道内腔を覆う粘膜層は丈の低い尿路上皮細胞
腎盂を経て集まる尿成分を膀胱へと運ぶための管状の器官を尿管と呼ぶ。
2) 肉眼的所見尿管は,径5~7 mm,長さ約30 cmの細長い管で(Figure 8.4),膀胱底の壁後方より膀胱内に開口する。筋層が発達しており蠕動運動によって少量ずつの尿がしごきだされる。
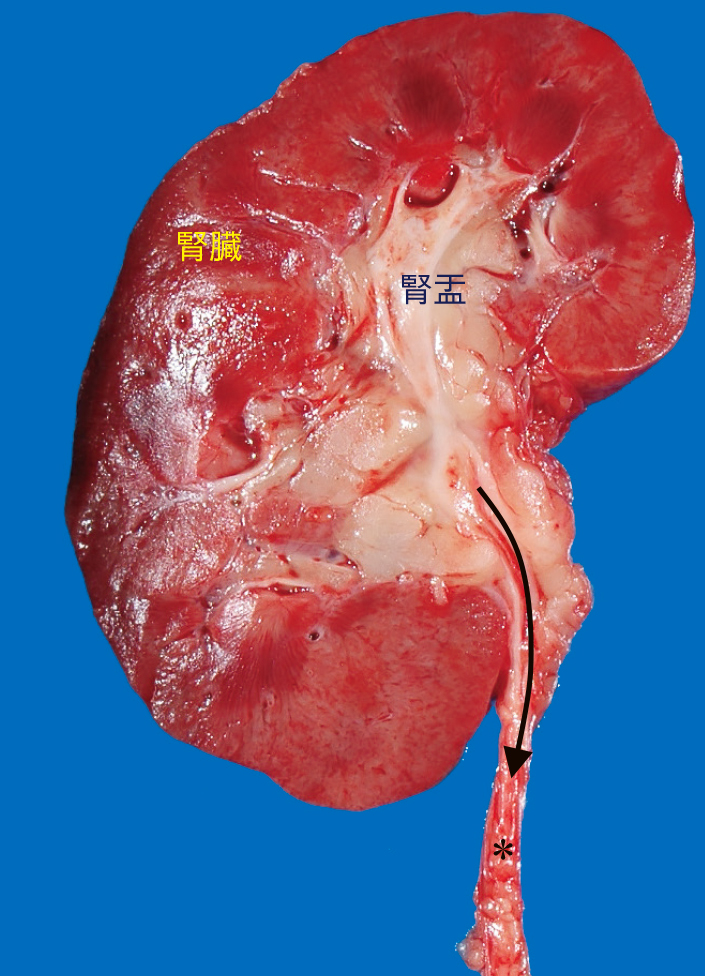
割面の肉眼像 尿の流れる方向を矢印で示す。
尿管横断面の弱拡大像をFigure 8.5に示す。尿管とその周囲組織は組織学的に,粘膜層,粘膜固有層,筋層,外膜から構成される。内腔側の粘膜層は,周囲に発達する筋層によって蛇行するヒダ状隆起を示し,ヒトデ状に見える。粘膜層の直下には基底膜があり,粘膜固有層が続く。粘膜固有層は層状に緩く配列する太い膠原線維に弾性線維をまじえた疎性結合組織よりなり,血管や神経,リンパ管が通る。その外側に平滑筋線維からなる筋層がある。筋層は,尿管の上部から中部では内縦,外輪の2層,下部で内従,中輪,外従の3層となるが,区別は難しい。筋層の外側は,疎性結合組織と脂肪に覆われ,周囲組織とつながっている3)。

尿管(*)ならび発達した筋層
腎盂から尿管,膀胱,尿道前立腺部までの内腔は,尿路上皮細胞が覆っている(Figure 8.6)。

尿管内腔を覆う粘膜層は尿路上皮細胞からなる。
尿管・膀胱・尿道の内腔粘膜は,尿路上皮細胞で構成される部分が多く,尿路上皮細胞の腫瘍性病変が主体となる。尿はpH 5~8と弱酸性で,外界に開口するため細菌の侵入も容易に起こるため,上皮細胞の変性や変化が起こりやすい。肉眼的血尿に至らず病変の進行が起こることもある。組織検体として提出されるものには,手術摘出材料や生検に加え,経尿道的膀胱腫瘍切除材料(trans-urethral resection of the bladder tumor; TUR-Bt)がある。広範囲な尿路に対する簡便な腫瘍の検索手段として細胞診は有効である。
2) 肉眼的所見非病変部の肉眼的所見は,尿を運ぶための管部では平坦で光沢があり,尿を蓄える膀胱ではシワ状で光沢は目立たず,粗造に見えることがある。腫瘍病変では,隆起の状態から乳頭型(有茎性と広基性),結節型(有茎性と広基性),平坦型および潰瘍型に分類されている(Figure 8.7, 8.8)。


膀胱内に発生した乳頭型(広基性)腫瘍が観察される。
腫瘍の組織構築と細胞の性状から以下の様に分類4)される。
① 非浸潤性平坦状尿路上皮腫瘍(non-invasive flat urothelial tumors) i 尿路上皮異形成(urothelial dysplasia)尿路上皮粘膜内で被蓋細胞を伴い平坦な増殖を示す尿路上皮細胞は,核の類円形化,核腫大,クロマチン増量,核縁の緊満感,細胞配列および極性の乱れなどの所見において,軽度から中等度の異型を示す(Figure 8.9)。

核腫大と核類縁型化,配列の乱れは軽度な異型細胞。核分裂像も見られる。
尿路上皮粘膜内に限局して,配列や極性の乱れを伴う異型細胞が,平坦な増殖を示す。クロマチン増量した類円形核や核腫大など高度な異型を伴う(Figure 8.10)。

クロマチン増量した類円型核を有する細胞が,極性の乱れを伴い密に増殖する。
他臓器の上皮内癌と異なり,表層細胞を伴う腫瘍細胞が完全に粘膜上皮を置換しない症例も適応される。
② 非浸潤性乳頭状尿路上皮腫瘍(non-invasive papillary urothelial tumors) i 尿路上皮乳頭腫(urothelial papilloma)異型を伴わないか極めて乏しい尿路上皮細胞が,細い血管結合組織を軸に外方向性乳頭状発育を示す良性の腫瘍性病変である。乳頭状構造の分枝や融合は稀であり,単発性で病巣は小さい。被蓋細胞を伴い,上皮の重層化も乏しい(Figure 8.11)。

極性の保たれた細胞が血管(⇩)を軸に乳頭状隆起する。
腫瘍を覆う表層の上皮は正常もしくは菲薄化した尿路上皮であるため,隆起性病変ではあるが肉眼的に表面は平滑で結節状。正常尿路上皮の直下に異型の乏しい尿路上皮が内反性に増殖した腫瘍で,膀胱三角部に好発する。腫瘍胞巣の中心部では腫瘍細胞はやや紡錘形,辺縁部では核が柵状配列を示す。核異型は軽度で分裂像がしばしば認められる(Figure 8.12)。

正常尿路上皮の直下に異型の乏しい尿路上皮が内反性に増殖する。
乳頭腫に類似するが,乳頭状構造は分枝や融合を示すことが少なくない。軽度の細胞異型や構造異型を伴う尿路上皮細胞が,血管結合織を伴って乳頭状に増殖する非浸潤性の悪性腫瘍である。卵円形核を有する腫瘍細胞は核クロマチン増量などの細胞異型を示し,細胞層密度の上昇や極性の乱れなどの様々な構造異型が観察され,高頻度に被蓋細胞が認められる(Figure 8.13)。

左側では血管を伴う融合状の乳頭状隆起が観察される。
低異型度非浸潤性乳頭状尿路上皮癌との違いは,細胞異型と構造異型が高度な点である。核の大型化,大小不同や極性の乱れが目立ち,上皮層の不均一性も増す。異型度の判定は,最も異型の強い病変で行う(Figure 8.14)。

核の大型化,大小不同や極性の乱れが目立つ。
腫瘍細胞が基底膜を超えて間質に浸潤する悪性尿路上皮腫瘍で,粘膜固有層以下に腫瘍細胞の浸潤像が観察される乳頭状尿路上皮癌や尿路上皮内癌の全てが含まれるが,浸潤の判定は難しい(Figure 8.15, 8.16)。癌取扱い規約では,間質組織反応の有無,腫瘍周囲の裂隙形成,間質浸潤した腫瘍細胞の胞体が豊富になり染色性が増すことや,孤在性の腫瘍細胞の存在を確認する必要があると記載されている。

核異型を伴う極性の乱れた腫瘍細胞が間質に浸潤する。

尿路上皮癌細胞が間質ならびに筋層内へ胞巣状に浸潤する。
背景に上皮内癌が混在する場合には,必ずその存在を付記する。扁平上皮細胞,腺上皮細胞や栄養膜細胞への分化を伴う特殊型も同様である(Figure 8.17)。

腫瘍細胞の一部に扁平上皮化生様の所見が見られる。
癌取扱い規約では,腫瘍の組織構築と細胞の性状から,尿路上皮系腫瘍以外に発生する腫瘍の組織分類が記載されている。例えば,扁平上皮系腫瘍(扁平上皮乳頭腫,扁平上皮癌,疣贅癌),腺系腫瘍(腺腫,腺癌(Figure 8.18)),尿膜管に由来する腫瘍(尿膜管癌,その他),神経内分泌腫瘍(傍神経節腫,カルチノイド,小細胞癌,その他),未分化癌,色素性腫瘍(母斑,悪性黒色腫),間葉系腫瘍,リンパ造血器系腫瘍など多彩である。

粘液産生を伴う腫瘍細胞が乳頭状に発育する。
成人の腎臓は,長さ約10 cm,幅約5 cm,重さ約100 gのソラマメ形の器官で,第12胸椎(T12)~第3腰椎(L3)の高さに左右一対(2個)存在する。右腎は肝臓右葉直下にあるため,左腎より2~3 cm低い位置となっており,腹膜後隙に存在する後腹膜臓器で,線維被膜と,腎臓および副腎を取り囲む脂肪被膜,Gerota筋膜に覆われている。Figure 8.19は剖検時の腹部臓器を一塊に取り出したものを背部からみたもので,矢印の部に厚い脂肪に覆われた腎臓の一部が見られる。通常Rokitansky法(ロキタンスキー法)で腹部臓器を一塊にして取り出し,まず腎上部にある左右の副腎を取り出した後,周囲の脂肪ごと左右の腎臓を取り出している。副腎は通常腎には接して存在していないことが多く,慣れないと見失ってしまうためである。周囲の脂肪組織を取り除き,大きさ・形・色を確認し,被膜の剥離を確認した後,重量測定,表面,および割面の写真撮影を行う。Figure 8.20は摘出された腎臓の全体像とその割面の記録である。施設によって様々ではあるが,右腎に割を入れて左右を区別したり,切り出し時には右を四角に,左を三角に切り出すことで各々を区別している施設もある(右という漢字は四角を含むため)。

解剖で取り出された腹部臓器を背面から観察したもの。腎臓は厚い脂肪組織に覆われている。LK:左腎臓 RK:右腎臓
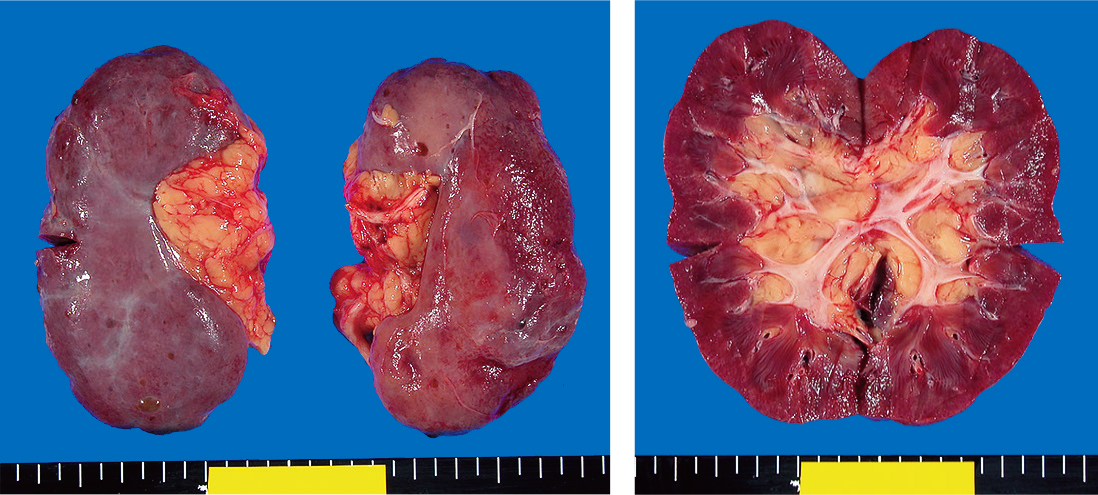
正常腎マクロ像とその割面を示す。表面は平滑で,割面像では皮質と髄質が明瞭に区別できる。
腎臓における尿生成の機能単位はネフロンと呼ばれ,糸球体とボウマン嚢,およびそこで作られる原尿の成分を調節する尿細管からなる。ネフロンは一つの腎臓で約100万個存在し,再吸収と分泌のための血液供給を行う皮質ネフロンと,髄質近くに存在し,濃縮尿生成のための機能を担う傍髄質ネフロンがある(Figure 8.21)。ネフロンの数は胎生約36週で完成し,その後は増加しないといわれている。またその数は出生体重に相関しており,低出生体重児ではネフロン数が少なく,この場合は糸球体の肥大を伴うことが多い。尿細管は近位尿細管,ヘンレ係蹄,遠位尿細管,集合管からなり,水分やナトリウム,グルコース,アミノ酸,ビタミンなど体に必要な成分のほとんどは近位尿細管で再吸収され,逆に尿酸,アンモニア等を分泌する。遠位尿細管と集合管ではホルモンの働きによって尿の組成が調整されている。

ボウマン嚢,尿細管,集合管からなるネフロンは皮質に存在している。
腎小体はボウマン嚢と糸球体からなる。血液は毛細血管が糸玉状の構造をとった糸球体の輸入細動脈から流入し,輸出細動脈から流出する間に濾過され,ボウマン嚢内に一日に約180 L原尿として放出される。ボウマン嚢は尿細管に連続しており,放出された原尿は尿細管によっておよそ1/100程度まで再吸収される(Figure 8.22)。

糸球体は毛細血管の塊で,内皮細胞,基底膜,上皮細胞,血管間質(メサンギウム領域)からなる。
JGAは緻密斑(macula densa; MD),傍糸球体細胞(juxtaglomerular cell; JG細胞),血管平滑筋細胞,糸球体外メサンギウム細胞からなり,糸球体濾過量や血圧の調整に関わっている。MDは遠位尿細管の一部で糸球体係蹄の輸入,輸出細動脈の接触部位にあり塩化ナトリウムNaCl(特にCl)の濃度を感知している。JG細胞は輸入細動脈の壁に存在する顆粒を持った細胞で,血圧低下による動脈壁の伸展性の低下を感知し,レニンの合成,分泌を行い,血圧をコントロールしている。この細胞の顆粒はperiodic acid methenamine silver染色(PAM染色)にて確認できる。血管平滑筋細胞は輸入,輸出細動脈の壁に存在し,収縮・弛緩することで血管抵抗を変化させている。糸球体外メサンギウム細胞はMDからのシグナルを中継している(Figure 8.22)。
4) 糸球体(Figure 8.23)
基底膜やメサンギウムに沈着物はなく,基底膜の厚みも正常範囲である。
糸球体は毛細血管の間を埋めるメサンギウム基質とメサンギウム細胞,基底膜,内皮細胞,上皮細胞(足細胞podocyte)からなり,血液の濾過を行っている。内皮細胞は70~100 nmの多数の孔が開いておりこれより大きな物質(血球など)は通さない(サイズバリア)。また細胞表面は陰性荷電のため陰性荷電物質を通しにくい(チャージバリア)。基底膜は糸球体における透過性を左右する最も重要な構造で,3~4 nmの小孔が開いており,小分子のみを通過させる。また内皮細胞同様陰性荷電のため陰性荷電物質を通しにくい。上皮細胞は足突起を伸ばし毛細血管を隈なく覆っている。足突起間は濾過スリットと呼ばれる20~40 nmの隙間が空いている。このように糸球体基底膜での濾過作用はサイズバリアとチャージバリアがバランスよく作用して選択的な濾過が行われている。上皮細胞の融合や基底膜に沈着物が見られると上皮細胞や基底膜のサイズバリアやチャージバリアが正常に機能せず,多量のタンパク質が漏れ出し,タンパク尿の原因となる。また毛細血管の破綻やメサンギウム領域の拡大や沈着物は血尿の原因となることが知られている。
3. 腎臓の組織学的検査6)腎臓は解剖や手術の他に背部からの超音波を用いた腎生検が一般的である。腎生検のアプローチは呼吸による腎の動きを超音波で確認しながら通常は左腎下極の組織を採取することが多い。採取される組織片は長さ15 mm程度,幅1 mm弱の糸状のもので,観察の中心となる糸球体は皮質にのみ見られることから必ず皮質の方向を確認して検体のサンプリングを行う。大きな出血がなければ通常3~4本の組織が採取されるが,症例によっては多数の糸球体観察のため,開腹生検が行われることもある。採取された腎組織は光学顕微鏡,蛍光抗体法,電子顕微鏡用にそれぞれに切り分けるが,その方向や量などに経験が必要となる。固定時のアーチファクトを最小限におさえるために鋭利なカミソリ刃を用いて素早く細切し,すみやかに固定液に浸ける。ピンセットも先のとがったものを使用し,物理的な圧力がかからないよう注意が必要である。
光学顕微鏡ではヘマトキシリン・エオジン(Hematoxylin-Eosin; HE)染色の他に過ヨウ素酸シッフ(Periodic acid-Schiff reaction; PAS)染色,過ヨウ素酸メセナミン銀・HE(periodic acid-methenamine silver-HE; PAM-HE)重染色,エラスチカ・マッソン(Elastica Masson; E-Masson)重染色が行われ(Figure 8.24),必要に応じてアミロイド染色なども追加される。基底膜の変化を見るにはPAS染色やPAM-HE重染色が優れており,これらの染色では2 μm程度の極力薄い切片が必要で,3 μmを超える厚めの切片では基底膜の正しい評価ができない(Figure 8.25)。

基底膜がPASでは赤く,PAM-HEでは黒く染色されている。E-Massonでは糸球体沈着物や線維化をはじめ,血管の弾性繊維の変化を見ることができる。
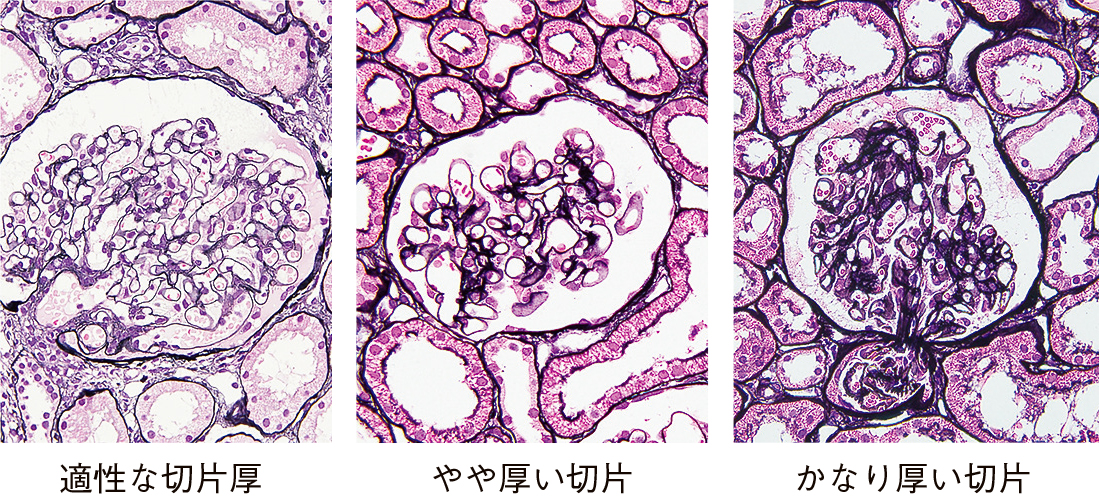
左から約2 μm,3 μm,4 μmの切片厚。切片が厚くなると基底膜の正確な状態が観察できない。
蛍光抗体法は凍結包埋された腎組織をクリオスタットで4 μm程度に薄切し,FITC標識された抗IgG,IgA,IgM,C3,C4,C1q,Fibrinogen抗体をはじめκ,λやIV型コラーゲン,IgGのサブタイプなどの抗体を用いて免疫染色するもので,各種抗原の沈着を比較的早期の段階で見つけることができる。
電子顕微鏡は腎生検で採取された組織の一部をグルタールアルデヒドで直ちに固定する。その後オスミウム酸でさらに2重固定し,洗浄後,樹脂包埋する。硬化したブロックをウルトラミクロトームにセットし,ダイヤモンドナイフを用いて厚さ900 Å(オングストローム)程度の連続切片を作製する。これを銅製のグリッドにすくいとり,酢酸ウランと鉛による電子染色の後,電子顕微鏡にて観察する。倍率を1,000倍から30,000倍程度に拡大することで,基底膜や上皮細胞,内皮細胞,メサンギウム領域などの光学顕微鏡では観察できない微細な変化や,微小な沈着物を見つけることができる。電子顕微鏡検査は標本作成過程においてアーチファクトを最小限に抑えることが重要で,検体採取後は直ちに細切し,すばやく浸漬固定することや,グルタールアルデヒドやオスミウム酸による固定操作はいずれも4℃に保つことなどが重要となる。
腎生検の診断においては,特に早期の病変では電子顕微鏡や蛍光抗体法を用いなければその所見をとらえることができないことも多く,光学顕微鏡,電子顕微鏡,蛍光抗体法の3種類の検査法が必須となる(Figure 8.26)。

早期の膜性腎症を蛍光抗体法,電子顕微鏡で見たもの。光学顕微鏡では沈着物が観察できなかった症例だが,蛍光抗体法や電子顕微鏡では明らかな沈着物を証明できた。
慢性腎炎等の症状が進むと腎機能は次第に低下し,腎臓自体の萎縮と,表面に凹凸が見られるようになる(Figure 8.27)。

両腎ともサイズは委縮し,表面には小さな嚢胞や細かな凹凸を認める。右図はその組織像で,硝子化した糸球体を多数認めた。
糸球体腎炎の場合,様々な原因から糸球体の毛細血管が荒廃,破綻し,周囲組織の炎症と線維化が広がり,その後,糸球体は硝子化していく。糸球体は再生しないためこれを繰り返して次第に腎機能は低下し腎は萎縮していく。さらに腎機能低下が進行すると皮質は菲薄化し,尿細管が変性して多数の嚢胞を形成し,後天性多発嚢胞腎となるが,その約5.8%に腎細胞癌の発生が見られるという報告があり,注意が必要である7)。
またアミロイドの沈着が見られることがあるが,透析腎に沈着するアミロイド物質はβ2-ミクログロブリンであることが多く,アミロイドAAやALなどとは異なる。
2) 組織学的所見糸球体は硝子化し,周囲の炎症細胞浸潤と線維化が目立つ。尿細管の萎縮も高度で基底膜の肥厚も著しい。
3) 透析腎の肉眼的所見皮質は菲薄化し,多数の嚢胞が見られる透析腎の割面像で,一部に充実部が見られた。その部の組織学的検索では淡明細胞型腎細胞癌であった(Figure 8.28)。

多数の嚢胞を主体とする透析腎に見られた充実性腫瘍(赤丸部)。組織型は淡明細胞型腎細胞癌であった。
水腎症は尿管結石や腫瘍により尿管が閉塞し,尿が腎内に滞留することによって起きる。尿路が閉塞すると最初に腎盂は拡張し,腎内動脈の攣縮,虚血性尿細管障害,間質の線維化が起こり1週間以内に開放されないと次第に腎不全に進行する8)。通常は片側のみに見られるため,もう片方の代償性作用により発見が遅れることが多い。
2) 肉眼的所見切開前は滞留した尿により腫大していたが割面には充実部はなく,皮質も菲薄化して腎不全状態であることがわかる(Figure 8.29)。

尿管癌による尿管閉塞によってできた水腎症。皮質は膜様で皮質が見られず,腎機能はほぼ消失している。
以前は家族性良性血尿と呼ばれていた疾患で,反復性の血尿を繰り返しても腎機能が低下することは稀な疾患として知られている。多くはIV型コラーゲンのα3鎖とα4鎖の異常によって起こり,常染色体優性遺伝の形式をとる。診断は電子顕微鏡検索によって菲薄化した基底膜が診断の決め手となる。通常は積極的な治療は行わない。
2) 組織学的所見光学顕微鏡では微小糸球体病変を示し,やや基底膜が菲薄なイメージだが,診断には電子顕微鏡所見が決め手となる。糸球体基底膜の厚さは正常では約300 nmであるが,本症ではどの部位をみても100~200 nmと菲薄であるのが特徴である(Figure 8.30)9)。

基底膜の厚みが通常の半分程度しかない。
腎アミロイドーシスは全身アミロイドーシスの部分症として腎臓の小血管にアミロイドが沈着し,血流障害から腎障害きたすものをいう。アミロイド線維はコンゴー赤染色,direct fast scalet 4BS(DFS)染色などで橙赤色に染色されるが,さらにこれを偏光顕微鏡下,または簡易偏向フィルターを用いて観察し,緑色偏光を確認することが必須となっている。全身性のアミロイドーシスにはALアミロイドーシス,AAアミロイドーシス,透析アミロイドーシス,老人性全身性アミロイドーシス,家族性アミロイドポリニューロパチーなどがあり,限局性のアミロイドーシスには脳アミロイドーシスなどがある10)。電子顕微鏡では分岐のない直径7~10 nmの特徴的なアミロイド線維が確認される。
2) 組織学的所見HE染色では糸球体,および周囲の血管に赤く染まる構造物を認める。DFS染色では同部位が橙赤色に染色され,アミロイドの沈着であることを示している(Figure 8.31)。

糸球体,周囲小血管に沈着したアミロイドを認める。HE染色ではエオジンに濃染する構造物質を認めるが,DFS染色では同部位が橙赤色に染まる。
同部位を偏光顕微鏡で観察すると,緑色の偏光が観察できる。電子顕微鏡では錯綜する特徴的なアミロイド線維が多数見られる(Figure 8.32)。

(左)糸球体,周囲小血管に沈着したアミロイドが緑色の偏光として確認できる。(右)錯綜するアミロイド線維が電子顕微鏡で多数確認できる。
間質の浮腫と炎症細胞の浸潤により腎機能障害が見られる。原因は多岐にわたり,多くの場合免疫学的機序が関与している。頻度としては薬剤アレルギーや感染症に対する免疫応答が原因となるものが多い。その他尿細管基底膜に対する抗体の産生や,免疫複合体の沈着が原因となることもある。臨床症状に乏しく,腎機能低下を機に発見されることが多い。急性期は間質の炎症が主体で,慢性化すると線維化が主体となる11)。
2) 組織学的所見間質の浮腫や炎症細胞浸潤,線維化が見られる。糸球体周囲にも炎症細胞が浸潤し,やや虚血に陥っている。尿細管上皮細胞の萎縮も見られる(Figure 8.33)。

間質の炎症細胞浸潤と尿細管の萎縮が見られる。
サルコイドーシスは全身性の疾患で,腎にも稀に見られる。肺などに見られるのと同様に,壊死を伴わない肉芽腫の形成と周囲の多核巨細胞が特徴的である。腎病変の合併率は5~20%で,以下の4群に分けられる。1群はサルコイドーシス性肉芽腫の形成によりカルシウム代謝異常が起こり腎石灰化症を招く。2群は著明な肉芽腫形成を認め,尿細管を破壊する。3群は糸球体腎炎を合併し,4群は動脈周囲リンパ管性に肉芽腫形成を伴う血管障害が主体である12)。
2) 組織学的所見壊死を伴わない肉芽腫と巨細胞が見られる。周囲には炎症細胞の浸潤と線維化も見られる(Figure 8.34)。

壊死を伴わない肉芽腫と多核巨細胞が見られる。
悪性高血圧とは拡張期血圧の著しい上昇と,腎機能障害が急速進行する病態で,放置すると脳,心臓などに臓器障害をきたす予後不良の疾患である。悪性腎硬化症は悪性高血圧によって生じる腎障害のことで,おもに小~細動脈と糸球体が障害される。30~40代の男性に見られ,60歳以上の発症は稀である。慢性的な高度の高血圧と急激に進行する腎機能障害が特徴的である13)。
2) 組織学的所見間質の炎症細胞の浸潤と線維化を認める。小動脈はOnion skin lesion,中動脈は内皮障害による狭小化,細動脈では硝子化が見られる。糸球体は虚血に陥り,毛細血管腔は狭小化している(Figure 8.35)。

中膜平滑筋細胞が内膜内で増殖して同心円状に配列したOnion-skin-lesion の所見。
腎細胞癌は,腎実質由来の上皮性腫瘍で,多くは発生起源を腎皮質近位尿細管とされている。2011年発行の腎細胞癌取扱い規約第4版14)における組織型分類と第5版をTable 8.1に示す。腎盂・尿管・膀胱発生の腫瘍は取扱い規約が異なる。本書では,そのうちの代表的な腫瘍について紹介する。
| 腎実質の上皮性腫瘍 |
|---|
| 1.腎細胞癌 |
| 1.1 淡明細胞型腎細胞癌(Clear cell renal cell carcinoma) |
| 1.2 乳頭状腎細胞癌(Papillary renal cell carcinoma) |
| 1.3 嫌色素性腎細胞癌(Chromophobe renal cell carcinoma) |
| 1.4 淡明細胞乳頭状腎細胞癌(Clear cell papillary renal cell carcinoma) |
| 1.5 Mitファミリー転座型腎細胞癌(MiT family translocation renal cell carcinoma) |
| 1.6 後天性嚢胞腎症随伴性腎細胞癌(Acquired cystic disease-associated renal cell carcinoma) |
| 1.7 集合管癌(Bellini管癌)(Carcinoma of the collecting ducts of Bellini) |
| 1.8 粘液管状紡錘細胞癌(Mucinous tubular and spindle cell carcinoma) |
| 1.9 多房嚢胞性腎細胞癌(Multilocular cystic renal neoplasm with low malignant potential) |
| 1.10 管状嚢胞状腎細胞癌(Tubulocystic renal cell carcinoma) |
| 1.11 遺伝性平滑筋腫症腎細胞癌症候群随伴性腎細胞癌(Hereditary leiomyomatosis and renal cell carcinoma-associated renal cell carcinoma) |
| 1.12 コハク酸脱水素酵素欠損腎細胞癌(Succinate dehydrogenase-deficient renal cell carcinoma) |
| 1.13 腎髄質癌(Renal medullary carcinoma) |
| 1.14 腎細胞癌,分類不能型(Renal cell carcinoma, unclassified) |
| 2 その他の腎腫瘍 |
| 2.1 乳頭状腺腫(Papillary adenoma) |
| 2.2 オンコサイトーマ(Oncocytoma) |
| 2.3 血管筋脂肪腫(Angiomyolipoma)類上皮性血管筋脂肪腫(Epithelioid angiomyolipoma) |
| 2.4 後腎性腺腫(Metanephric adenoma) |
| 2.5 傍糸球体細胞腫(Juxtaglomerular cell tumor) |
| 腎実質の上皮性腫瘍 |
|---|
| 悪性 |
| 1.淡明細胞型腎細胞癌(Clear cell renal cell carcinoma) |
| 2.多房嚢胞性腎細胞癌(Multilocular clear cell renal cell carcinoma) |
| 3.乳頭状腎細胞癌(Papillary renal cell carcinoma) |
| 4.嫌色素性腎細胞癌(Chromophobe renal cell carcinoma) |
| 5.集合管癌(Bellini管癌)(Carcinoma of the collecting ducts of Bellini) |
| 6.腎髄質癌(Renal medullary carcinoma) |
| 7.Xp11.2転座型腎細胞癌(Renal carcinoma associated with Xp11.2 translocations/TFE3 gene† fusions) |
| 8.神経芽腫随伴腎細胞癌(Renal cell carcinoma associated with neuroblastoma) |
| 9.粘液管状紡錘細胞癌(Mucinous tubular and spindle cell carcinoma) |
| 10.腎細胞癌,分類不能型(Renal cell carcinoma, unclassified) |
| 良性 |
| 1.乳頭状腺腫(Papillary adenoma) |
| 2.オンコサイトーマ(Oncocytoma) |
| 付記 |
| 1.透析関連腎腫瘍(Dialysis-related renal tumors) |
| 2.後腎性腺腫(Metanephric adenoma) |
| 3.紡錘細胞型腎細胞癌(Spindle cell renal cell carcinoma) |
†: TFE3 gene: Transcription Factor E3 gene
腎疾患に伴う腎糸球体機能低下を反映する臨床検査値は,血小板,総蛋白,A/G比の低値,血清中の尿素窒素,クレアチニン値の上昇とクレアチニンクリアランス,推算糸球体濾過量(eGFR)の低下があり,また,尿検査では血尿や尿沈渣像での異型細胞成分の出現がある。いずれも癌に限らず発熱や加齢による現象でも見られ特異的ではない。
腎細胞癌において,肉眼的血尿は病状が進行した状態を反映するものが多く,顕微鏡的血尿での細胞診検査によって発見されることもある。多くは,無症候性状態で経過し,血尿の精査で施行する超音波やCTで発見されることが多い。腎臓の超音波検査画像は,楕円形の低エコー域として腎実質が描出され,その中心部で腎盂,腎杯,腎洞,血管などが複合的に高エコー域を示す。嚢胞病変は辺縁不正や円形な低エコー域となり,腫瘍では不均一で多彩なエコーレベルとなることが多い15~17)。
2) 肉眼的所見腎細胞癌の多くは腎皮質の腎被膜下に発生し,外側へ半球状に膨張隆起する腫瘍である。腎細胞癌取扱い規約第4版では,肉眼的発育様式は膨張型と浸潤型に分類される。膨張型は癌と非癌部の境界が明瞭に分かれ,圧排増殖した腫瘍細胞の消失と残存線維による偽被膜形成がある(Figure 8.36左)。浸潤型は,癌部と非癌部の間に偽被膜がなく境界不明瞭となる(Figure 8.36右)。腫瘍の大きいものでは出血壊死傾向も強く,石灰化を伴うこともある14,16,17)。

左:左腎上極に発生した,膨張型腎腫瘍。正常腎と境界明瞭な黄色調腫瘍が外側に膨張性に発育する。
右:右腎中極に発生した,浸潤型腎腫瘍。正常腎と境界不明瞭な淡褐色調腫瘍が内側に浸潤性に発育する。
腫瘍部の割面は黄色調が最も多いが,淡褐色,灰白色,赤褐色調の出血・壊死部や白色から淡黄色調の硝子化・線維化部を伴う。また,光沢を有する嚢胞形成が単から多房性に見られることもあり,多彩な像が混在することが特徴で,この多彩性が超音波やCTなどの画像診断における腎細胞癌の推定根拠とされている。
3) 組織学的所見14~17)腎実質の悪性腫瘍すなわち腎細胞癌は,細胞型より10型に分類される(Table 8.1)。最も優勢な組織型で分類し,混在する組織型は付記される。以下に症例を含めいくつかを提示する。
① 淡明細胞型腎細胞癌(clear cell renal cell carcinoma; ccRCC) i 概要腎細胞癌の約80%に発生する組織型で60代以降の男性に多い。遺伝子座3pに位置するVon Hippel-Lindau病(VHL)遺伝子の欠失異常を伴うことが多く,VHL遺伝子不活化により低酸素誘導因子(hypoxia-inducible factor)の発現が誘導され,そのため血管内皮増殖因子vascular endothelial growth factor; VEGF,glucose transportor-1(GLUT1),carbonic anhydrase 9(CA9)の発現が亢進している。
ii 肉眼的所見肉眼的所見は腎実質に位置する境界明瞭な腫瘍で,偽被膜により被包されるが,浸潤性発育を示す腫瘍では境界は不明瞭化する。割面は明るい黄色調が多く,暗赤色状の出血巣や淡褐色状の壊死部,硬化による白色調の部位を伴う。
iii 組織学的所見組織学的所見は淡明細胞を主体とする腫瘍細胞で構成され(Figure 8.37),淡明な胞体はSudan IV陽性の豊富な脂質とperiodic acid-Schiff:PASに陽性を示すグリコーゲン(Figure 8.38)を含み,細胞内小器官が乏しく,エオジンに染色されないために淡明な所見として観察される。細胞境界も明瞭であり,腫瘍細胞が毛細血管性の細い間質に取り囲まれて,大小の胞巣状の細胞構造を示す症例が多い(Figure 8.39)。

淡明な細胞質と異型の乏しい核を有する腫瘍細胞が胞巣状に増殖する。

腫瘍細胞の胞体に含まれるグリコーゲンは,PAS染色により暗赤色の顆粒状に陽性を示す。

核小体と核異型を伴う腫瘍細胞の胞巣状増殖が見られる。間質は毛細血管からなる。
組織学的所見は胞巣状構造の他,索状(Figure 8.40),腺管状(Figure 8.41),嚢胞状(Figure 8.42)あるいは充実性と様々な形態が見られるが,血管性の間質が腫瘍細胞を取り囲む点は共通している。

淡明な細胞質の腫瘍細胞が索状配列を示し増殖する。

淡明な細胞質の腫瘍細胞が腺管構造(★)を中心に配列する。

淡明な細胞質の腫瘍細胞が嚢胞状を示しエオジン好染する滲出物を含む。
腫瘍細胞の核は小型で,核小体の目立たない症例から核小体や核異型を伴う症例がある。
基本的に腫瘍細胞は基底膜上に一層から多層に配列する。多層化した上皮の一部で低乳頭状を示す場合があるが,中心部に血管は介在しない点で後述の乳頭状腎細胞癌とは異なる。腫瘍壊死部では,融解壊死に伴う脂肪を胞体内に持つ組織球が見られることがある(Figure 8.43)。

腫瘍壊死部では泡沫状細胞質を持つ組織球が観察される。
組織発生が近位尿細管上皮由来であることから,免疫染色は,CA9, CD10, CD15, CK19, AE1/AE3, CAM5.2, vimentin, N-cadherin, renal cell carcinoma marker(RCC-Ma)の各抗体が陽性となる。遠位尿細管由来のCK7, E-cadherinの反応性は低い。
② 乳頭状腎細胞癌(papillary renal cell carcinoma; pRCC) i 概要腎細胞癌の10%程度に発生する。責任遺伝子はmesenchymal-epithelial transition(MET)遺伝子,Fumarate hydratase(FH)遺伝子で,家族性腫瘍性症候群に見られることが多い。好発年齢は60代である。
ii 肉眼的所見肉眼的所見は境界明瞭な腫瘤を形成し,偽被膜を形成することもある。腫瘍の割面は灰色,黄色,黄褐色,茶褐色と多彩で,出血や壊死,嚢胞形成を伴うことがある。Figure 8.44では左腎臓下極から上極にかけて広がる灰白色調の結合の緩い粗造な割面を示す腫瘍が観察される。

結合の緩い粗造な灰白色調の腫瘍が膨張性に発育する。
組織学的所見の特徴は,毛細血管を軸に円柱状ないし立方状腫瘍細胞が乳頭状発育を示し,腫瘍細胞の異型と細胞質の性状から2つのTypeに分ける。
Type 1の腫瘍細胞は小型で核の重層化は稀で核異型に乏しい,単層な丈の低い細胞が毛細血管を軸に乳頭状構造を示す。細胞質は好塩基性を示し,血管周囲の間質内に泡沫状組織球浸潤(➡)や出血を伴う(Figure 8.45)。腫瘍細胞の胞体内にヘモジデリン顆粒,硝子化や砂粒体を伴うことがある。予後は良好とされる。

弱拡大では,毛細血管を軸に丈の低い腫瘍細胞の乳頭状増殖が観察される。強拡大で腫瘍細胞の核は小型で均一,異型が乏しい。間質には泡沫状組織球浸潤が観察される。
Type 2の腫瘍細胞は円柱状,大型で核異型は高度,偽重層が見られ乳頭状構造を示し,細胞質は好酸性である(Figure 8.46)。
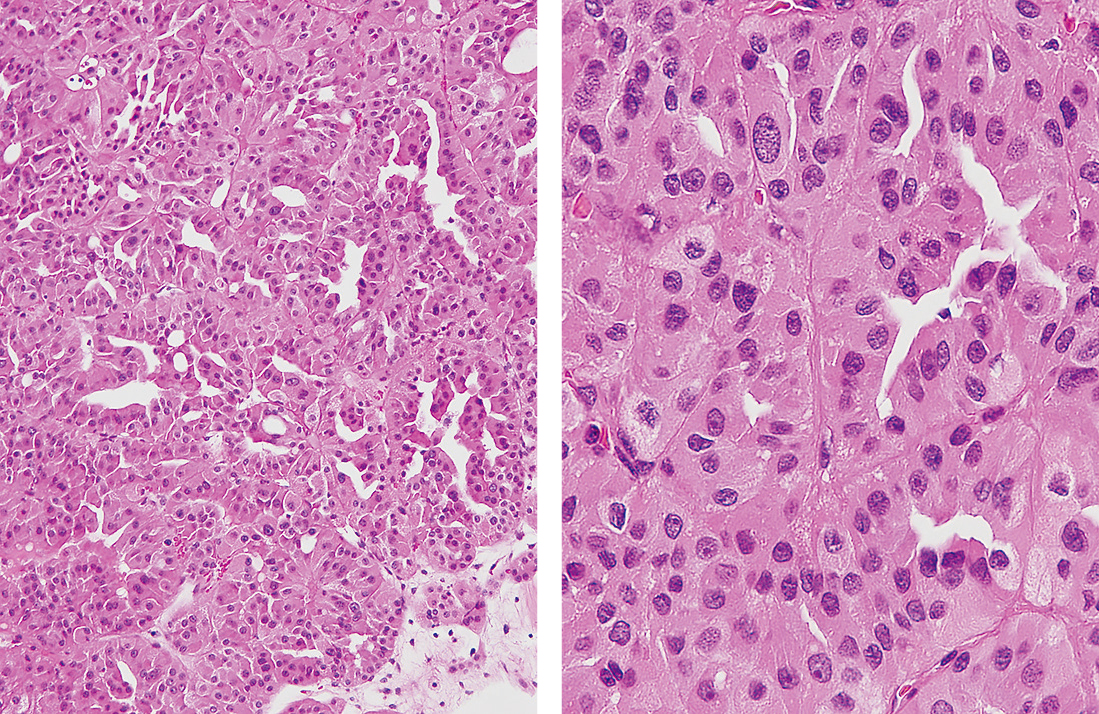
弱拡大では,腫瘍細胞が密に乳頭状に増殖する。強拡大では,核の大小不同や核異型が目立ち,好酸性の細胞質が観察される。
免疫染色では,α-methylacyl CoA racemase(AMACR; P504S),CK7(Type 1優位),CD10(Figure 8.47),EMA,RCC-Ma抗体が陽性を示す。

HE染色で観察される丈の低い乳頭状の腫瘍細胞は,CD10免疫染色で細胞質に陽性(褐色)が観察される。
鑑別の点で集合管癌はCD10陰性,後腎性腺腫はCytokeratin陰性でWilms’ tumor 1(WT-1)とCD57が陽性となる。
乳頭状腎細胞癌Type 1,2や嫌色素性腎細胞癌では,CA9が陰性で前者はCD10陽性,後者はCD10陰性となる。
③ 嫌色素性腎細胞癌(chromophobe renal cell carcinoma; chRCC) i 概要集合管を発生母地とする比較的若年者に多い腫瘍で,腎細胞癌の5%程度を占める。染色体1, 2, 6, 10, 13, 17, 21番に欠失変異が認められる。
ii 肉眼的所見肉眼的に充実性均一で境界明瞭な腫瘤であることが多く,割面では黄褐色調(tan-color)あるいはベージュ色を示す(Figure 8.48)。

腫瘍細胞の割面は,黄褐色調(tan-color)で境界明瞭。
組織学的所見は,細胞境界明瞭で混濁した細胞質を有する大型な細胞が充実性に敷石状ないし管状に増殖する(Figure 8.49)。本腫瘍はeosinophilic variantと,typical variantに大別され,前者は好酸性顆粒状細胞質を有するエオジンに良く染まる小型の細胞(eosinophilic cell)を主体とする像で,後者は小型のeosinophilic cellと大型で微細網状の明るい細胞質を持つ細胞(Pale cell:Figure 8.50 ★)の2種類が混在する。核周囲明庭(perinuclear halo:Figure 8.50 ➡)を持つ小型の好酸性細胞が混在することもある。胞体内のグリコーゲンは少量であるが,大型の細網状細胞質を有する細胞は,コロイド鉄染色に強く陽性を示すことが特徴である。

細胞境界明瞭な腫瘍細胞が敷石状に配列する。
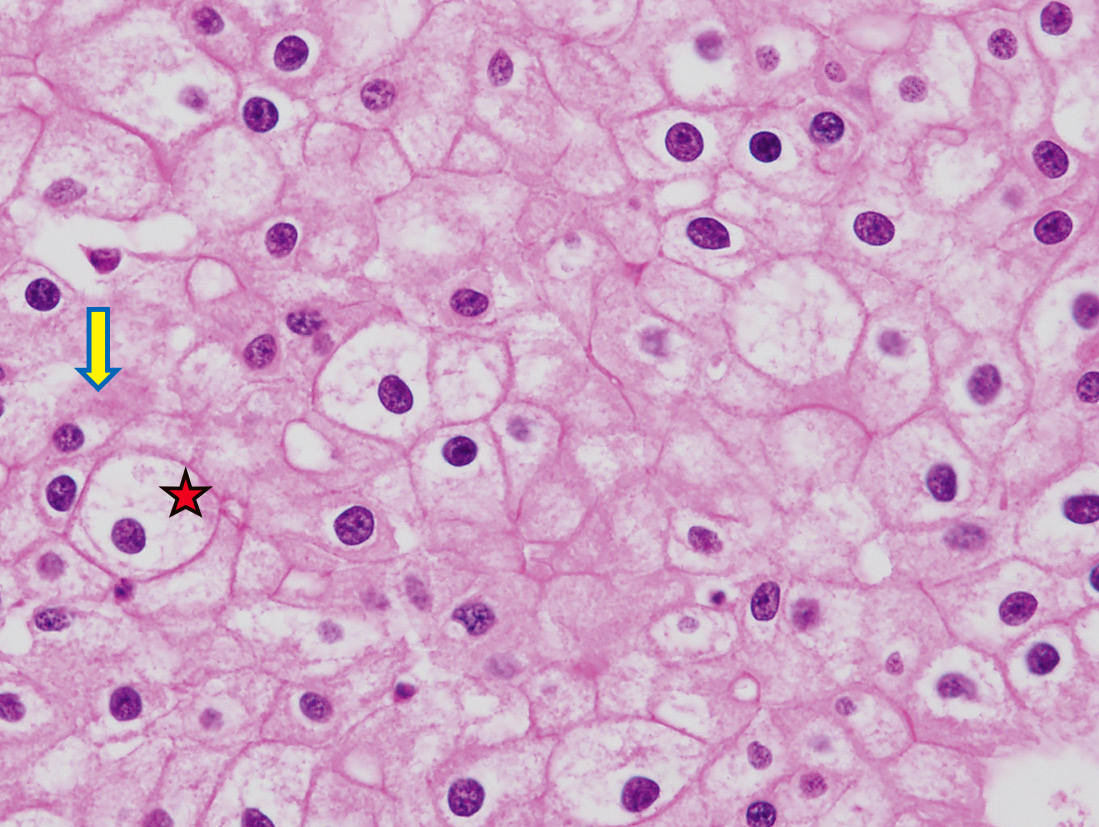
微細網状の明るい細胞質を持つ細胞(Pale cell:★)と核周囲明庭(Perinuclear halo:➡)を持つ小型の好酸性細胞が混在する。
免疫染色では,c-Kit(CD117)が高頻度に陽性を示す。KAI1(CD82),epithelial related antigen(MOC-31),AE1/AE3,CK7(Figure 8.51),EMA,E-cadherinなどにも陽性を示す。反対にCD10, Vimentin, RCC-Ma, CA9は陰性となる。

腫瘍細胞の細胞質に陽性(褐色)を示す。
腎細胞癌の1%以下の稀な高悪性度の腫瘍である。腎盂開口部に近い集合管(Bellini管)に類似した構造を呈する。
ii 肉眼的所見肉眼的に灰白色で髄質を中心に放射状に広がる境界不明瞭な浸潤性腫瘍で,腎臓の外形が保持される。写真に示す症例(Figure 8.52)は,60代男性の右腎臓に発生した境界不明瞭な腫瘍で,下極の一部を除く腎全体が灰白色調病変により浸潤性に占拠されている。

灰白色調で境界不明瞭な腫瘍が腎全体に浸潤性に広がる。
組織学的所見は多彩で異型の強い腫瘍細胞が管状発育を主体として,索状,乳頭状,充実性の増殖も認められる。間質線維増生を伴いながら浸潤性増殖を示す(Figure 8.53)。腫瘍細胞は高度の異型を伴う単層あるいは数層の好酸性細胞により蛇行した索状構造を示す(Figure 8.54)。

管状構造や索状配列を示す腫瘍細胞の間質浸潤増殖が見られる。

大型核と高度な核異型を伴う腫瘍細胞は,細胞境界が不明瞭で渦巻き状の索状配列を示す。
免疫染色は,Vimentin, CK7,E-cadherinに陽性で,AMACR, CD10, RCC-Maは陰性を示す。
写真に示す症例(Figure 8.52~8.55)は,自然尿の細胞診において,核腫大とクロマチン増量を伴う核形不整を示す,尿路上皮系由来と考えられる異型細胞が孤立散在性に認められ,悪性疑いと診断された(Figure 8.55)。

尿細胞診像は,大型で核腫大とクロマチン不均等分布を示す細胞が観察される。腫瘍近傍の集合管上皮では,核異型を伴う好酸性細胞が観察される。
本腫瘍は,近傍の集合管上皮に異型性が見られ,尿中にはその細胞が出現したと考えられる。
⑤ 粘液管状紡錘細胞癌(mucinous tubular and spindle cell carcinoma) i 概要粘液管状紡錘細胞癌は比較的稀な腫瘍で,中高年女性に多いとされる低悪性度の腫瘍である。
ii 肉眼的所見肉眼的に皮質を主体に境界明瞭な灰白色ないし淡褐色調を呈する。
iii 組織学的所見異型に乏しい腫瘍細胞が粘液状間質を伴い,管状および乳頭状に増殖し,紡錘形細胞が錯綜する部分が混在する。核異型度は低いものが多い。背景間質にはAlucian blue染色陽性の粘液が認められる。
写真に示す症例(Figure 8.56, 8.57)は,60代女性の左腎臓に発生した4 cm × 3 cm大の腫瘍で,検診の腹部エコーで指摘された。組織学的所見は,淡好酸性の細胞質を持つ小型立方状卵円形の腫瘍細胞が管状構造を形成しつつ増殖する。

弱拡大では,小型で均一な腫瘍細胞の管状構造が目立つ。

淡好酸性の細胞質を持つ小型立方状卵円形の腫瘍細胞が,管状構造を形成しつつ増殖する。
Table 8.1に示される悪性腫瘍の1から9に適合しない腫瘍となる。症例を1つ提示する。
ii 肉眼的所見70代女性の左腎臓下極に発生した8.4 cm × 6.3 cmの膨張型腫瘍性病変で,割面では淡黄褐色調と黒褐色調の腫瘤が観察される(Figure 8.58)。

中央の淡黄褐色調小結節状腫瘍に連続して黒褐色調の腫瘍が境界不明瞭に広がる。
組織学的所見は,核は類円形で均一な大きさで,淡好酸性の細胞質を有する腫瘍細胞が胞巣状に増生している(Figure 8.59)。細胞質が淡明な腫瘍細胞も混在し,核の大型化や奇異な形態の核も見られた。また,一部では腺管状構造も見られ,胞巣間は,浮腫性の間質が介在していた。

核は小型濃縮状で淡好酸性の細胞と核は類円形で核小体が目立つ顆粒状から淡明な細胞質を有する細胞が混在し胞巣状に増殖する。
腫瘍細胞の免疫染色所見は,Ber-EP4, c-Kit, Synaptophysinに陽性,Leu-M1(CD15),NCAMは弱陽性,CK7, CK20, RCC-Ma, Uroplakin III, Vimentin, S-100A, p63, CD10, Chromogranin-A, Somatostatin receptor 2(SSTR2)は陰性でMIB-1 Labeling Index(LI)は約5%であった。
2. その他の腎腫瘍規約第4版では腎実質に由来する腫瘍のうち良性のものは,以下の2型に分類されていた(Table 8.1)。
① 乳頭状腺腫(Papillary adenoma) i 概要癌取扱い規約によれば直径5 mm以下の小さな腫瘍と定義されている。手術や剖検によって偶発的に発見されることが多いとされる。
ii 肉眼的所見肉眼的に皮質直下に,境界明瞭な黄色ないし灰白色調の結節として見られる。
iii 組織学的所見一層の好塩基性ないし濃好酸性細胞に被包される乳頭状あるいは管状乳頭状発育を呈す。核異型や核小体は目立たない。浸潤,出血,壊死を伴わない。
写真の症例は60代男性の左腎上極に発生した腎細胞癌疑いで提出された標本で,肉眼上の結節病変は不明であった。腎組織は多嚢胞化を示し,組織学的所見は甲状腺類似の大小の嚢胞で,立方状の上皮が乳頭状に発育する病変が存在した(Figure 8.60, 8.61)。
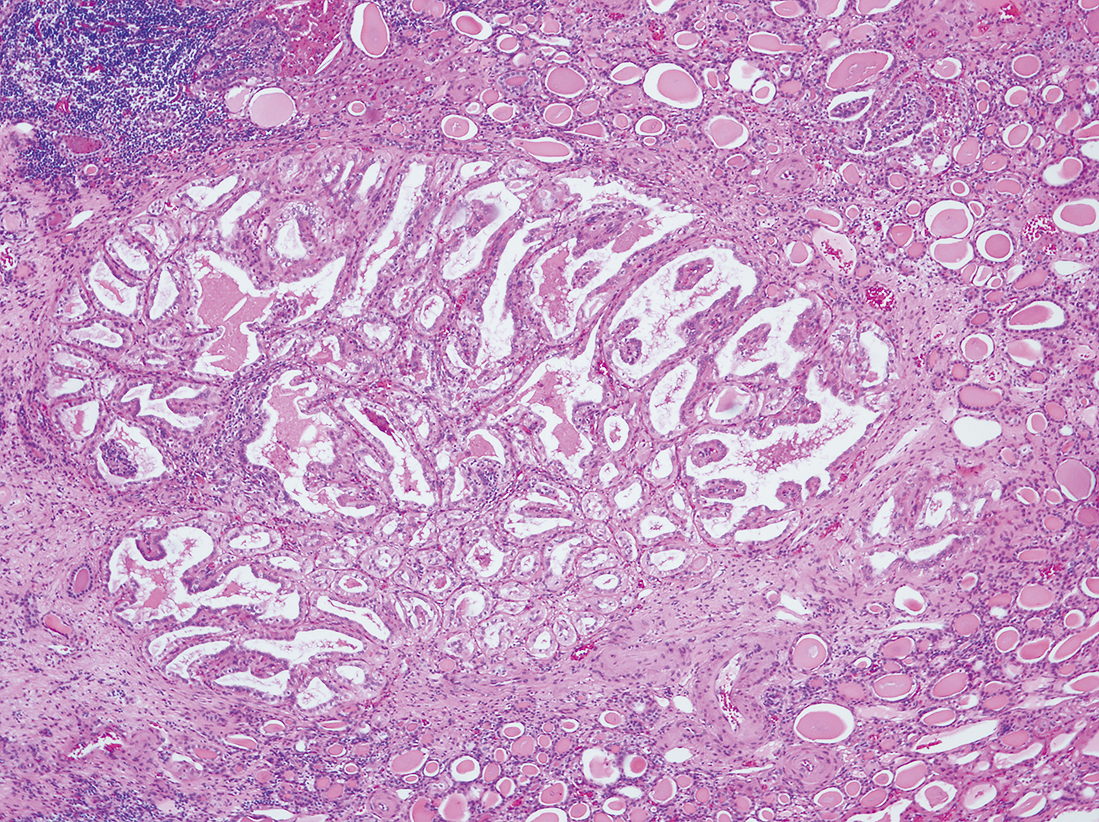
甲状腺類似の大小の嚢胞の中に,上皮が乳頭状の発育を示す病変が観察される。

乳頭状発育を示す病変の強拡大では,核異型の目立たない,一層の好塩基性ないし濃好酸性細胞に被包される乳頭状あるいは管状乳頭状発育が観察される。
オンコサイトーマ(好酸性腺腫)は良性腫瘍で,唾液腺,甲状腺,膵臓,腎臓に発生することが知られている。腎腫瘍病変の5%程度で若年者から高齢者まで見られ通常の腎細胞癌に比べ年齢分布は幅広く男性に多い。
ii 肉眼的所見割面は境界明瞭な球形で皮質,髄質いずれにも見られ,黄色から黄褐色で小さな出血巣を伴うが,通常の腎細胞癌に比べ頻度は少ない(Figure 8.62)。

1.5 cm × 0.8 cm大の黄褐色調を呈する腫瘍で境界は明瞭である。
組織学的に腫瘍細胞は類円形ないし多稜形で,充実胞巣状に増生し,腺腔形成や嚢胞を伴うこともある(Figure 8.63)。腫瘍細胞は,核は円形で中心性,N/C比は小さい。豊富なミトコンドリアを保有し,HE染色において好酸性(エオジン好性)顆粒状の所見として観察される(Figure 8.64)。胞体内に脂肪滴やグリコーゲン顆粒は見られない。

充実胞巣状に増生する好酸性の腫瘍細胞で,腺腔形成や嚢胞を伴う。

好酸性胞体を有する比較的均一な腫瘍細胞の充実性増殖が見られる。核は類円形で大小不同は目立たない。
免疫染色は,AE1/AE3,EMA,c-Kit(Figure 8.65),E-cadherin,Mitochondria antigen,S-100Aに陽性で,CK7, MOC-31, KAI1は陰性。

腫瘍細胞の膜と細胞質に褐色に陽性を示す。
写真に示す症例は,原発性アルドステロン症の60代の女性で,CTで発見された。標本は部分切除された右腎臓の一部に1.5 cm × 0.8 cmの黄褐色調の腫瘍が確認できる。組織学的所見は,好酸性胞体を有する比較的均一な腫瘍細胞の充実性増殖が見られる。核は類円形で大小不同は目立たない。免疫染色ではc-Kit, CD15,陽性。
3. 腎癌取り扱い規約第4版の付記にある腫瘍 ① 後天性嚢胞随伴腎細胞癌(acquired cystic disease-associated renal cell carcinoma; ACDK-RCC) i 概要長期の透析患者において多くは後天性に発生した嚢胞腎に発生する腫瘍。
ii 肉眼的所見割面では淡褐色から黄色調を示すが,多房性嚢胞を伴うことが多い。写真に示す症例では,腎全体に多房性嚢胞が占め,下極の腫瘤は肉眼上で判然としない(Figure 8.66)。

腎臓全体に壁の薄い嚢胞が多数観察される。腫瘤部を○で示す。
組織学的には,多彩な増殖形態を示し,いくつかの組織型が混在することがある。多くは,嚢胞内に好酸性細胞質を有する腫瘍細胞が乳頭状,充実性,微小嚢胞状構造を形成しながら増殖する。腫瘍間質内にはシュウ酸カルシウム結晶が見られることがある。
iv 免疫染色所見免疫染色ではRCC-Ma, CD10, AMACRが陽性,CK7は陰性である。
写真の症例は,60代男性で22年前より両側腎梗塞にて人工透析を行っていた。CTにて腎腫瘍を指摘され,左腎臓摘出された。割面は多嚢胞を伴い,下極に4 × 3 cm大の不明瞭な腫瘤を認めた(Figure 8.66)。組織学的所見は,弱拡大で大小の嚢胞が見られ,その内側に密に増殖する腫瘍細胞が見られる。また,間質には石灰化の所見も見られる(Figure 8.67)。腫瘍細胞は,索状から乳頭状に増殖を示し(Figure 8.68),顆粒形成が目立つ好酸性の細胞質で,核小体の目立つ小型円形の核を有する異型細胞(Figure 8.69)と一部に淡明細胞質も見られた。ACDKを背景としたclear cell papillary RCCと診断された。

大小の嚢胞の内側に密に増殖する腫瘍細胞が見られる。間質には石灰化を伴う。

嚢胞内に好酸性細胞質を有する腫瘍細胞が索状から乳頭状,充実性に増殖する。

腫瘍細胞は,好酸性顆粒を有する細胞質で,核小体が目立つ小型円形の核を有し,一部に淡明細胞質も見られた。
紡錘細胞の密な肉腫様増殖を示す腎細胞癌。
ii 肉眼的所見肉眼的所見は浸潤性発育を示し,灰白色で黄色調に乏しい。
iii 組織学的所見腫瘍細胞は細長く紡錘形で錯綜する索状配列を示す。多形性が強く高度な核異型や奇異な細胞を伴う。種々の組織型を伴うこともある。
写真の症例は右腎臓で,肉眼的に径約6 cm大の辺縁不整で境界不明瞭な黄白色調,軟~弾性硬の充実性病変が見られた(Figure 8.70)。組織学的に,紡錘形や多核を含む多形性を示す異型細胞が種々の程度に膠原線維の増生を伴い,びまん性~シート状に増殖を示す(Figure 8.71)。一部に淡明な胞体を有する異型細胞が小胞巣様~索状構造を示し,嚢胞内に出血や壊死物を認めた。

非腫瘍部との境界が不明瞭な黄白色調の充実性腫瘍が観察される。

濃縮核や多核を伴う紡錘形の異型細胞がびまん性~シート状に増殖を示す。
免疫染色では,CD10, Vimentin, Smooth muscle actin(SMA),p53に陽性,MIB-1のLIは40%,AE1/AE3, CAM5.2, MUC1, S-100Aにびまん性に弱陽性,EMA, RCC-Ma, Desmin陰性であった。
4. 腎細胞癌取扱い規約に含まれない腎発生腫瘍 ① 小児腎細胞癌 i 概要腎芽腫(Wilms’ tumor; WT)は腎に発生する腫瘍で5歳以下に多く,5%の例では両側の腎に発生し,稀に腎以外の部位にも発生する。5~10%の頻度で先天奇形を合併するWilms tumor-aniridia-genitourinary anomalies-mental retardation syndrome(WAGR症候群),Denys-Drash症候群がある。一方,腎芽腫は身体の過成長や肥大を伴う症候群とも関連があり,Beckwith-Wiedemann症候群,Perlman症候群などがある。発生学的には胎生5週頃に出現する中胚葉の後腎芽組織に由来する腫瘍である。WT1(11p13領域),WT2(11p15領域)の癌抑制遺伝子が原因遺伝子の一つと考えられており,腎芽腫の10%程度でWT-1遺伝子の異常が確認される。WT-1遺伝子は腎および泌尿生殖器の分化に関連し,転写調節因子として細胞増殖を制御している。Denys-Drash症候群ではWT-1遺伝子に変異があり,WAGR症候群ではWT-1遺伝子と近傍の無虹彩症原因遺伝子PAXの両者を含めた遺伝子座が欠失している。Beckwith-Wiedemann症候群では11番染色体短腕(11p15.5)に異常がある。
ii 肉眼的所見写真に示す症例(Figure 8.72~8.75)は,1歳の小児に発生した腫瘍である。肉眼的に灰白色~黄白色充実性の約10 cm × 5.5 cmの腫瘤と褐色充実性の腫瘤が混在する(Figure 8.72)。肉眼的所見は黄白色調から灰白色調で横紋筋線維などの間葉系成分が豊富な場合は灰白色で硬い。

黄白色から灰白色調で光沢のある充実性腫瘍が観察される。
腎芽腫は腎芽細胞の増殖が主であるが,未分化から管状構造を伴う上皮成分を主とする上皮型と筋組織,脂肪組織などの分化を伴う間葉型がある。
腫瘍組織は,myxomatousな間質組織の増生を伴い,腫瘍細胞が集簇巣を形成している(Figure 8.73)。肉眼所見で褐色充実性の領域は,極性の乱れた配列の腫瘍細胞で,細胞質に乏しい未熟なnephroblastoma成分で,massiveな変性・壊死が目立つ(Figure 8.74)。灰白色調領域では,異型の乏しい紡錘形細胞の増生からなる間葉系成分,myxoidな変化は目立つが,明瞭な軟骨・筋系分化はない。腺腔形成やロゼット様構造が見られた(Figure 8.75)。mixed typeのnephroblastomaと最終的に診断された。

Myxomatousな間質組織の増生を伴い,腫瘍細胞が集簇巣を形成している。

腫瘍細胞の集簇巣は,細胞質の乏しい未熟なnephroblastoma成分が観察される。

腫瘍細胞の一部に,腺腔形成やロゼット様構造が観察される。
腎を構成する器官は,腎実質と尿路で構成され,組織学的には,血液を濾過し尿の産生をする腎糸球体,尿を運び集める尿細管,集合管と体外に排出する経路である腎盂からなる。腎盂の内腔粘膜は尿路上皮細胞で覆われ,腎盂腫瘍は基本的に尿路上皮より発生する。
ii 肉眼的所見Figure 8.76は左腎全摘(11 cm × 5 cm × 4 cm大,350 g)検体。腎盂全体を占拠し,さらに腎実質へ浸潤する5 cm × 5 cm × 3.5 cm大のmassive typeの腫瘍を認める。

淡黄色の乳頭状腫瘍が腎盂全体に広がり,腎実質に浸潤する。
組織学的所見は,比較的均一な腫瘍細胞から構成される部位と大型核や高度核異型を示すGrade 3相当の腫瘍細胞を混在する尿路上皮癌で,さらに腫瘍細胞の一部に濃縮核や層状構造を示す輝度の高い扁平上皮への分化を示す(squamous differentiation)像を認める(Figure 8.77)。

左:比較的均一な腫瘍細胞からなる尿路上皮癌,右:層状構造を伴う核異型の強い扁平上皮癌が観察される。
左腎の腎盂に1 cm × 0.8 cm大の結節型・広基性の腫瘍が観察される(Figure 8.78左)。
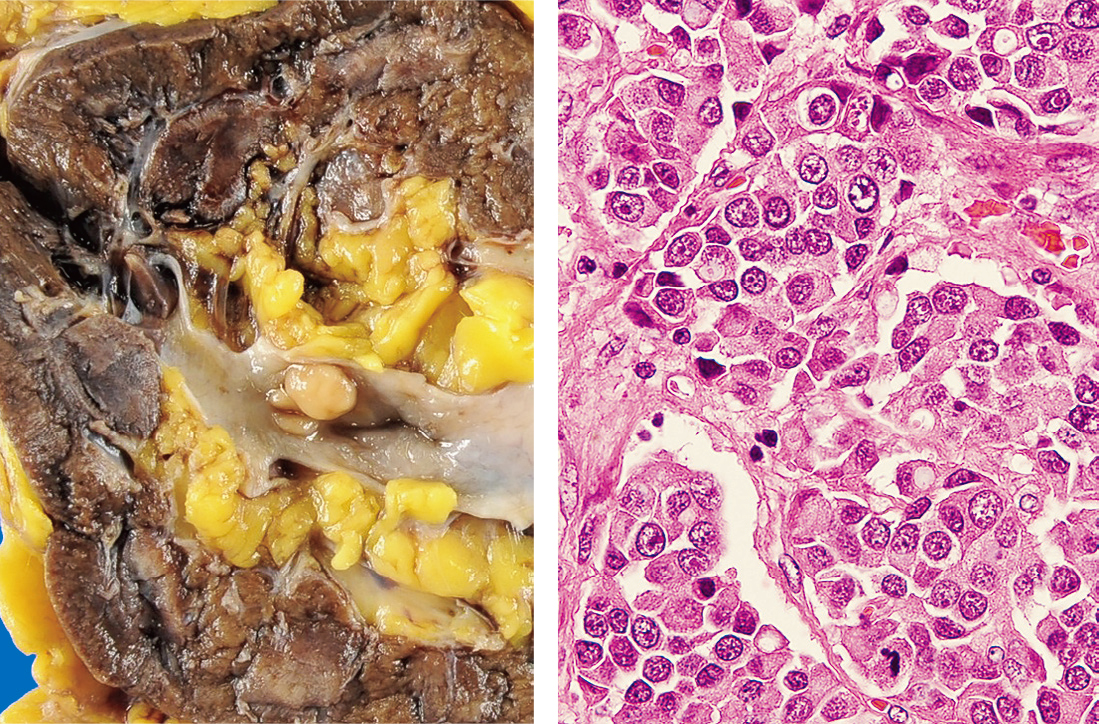
左:腎盂に黄色調の結節が肉眼で認められる。右:×40 HE染色 胞巣状増殖を示す細胞の一部は核偏在性で粘液胞が観察される。
組織学的に,核腫大・核形不整を伴う異型細胞が充実性に増殖する(Figure 8.78右)。腫瘍細胞の一部は核が偏在し細胞質に微細な空胞を形成する。腫瘍の細胞質にAlcian-blue PAS重染色に陽性の粘液を認める(Figure 8.79左)。

左:腫瘍細胞の粘液空胞は青紅色に陽性を示す。右:腫瘍細胞が褐色に陽性を示す。
腫瘍細胞の免疫染色所見は,AE1/AE3, CK7, CK20(Figure 8.79右),carcinoembryonic antigen(CEA),Mucin 1(MUC1),MUC5ACに陽性で,p63,Uroplakin III陰性。HEと併せて評価すると,Signet ring cell型のadenocarcinomaの所見。
1968年にJean Bergerが現在のIgA腎症にあたる疾患を発表し20),日本においては慢性糸球体腎炎の40%以上を占め,年長児あるいは若年成人に多く発症する疾患である。腎炎症候を示唆する尿所見を呈し,腎生検にてメサンギウム細胞の増殖と基質の拡大,蛍光抗体法でIgAが糸球体のメサンギウム領域に優位に染色されることにより確定診断される。メサンギウム領域にIgAが沈着することで腎障害が生じると考えられている。
2) 臨床所見臨床症状,検査結果は多彩であるが,一般的に,血清IgA高値,上気道炎,顕微鏡的血尿,肉眼的血尿や蛋白尿とした症状がある。しばしば持続的な蛋白尿や血尿,むくみ,高血圧を呈する慢性腎炎症候群が認められる。ネフローゼ症候群を伴うことは稀だが予後不良である21)。
3) 組織学的所見IgA腎症の組織型は多彩で,WHO分類の一次性糸球体病変の多くの像を示し,メサンギウム細胞の増殖や分布様式によって,微小変化群,巣状メサンギウム増殖性糸球体腎炎,びまん性メサンギウム増殖性糸球体腎炎に分類される。また,糸球体毛細管係蹄内のマクロファージ浸潤,細胞性半月体形成や線維細胞性半月体形成などの所見を認める。これらの病変が進行すると糸球体ボウマン嚢周囲の線維化,癒着あるいは線維性半月体の形成を経由して球状硬化に進展する22)。
一般的な組織像はperiodic acid Schiff反応(以下 PAS反応)が陽性,Masson trichrome染色が赤染し,PAM染色にて基底膜直下の傍メサンギウム領域の沈着物を特徴的とする半球状沈着物が認められる。また,メサンギウム細胞の増殖とそれを取り巻くメサンギウム基質の拡大が見られる(Figure 8.80)。通常,1つのメサンギウム領域には,メサンギウム細胞は3個まで存在するが,4個以上となると増殖があると判定する。血管極近くのメサンギウム領域は正常でも多く細胞が存在するため,血管極から離れた末梢のメサンギウム領域で判断する。

メサンギウム領域の拡大とメサンギウム細胞の増殖を認める。
HE染色は糸球体病変だけではなく,尿細管やその間質,血管などの標本全体像を把握することが重要である(Figure 8.81)。IgA腎症はメサンギウム領域の拡大と増殖が観察できるが,詳細に観察することは難しいため,PAS反応,Masson trichrome染色やPAM染色などの特殊染色が必須となる。

2つの糸球体のうち,1つの糸球体硬化を認める。
PAS反応は細胞個々の詳細な観察は不可能であるが,糸球体基底膜とメサンギウム基質が陽性を示すため,メサンギウム基質の拡大が詳細に観察でき,核染色から細胞の増殖が明らかである(Figure 8.82)。また,基底膜がやや肥厚した所見は,傍メサンギウム領域に免疫複合体が沈着し,肥厚したように観察される。

PAS反応陽性のメサンギウム基質の拡大を認める。
Masson trichrome染色は,膠原線維を主成分とするメサンギウム基質や基底膜などを青く染め,免疫複合体を赤く染める特性を持っている。拡大したメサンギウム領域あるいは基底膜直下の傍メサンギウム領域に顆粒状に免疫複合体の沈着を認める(Figure 8.83)。

メサンギウム基質領域に赤染する免疫複合体の沈着を認める。
PAM染色は基底膜を黒く染め,細胞と細胞外基質の関係を明瞭に把握できるという最大の利点がある。基底膜とメサンギウム領域が明瞭であり(Figure 8.84),メサンギウム領域に細胞増殖していることが詳細に観察できる。また,細胞性半月体形成を認める(Figure 8.85)。

銀で黒染するメサンギウム領域の拡大を認める。

メサンギウム細胞の増殖と細胞性半月体形成を認める。
メサンギウム領域にIgAが優勢に沈着し,IgA腎症の診断根拠となる(Figure 8.86)。IgMやC3が同時に沈着することも多く認められる。免疫グロブリン及び補体が沈着する場所により,メサンギウム基質に陽性となる場合をmesangial pattern,基底膜に沿って陽性となる場合をperipheral patternとする。IgA腎症診断時には,IgA, C3がmesangial patternを示す(Figure 8.87)。

メサンギウム領域にIgAの沈着を認める。

メサンギウム領域及び傍メサンギウム領域にC3の沈着を認める。
膜性腎症は,糸球体係蹄基底膜上皮下に免疫複合体の沈着と補体の活性化により惹起される疾患で,基底膜の蛋白の透過性が亢進され,ネフローゼ症候群をきたす。その原因は長い間不明であったが,特発性(一次性)膜性腎症において2009年にBeckらが,phospholipase A2 recepter type 1(PLA2R1)が責任抗原であること見出した23)。また,続発性(二次性)の症例は20~30%であり,その原因は,膠原病,薬剤性,感染症や悪性腫瘍などがある。
2) 臨床所見35歳以上の中年層に多く発生し,浮腫や蛋白尿を症状とし,70%以上の症例でネフローゼ症候群を発症する。10%程度で血尿が見られ,その程度は軽い。発症は緩徐で,20~30%は自然寛解する。一般的に腎機能は保たれており,腎不全への移行は少ない。
3) 組織学的所見膜性腎症は,基底膜上皮下に免疫複合体が沈着することで,経時的に基底膜の肥厚を引き起こすことが特徴である。PAM染色やMasson trichrome染色などの特殊染色により,その変化を容易に捉えることができる。初期段階では,基底膜上皮下に免疫複合体の沈着があるが,基底膜には変化が見られないため,光学顕微鏡では異常を見いだすことは,困難である。免疫複合体の沈着物の大きさや数が増し,病期が進むことで観察が可能となり,免疫複合体を囲むように基底膜が変化し,棘状のspikeが形成される。さらに,基底膜が免疫複合体を完全に取り込むと,二重化,虫食い像などが認められ,係蹄壁は著明な肥厚を示す。経過の長い膜性腎症において見られる所見である24)。これらの光学顕微鏡の所見は,電子顕微鏡において詳細に観察され,高電子密度沈着物(electron dense deposit)と基底膜の変化でEhrenreich-Churgの病期分類によって4つに分けられている25)。
① HE染色HE染色では糸球体基底膜の詳細な観察は不明瞭であるが,基底膜の肥厚と基底膜上皮細胞の腫大が認められる(Figure 8.88)。病期が進行した症例では,基底膜の硬化が認められる(Figure 8.89)。

糸球体係蹄壁の肥厚が認められる。

3個の糸球体のうち,2個が糸球体硬化(黄色矢印)に陥っている。
PAS反応は基底膜がシッフ反応により詳細に染め出されるため,基底膜の肥厚が明らかとなる(Figure 8.90)。また,一部にはspikeに類似した毛羽立ち状の所見も確認される。

基底膜がPAS染色で強陽性に染まり,肥厚が認められる(黄色矢印)。
基底膜の主成分は膠原線維であり,アニリン青により染色され,免疫複合体は酸フクシンなどの赤に染色される。写真では,肥厚した基底膜が青色に染色され,さらに基底膜上皮下の免疫複合体が線状あるいは滴状に赤色を呈している(Figure 8.91)。

基底膜上皮下に赤染する免疫複合体を認める(黄色矢印)。
基底膜がキレートされた銀粒子により黒く染め出され,その変化を詳細に観察することが可能である。基底膜上皮下には免疫複合体が存在するため,基底膜が変化してspike形成が認められる(Figure 8.92)。spike形成は膜性腎症の典型的な所見である。また,病期が進むと基底膜は二重化,虫食い状となり基底膜が空洞化した中に免疫複合体が存在し,基底膜の肥厚が明らかとなる(Figure 8.93)。

基底膜の上皮側にspike形成(赤色矢印)が認められる。

肥厚した基底膜は二重化,虫食い状,ハシゴ状(赤色矢印)の変化を認める。
膜性腎症では,IgGやC3が免疫複合体として証明される(Figure 8.94)。これらが,係蹄壁に顆粒状に染色される。初期では微細顆粒状となり,進行すると粗大顆粒状に変化する。また,C4dや補体の最終産物であるC5b-9も検出され,診断の補助となりうる。特発性膜性腎症の場合では,IgGサブクラスの中でもIgG4が優位に沈着する(Figure 8.95)。そして,責任抗原であるPLA2R1を蛍光抗体法や酵素抗体法で検出することで,特発性膜性腎症の診断精度を高めることが可能となる。

糸球体係蹄壁に沿って顆粒状にIgGの陽性像が認められる(黄色矢印)。

糸球体係蹄壁に沿ってIgGサブクラスのIgG4が顆粒状に染色される(黄色矢印)。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
山下 和也(北里大学病院)…I, III
村雲 芳樹(北里大学)…I, III
迫 欣二(知多厚生病院)…II
島田 直樹(聖マリアンナ医科大学病院)…IV
担当編集委員滝野 寿(一般社団法人日本臨床衛生検査技師会)