2023 Volume 72 Issue 1 Pages 141-147
2023 Volume 72 Issue 1 Pages 141-147
高度の好酸球増多を伴うIgG4関連疾患(IgG4-RD)の1例を報告する。症例は70歳代女性。他院でIgG4-RDが疑われ,経過観察中に両側の顎下腺腫大を認めたため精査目的で当院を受診した。高IgG4血症(3,420 mg/dL)と高度の白血球増多症(115.2 × 109/L)を認めたが,自動血球分析装置では好中球と好酸球を算出できなかった。目視法で好酸球は全白血球の96.9%を占め,好酸球には核の分葉異常や顆粒の減少を認めた。顎下腺とリンパ節の生検が行われ,IgG4-RD包括診断基準に則りIgG4-RD(確診)と診断された。リンパ節捺印細胞診のMay-Giemsa(MG)染色で多数のリンパ球・形質細胞と共に末梢血と同様の好酸球を認めたが,Papanicolaou(Pap)染色では好酸球顆粒を認識できず,好中球との区別が困難であった。好酸球増多を起こす原因疾患を鑑別するために行った追加検査は全て陰性であった。その後,IgG4-RDの治療目的で行ったステロイド剤で好酸球増多を含む諸症状は改善した。上記の結果を踏まえ,最終的に,好酸球増多はIgG4-RDに伴う二次反応と判断された。臨床検査技師としては,高度の好酸球増多症では,自動血球分析装置で好酸球を算出できない場合があることを知っておく必要がある。また,好酸球浸潤を伴う疾患の細胞診にはPap染色とMG染色を併用すべきである。
We report a case of IgG4-related disease (IgG4-RD) with severe hypereosinophilia. A woman in her 70s with suspected IgG4-RD noticed swellings on both submandibular regions. She was referred to our hospital for further examination. Laboratory data revealed a high level of serum IgG4 (3,420 mg/dL) and leukocytosis (115.2 × 109/L), but neutrophils and eosinophils could not be calculated on an automated hematology analyzer. By visual inspection, we found that 96.9% of the total leukocytes were eosinophils, many of which showed abnormal nuclear lobulations and decreased counts of intracytoplasmic granules. She underwent a surgical biopsy of the submandibular gland and supraclavicular lymph nodes, and was eventually diagnosed as having IgG4-RD (definite) according to the comprehensive diagnostic criteria of IgG4-RD. In the imprinted smears of lymph node specimens subjected to May–Giemsa staining, eosinophils were easily recognized together with numerous plasma cells and lymphocytes. However, in the imprinted smears of lymph node subjected to Papanicolaou staining, eosinophils were not distinguishable from neutrophils because the acidophilic granules were not stained. Every additional test for determining the cause of hypereosinophilia showed negative results. Thereafter, steroid administration for IgG4-RD treatment improved her symptoms and laboratory data, including hypereosinophilia. On the basis of these findings, hypereosinophilia was judged to be a secondary response associated with IgG4-RD. On a practical level of medical technologists, it should be recognized that automated blood cell analyzers may not distinguish between neutrophils and eosinophils in patients with severe hypereosinophilia. Thus, for observing cytological smears with suspected eosinophilic infiltration, May–Giemsa staining, together with Papanicolaou staining, is advisable.
IgG4関連疾患(IgG4-related disease,以下IgG4-RD)は,2001年にHamanoら1)によって報告された自己免疫性膵炎を契機に,本邦から発信された新しい疾患概念である。侵襲臓器は多岐にわたり,しばしば複数臓器に及ぶ原因不明の全身性慢性炎症性疾患である。臨床症状は侵襲臓器によって異なるが,特徴的な病理学的所見(線維化とIgG4陽性形質細胞浸潤)と高IgG4血症が共通してみられ,高IgE血症や好酸球増多症を伴うことも多い2)~7)。
今回,我々は多項目自動血球分析装置(XE-5000シリーズ,シスメックス社)で好酸球と好中球が分類不能であった高度の好酸球増多症を伴うIgG4-RDを経験したので,好酸球増多症を起こす疾患の鑑別および白血球分類不能の原因を中心に報告する。
患者:70歳代,女性。
既往歴:慢性甲状腺炎,糖尿病。
現病歴:X − 4年前の検診で胸部異常陰影を指摘された。前医・呼吸器内科で精査の結果,抗核抗体320倍,抗Scl-70抗体陽性であったため,強皮症に合併した間質性肺炎が疑われたが確定診断には至らず,経過観察となった。X − 1年前に胸部異常陰影を再度指摘され,間質影は増強していたが,抗核抗体80倍,抗Scl-70抗体は陰性であった。経過観察中に高γ-グロブリン血症,高IgG4血症を認め,肺野病変,肺門・縦隔リンパ節腫大からIgG4-RDが疑われた。自覚症状には乏しく,患者が胸腔鏡下肺生検や気管支内視鏡検査に消極的であったため引き続き経過観察となった。その間に貧血,好酸球増多症,両側顎下腺の腫大を認めたため,精査目的で当院を受診し,左顎下腺の一部と鎖骨上リンパ節が生検された。
総タンパクが高値(11.1 g/dL)にもかかわらず,アルブミンは低値(2.3 g/dL)を示し,高IgG血症(6,522 mg/dL),特に高γ-グロブリン血症(蛋白分画:60.1%)と高IgG4血症(3,420 mg/dL)が目立った(Table 1)。
| 項目 | 測定値 | (基準範囲) | |
|---|---|---|---|
| Total protein | 11.1 | (6.6~8.1 g/dL) | |
| Albumin | 2.3 | (4.1~5.1 g/dL) | |
| IgG | 6,522 | (870~1,700 mg/dL) | |
| IgG4 | 3,420 | (4.5~117 mg/dL) | |
| タンパク分画 | albumin | 23.8 | (55.8~66.1%) |
| α1-globulin | 1.9 | (2.9~4.9%) | |
| α2-globulin | 4.5 | (7.1~11.8%) | |
| β1-globulin | 3.0 | (4.7~7.2%) | |
| β2-globulin | 6.7 | (3.2~6.5%) | |
| γ-globulin | 60.1 | (11.1~18.8%) | |
大球性貧血と著明な白血球増多(115.2 × 109/L)が認められ,XE-5000による白血球分類では好中球と好酸球が算出できず(Figure 1),目視法(500カウント)で好中球0.3%,好酸球96.9%と算定された(Table 2, 3)。好酸球は通常の2分葉核に加え,単核の低分葉核や3~5核の過分葉核が混在し,低分葉核の好酸球には顆粒の減少がみられた(Figure 2)。

| 項目 | 測定値 | (基準範囲) | |
|---|---|---|---|
| RBC | 2.45 | (3.86~4.92 × 1012/L) | |
| Hb | 8.6 | (11.6~14.8 g/dL) | |
| Ht | 25.4 | (35.1~44.4%) | |
| PLT | 110 | (158~348 × 109/L) | |
| MCV | 103.7 | (83.6~98.2 fL) | |
| MCH | 35.1 | (27.5~33.2 pg) | |
| MCHC | 33.9 | (31.7~35.3 g/dL) | |
| WBC | 115.2 | (3.3~8.6 × 109/L) | |
| 白血球分類 | Neut | (算出不能) | (34.6~71.4%) |
| Lym | 3.0 | (19.6~52.7%) | |
| Mono | 0.8 | (2.4~11.8%) | |
| Eo | (算出不能) | (0~7.8%) | |
| Baso | 0.2 | (0~1.8%) | |
| 項目 | 測定値 |
|---|---|
| Stab | 0.0% |
| Seg | 0.3% |
| Lym | 1.4% |
| Mono | 0.5% |
| Eo | 96.9% |
| Baso | 0.2% |
| Atypical lymph | 0.7% |

May-Giemsa staining, objective 40×
顎下腺と鎖骨上窩リンパ節は左右対称性に腫大し,顎下腺内部は低エコー,不均質で,IgG4関連唾液腺炎(ミクリッツ病)が疑われた。
4. CT検査両側の顎下腺腫大は指摘できなかったが,両側鎖骨上部から縦隔および腹部・脾門部にかけて多数の腫大リンパ節が認められた。鑑別疾患として,IgG4-RD,リンパ腫,サルコイドーシス,多中心性キャッスルマン病が挙がった。
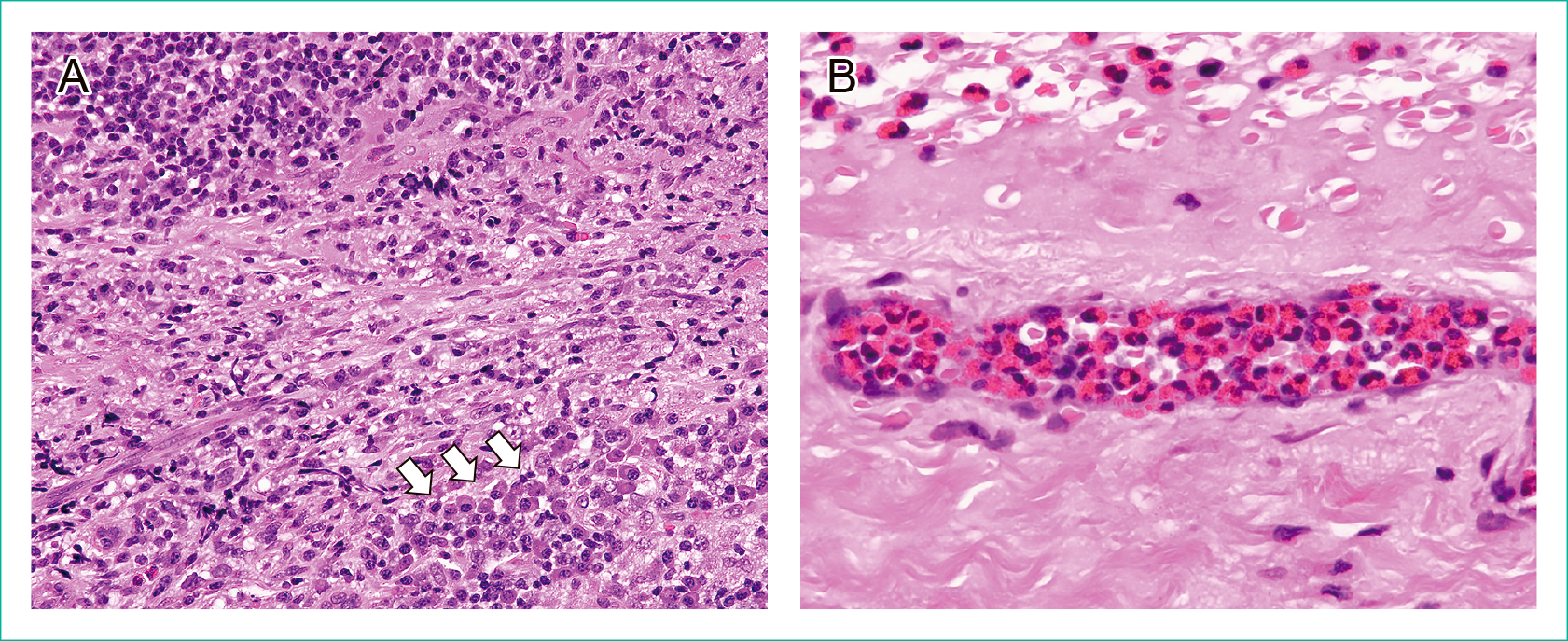
5. リンパ節の捺印細胞診多数のリンパ球,形質細胞,好酸球が混在してみられた。好酸球顆粒は,May-Giemsa(MG)染色で明瞭であったが,Papanicolaou(Pap)染色では顆粒を認識できず,好中球との鑑別が困難であった(Figure 3)。また,MG染色では末梢血と同様に,低分葉核および過分葉核を有する好酸球もみられた。

A: May-Giemsa staining, objective 100×; B: Papanicolaou staining, objective 100×
顎下腺には好酸球を混じた高度のリンパ球・形質細胞浸潤,線維化,腺房の萎縮・減少がみられ,一部の小静脈内には好酸球が充満していた(Figure 4)。リンパ節は正常構造を保ち,濾胞間には形質細胞浸潤が目立ち,少数の好酸球も混在していた(Figure 5)。少なくとも,顎下腺とリンパ節に血管炎やリンパ腫・形質細胞腫といえる所見はなかった。免疫組織化学染色では,両組織に多数のIgG4陽性形質細胞を認め,IgG4/IgG比は顎下腺で77%,リンパ節で66%であった(Figure 6)。
H-E staining, left objective 20×, right objective 40×

H-E staining, A: objective 10×, B: objective 40×

Immunohistochemical staining, both objectives 40×
IgG4-RD包括診断基準の全項目を満たしたが,シェーグレン症候群や,IgG4陽性形質細胞浸潤,高IgG4血症,好酸球増多症を伴う疾患群が鑑別として挙がった。生検後の追加検査で,抗核抗体価160倍,抗SS-A抗体と抗SS-B抗体は陰性,抗好中球細胞質ミエロペルオキシダーゼ抗体(myeloperoxidase-anti-neutrophil cytoplasmic antibody; MPO-ANCA)と抗好中球細胞質プロテイナーゼ3抗体(proteinase3-anti-neutrophil cytoplasmic antibody; PR3-ANCA)も陰性,生検時の検体を用いたリンパ腫に関する遺伝子および染色体検査にも異常はなかった。なお,大球性貧血の原因精査のために測定したビタミンB12は正常範囲であった(葉酸の検索は未施行)。
精査・加療目的で前医の血液内科に転院後に施行された好酸球増多症関連の検査では,骨髄検査で芽球の増加はみられず,血小板由来成長因子受容体α(platelet-derived growth factor receptor alpha; PDGFRA),血小板由来成長因子受容体β(platelet-derived growth factor receptor beta; PDGFRB),線維芽細胞増殖因子受容体1(fibroblast growth factor receptor 1; FGFR1)に関する遺伝子異常もなかった。IgG4-RDの治療目的で行ったプレドニゾロン投与で,好酸球増多および症候は改善した。シェーグレン症候群,リンパ腫,ANCA関連血管炎,慢性好酸球性白血病を疑う検査所見はなく,ステロイド治療による反応も踏まえ,最終的に好酸球増多症はIgG4-RDに伴う二次性反応と判断された。
現在,他院でプレドニゾロンの外来加療を受けており,当院の外来経過観察でも顎下腺およびリンパ節腫大は認めていない。
IgG4-RD包括診断基準として(1)臨床的に単一または複数臓器に特徴的なびまん性あるいは限局性腫大,腫瘤,結節,肥厚性病変を認める,(2)高IgG4血症(135 mg/dL以上),(3)病理組織学的に著明なリンパ球・形質細胞の浸潤およびIgG4/IgG陽性細胞比40%以上のIgG4陽性形質細胞浸潤,の3項目があり,満たす項目によってIgG4-RDの確診群(definite),準確診群(probable),疑診群(possible)とされる2),8)。自験例には両側の顎下腺腫大,両鎖骨上から縦隔・腹部・後腹膜におよぶリンパ節腫大,肺の間質影,高IgG4血症(3,420 mg/dL),病理組織学的に高度のIgG4陽性形質細胞の浸潤,40%以上のIgG4/IgG陽性形質細胞比があり,ステロイド剤の有効性の点においてもIgG4-RDの確診群と考えられた。
しかし,IgG4陽性形質細胞浸潤や高IgG4血症を伴う多数の非IgG4-RD(シェーグレン症候群,多中心性キャッスルマン病,ANCA関連血管炎/チャーグ・ストラウス症候群,リンパ腫,好酸球増多症など)が鑑別すべき除外疾患として付記されている2),7)~12)。臨床所見,血液・生化学所見,病理所見から,シェーグレン症候群,ANCA関連血管炎(チャーグ・ストラウス症候群),リンパ腫・形質細胞腫は否定的と考えられた。多中心性キャッスルマン病には高IgG4血症や高IgG4/IgG陽性形質細胞比を示す症例もあるので,重要な鑑別疾患として挙がったが,好酸球増多症を伴う多中心性キャッスルマン病は殆ど報告がなく9),否定的と判断された。但し,多中心性キャッスルマン病の診断に重要な血中IL-6やHHV-8陽性細胞の検査は行われていない。
自験例のIgG4-RDは高度の好酸球増多症を伴い,自動血球分析装置で好中球と好酸球が分類不能であった点でも特異な症例である。IgG4-RDの約20~30%に末梢血の好酸球増多があり,約50%で組織中に好酸球浸潤がみられると報告されている5)~7)。好酸球増多症は6ヶ月以上持続する1,500/μL以上の末梢血好酸球数と定義されているが13),本例の好酸球は111.6 × 109/L(全白血球の約97%)と異常に高値であった。慢性好酸球性白血病も考慮されたが,骨髄検査とPDGFRA,PDGFRB,FGFR1遺伝子に異常はなく,最終的にはIgG4-RDに伴う二次性好酸球増多症と判断された。
IgG4-RDにはTh2 系サイトカイン(IL-4, IL-5, IL-13)と制御性T細胞(regulatory T-cell; Tregs)系サイトカイン(IL-10, TGF-β)が関与すると考えられている3)~7),10)~12)。Th2 系サイトカインはIgE抗体産生と好酸球増多を誘導する一方で,Th2反応を制御するTregs系サイトカインのIL-10がIgG4の増加,TGF-βが線維化を起こすと考えられている3)~7),10)~12)。中でも,IL-5は好酸球の増殖,分化,成熟,生存延長に関係する強力な活性化因子であることが知られている14)。自験例ではIL-5の測定が行われていないが,長期にわたるIL-5産生による好酸球の過剰増殖により,未熟好酸球(単核,顆粒の減少)の出現や生存延長による過分葉核などの異常が生じたと推察される。
自験例はXE-5000で好酸球と好中球が分類不能であった。XE-5000の白血球5分画の原理は半導体レーザーを使用したフローサイトメトリーで,細胞から得られる前方散乱光,側方散乱光,側方蛍光の信号を解析して細胞を検出する。前方散乱光にて細胞の大きさ,側方散乱光にて核形・顆粒の有無,側方蛍光にて核酸量が得られる。好中球,リンパ球,単球,好酸球の4項目は側方散乱光と側方蛍光,好塩基球の検出は前方散乱光と側方蛍光を組み合わせてスキャッタグラムを描き,全白血球からリンパ球,単球,好酸球,好塩基球を差し引いた値が好中球である。好中球と好酸球は細胞の大きさと核の分葉が類似するため,側方散乱光を増強させて好中球集団から好酸球を分離する15)。自験例の如く全白血球から引いた残りの好中球比率が著しく低値であっても,XE-5000で分類可能な場合は実数値を表示するように設計されており(私信),自験例で好中球と好酸球を算出できなかった原因は装置上の問題ではなく,好酸球自体が原因であったと思われる。好酸球の顕微鏡的観察では,低分葉核や過分葉核などの分葉異常があり,低分葉核の好酸球には顆粒の減少もみられた。これらの分葉異常核と顆粒の減少が原因で,好酸球と好中球を分類できず,算出不能となったと推察される。
リンパ節捺印細胞診では,MG染色で明らかな好酸球顆粒を認めたが,Pap染色では好酸球顆粒を認識できず好中球との鑑別が困難であった。この染色性の差は,MG染色とPap染色に用いられる酸性色素に起因する。MG染色にはエオジン(赤染)のみ,Pap染色には分子量の異なる3種の酸性色素(オレンジG<エオジン<ライトグリーン)が用いられている。細胞質が疎な好酸球には,いずれの色素も入り込むが,最も結合性の強いライトグリーンで緑染されるため,特徴的な好酸性(赤色)顆粒として認識できない場合が多い16)。細胞診における好酸球の同定にはMG染色とPap染色を併用すべきである。
高度の好酸球増多症を伴うIgG4-RDを報告した。XE-5000にて好酸球と好中球が分類不能であった原因は,好酸球の核の分葉異常と顆粒の減少に起因すると考えられた。術前細胞診ではPap染色のみが施行されることが多いが,MG染色とPap染色を併用すべきである。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。