2023 Volume 72 Issue 1 Pages 1-10
2023 Volume 72 Issue 1 Pages 1-10
テトロドトキシン(TTX)は主としてフグ科魚類が有する神経毒である。TTXが原因の食中毒は近年でも多く見られるが,医療施設においてそれら食中毒患者の生体試料中TTXの測定はほとんど実施されていない。そこで,我々は陰イオン交換カラムを用いた高速液体クロマトグラフィー(HPLC)分析を活用して生体試料中のTTXを検出・定量する手法の構築を試みた。我々が構築したHPLC分析系では,保持時間が0.1–0.4 minの分画において,TTXを示す波形が検出された。さらに,クエン酸緩衝液で調製したTTX試料は,1.0–50 μg/mLの濃度範囲で測定が可能であり,測定結果に基づき検量線を作成することができた。続いて,ヒトの血清や尿で調製したTTX試料の検出と定量を試みた。血清試料の場合,除タンパク処理を施してもTTXを正確に検出・定量することは困難であった。一方,尿試料では,TTXは5.0–50 μg/mLの濃度範囲でTTXを示す波形の検出が可能であったが,検量線に当てはめると実際のTTX濃度よりも低い値に算出された。そこで,尿を用いて調製したTTXの測定結果に基づき,改めて作成した検量線に当てはめることで,TTX濃度の算出値を補正することができた。本研究の結果から,我々が構築したHPLC分析系はTTX食中毒患者の尿試料に適応が可能と考えられた。
Tetrodotoxin (TTX) is a neurotoxin mainly found in pufferfish. Although food poisoning caused by TTX has been reported in recent years, TTX measurement in biological samples derived from patients has rarely been performed at medical facilities. Therefore, we attempted to establish a high-performance liquid chromatography (HPLC) analytical method using an anion-exchange column to detect and quantify TTX. First, TTX samples (0.5–50 μg/mL) diluted in citrate buffer solution were analyzed by HPLC. According to this method, TTX chromatograms were detected in the retention time range of 0.1–0.4 min. Furthermore, TTX in citrate buffer could be detected in the concentration range of 1.0–50 μg/mL, and the standard curve was successfully created on the basis of the obtained results. Next, we examined whether TTX diluted in human serum or urine could be detected and quantified. Despite deproteinization, TTX in serum could not be measured. In urine samples, TTX was detected in the concentration range of 5.0–50 μg/mL; however, the calculated value was lower than the actual TTX concentration. Next, the calculated TTX concentration was corrected by applying the recreated standard curve based on the measurement results of TTX samples diluted in urine. In conclusion, this HPLC analytical method may be adapted to urine samples from patients with TTX poisoning.
テトロドトキシン(TTX)は主としてフグ科魚類が有する神経毒である。TTX食中毒は,本邦の動物性自然毒が原因の中毒において,長年に渡り発生数1位を記録している1)。TTXが生体に及ぼす影響は深刻であり,骨格筋や神経の膜電位依存性ナトリウムイオンチャネルに結合し,チャネル内へのナトリウムイオンの流入を阻害して神経伝達を遮断する2)。結果として,頭痛や腹痛,全身の痺れや麻痺を引き起こし,呼吸困難により死亡に繋がる場合もある3)。ヒトにおけるTTXの致死量は1.0–2.0 mgと推定されており,他の自然毒と比較しても少量の摂取で生命の危機に至ることが報告されている4)。以上の観点から,TTX食中毒患者への対応は一刻を争う場合が多い。患者の生体試料,特に血清や尿に含まれるTTXの簡易・迅速な検査が可能であれば,医師による診断と処置,その後の経過観察に大きく貢献できるが,現在,医療施設において患者の生体試料中TTXの測定はほとんど実施されていない。
TTXを測定する手法としては,古くから高速液体クロマトグラフィー(HPLC)分析が活用されていた5)。その後,HPLC分析に質量分析法を組み込んだLC/MSおよびLC/MS/MSが発達した6),7)。なお,これらの分析は,主としてフグ科魚類の組織中TTXの検出と測定を目的としたものであり,医療分野への活用例は乏しい。やがて,LC/MS/MSを用いて,ヒトの血清および尿に含まれるTTXを検出・定量する手法が報告された8),9)。さらに,TTXに対する抗体が開発され,それを使用した酵素結合免疫吸着法(ELISA)による検体中TTXの測定が可能となった10)。我々も以前,ヒトの血清や尿に含まれるTTXの検出と定量に有用な非競合ELISA測定系を構築,その性能を評価した。その際,血清試料中および尿試料中のTTXを測定することができたが,検出感度に課題を残す結果となった11)。
現状,HPLC装置や質量分析装置あるいはELISAに使用するマイクロプレートリーダー等の機器類は,大半の医療施設には導入されていない。しかし,HPLC分析に関しては,HbA1cや尿中カテコールアミンの測定など,古くから臨床検査に応用されてきた12)。そこで,我々はHPLC分析による生体試料中TTXの分析手法を確立することが,医療現場におけるTTX測定導入の一助になると考えた。これまでは,検体中成分の極性(親水性)の違いを利用する,逆層クロマトグラフィー(RPC)を原理としたカラムを用いたTTX検出に関する報告が多くみられる5)。RPCはHPLC分析において盛んに採用されるものの,原理が単純であるが分離能は高いとは言い難い。そこで,TTXが酸性の溶液中で安定という性質を利用し13),我々はイオン交換クロマトグラフィーによる分離分析の方が適すると予想した。本研究では陰イオン交換クロマトグラフィー用カラム(DEAE-825)を用いたHPLC測定系を構築し,生体試料に溶解したTTXの検出および定量性能を評価する。
本研究におけるHPLC分析には,汎用HPLC装置Prominence(株式会社島津製作所:京都)とDEAE-825(昭和電工株式会社:東京)を用いた。実際の患者検体に見立て,TTXを溶解する溶媒は健常人の血清試料として,Human Serum pool(serum)および尿試料は,Urine, Single Male Donor, Human(urine)(いずれも,コスモ・バイオ株式会社:東京)を用いた。TTX(フグ由来細胞生物学用)および各種一般試薬(富士フイルム和光純薬株式会社:東京)を用いた。
2. 方法 1) 試料の調製TTX中毒の患者検体を入手することは困難であるため,①buffer試料(10 mMクエン酸緩衝液pH 3.25)(以下bufferとした),②urine試料(pH 6.8)および③serum試料(pH 7.4)の3つの溶媒にTTX試薬を溶解し各測定試料とした。なお,serum試料の実験のみTTX試薬を溶解した後,除タンパク処理を行ない測定試料(dp-serum)とした。具体的には,TTXを溶解したserum試料と等量の10%トリクロロ酢酸を加え,混和後,微量高速冷却遠心機KITMAN-T24(株式会社トミー精工:東京)で14,000 × g(12,000 rpm),15分間(min)遠心分離後,得られた上清をdp-serum試料とした。
2) HPLC測定系の構築本研究におけるHPLC分析は,汎用HPLC装置ProminenceにDEAE-825カラムを接続して実施した。保持時間(retention time; RT)は30 min,流速は1.0 mL/min,波長は280 nm,カラムオーブン温度は20℃に設定した。移動相の溶液はbufferとした。このHPLC分析系を用いて,buffer試料,urine試料およびserum試料で調製したTTX試料を分離分析し,波形を検出した。得られた波形に基づき,HPLC装置に付属のソフトウェアLabSolutionsを用いて波形下面積を算出した。
3) 統計解析とHPLCの性能評価全ての実験で5回測定を実施し,数値データはその平均値(Mean)をプロットした。グラフ内のエラーバーは各測定の標準偏差(SD),即ち±1SDを示す。精密度の評価に際しては,同一TTX濃度の各種試料を改めて10回測定し,変動係数(CV, %)を算出した。さらに,添加回収試験を実施し,回収率(Recovery, %)を算出することで,正確さを評価した。定量限界(LoQ,本研究ではCVが10%以内に収まる限界濃度とした)の濃度は,日本臨床化学会クオリティマネジメント専門委員会の報告に掲載された計算式を用いて算出した14)。HPLC分析により得られた波形下面積とTTX濃度との相関性を検証し,検量線を作成した。相関性はソフトウェアKaleidaGraph(株式会社ヒューリンクス:東京)を用いて,ピアソンの積率相関係数(R)を算出することで検証した。
本HPLC分析系を用いてTTX成分の波形を検出した。まず,bufferで希釈したTTXの6段階希釈系列(0.5, 1.0, 5.0, 10, 30, 50 μg/mL)をHPLC分析した。なお,Figure 2~5では0–5.0 minの区間を拡大して示した。50 μg/mLのTTXをHPLC分析したところ,RTが0.1–0.4 minの箇所でTTXの波形が検出された(Figure 1A)。そこからTTX濃度を下げ,1.0 μg/mLまではTTXを示す波形が検出された(Figure 1B–E)。一方,TTX濃度0.5 μg/mLは検出不可であった(Figure 1F)。

HPLC analysis was conducted on TTX samples in buffer. In panels A–F, the concentration of TTX in buffer was as follows: A, 50 μg/mL; B, 30 μg/mL; C, 10 μg/mL; D, 5.0 μg/mL; E, 1.0 μg/mL; F, 0.5 μg/mL. Red arrows indicate the TTX peak detected in the chromatogram, while the blue arrow indicates that the peak was undetectable. The x-axis presents the retention time, and the y-axis presents the absorbance at 280 nm. Each experiment was performed in quintuplicate. HPLC, high-performance liquid chromatography; TTX, tetrodotoxin.
Figure 1の結果に基づき,TTXの検量線作成を試みた。解析ソフトウェアを用いてTTXの波形の下側面積(Figure 2A,赤色部分)を算出した(Figure 2A,青枠部分)。さらに,TTX濃度と波形下面積の相関性から,検量線の式を求めた(Figure 2B)。本式の相関係数Rは0.9912と非常に良好であった。さらに,同一検体(TTX濃度50,10,1.0 μg/mL)10回測定における定量性能を評価した。TTX濃度1.0 μg/mL測定のCVは17.9%であり,50 μg/mLおよび10 μg/mL測定のCVは10%以内であった(Figure 2C, Table 1)。これらTTX濃度測定のRecoveryは98.9–108.2%,LoQは3.42 μg/mLであった(Table 1)。

A standard curve was constructed based on the results shown in Figure 1. (A) Calculation of the chromatogram area of TTX. The red color indicates the chromatogram area, whereas the blue frame shows the calculation result. (B) Standard curve of TTX in buffer. The x-axis presents the TTX concentration, and the y-axis presents the calculated area of TTX. Values for the calculated area are plotted as the mean ± standard deviation (SD) of values obtained from quintuplicate experiments. (C) Calculated TTX values (y-axis) based on the standard curve against actual TTX concentrations (50, 10, 1.0 μg/mL; x-axis) in buffer. Dotted lines indicate the mean value. Each experiment was performed 10 times. HPLC, high-performance liquid chromatography; TTX, tetrodotoxin.
| Solvent | buffer | ||
|---|---|---|---|
| TTX concentration (μg/mL) | 50 | 10 | 1.0 |
| Mean (μg/mL) | 52.82 | 9.89 | 1.08 |
| SD | 3.24 | 0.62 | 0.19 |
| CV (%) | 6.13 | 6.31 | 17.91 |
| Recovery (%) | 105.6 | 98.9 | 108.2 |
| LoQ (μg/mL) | 3.42 | ||
次にserum試料を溶媒としたTTX試料のHPLC分析を試みた。まず,TTXを含まないserum試料を分析したところ,serum試料中の成分が多量に検出された(Figure 3A)。RTが0–5 minの分画を拡大したところ,0.1–0.5 minの箇所に何らかの成分を検出した(Figure 3B)。この状態ではTTXと同箇所に波形が認められ正確に測定できないため,serum試料の除タンパク処理を実施した。dp-serum試料中成分の検出量は1/10程度に減少した(Figure 3C)。さらに,RTが0.1–0.5 minの箇所の波形も消失した(Figure 3D)。そこで,あらかじめserum試料に50 μg/mLの濃度となるようにTTXを溶解した後のdp-serum試料を分析した。その結果,serum中成分の量は減少したが(Figure 3E),同時にTTXを示す波形も消失した(Figure 3F)。

HPLC analysis was conducted on samples as follows: (A) serum without TTX, (C) deproteinized serum (dp-serum) without TTX, and (E) dp-serum with 50 μg/mL TTX. (B, D, F) Enlarged images of panels A, C, and E, respectively. The red arrow indicates that some type of serum component can be detected in the chromatogram, while the blue arrows indicate that the peak is undetectable. The x-axis presents the retention time, and the y-axis presents the absorbance at 280 nm. Each experiment was performed in quintuplicate. HPLC, high-performance liquid chromatography; TTX, tetrodotoxin.
次に,urine試料を用いて調製したTTX試料のHPLC分析を試みた。TTXを含まないurine試料を分析したところ,urine試料中の成分が多量に検出された(Figure 4A)。RTが0–5 minの分画を拡大したところ,0.1–0.5 minの箇所には波形を認めなかった(Figure 4B)。そこで,urine試料に50 μg/mLの濃度となるようにTTXを溶解した試料に対して,HPLC分析を行なった。結果,元々のurine試料中成分は多量に検出されるが(Figure 4C),0.1–0.5 minの箇所ではTTXを示す波形を検出した(Figure 4D)。

HPLC analysis was conducted on samples as follows: (A) urine without TTX and (C) urine with 50 μg/mL TTX. (B, D) Enlarged images of panels A and C, respectively. The red arrow indicates that the TTX peak in the chromatogram can be detected, while the blue arrow indicates that the peak is undetectable. The x-axis presents the retention time, and the y-axis presents the absorbance at 280 nm. Each experiment was performed in quintuplicate. HPLC, high-performance liquid chromatography; TTX, tetrodotoxin.
次にurine試料で希釈したTTXの5段階希釈系列(1.0, 5.0, 10, 30, 50 μg/mL)をHPLC分析した。結果,5.0–50 μg/mLのTTXを検出できたが(Figure 5A–D),1.0 μg/mLのTTXは検出できなかった(Figure 5E)。
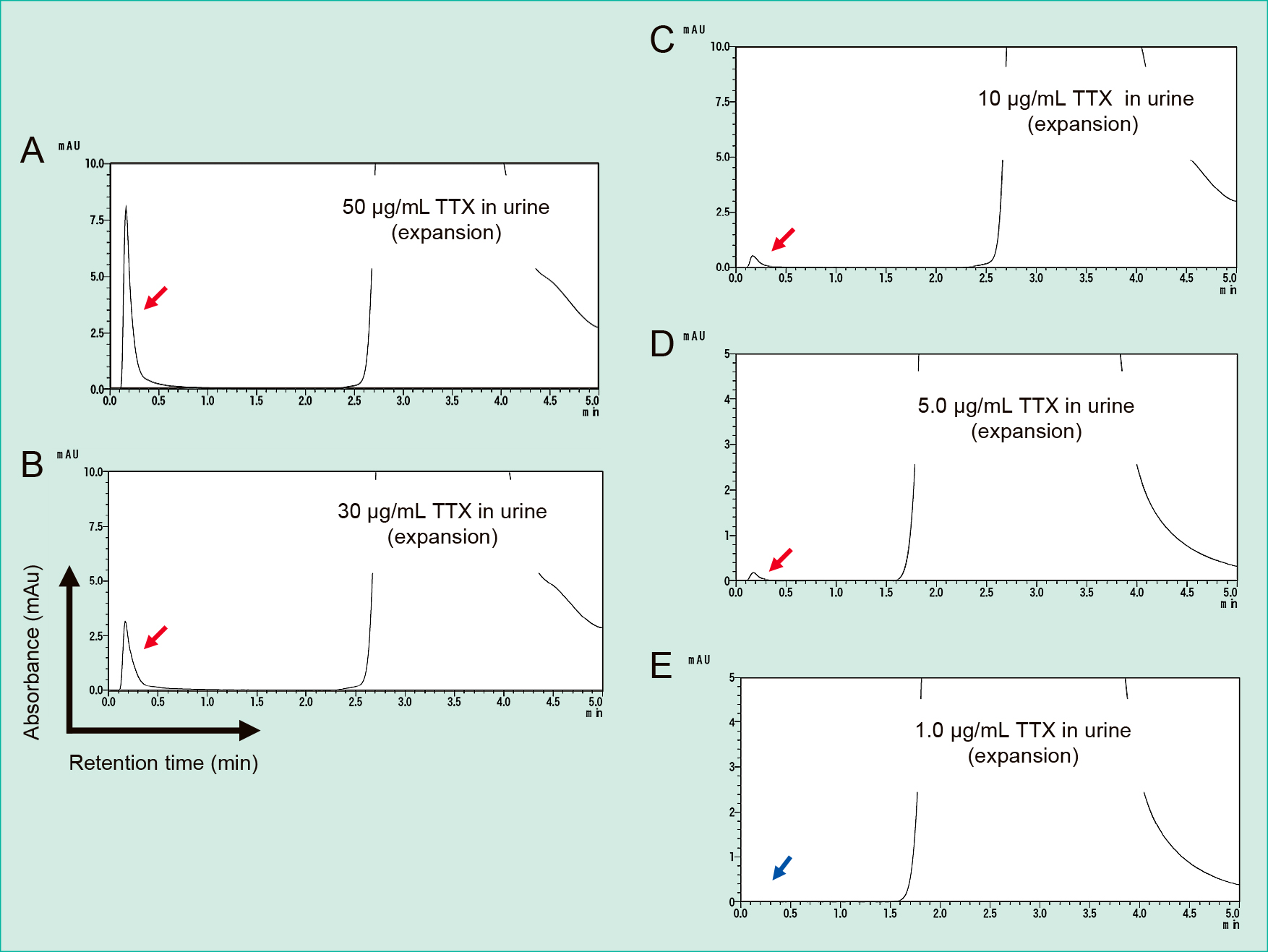
HPLC analysis was performed to detect TTX in urine samples. In panels A–E, the concentration of TTX in urine was as follows: A, 50 μg/mL; B, 30 μg/mL; C, 10 μg/mL; D, 5.0 μg/mL, E, 1.0 μg/mL. All panels show enlarged images. Red arrows indicate that the TTX peak in the chromatogram can be detected, while the blue arrow indicates that the peak is undetectable. The x-axis presents the retention time, and the y-axis presents the absorbance at 280 nm. Each experiment was performed in quintuplicate. HPLC, high-performance liquid chromatography; TTX, tetrodotoxin.
Figure 2にて作成した検量線に基づき,Figure 5におけるTTXの波形下面積から,TTX濃度を算出した。この時,実際のTTX濃度よりも低い濃度に算出された(Figure 6A)。さらに,同一検体(urine試料中TTX濃度50,10,5.0 μg/mL)10回測定における定量性能を評価した。各濃度におけるMeanは,実際のTTX濃度の1/6–1/3程度に留まった(Figure 6B)。測定性能として,CVが大きくRecoveryが低い結果となった(Table 2)。

The TTX concentration was calculated based on the calibration curve shown in Figure 2B. (A) Calculated TTX values (y-axis) against actual TTX concentrations (50, 40, 30, 20, 10, 5.0, 1.0 μg/mL; x-axis) in urine. Calculated concentrations are plotted as the mean ± standard deviation (SD) of the values obtained from quintuplicate experiments. (B) Calculated TTX values (y-axis) against actual TTX concentrations (50, 10, 5.0 μg/mL; x-axis) in urine. Dotted lines indicate mean values. Each experiment was performed 10 times. TTX, tetrodotoxin.
| Solvent | urine | ||
|---|---|---|---|
| TTX concentration (μg/mL) | 50 | 10 | 5.0 |
| Mean (μg/mL) | 17.21 | 2.52 | 0.79 |
| SD | 2.84 | 0.56 | 0.48 |
| CV (%) | 16.50 | 22.38 | 60.53 |
| Recovery (%) | 34.4 | 25.2 | 15.8 |
Figure 2にて作成した検量線はbufferで調製したTTXのHPLC分析結果に基づいたものである。urine試料中にて検出したTTXをこの検量線に当てはめるのは不適と判断し,改めて検量線を作成した。urine試料で調製したTTXの6段階希釈系列(5.0, 10, 20, 30, 40, 50 μg/mL)をHPLC分析し,改めて検量線の式を求めた(Figure 7A)。本式の相関係数Rは0.9701と非常に良好であった。この検量線に基づき,同一検体(urine試料中TTX濃度50,10,5.0 μg/mL)10回測定における定量性能を再評価した。この時,算出されたTTX濃度は実際の濃度に近似した(Figure 7B)。特に,50 μg/mLおよび10 μg/mL測定ではばらつきが小さく,CVは10.2%以内であった(Table 3)。これらTTX濃度測定のRecoveryは94.4–97.5%,LoQは10.82 μg/mLであった(Table 3)。

To avoid the effect of urine as a TTX solvent, a new standard curve was constructed using urine samples. (A) Standard curve based on six serial dilutions of TTX in urine (50, 40, 30, 20, 10, 5.0 μg/mL). The x-axis presents the TTX concentration, and the y-axis presents the calculated area of TTX. Values for the calculated area are plotted as the mean ± standard deviation (SD) of values obtained from quintuplicate experiments. (B) Calculated TTX values (y-axis) based on the new standard curve against actual TTX concentrations (50, 10, 5.0 μg/mL; x-axis) in urine. Dotted lines indicate mean values. Each experiment was performed 10 times. TTX, tetrodotoxin.
| Solvent | urine | ||
|---|---|---|---|
| TTX concentration (μg/mL) | 50 | 10 | 5.0 |
| Mean (μg/mL) | 48.96 | 9.44 | 4.86 |
| SD | 4.77 | 0.96 | 0.83 |
| CV (%) | 9.74 | 10.17 | 17.13 |
| Recovery (%) | 97.5 | 94.4 | 97.2 |
| LoQ (μg/mL) | 10.82 | ||
TTXは有機溶媒や水には不溶で,酸性溶液には可溶である13)。そのため,本HPLC分析系の移動相溶液には,pH 3.25のbufferを採用した。本研究のHPLC分析には陰イオン交換クロマトグラフィーを採用している。この時,検体中成分が負に帯電するほどカラムへの結合が強力となり,カラム内における物質の移動は遅くなる。本HPLC分析系において,TTXは0.1–0.4 minの箇所に検出された(Figure 1)。このことから,buffer中においてTTXは負に帯電することなく,カラムにほとんど結合しなかったと考えられる。そのため,RTが早い段階で検出されたことが分かった。一方,検体中にTTXと同程度の荷電状態の化合物が多く含まれるほど,TTX単体の検出は困難となる。本法でRT 0.1–0.4 min付近に検出された波形が,必ずしもTTXであるとは限らない点には注意すべきである。
溶媒がbufferの場合は ≥ 1.0 μg/mLのTTXを検出することができた(Figure 1)。さらに,検量線の作成と,それに基づく検体中TTX濃度の測定が可能であった(Figure 2)。CV 10%以内をLoQと考えた場合,TTX濃度が ≥ 3.42 μg/mLにおいて高い精密度での測定が可能と思われた(Table 1)。過去の報告にあるRPCカラムを用いたHPLC分析においては,≥ 4.0 μg/mLのTTX濃度が検出可能であった5)。この報告と比べ,我々の研究成果は,TTXの検出性能が同等の結果であった。一方で,過去の報告ではTTXを示す波形の検出に10 min程度を要する5)。我々の分析系では1.0 min以内にTTXの検出が可能という利点が考えられた。したがって,フグ組織などの食材由来の抽出液試料においてはbufferにて希釈し,本研究にて構築したHPLC測定系により分析することで,TTXの迅速な検出と定量が可能と思われた。
2. serum試料中のTTXの検出性能について続いて,serum試料中TTXの検出性能を検討した。serum試料中には,RTが0.1–0.4 minの分画に何らかの成分を検出した(Figure 3B)。TTXの波形と被る箇所に別成分を検出することは,TTXの正確な測定を困難にする。これはserum試料に除タンパク処理を施すことで,取り除くことに成功した(Figure 3D)。しかし,除タンパク処理に伴い,TTXを示す波形も消失していた(Figure 3F)。なお,TTXはアルカリ性や強酸性下では不安定であり,pH変化の影響を受けやすい13)。除タンパク処理における10%トリクロロ酢酸の添加がpHに大きく影響し,TTXが分解した可能性が考えられた。しかし,除タンパク法としてメタノールやアセトニトリルをserum試料に加える手法も試みたが,結果は同様であった。本研究にて検証した除タンパク法は特殊なフィルターや高価な試薬を要しないため,臨床応用に関して実現性が高いと考えた。しかし,実際に確かめてみるまで分からなかったが,除タンパク処理後にTTXの波形を認めなかったことで,TTXも沈殿物として析出する,あるいは,検体の成分に対して思わぬ化学反応や分解反応を引き起こしTTX自体が分解する可能性が考えられた。いずれにしても,serum試料中のTTXを検出することは困難であった。
3. urine試料中のTTXの検出性能についてurine試料中には,RTが0.1–0.4 minの分画に,他成分の波形を検出しなかった(Figure 4B)。そして,TTXをurine試料に溶解した場合のみ波形を認めた(Figure 4D)。尿の一般的な組成から考えて,2.5–5.0 minのRTに検出される波形は尿素や尿酸のものと思われる。基本的にurine試料は構成成分が少なく,serum試料に比べるとTTX検出が容易と思われた。一方で,本研究に用いたurine試料は健常人由来の市販品である。そのため,実際のTTX中毒患者のurine試料とは組成が異なると考えられた。すなわち,TTX中毒時のurine試料中には,TTXの検出を阻害する何らかの成分が存在する可能性が考えられた。しかし,少なくともserum試料よりurine試料を検査対象とした方が,医療現場においては本HPLC分析法の導入が期待できると判断した。続けて,urine試料中におけるTTXの定量性能を評価した。Figure 2で得られた検量線に基づき濃度を算出した場合,実際よりも低いTTX濃度が算出された(Figure 6)。すなわち,urine試料中のTTX波形下面積は,buffer試料中のTTX波形下面積よりも小さくなることが分かった。これは,buffer(pH 3.25)と市販のurine試料(pH 6.8)とのpHの違いが影響すると思われた。urine試料は中性付近のpHであるが,緩衝能が乏しい。したがって,urine試料中のpHの不安定さが影響し,TTXが多少なりとも分解された可能性が考えられた。あるいは,何らかの尿中成分がTTXに干渉し,分解を促進することも考えられる。urine試料を検体とする場合は,検量線もurine試料中TTXの測定結果に基づいて作成する必要があった。そこで改めてurine試料中TTXの希釈系列を測定し,直線性を確認したところ優れた検量線が得られた(Figure 7A)。しかしながら,buffer試料中のTTX濃度測定と比べ,urine試料中TTX濃度測定のばらつきは大きい傾向にあった(Figure 7B)。CV 10%以内となるLoQ濃度は ≥ 10.82 μg/mLであり(Table 3),検出感度は低いといえた。なお,TTX濃度はLC/MS/MS分析では15–150 ng/mL程度,LoQ濃度は ≥ 0.3 ng/mLと報告されている8)。本HPLC分析系をTTX中毒患者の生体試料に適応するためには,検体を濃縮する必要があった。濃縮操作も含め,検体の前処理法や測定条件(移動相溶液の種類や測定波長など)を工夫・変更することで,本HPLC分析系の測定性能はさらに向上する余地があると考えている。一方,我々が以前に構築したELISA測定系における尿中TTXのLoQは31.25 μg/mLであった11)。本HPLC分析系は,少なくともこのELISAに勝るTTX検出性能といえた。
また,HPLC分析の短所として,装置を導入している医療施設が少なく実施が困難である点が挙げられる。しかし,HPLC分析の汎用性は高く,カフェインなどの中毒物質測定や血中薬物動態の分析には古くから導入されている15),16)。今後,HPLC分析は臨床検査へのさらなる応用が期待される。また,得られた波形が必ずしもTTXのものとは限らないのが弱点である。そのため,現状は確定診断に導入できないと思われる。検体中のTTXの存在を確定させるためには,ELISA等の別の手法を用いる必要がある。緊急時を脱したTTX中毒患者の経過観察において,生体試料中のTTX濃度を測定するためにHPLC分析を活用することが現実的と思われた。本HPLC測定系の利点としては,特に結果が得られるまでの時間が極めて短い点が挙げられる。また,作業工程が少なく分析自体が簡単なことも利点として挙げられる。そのうえ,高い正確性と再現性を備えた測定法である点も重要である。なお,本HPLC測定系では30 minのRTを設定したが,実際には0.1–0.4 minの分画にTTXを示す波形が検出されている。そのため,RTは1.0 min程度の設定でも問題がない。既存のあらゆる臨床検査法と比較しても,この時間で測定が済むことは大きな利点といえる。Table 4には,尿中TTX検出性能に関する本HPLC測定系とELISAおよびLC/MS/MSの各種測定法による比較データを示した。やはり,LC/MS/MSの優れた検出性能が際立つが,HPLC測定系でも測定時間やRecovery,直線性(Linearity)では劣らないといえる。ELISAと比較すると,HPLC測定系は検出性能を示すデータの大半が優位であった。TTX中毒患者尿に対する検査法として考えると,現状はLC/MS/MSが第一選択となり,次いでHPLC,ELISAの順が妥当と思われる。一方で,本HPLC測定系は性能の改善を図る余地が充分にある。具体的には,効率的な除タンパク処理法の探究,測定波長や測定時間の改善,最適な溶媒の検証により,性能の向上が見込まれる。近年,TTXの検出を可能とする測定法の報告がほとんど見られず,発展が乏しい。その中で,本研究を通じて新たな測定系を提案することができた。検出性能等には改善の余地があるものの,TTX中毒の検査と診療の将来的な発展に寄与する,重要な知見を提供できたと考えている。
| Sample | TTX in urine | ||
|---|---|---|---|
| Method | HPLC (this study) | ELISA (our previous study) | LC/MS/MS |
| Measurement Time (min) | < 30 (less than 1 min may be possible) | < 180 | < 10 |
| CV (%) | 9.74–17.13 (TTX: 50–5 μg/mL) | 14.55 (TTX: 100 μg/mL) | 2.60 (TTX: 0.005 μg/mL) |
| Recovery (%) | 94.4–97.5 | data not shown | 93.0–101 |
| LoQ (μg/mL) | 10.82 | 31.25 | 0.0003 |
| Linearity (R-value) | 0.970 | 0.982 | 0.999 |
| Reference | Figure 5, 7, Table 3 in this study | Reference 11) | Reference 8) |
本研究において構築した,陰イオン交換クロマトグラフィーを原理とするHPLC測定系は,bufferやurine試料を検体とした場合に適応可能である。なお,TTXのHPLC測定系では,測定試料と同成分の溶媒を用いた希釈系列を作製し,その測定結果に基づいた検量線の作成が重要である。いくつかの弱点を考慮し,現状,臨床検査法としての有用性は乏しい。すなわち,検体の前処理法や測定条件の改善を図る追加検証が必須である。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本研究は,厚生労働科学研究費補助金「食品の安全確保推進研究事業」21KA3007の助成を受け実施した。