2023 Volume 72 Issue 2 Pages 197-204
2023 Volume 72 Issue 2 Pages 197-204
Rhodotorula属およびRhodotorula属の類縁菌であるSporobolomyces属は環境中に生息する環境酵母菌である。臨床検体から分離されるRhodotorula属のほとんどはR. mucilaginosa(旧名:R. rubra)であり,次いでR. glutinisおよびR. minutaが報告されている。今回,臨床分離保存株17株(内訳:R. mucilaginosa 12株,R. glutinis 2株,R. minuta 2株およびS. salmonicolor 1株)を用手法および自動同定感受性システムBD Phoenix M50にBD phoenix yeast IDパネルを併用し菌種同定を試みたところ,3株の不一致があった。用手法との一致率は82.3%(14/17株)であった。不一致の3株は,用手法の硝酸塩還元反応,カルチノイド色素および水様性粘液様コロニーの鑑別性状から菌種同定が一致した。日常検査ではM50で同定を実施し,用手法を併用することで,菌種同定が可能であることが判明した。さらに,抗真菌薬感受性試験を実施したところ,すべての分離株は,AMPH-B,5-FCに感性域を示し,FLCZ,MCFGおよびCPFGに耐性を示した。ITCZおよびVRCZは感性域と耐性域が混在していた。Rhodotorula属およびSporobolomyces属菌の抗真菌療法としてAMPH-Bおよび5-FCが有効であると考えられた。
The genus Rhodotorula and its relative, Sporobolomyces, are yeasts that are ubiquitous in the environment. Most of the Rhodotorula spp. isolated from clinical specimens are Rhodotorula mucilaginosa (formerly known as Rhodotorula rubra), followed by Rhodotorula glutinis and Rhodotorula minuta. We attempted to identify the 17 strains that were clinically isolated and stored (namely, 12 strains of R. mucilaginosa, 2 strains of R. glutinis, 2 strains of R. minuta, and 1 strain of Sporobolomyces salmonicolor) using the conventional method and the BD Phoenix M50 automatic identification sensitivity system (M50) in combination with the BD phoenix yeast ID panel. The concordance rate of M50 with the conventional method was 82.3% (14/17 strains). Although three strains showed different results when using M50, they were identified on the basis of their differential characteristics of nitrate reduction reaction, carcinoid pigment, and watery slime-like colonies by the conventional method. In routine examinations, the identification should be carried out using M50 first, followed by using the conventional method, because it is easy to identify the fungal species. In addition, antifungal susceptibility tests were conducted, and all the isolates were found to be sensitive to AMPH-B and 5-FC and resistant to FLCZ, MCFG, and CPFG. ITCZ and VRCZ showed inconsistent results for sensitivity and resistance. AMPH-B and 5-FC were considered effective as antifungal therapies for Rhodotorula spp. and Sporobolomyces spp.
Rhodotorula属菌およびSporobolomyces属菌は担子菌系の不完全酵母であり,形態学的にはCryptococcus属菌に類似している。顕微鏡下では円形または楕円形の出芽細胞として認められ,仮性菌糸はほとんど存在しないが,かすかな莢膜が形成されることがある。本菌属はカルチノイド色素carotenoid(β-carotene)を産生するため,サブロー・デキストロースCG寒天培地(BD)およびXM-カンジダ寒天培地(日水)の所見から特徴的なサーモンピンク色~紅色を呈する集落を形成する(色素性酵母:pigmented yeastとも呼ばれる)1)。また,カルチノイド色素を産生することによって食細胞の貪食殺菌作用に対する抵抗性が増大すると考えられている。
Rhodotorula属は49菌種があり,臨床検体から分離されるのはほとんどがR. mucilaginosaである。その他,R. glutinisおよびR. minutaが報告されている2),3)。Sporobolomyces属は約20菌種があり,最も一般的なのはS. salmonicolorである。S. salmonicolorは環境中から分離されることが多い。極まれに,免疫不全患者の感染症原因菌として報告されている(Table 1)4)。
| R. mucilaginosa | R. glutinis | R. minuta(*) | S. salmonicolor | |
|---|---|---|---|---|
| 生息場所 | 環境中 | 環境中 | 環境中 | 環境中 |
| 検出頻度 | 最も多い | しばしば | まれに | まれに |
| 射出胞子 | − | − | − | + |
| 硝酸塩還元反応 | − | + | − | + or − |
| 水様性粘液集落 | − | − | + | + |
| 尿素分解反応 | + | + | + | + |
| 生育温度 | 35℃ | 35℃ | 35℃ | 25~30℃(**) |
| 生熟速度 | 4日 | 4日 | 4日 | 5日 |
(*) Cystobasidium minuta(旧:R. minuta)
(**) 一部の分離株は,35℃で良好に生育できないことがある。
Rhodotorula属菌は自然界に広く分布しており,ヒトの皮膚,肺,尿,土壌,海水,植物,乳製品,およびシャワーカーテン,浴槽グラウトから検出され,医療環境だけでなく日常生活環境にも存在している。ヒトの感染は,免疫不全患者に多く見られ,敗血症,腹膜炎,心内膜炎および眼内炎などを起こし,その多くはカテーテル関連血流感染症(catheter-related bloodstream infections; CRBSI)である5),6)。Rhodotorula属菌の病原性はそれほど高くないと考えられているが,CRBSI患者由来株は環境由来株に比較してbiofilm産生量が多いとされている1)。血管内アクセスデバイス(メディカルデバイス挿入)は,biofilm形成に必要な表面を提供し,現在,ヒトの感染症において,かなりの割合を占めていると考えられる7)。Rhodotorula属菌が,一旦biofilmを形成するとアゾール系抗真菌薬に対する感受性が低下するとされているが,ポリエン系抗真菌薬のliposomal amphotericin B(L-AMB)は,biofilm形成株に対しほとんどMIC値の上昇がみられないことが報告されている1)。Rhodotorula属菌は,菌種同定が難しい菌種であり,また抗真菌薬感受性パターンもCandida属菌と異なり耐性傾向があるため,血流感染では迅速な対応が必要である。今回我々は当病院保管のRhodotorula属菌およびSporobolomyces属菌を用い,用手法およびBD phoenix M50の結果を比較し,さらに抗真菌薬感受性試験を実施したので報告する。
臨床分離株のRhodotorula属菌16株,Rhodotorula属の類縁菌(S. salmonicolor)1株の計17株を検討に用いた。検討に用いた菌株の内訳は血液由来4株,皮膚創部由来4株,爪由来2株および尿由来1株の計11株のR. mucilaginosaおよび環境由来(病院内の水廻り環境)の株は,R. mucilaginosa 1株,R. glutinis 2株,R. minuta 2株およびS. salmonicolor 1株の計6株である。本検討は,社会福祉法人恩賜財団済生会中和病院倫理委員会の承認(承認番号:02-005)を得て実施した。
2. 属レベル同定法Figure 1のフローチャートに沿って,以下に示した用手法による同定検査を実施した。

サブロー・デキストロースCG寒天培地(以下,SDA)に菌株を塗抹し,35℃,好気環境下で5日間培養した。S. salmonicolorは30℃,好気培養で5~10日間培養した。
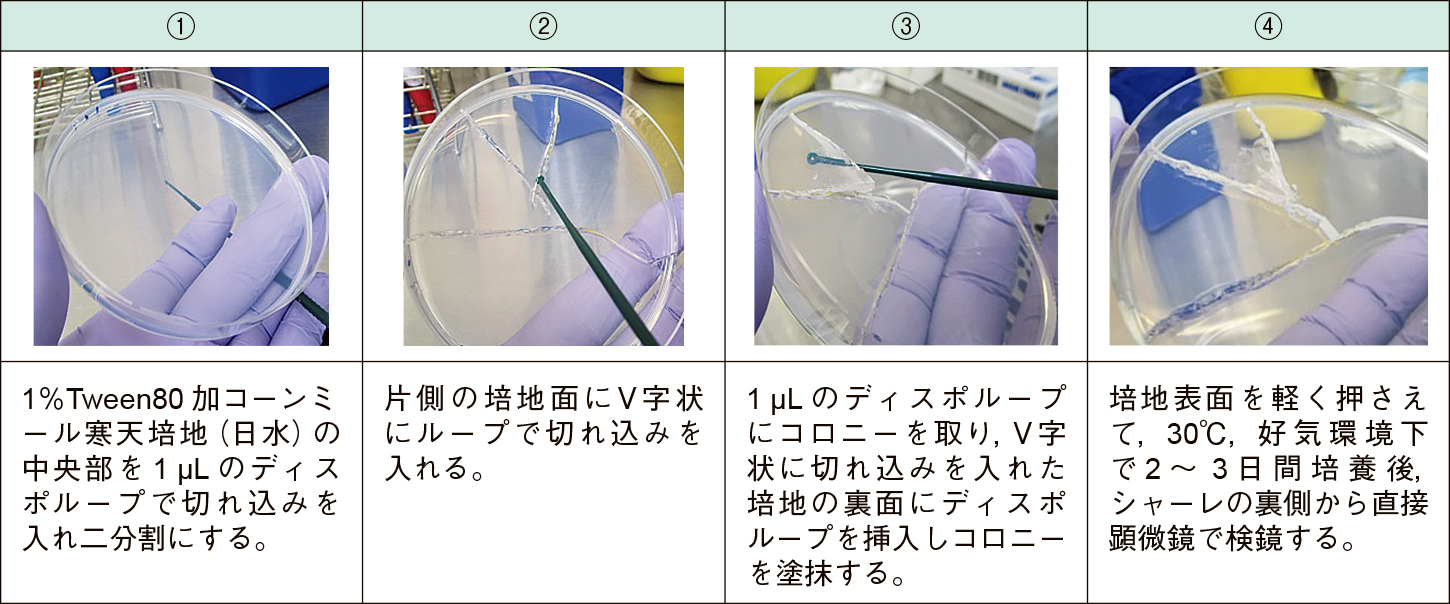
2) スライド培養法(slide culture method)による形態学的性状1%Tween80加コーンミール寒天培地(日水)の中央部を1 μLのディスポループで切れ込みを入れ二分割にする。片側の培地面にV字状に切れ込みを入れ,1 μLのディスポループにコロニーを取り,V字状に切れ込みを入れた培地の裏面にディスポループを挿入しコロニーを塗抹する。培地表面を軽く押さえて,30℃,好気環境下で2~3日間培養後,シャーレの裏側から直接顕微鏡で検鏡した(Figure 2)。
MIT法は出芽と射出胞子(ballistospore)の形成によって増殖する性状を調べる方法である。菌を塗抹したSDAと,塗抹していないSDAを向かい合わせにしてサージカルテープでシャーレの接合部を固定する。塗抹したSDAを上側にして,25~30℃,好気環境下で3~5日間培養した。放出された射出胞子が下側のSDAに鏡像およびサテライトコロニー形成の有無を観察した。
2) ウレアーゼ反応尿素培地(栄研)1~2 mLに少量の菌を接種し,35℃,好気環境下で2~3日間培養後,赤変をウレアーゼ分解陽性とした。
3) 硝酸塩還元試験自家調整硝酸塩溶液2 mLに少量の菌を接種し,35℃,好気環境下で一夜培養後,硝酸塩反応試薬(Beckman-Coulter,硝酸塩還元反応試薬MicroScan用)NIT-1(0.8%-Sulfanilic acid)およびNIT-2(0.5%-N,N-dimethyl α-naphthylamine)を5滴ずつ加え,ピンク色~淡紅色を陽性とした。但し,薄いピンク色は陰性とした。硝酸塩還元反応の判定例をFigure 3に示した。硝酸塩還元試薬はKNO3 1.0 g,NaH2PO4·H2O 6.0 g,Na2HPO4 0.6 g,蒸留水100 mLを混和し,pH 5.8に調整後,高圧蒸気滅菌して使用した。

BD Phoenix yeast IDパネルを用いて,添付文書に従い同定を実施した。
5. 抗真菌薬感受性試験Rhodotorula属菌およびSporobolomyces属菌は,Clinical and Laboratory Standards Institute(CLSI)で検査方法および判定基準が記載されていない菌属である。抗真菌薬感受性試験は酵母様真菌薬剤感受性キットAntifungal Susceptibility Testing of Yeasts:ASTY(極東)を応用し,添付文書に従って,微量液体希釈法にてamphotericin B(AMPH-B),flucytosine(5-FC),fluconazole(FLCZ),micafungin(MCFG),caspofungin(CPFG),itraconazole(ITCZ)およびvoriconazole(VRCZ)の7薬剤の最小発育阻止濃度(MIC)を測定した。結果は3~4日間培養後に目視判定した。但し,発育不良の場合はコントロールが陽性となるまで5~6日間,培養期間を延長した8)。
1)菌種同定済菌株をSDAに培養したところ発育性状は,Figure 4のように,R. mucilaginosaおよびR. glutinisはオレンジ色~サーモンピンク~赤紅色の異なる色素を産生するコロニーを形成した。R. minutaおよびS. salmonicolorはサーモン色の水様性粘液様コロニーを形成したが,S. salmonicolorはR. minutaよりも色味が薄い性状を示した。

2)スライド培養法による形態学的性状は,Rhodotorula属菌は球形の酵母様細胞を形成し,仮性菌糸を認めなかった。Sporobolomyces属菌は卵円形の少し大型の酵母様細胞を認めた。また,一部に長く伸びた酵母様細胞を認めた。Rhodotorula属菌よりもSporobolomyces属菌の方が細胞が大きい傾向にあった(Figure 5)。

1)MIT法はS. salmonicolorのみ鏡像およびサテライトコロニーを形成した。S. salmonicolorは,放出された射出胞子が下側のSDAに鏡像(鏡に映したように,上下が同じで左右だけ反対になった像)およびサテライトコロニー(大きなコロニーの周囲に小さな飛び散ったようなコロニーが衛星現象のように見える)を形成したが,Rhodotorula属菌はいずれの現象も認めなかった(Figure 6)。

2)ウレアーゼ反応は検討株すべて陽性を示した。
3)硝酸塩還元反応はR. mucilaginosaおよびR. minutaが陰性,R. glutinisは陽性を示した。S. salmonicolorは陽性を示したが,本菌は陰性の株が存在するため,参考値とした。
4)M50は,R. mucilaginosaおよびS. salmonicolorは用手法と一致したが(Table 2),M50でR. minutaと同定された3株のうち2株は硝酸塩還元反応(+)を示しR. glutinisと同定した(Table 3)。1株は硝酸塩還元反応(−)および水溶性粘液様コロニー(+)の性状からM50の結果と一致した。M50でCryptococcus neoformansと誤同定された1株は,硝酸塩還元反応(−),カルチノイド色素(+)および水様性粘液様コロニー(+)の性状からR. minutaと同定した(Table 2, 3)。
| R. mucilaginosa | R. glutinis | R. minuta | S. salmonicolor | 誤同定 | |
|---|---|---|---|---|---|
| M50 | 12 | 3 | 1 | 1(*) | |
| 用手法 | 12 | 2 | 2 | 1 |
(*) Cryptococcus neoformans
| M50同定菌種 | R. minuta | C. neoformans | ||
|---|---|---|---|---|
| 硝酸塩還元能 | + | + | − | − |
| 水溶性粘液集落 | + | + | + | + |
| カルチノイド色素 | + | + | + | + |
| 同定菌種 | R. glutinis | R. glutinis | R. minuta | R. minuta |
ASTYを応用した最小発育阻止濃度(MIC)はAMPH-B(0.125~0.5 μg/mL),5-FC(0.125~0.5 μg/mL)が感性域を示した。FLCZ(32~ > 64 μg/mL),MCFGおよびCPFG(> 16 μg/mL)は耐性を示した。ITCZ(0.5~4 μg/mL)およびVRCZ(0.25~8 μg/mL)は感性域と耐性域が混在した結果となった(Table 4)。抗真菌薬感受性の判定例をFigure 7に示した。
| N = 16 | Rhodotorula 属(MIC: μg/mL) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 0.03 | 0.06 | 0.125 | 0.25 | 0.5 | 1.0 | 2.0 | 4.0 | 8.0 | 16 | 32 | ≥ 64 | |
| AMPHB | 2 | 8 | 6 | |||||||||
| 5-FC | 11 | 2 | 3 | |||||||||
| FLCZ | 2 | 14 | ||||||||||
| ITCZ | 6 | 4 | 5 | 1 | ||||||||
| VRCZ | 2 | 1 | 2 | 3 | 7 | 1 | ||||||
| MCFG | 16 | |||||||||||
| CPFG | 5 | 11 | ||||||||||
| N = 1 | Sporobolomyces属(MIC: μg/mL) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 0.03 | 0.06 | 0.125 | 0.25 | 0.5 | 1.0 | 2.0 | 4.0 | 8.0 | 16 | 32 | ≥ 64 | |
| AMPHB | 1 | |||||||||||
| 5-FC | 1 | |||||||||||
| FLCZ | 1 | |||||||||||
| ITCZ | 1 | |||||||||||
| VRCZ | 1 | |||||||||||
| MCFG | 1 | |||||||||||
| CPFG | 1 | |||||||||||

Rhodotorula属菌およびSporobolomyces属菌の抗真菌薬感受性試験法は確立されていないので,ASTY による感受性結果を参考値としたが,今回の検討では,Rhodotorula属菌およびSporobolomyces属菌はFLCZおよびechinocandin系抗真菌薬に自然耐性であることが示された。一方,AMPH-Bおよび5-FCには感受性であることが示された。FLCZの同系薬であるITCZおよびVRCZのアゾール系抗真菌薬に高いMIC値を有する株や両薬剤に抗菌活性を有していた株が混在していたが,ITCZよりもVRCZの方があまり感受性でないことを示した。
Rhodotorula属菌の中でヒトの感染症に最も関与する菌種は,R. mucilaginosaであり,次いでR. glutinisおよびR. minutaが報告されている9)。ヒトから検出されるRhodotorula属菌は上記の3菌種をターゲットに考慮すると,菌種同定は比較的容易である。今回,用手法でR. mucilaginosaと同定した12株は,M50の結果と一致した。しかし,2株のR. glutinisはM50でR. minutaと同定され,また2株のR. minutaは,1株がC. neoformansと同定され不一致が認められた。Rhodotorula属菌は形態学的および生理学的特徴が,Cryptococcus属菌に類似しているためM50では誤同定されたと考えられた。C. neoformansはメラニン色素の産生を担うフェノールオキシダーゼ活性を有する菌種なので,SDA培地に発育するムコイド様または白色コロニーの色調から鑑別は容易である。
M50はR. mucilaginosa,R. glutinisおよびR. minutaの3菌種が同定可能とされているが,今回の検討では,R. mucilaginosa以外の2菌種について,同定精度はよくなかった。日常検査ではM50で同定を実施し,R. mucilaginosa以外の場合,用手法のMIT法,硝酸塩還元反応,カルチノイド色素およびコロニーの発育性状試験を実施する必要がある。
Sporobolomyces属菌の特徴は,コロニー周辺に,霧吹きで吹いたように多数のコロニーが認められる。これは,コロニーから放出された射出胞子が増殖し,新たなサテライトコロニーが形成されたことに起因する。MIT法はRhodotorula属菌とSporobolomyces属菌を鑑別する有用な増殖法であると考えられた。
Sporobolomyces属菌は培地上で速やかに発育し,約5日で成熟する。最適な生育温度は25~30℃であるが,一部の分離株は,35℃で増殖できない場合がある。コロニーは滑らかで,明るいオレンジ色は典型的で,Rhodotorula属菌に酷似している。これはカルチノイド色素(carotenoid pigment)であるトルラロジン(torularhodin)によって引き起こされる異なった外観を呈する湿ったコロニーを形成するためである。Rhodotorula属菌はSporobolomyces属菌およびCryptococcus属菌と同様に担子菌類に属するため,ウレアーゼ酵素を生成し,炭水化物を発酵しない特徴を有している。
用手法における同定検査は検査技術および経験が必要であるため,M50を所有していない施設において本菌属を分離した場合,同定フローチャートに沿って同定検査を進めていくことにより,M50や同定キットなどを用いなくても容易に鑑別同定が可能と思われる。市販の簡易同定キット(API 20C AUX system,API ID 32C:bioMerieux,PapID Yeast Plus:極東など)は簡便ではあるが,キットのみに依存した単独での同定は誤同定のリスクがあるため,必ず用手法の結果から菌種を推定し,確認用として使用すべきである。
血液培養陽性のグラム染色で仮性菌糸を認めない酵母様真菌が観察され,さらに血中(1→3)β-D-グルカンの上昇が認められない場合は,Rhodotorula属菌およびCryptococcus属菌を考慮する必要がある。但し,直接塗抹標本では,Candida属菌感染と間違えられる可能性があるので注意する必要がある。SDAまたはXM-カンジダ寒天培地などに特徴的なサーモンピンク色のコロニーを形成した場合,Rhodotorula属菌を強く疑うことができる。
Rhodotorula属菌による感染症では血中(1→3)β-Dグルカンの上昇が起こらないとされている。Cryptococcus属菌の細胞壁は(1→6)β-Dグルカンが主成分であり,また厚い莢膜多糖体を有していることが原因で,血中の(1→3)β-Dグルカンはあまり上昇しないことが報告されている2)。従って,Cryptococcus属菌と同じ担子菌系のRhodotorula属菌もあまり上昇しないと考えられる。Rhodotorula属菌の細胞壁は(1→6)β-Dグルカンが主成分であり,標的分子が異なることからechinocandin系抗真菌薬に自然耐性である。
Rhodotorula属菌の抗真菌薬耐性以外に治療に難渋する要因としては,biofilmの形成が考えられる。アゾール系抗真菌薬耐性の機序の一つとして,biofilm形成菌内の薬剤排出ポンプの過剰発現が報告されている。アゾール系抗真菌薬の標的分子は,エルゴステロールの合成を担うラノステロール14α-脱メチル酵素であるが,エルゴステロールの構成比がその初期に比較して,中~後期には減少し,中間体(ステロール)が増加してその構成比を変化させていると考えられている。これらの結果,biofilm形成過程の時期によって異なる複数の耐性機序が存在することが示唆されている10)。そのためRhodotorula属菌によるCRBSI患者由来株は環境由来株に比して有意にbiofilmが形成されると考えられる。従って,Rhodotorula属菌のbiofilm形成菌は,アゾール系抗真菌薬に低感受性である可能性が考えられる。FLCZに対する耐性のメカニズムはbiofilm形成と関係なく,高いMIC値は固有の耐性を示している可能性が考えられる。今回の検討において,FLCZの同系薬であるITCZおよびVRCZに高いMIC値を有する株が認められたことから,治療の際は抗真菌薬剤感受性試験が必要である11),12)。
Rhodotorula属菌は化学療法後の好中球減少症や血管内カテーテルの使用,抗真菌薬の投与など患者側の要因が本菌による血流感染症を発症する主な原因と考えられる。免疫不全状態や血管内留置カテーテルの挿入は,Rhodotorula属菌の危険因子となり得ると考えられる。
当病院保存株のRhodotorula属菌およびSporobolomyces属菌を用いて,用手法およびBD phoenix M50の結果を比較し,さらに抗真菌薬感受性試験について報告した。日常検査ではM50で同定を実施し,用手法を併用することで,菌種同定が可能であった。M50を所有していない施設においてもフローチャートに沿った方法で菌種同定は可能であった。すべての分離株の抗真菌薬感受性は,AMPH-B,5-FCが最も有効であった。FLCZ,echinocandinは耐性を示したが,ITCZおよびVRCZは感性域と耐性域が混在していたことから抗真菌薬に対する感受性を知ることが重要であると思われた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。