2023 Volume 72 Issue 2 Pages 287-293
2023 Volume 72 Issue 2 Pages 287-293
中皮細胞は尿路と腹腔との交通が生じた場合,尿沈渣で認めることがある。今回われわれは,ロボット支援腹腔鏡下前立腺全摘除術(RARP)後に生じた吻合部尿漏により尿が腹腔に貯留し,尿沈渣で中皮細胞を検出した症例を経験したので報告する。症例は前立腺癌でRARPを施行した70代男性で,3日前から食欲不振と嘔気が出現した。退院時の採血結果と比較して血清K,BUN,CRE,CRPの急激な上昇を認め,腹水が出現していた。尿沈渣で中型から大型の類円形細胞が散在性または小集塊状に出現し,一部の細胞ではつなぎ目に窓形成を認めた。核は単核からときに多核で,核小体を認めたが,核クロマチンの増量はみられなかった。以上の所見から中皮細胞と報告した。採取された腹水のK,BUN,CRE値は血清よりも高値であった。病歴と検査所見からRARP後の吻合部尿漏が疑われた。残りの尿で液状化検体細胞診(LBC)標本を作製し,免疫染色を行ったところD2-40陽性であり,尿沈渣で検出した細胞は中皮細胞と確認した。尿道カテーテルを留置すると3日後には採血データが正常化した。抜去後も採血データに異常がないことを確認して,受診から7日で退院した。自験例は血清と腹水でのK,BUN,CRE値の比較,免疫染色による中皮細胞の確認,主治医との円滑なディスカッションを行えたことで,過去の症例経験が活かされたことを実感できた症例であった。
Mesothelial cells were detected in urine sediments on the anastomose urinary tract and peritoneum. We report a case of urine leakage after robot-assisted laparoscopic radical prostatectomy (RARP) detected mesothelial cells in urine sediments. A seventy-year-old man was admitted to our hospital with a complaint of anorexia and nausea. His serum K, BUN, CRE, and CRP levels suddenly increased at the time of discharge, and ascites appeared. Oval cells were seen scattered or in small clusters, and cell-to-cell apposition was recognized at the points where cells are joined. Cells had nucleoli in mononuclei and multinuclei, but no hyperchromatin was seen in the nuclei. Therefore, we identified them as mesothelial cells on the basis of these findings. K, BUN, and CRE levels in ascites were higher than those in serum. The doctor in charge suspected an anastomotic leakage on the basis of his medical history and laboratory data. Immunocytochemically, the oval cells were positive for D2-40, so they were identified as mesothelial cells. Three days later, his laboratory data returned to normal with the use of an indwelling catheter in the urinary bladder. We were able to compare the K, BUN, and CRE levels in serum with those in ascites and identified mesothelial cells by immunostaining. In addition, the discussions with the doctor in charge went smoothly. We were able to make good use of the last case’s experience.
中皮細胞は胸腔や腹腔を覆う一層の細胞であり,通常の尿沈渣で認めることはない。しかし,尿路と腹腔との交通が生じた場合,尿沈渣で中皮細胞を認めることがあるとされている1)。過去にわれわれは医学検査Vol. 67 No. 2 2018で,尿沈渣が診断の端緒になった膀胱破裂例において尿沈渣で中皮細胞を認めたので症例報告をした2)。今回われわれは,ロボット支援腹腔鏡下前立腺全摘除術(robot assisted laparoscopic radical prostatectomy; RARP)後に生じた吻合部尿漏のため尿が腹腔に貯留し,尿沈渣で中皮細胞を検出した症例を経験したので報告する。
患者:70代,男性。
既往歴:前立腺肥大症,前立腺癌,大腸ポリープ,メニエール症候群。
現病歴:前立腺癌で15日前に当院でRARPを施行した。術後5日目に問題なく退院していたが,3日前から食欲不振と嘔気が出現したので,当院泌尿器科外来を受診した。受診時の採血では血清KやBUN,CRE,CRPが高値であり,退院時の採血結果と比較して急激な上昇を認めた。CTではこれまで認めなかった腹水が出現しており,同日に腹腔穿刺が施行された。腹水のK,BUN,CREは血清と比べて高値であった。尿生化学検査結果も考慮すると,この腹水は尿が腹腔に流入したものであると考えられた(Table 1)。尿培養および腹水培養検査では,ともにEnterococcus faecalisが検出された。吻合部尿漏および腹膜炎の治療のため,同日に入院となった。
| 生化学 | 尿定性 | 尿生化学 | |||
|---|---|---|---|---|---|
| Na | 131 mmol/L | 混濁 | (+) | Na | 94 mmol/L |
| K | 5.74 mmol/L | 色調 | 黄 | K | 43.79 mmol/L |
| Cl | 97 mmol/L | 比重 | 1.015 | Cl | 80 mmol/L |
| BUN | 73.2 mg/dL | pH | 6.5 | BUN | 633.5 mg/dL |
| CRE | 4.39 mg/dL | 蛋白 | (3+) | CRE | 110.61 mg/dL |
| eGFR | 11.1 | 糖 | (+) | TP | 472.91 mg/dL |
| AST | 25 U/L | ケトン体 | (−) | ||
| ALT | 29 U/L | 潜血 | (2+) | ||
| LDH | 200 U/L | ウロビリノーゲン | (±) | ||
| TP | 7.1 g/dL | ビリルビン | (−) | ||
| ALB | 3.4 g/dL | 亜硝酸塩 | (−) | ||
| CRP | 14.27 mg/dL | 白血球 | (3+) | ||
| 血算 | 尿沈渣 | 腹水 | |||
| WBC | 13.7 × 103/μL | 赤血球 | 31.3/HPF | Na | 118 mmol/L |
| RBC | 4.40 × 106/μL | 白血球 | 1,094.3/HPF | K | 15.92 mmol/L |
| Hb | 14.2 g/dL | 細菌 | (+) | Cl | 120 mmol/L |
| Ht | 40.9% | 硝子円柱 | 1–4/WF | BUN | 208.6 mg/dL |
| MCV | 93.0 fL | 大食細胞 | (+) | CRE | 32.90 mg/dL |
| MCH | 32.3 pg | 中皮細胞 | (+) | TP | 1.0 g/dL |
| MCHC | 34.7 g/dL | ALB | 0.7 g/dL | ||
| Plt | 389 × 103/μL | ||||
尿検査所見:尿は混濁しており,蛋白尿,血尿,強い膿尿と細菌尿を認めた。その中に中型から大型の類円形細胞が散在性または小集塊状に出現していた(Figure 1)。白血球大の核を有し,単核からときに多核で,核小体を認めたが,核クロマチンの増量はみられなかった。細胞質は厚みがあり,辺縁がやや不明瞭で,一部の細胞ではつなぎ目に窓形成(window formation)を認めた(Figure 2, 3)。尿沈渣のメイ・ギムザ染色(May-Giemsa;MG染色)でも同様の細胞が散在性または小集塊状に出現していた。細胞質は好塩基性で,体腔液に出現する反応性中皮細胞に類似していた(Figure 4)。細胞形態および臨床情報から中皮細胞を疑って主治医に報告した。細胞確認のため液状化検体細胞診(liquid based cytology; LBC)標本を数枚作製し,パパニコロウ染色(Papanicolaou;Pap染色)と免疫染色を行った。
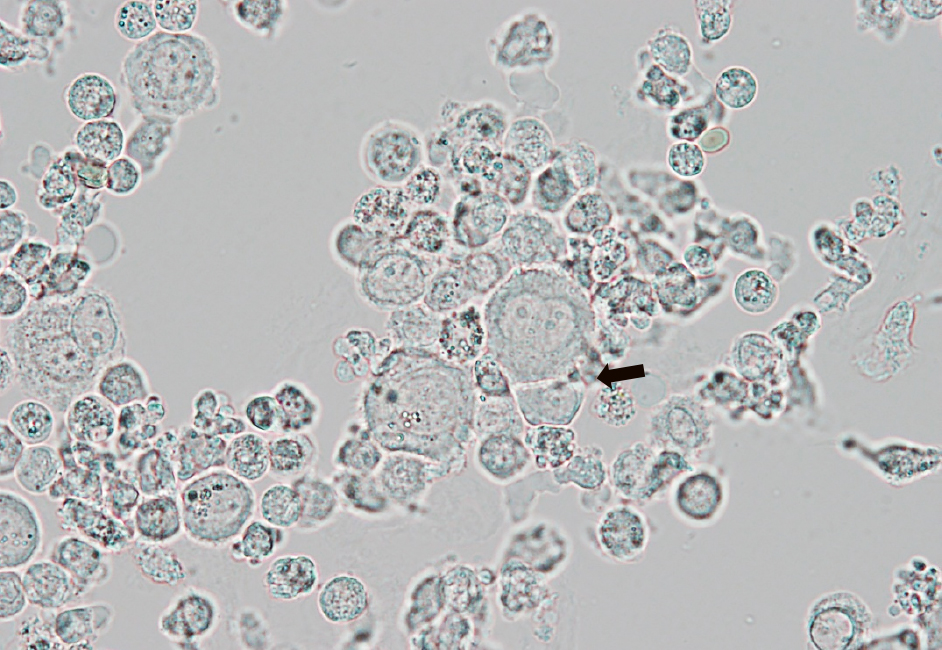
大型の単核~2核細胞が出現し,核小体が目立つ。一部に窓形成を認める(矢印)。

A:細胞同士のつなぎ目に窓形成を認める(矢印)。
B:3つの核を有する大型細胞。細胞質辺縁はやや不明瞭である。

細胞質は厚く,辺縁はやや不明瞭である。
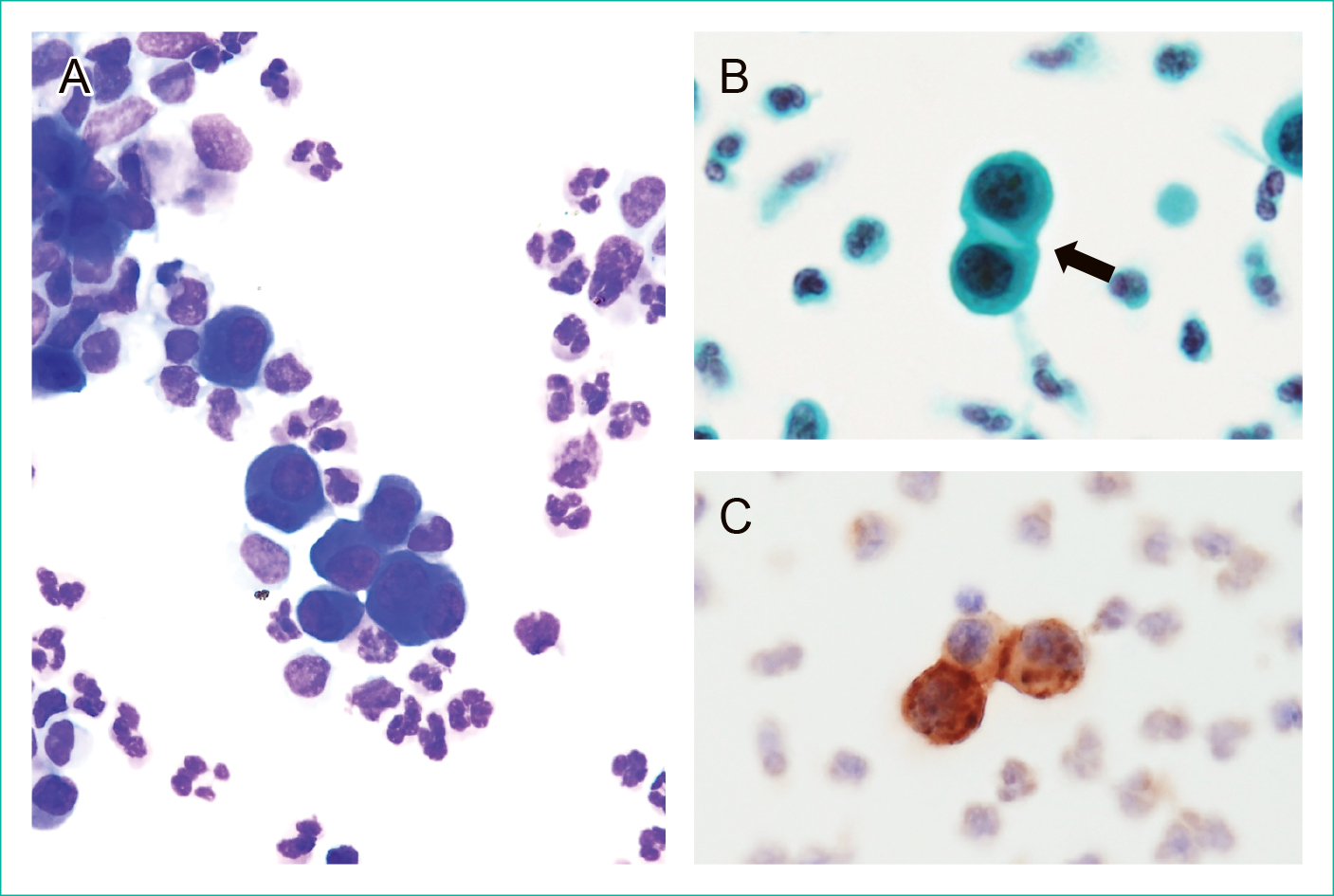
尿沈渣と同様の細胞が出現し,一部に窓形成を認める(矢印)。
中皮細胞マーカーであるD2-40に陽性である。
Pap染色所見:尿沈渣と同様の細胞が出現していた。細胞質はやや厚みがあり,核小体を認めたが,核クロマチンの増量は乏しかった。一部の細胞では窓形成も観察された。
免疫染色所見:中皮細胞と報告した細胞はD2-40陽性,CD68とBer-EP4陰性であり,尿沈渣で検出した細胞は中皮細胞と確認した(Figure 4)。
経過:外来受診日と同日に膀胱造影が施行されたが,膀胱外への造影剤の溢流所見はごく軽度で,確定診断には至らなかった。しかし,尿沈渣で中皮細胞を認めたことや腹水生化学検査所見などから尿漏が疑われ,尿道カテーテルを留置すると3日後には採血データが正常化した。カテーテル抜去後も採血データに異常がないことを確認して,受診から7日で退院となった。
RARPは前立腺癌に対してロボット支援下に前立腺全摘除を行う手術である。本邦では2009年に薬事承認された「da Vinciサージカルシステム」を使用し,術者はコンソールで三次元画像を観察しながら微細な手術操作ができる。2012年に保険適用となり導入施設および手術数は急速に増加し,本邦においても限局性前立腺癌に対する新たな標準術式として定着した3)。当院では2013年にda Vinciシステムを導入し,前立腺手術を開始した。RARPの合併症の一つとして吻合部尿漏がある4)。RARPでは尿路再建時に尿道膀胱吻合を行い,尿道カテーテルを留置する。自験例では退院時にカテーテル抜去後,吻合部尿漏がないことを確認した。しかし,まれに排尿時の尿道膀胱内圧上昇により後に吻合部から尿が漏出し,RARPは経腹膜的に施行されることから,漏出した尿が腹腔内に溢流することがある。尿沈渣での中皮細胞の検出と採取した腹水の生化学検査結果から,自験例の機序として,まず尿道膀胱吻合部から漏出した尿が腹腔内に貯留し,今度は腹腔内圧の上昇時に貯留した尿が吻合部から尿路に戻ってきた可能性が考えられた。受診時の尿検査では膿尿・細菌尿を呈しており,尿路感染が考えられた。さらに腹痛も認め,採血の炎症マーカーも高値となっていることから,その尿が腹腔に溢流したことで腹膜炎を発症したと考えられた。尿と腹水の培養検査では,ともにEnterococcus faecalisが検出されている。腹水が貯留する原因として腹膜炎やリンパ漏がある。自験例は腹膜炎により腹水が貯留したのか,腹腔に尿が溢流したのか鑑別を要するが,尿沈渣や血液,腹水検査結果から腹腔に尿が溢流したと考えられ,その結果腹膜炎を発症したと推察された。また,リンパ漏による腹水の場合は肉眼的に乳糜を呈し,腹水の中性脂肪(TG)が200 mg/dL以上となることから鑑別可能である。尿沈渣で中皮細胞を検出した症例報告の論文は膀胱破裂症例が多いが,RARP症例についても手術数の増加に伴い今後遭遇する機会が増加する可能性があり,尿沈渣の臨床的意義がますます高まることが期待される。
腹腔内に尿が貯留すると,腹膜を介して尿が再吸収される(逆腹膜透析)ことで血清K,BUN,CREの上昇がしばしばみられ,偽腎不全(pseudo-renal failure)の状態を呈する5)。自験例は症状の出現とともにこれまで認めなかった腹水が出現し,血清K,BUN,CREの急激な上昇を認めている。急性腎障害の診断基準としてKDIGO分類が用いられている。KDIGO分類は従来のRIFLE分類とAKIN分類を基に,より多くの急性腎障害を診断できるように作成された。KDIGO分類は,①48時間以内に血清CRE値が0.3 mg/dL以上増加した場合,②血清CRE値がそれ以前7日以内にわかっていたか,予想される基礎値よりも1.5倍以上の増加があった場合,③尿量が6時間にわたって0.5 mL/kg/時に減少した場合のいずれかを満たすと急性腎障害と診断される。また,重症度分類はAKIN分類に類似し3ステージに分けられている。自験例は受診10日前(退院時)が判明している直近の血清CREであるが,その時点と比較して基礎値の3倍以上の血清CRE上昇を認める。したがって,自験例の術後からの腎機能変化はKDIGO分類から急性腎障害と考えられ,重症度分類はステージ3に相当する。治療後は血清K,BUN,CREが症状出現前の値に戻っていることから,偽腎不全の状態であったと考えられた(Figure 5, Table 2)。また,腹腔貯留液が尿であるため,腹腔穿刺液中のK,BUNが血中の値と比べて高値であることが診断に役立つという報告もある6)。自験例では血清,腹水,尿のK,BUN,CREを測定しており,それぞれの値を比較すると,自験例の腹水は尿が腹腔内に溢流したものと考えられた(Table 1)。

| 15日前 | 14日前 | 10日前 | 受診日 | 1日後 | 3日後 | 6日後 | 7日後 | |
|---|---|---|---|---|---|---|---|---|
| K(mmol/L) | 3.85 | 4.11 | 4.31 | 5.74 | 5.02 | 4.24 | 4.42 | 4.31 |
| BUN(mg/dL) | 17.8 | 18.8 | 17.6 | 73.2 | 36.6 | 9.7 | 11.6 | 12.4 |
| CRE(mg/dL) | 0.84 | 0.80 | 0.73 | 4.39 | 1.20 | 0.63 | 0.65 | 0.70 |
| eGFR | 67.5 | 71.2 | 78.7 | 11.1 | 45.7 | 92.4 | 89.3 | 82.4 |
| イベント | RARP施行 | 退院 | 緊急入院尿道カテーテル留置 | 尿道カテーテル抜去 | 退院 |
自験例の尿沈渣に出現していた中皮細胞は,体腔穿刺液中にみられる一般的な中皮細胞の特徴7)とほぼ同様の所見を示していた。中皮細胞と鑑別を要する細胞として大食細胞,深層型扁平上皮細胞,腺癌細胞が挙げられる。中皮細胞は細胞表面の微絨毛により,細胞質が厚ぼったいのに対して細胞質辺縁は不明瞭に見える。したがって,染色すると中心部に向かって濃染傾向を示し,辺縁部は淡くなる。深層型扁平上皮細胞や腺癌細胞などの上皮細胞は細胞質辺縁まで明瞭であるため,この点が上皮細胞との鑑別点となる。また,中皮細胞の細胞質表面には滴状表面構造がみられることもある。さらに,腺癌細胞は核クロマチンの増量や核形不整,核の大小不同,腫大した核小体などの核異型を認めるが,通常の中皮細胞は核異型に乏しい。中皮細胞や深層型扁平上皮細胞はいずれも平面的な細胞集塊を作ることはあるが,中皮細胞は微絨毛により結合部が窓様にみえる特徴がある(窓形成)。大食細胞の細胞質辺縁も不明瞭にみえるが,細胞質は淡くレース状で,細胞中心部から辺縁部まで染色性に差がない点が中皮細胞と異なる。大食細胞は時に集塊を作るが細胞境界は不明瞭で,中皮細胞のような窓形成はみられない。自験例のように尿沈渣が炎症性背景の場合には,出現細胞が多く中皮細胞の検出に苦慮することがある。その中で細胞質が厚い比較的大型の細胞を見つけ,細胞質辺縁構造や細胞同士の接合部を観察して中皮細胞を鑑別する。また,S染色で白血球(輝細胞)や深層型扁平上皮細胞は染色されにくいのに対して中皮細胞は赤紫色を呈するため,中皮細胞をよりピックアップしやすくなる。
しかし,通常は中皮細胞を尿沈渣中に認めることがないので,尿沈渣のみで判断することは容易ではない。そのため,臨床情報や尿以外の検査結果を参照する必要がある。われわれは過去の膀胱破裂症例の経験2)から,尿沈渣以外の有用所見として,①尿路と腹腔の交通が起こる可能性がある既往歴の存在,②血清K,BUN,CREの不規則な変動(逆腹膜透析による偽腎不全),③K,BUN,CRE値が血中より腹腔貯留液の方が高値,④膀胱造影での膀胱外への造影剤の溢流所見,以上4点に着目した。自験例は尿沈渣で中皮細胞を疑った時点で,先述の①と②を確認することで迅速に主治医に報告できた。また,われわれは過去に経験した膀胱破裂症例を,泌尿器科医,病理医,病理検査技師,腹部超音波検査技師らで毎月行っている「泌尿器カンファレンス」で共有していた。尿の腹腔内溢流を示唆する検査所見の一つとして,尿沈渣中の中皮細胞の存在についてはほとんど知られておらず,有意義なカンファレンスとなった。この症例共有により,自験例は尿沈渣結果報告時に主治医とのディスカッションも円滑であり,③を確認するための腹腔穿刺と④膀胱造影の検査計画がすでに立てられていた。さらに,尿沈渣でLBC標本を数枚作製して免疫染色を行い,中皮細胞の確認も行うことができた。このように,検査計画や診断過程において,過去の経験が活かされたことを実感した。
免疫染色において,中皮細胞マーカーとしてカルレチニン,CK5/6,D2-40,WT-1,腺癌マーカーとしてCEA,MOC-31,Ber-EP4,B72.3,TTF-1,組織球マーカーとしてCD68などがある。通常はこれらのマーカーを複数組み合わせて細胞由来の特定を行う。しかし,自験例は尿検査後に腹腔穿刺や膀胱造影などの精密検査を行い,同日にカテーテルを再留置し治療が開始されたので,限られた残りの尿検体でPap染色と免疫染色用のLBC標本を作製した。作製できたLBC標本は4枚であり,1枚をPap染色,3枚を免疫染色に使用した。自施設で保有する抗体の中で中皮細胞の特定のためD2-40を,組織球,腺癌細胞の否定のためそれぞれCD68,Ber-EP4を使用した。
確定診断には膀胱造影での膀胱外への造影剤の溢流所見が有用である。しかし,ときに偽陰性となる場合があり,注意が必要である8)。自験例は膀胱造影が行われたものの,確定診断となるほどの明らかな所見は得られなかった。このように画像検査で必ずしも確定診断が得られるわけではないので,非侵襲的な検査である尿沈渣の果たす役割はきわめて大きい。また,中皮細胞は尿路と腹腔との交通が生じない限り尿沈渣に出現することはないので,免疫染色などで中皮細胞を確認できれば,確定診断となり得る尿沈渣成分といえる。
自験例は追加検査として血清と腹水でのK,BUN,CRE値の比較,免疫染色による中皮細胞の確認,さらには主治医との円滑なディスカッションを行えたことで,過去の症例経験が活かされたことを実感できた症例であった。また,当院では一般検査と病理検査が同一部門にあり,免疫染色などの病理に関する検査を実施しやすい環境にあることも自験例に活かされたと考えた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。