2023 Volume 72 Issue 3 Pages 382-389
2023 Volume 72 Issue 3 Pages 382-389
新しいCB作製方法であるパラフィン・寒天サンドイッチ法において,作製過程で加える寒天が熱処理後の免疫組織化学法標本中から消失する既知の事実に着目し,ヘマトキシリン・エオシン染色標本などの観察時に妨げと成り得る寒天の除去を目的として,寒天が消失する温度条件と加温時間条件について残存寒天数を比較した。その結果,温度条件98℃の残存寒天数は,未加温は加温10分後以降と比較して差を認め,加温0.5分後は加温15分後以降と比較して差を認めた。さらに温度条件80℃と90℃の残存寒天数を未加温と比較した結果,加温60分後において温度条件80℃では最大15%の減少を示し,温度条件90℃では最大50%の減少を示したのに対して,温度条件98℃では加温0.5分後で99%の減少を示し,加温15分後以降では0.05%以下で一定を示した。以上の結果より,寒天の完全融解に必要とされる温度条件は98℃で,その完全融解最短時間は加温15分後であることが明らかとなった。また,第一報からの使用実績より得られた作製手順の変更や新たな知見も報告する。
In the paraffin-agar sandwich method, which is a new cell block manufacturing method, we focus on the known fact that the agar added during the preparation process disappears from the specimens for immunohistochemistry after heat treatment. To remove the agar that may interfere with the observation of hematoxylin-eosin-stained specimens, the temperature and heating time at which the agar disappears were quantified, and the amount of residual agar was compared. Results showed that at 98°C, there was a difference in the number of residual agar between the start of heating at 0 minutes and after 10 minutes of heating or later and between after 0.5 minutes of heating and after 15 minutes of heating or later. Furthermore, comparison of the number of residual agar between heating at 80°C and that at 90°C showed that after 60 minutes of heating, the maximum degrees of decreases were 15% at 80°C and 50% at 90°C, whereas at 98°C, a decrease of 99% was observed after 0.5 minutes of heating, which remained constant at 0.05% or less after 15 minutes of heating. From the above results, it was shown that the temperature required for the complete melting of agar was 98°C, and the shortest time for the complete melting of agar was 15 minutes after heating. In this paper, we will also report changes in the preparation procedure and new findings obtained from the first report.
セルブロック(cell block; CB)とは,様々な方法で集塊にした細胞検体を用いて作製されるパラフィン包埋ブロックのことである1)~8)。このCBを用いることで組織検体と同様に細胞検体の薄切標本を作製できるため,近年免疫組織化学(immunohistochemistry; IHC)法や蛍光in situハイブリダイゼーション(fluorescence in situ hybridization; FISH)法のみならず,遺伝子関連検査(体細胞遺伝子検査)にも利用されており9)~12),その作製方法は平成30年度の診療報酬改定において細胞診(CB法によるもの)から病理組織標本作製(CB法によるもの)に項目の見直しが行われ13),改めてその有用性が認識されている。そこでこれまでにも我々は,パラフィン・寒天サンドイッチ(paraffin-agar sandwich; PAS)法と名付けた新しいCB作製方法を考案し報告しているが14),さらに今回我々はPAS法で加える寒天が熱処理後のIHC法標本中から消失する既知の事実に着目し,ヘマトキシリン・エオシン(Hematoxylin-Eosin; HE)染色標本やその他多くの特殊染色標本の観察時に妨げと成り得る寒天の除去を目的として,寒天が消失する温度条件と加温時間条件について比較検討するとともに,第一報から7年間のPAS法使用実績より得られた作製手順の変更や新たな知見をPAS法-補遺として報告する。
寒天 試薬特級(Agar:富士フイルム和光純薬株式会社)を使用した。
2. 標本作製方法1)細胞検体は使用せず寒天 試薬特級(以下,寒天)のみを使用したPAS法により,同一の手順で5つのCB用試料を作製しパラフィン浸透する。
2)パラフィン浸透後,5つのCB用試料を1つの包埋皿に並べてパラフィン包埋ブロックを作製する。
3)5つの試料が並んだパラフィン包埋ブロックより,比較方法の条件ごとに2枚のスライドガラスを用意し,それぞれのスライドガラスに3 μmの厚さで薄切したパラフィン切片を1枚ずつ貼り付ける。
3. PAS法-補遺ここでは細胞検体を使用する通常の方法を示す。
1)サンプリングチューブ(PEサンプリングチューブ1.5 mL:アジア器材株式会社)1個につき浸透・包埋用パラフィン(Paraplast High Melt Paraffin:ライカマイクロシステムズ株式会社)2粒を加える(Figure 1A)。

A:サンプリングチューブにパラフィンを加える。
B:融解したパラフィンが中心部の窪んだ円錐状に再凝固する。
C:細胞検体をチューブに加える。
D:遠心分離後,寒天を直接添加する。
E:遠心分離後,パラフィン層の上に「細胞層」「寒天層」「10% NBF」の順で積層される。
F:パラフィン層と寒天層を切離する。
G:切離したチューブを包埋カセットに入れパラフィン浸透する。
H:パラフィン浸透完了後,パラフィン包埋ブロックを作製する。
※1 サンプリングチューブの材質にはポリエチレン樹脂(PE)やポリプロピレン樹脂(PP)が使用されているが,後述の刃物による切断に際してはPEのほうが柔らかく切断しやすい。
※2 浸透・包埋用パラフィンは販売メーカーごとにその形状が異なるため,サンプリングチューブに加える量は適時増減する。
2)サンプリングチューブ内のパラフィン(融点60℃)を恒温槽中で融解させた後,室温に戻して再凝固させたものをPAS法用サンプリングチューブ(以下,チューブ)とする(Figure 1B)。
※3 サンプリングチューブ内の融解したパラフィンは,室温に戻した際にサンプリングチューブ壁面との張力によって中心部が窪んだ円錐状に再凝固するため集細胞効果が期待できる。
※4 恒温槽が使用できない場合は,ヘアドライヤーの温風でも融解できる。
※5 事前に2)までの工程を済ませたチューブを複数本用意しておくと,必要時すぐに利用できるため簡便でCB作製時間も短縮できる。
3)10%中性緩衝ホルマリン液(10% Formalin Neutral Buffer Solution:富士フイルム和光純薬株式会社)にて24時間から48時間固定を行った細胞検体を1,000 Gで5分間遠心分離する。
※6 10%中性緩衝ホルマリン(以下,10% NBF)を扱う際は,必ず局所排気装置や防毒マスクを使用する。
4)遠心分離後,得られた細胞検体を上清の10% NBF 0.5 mLから1.0 mL相当で浮遊させ,チューブに加えて再度1,000 Gで5分間遠心分離する(Figure 1C)。
5)遠心分離後,薬匙を用いて上清の10% NBF上から寒天を直接添加する(Figure 1D)。
※7 添加した寒天は10% NBF中の水分と反応することで速やかに膨潤し半流動状となる(細胞保存液のBDサイトリッチTMレッド保存液を使用した場合も同様に膨潤する。)。
※8 遠心管法の一種であるPAS法において寒天を添加する目的は,CB作製過程における細胞検体散逸を防ぐ蓋の役割にすぎないため,細胞固化法の一種である寒天法とは異なり寒天を煮沸しゾル状にする必要はない。
※9 添加する寒天量の目安は,チューブを刃物で切断し易い厚さとなるよう,遠心分離後の細胞検体上に膨潤した寒天層が概ね3 mmから5 mm程度となるように添加する。
6)再度チューブを1,000 Gで5分間遠心分離する(Figure 1E)。
※10 遠心分離後のチューブ内は,あらかじめ添加・融解しておいたパラフィン層の上に「細胞層」→「寒天層」→「10% NBF」の順で積層される。
7)遠心分離後,寒天層上方の10% NBFをデカンテーションにより取り除く。
8)チューブ下方のパラフィン層とチューブ上方の寒天層を,挟まれている細胞層からそれぞれ2 mmから3 mmの間隔を空けて剃刀やミクロトーム用替え刃などを用いて切離する(Figure 1F)。
※11 この状態であれば,切離したチューブの両端はそれぞれパラフィンと寒天により塞がれているため,指でつまんで移動させることも可能である。
9)両端を切離したチューブをスポンジシートやメッシュシートなどで挟んで包埋カセットに入れ,全自動パラフィン包埋装置を用いてパラフィン浸透を行う(Figure 1G)。
※12 切離したチューブはパラフィン層を下にして包埋カセットに入れておくと,パラフィン浸透後パラフィンブロック作製のために包埋皿へ試料を移動する際,チューブ内の細胞寒天塊が脱落することなく容易に移動できる。
※13 細胞量が多く,切離したチューブが包埋カセットの底部に対して垂直方向に入れられない長さの場合は,チューブを水平方向に入れてもよいが,切離したチューブの両端から中心部までの距離が長いと融解パラフィンの浸透不良が起こることもあるため,複数のチューブで細胞検体を分割してCBを作製するとよい。
10)パラフィン浸透完了後,包埋皿に分注した融解パラフィン中でチューブより円錐状の試料を取り出しパラフィン包埋ブロックを作製する(Figure 1H)。
※14 融解パラフィン中でチューブ開口が大きい面を下に傾けると自重で落下し容易に細胞寒天塊を取り出すことができる。
※15 垂直断面でのCB薄切に際して,包埋カセットから取り出したパラフィン包埋後のチューブを一旦室温で固化し,チューブごと刃物で垂直方向に切離し,再度溶融パラフィン中で包埋することで,薄切時の面出し操作による細胞検体喪失を減らせるとともに,パラフィン包埋時の細胞検体散逸や崩壊も防止できる。
4. 比較方法寒天は熱水で徐々に溶ける性質を持つことから,加温した組織洗浄用の0.01 mol/Lりん酸緩衝生理食塩水pH 7.2~7.4(0.01 mol/L Phosphate Buffered Saline;PBS:富士フイルム和光純薬株式会社)に未染色薄切標本を浸漬し,一定時間経過後に取り出して染色する。次に顕微鏡にて染色標本の画像を撮影し,画像解析ソフトウェアを用いて残存寒天数をpixel数(px)として数値化し比較する。
1)市販の電気ポットを用いて80℃,90℃,98℃の3通りの温度条件ごとに,臓器用の保存袋(村角工業株式会社)に入れたPBS 300 mLを湯煎する。
※16 電子温度計を用いた実測の平均温度は80.3℃(80℃),89.8℃(90℃),97.8℃(98℃)であった。
2)寒天のみを使用したPAS法を用いて作製した未染色薄切標本を脱パラフィンし,100%アルコール中に保管する。
3)検討1として,寒天の完全融解最短時間を調べることを目的に,IHC法の熱処理反応温度に近似する98℃で加温したPBSを用いて,未加温および9通りの加温時間条件(0.5分後,1分後,3分後,5分後,10分後,15分後,30分後,45分後,60分後)のうち,PBSに浸漬せず脱パラフィンのみを行う未加温を除いた9通りの加温時間条件ごとに2枚の未染色薄切標本を浸漬する。
※17 未染色薄切標本を20枚用意した。
4)検討2として,異なる温度条件下での残存寒天数を調べることを目的に,3通りの温度条件(80℃,90℃,98℃)で加温したPBSを用いて,検討1で得られる寒天の完全融解最短時間の加温時間条件以降60分までの加温時間条件ごとに2枚の未染色薄切標本を浸漬する。
※18 各温度条件×2枚の未染色薄切標本を用意した。
※19 加温時間条件の未加温と温度条件98℃は検討1の解析結果を使用した。
5)各未染色薄切標本の浸漬にはステンレス製スライドラックを使用し,浸漬中は電気ポットを血液製剤用の振とう器に乗せて常に振とうする。
6)各浸漬時間経過後,臓器用の保存袋中のPBSから2枚の未染色薄切標本を取り出し100%アルコール中で保管する。
7)検討1と検討2で作製した各々2枚の未染色薄切標本すべてにアルシアンブルー染色液pH 2.5(組織用)(Alcian Blue Stain Solution pH 2.5 for Histology;AB染色液:武藤化学工業株式会社)染色液で着色する。
※20 アガロースとアガロペクチンからなるヘテロ多糖類の寒天を,多糖類の染色に使用されるAB染色液で着色可能か予備試験を実施し,寒天に着色が得られたため画像解析に使用した。
8)AB染色液で着色した各温度条件の2標本中10試料について光学顕微鏡の接眼レンズ倍率10倍,対物レンズ倍率4倍の組み合わせで,各試料の中心部1視野を画像撮影する。
9)撮影した各試料の画像を画像処理ソフトウェアImageJ/Fiji(an open-source platform for biological-image analysis)を用いて2値化し15),Adobe Photoshop Elements 2021(アドビ株式会社)を用いて2標本中10試料のpxをそれぞれ算出する16)。
10)検討1では,未加温のpxおよび温度条件(98℃)における各加温時間条件のpxを求め,統計処理にSPSS Statistics 27(日本アイ・ビー・エム株式会社)を用いてノンパラメトリック検定のFriedman検定と多重比較を行う17),18)。p値が0.01未満を統計的に有意とみなす。さらに未加温のpxの中央値に対する相対値を算出し,傾向を比較する。
※21 統計処理で加温開始直後の加温0.5分後に対して差を認めた最短の加温時間条件を寒天の完全融解最短時間とした。
11)検討2では,3通りの温度条件に対して検討1で決定した完全融解最短時間から加温60分後までの各加温時間条件のpxを求め,未加温のpxの中央値に対する相対値を算出し,傾向を比較する。
※22 未加温のpxおよび各温度条件(80℃,90℃,98℃)における各加温時間条件のpxはいずれも正規分布に従っていると仮定できないため,データの代表値には外れ値の影響も受けにくい中央値を用い,データのばらつきを表す指標には四分位範囲を用いた19)。
pxとして数値化した残存寒天数の表記は,中央値と四分位範囲(左から順に中央値,第1四分位数,第3四分位数)で示す。
1. 検討1:温度条件(98℃)での「Friedman検定と多重比較」結果および残存寒天数の比較(Figure 2, Table 1)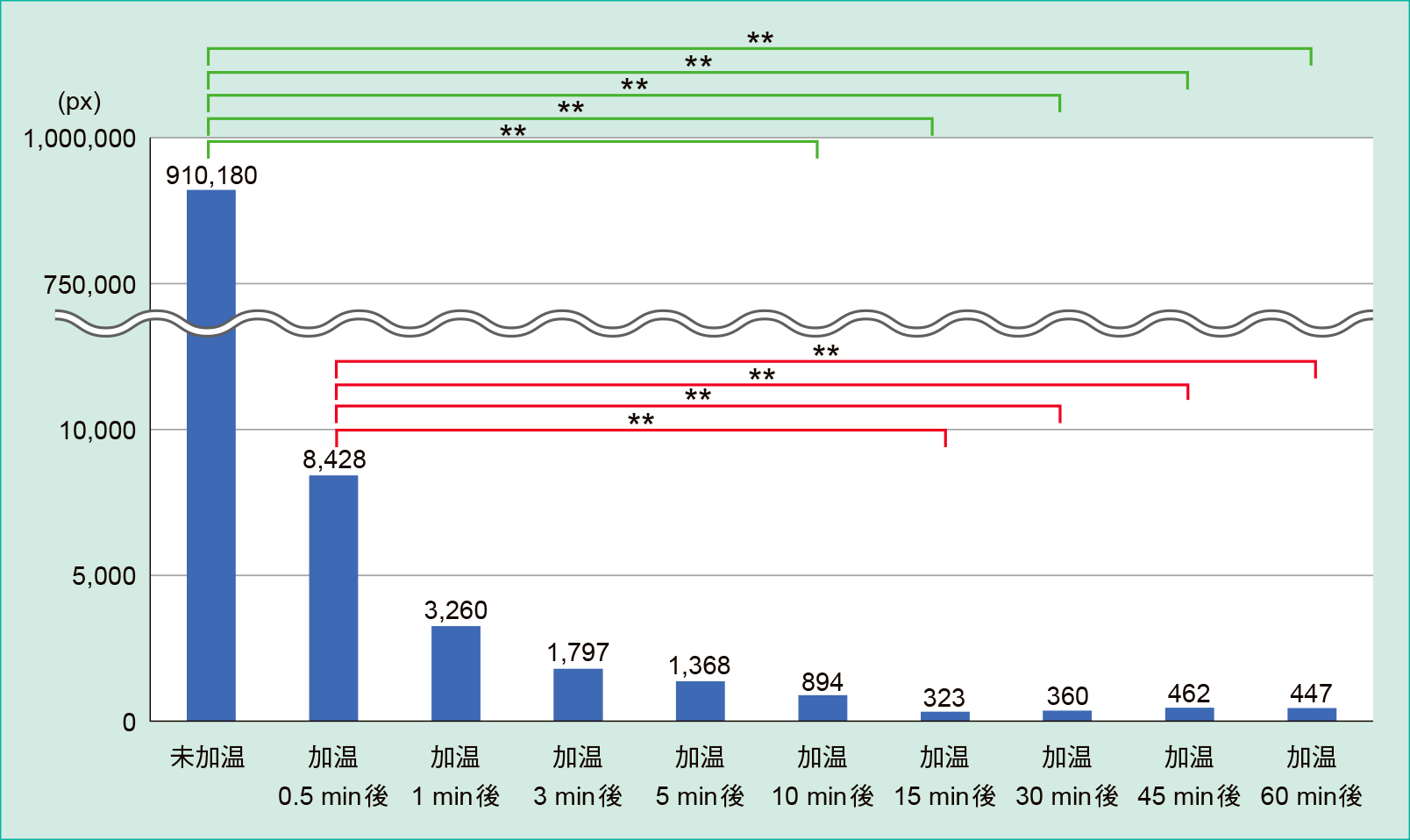
未加温は加温10分後,15分後,30分後,45分後,60分後と比較して差を認めた(**p < 0.01)。
加温0.5分後は加温15分後,30分後,45分後,60分後と比較して差を認めた(**p < 0.01)。
| 温度条件 | 未加温 | 加温0.5 min後 | 加温1 min後 | 加温3 min後 | 加温5 min後 |
|---|---|---|---|---|---|
| (98℃) | 910,180(895,035–928,299) | 8,428(4,963–11,358) | 3,260(990–5,947) | 1,797(1,029–2,951) | 1,368(591–5,039) |
| 100.00% | 0.93% | 0.36% | 0.20% | 0.15% | |
| 温度条件 | 加温10 min後 | 加温15 min後 | 加温30 min後 | 加温45 min後 | 加温60 min後 |
| (98℃) | 894(704–1,218) | 323(274–510) | 360(278–608) | 462(94–753) | 447(185–604) |
| 0.10% | 0.04% | 0.04% | 0.05% | 0.05% |
上段:pxとして数値化した残存寒天数の中央値と四分位範囲(左から順に中央値,第1四分位数,第3四分位数)。
下段:未加温のpxに対する相対値。
残存寒天数は,未加温では910,180(895,150–927,108)px,加温0.5分後では8,428(5,228–11,337)px,加温1分後では3,260(1,008–5,874)px,加温3分後では1,797(1,053–2,770)px,加温5分後では1,368(723–4,282)px,加温10分後では894(716–1,155)px,加温15分後では323(275–505)px,加温30分後では360(290–577)px,加温45分後では462(136–737)px,加温60分後では447(205–592)pxであり,未加温は加温10分後,15分後,30分後,45分後,60分後と比較して差を認め,加温0.5分後は加温15分後,30分後,45分後,60分後と比較して差を認めた。
以上の結果より,寒天の完全融解最短時間を加温15分後と決定した。
また,未加温のpxに対する相対値は,加温0.5分後で0.93%,加温1分後で0.36%,加温3分後で0.20%,加温5分後で0.15%,加温10分後で0.10%,加温15分後で0.04%,加温30分後で0.04%,加温45分後で0.05%,加温60分後で0.05%であった。
2. 検討2:各温度条件(80℃,90℃,98℃),未加温および加温時間条件(15分後,30分後,45分後,60分後)での残存寒天数の比較(Figure 3, Table 2)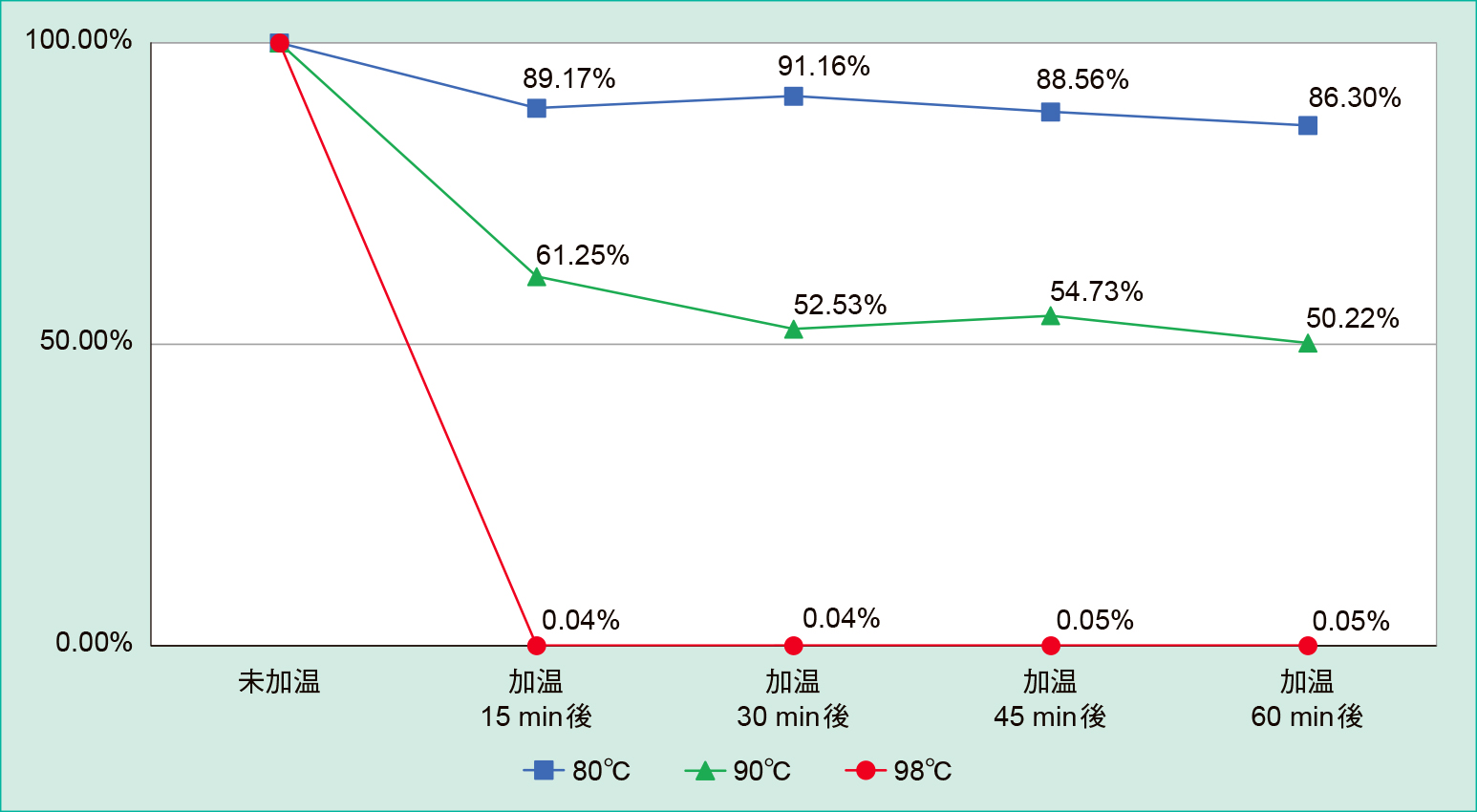
温度条件80℃では,加温15分後から加温60分後の間で89.17%から86.30%の残存を示した。
温度条件90℃では,加温15分後から加温60分後の間で61.25%から50.22%の残存を示した。
温度条件98℃では,すべての加温時間条件(15分,30分,45分,60分)で0.05%以下の残存を示した。
| 温度条件 | 未加温 | 加温15 min後 | 加温30 min後 | 加温45 min後 | 加温60 min後 |
|---|---|---|---|---|---|
| (80℃) | 910,180(895,035–928,299) | 811,568(730,074–971,593) | 829,693(806,374–845,212) | 806,039(776,597–865,498) | 785,470(749,056–803,576) |
| 100.00% | 89.17% | 91.16% | 88.56% | 86.30% | |
| (90℃) | 910,180(895,035–928,299) | 557,462(451,040–648,655) | 478,129(410,389–591,672) | 498,185(394,196–572,950) | 457,090(412,599–528,597) |
| 100.00% | 61.25% | 52.53% | 54.73% | 50.22% | |
| (98℃) | 910,180(895,035–928,299) | 323(274–510) | 360(278–608) | 462(94–753) | 447(185–604) |
| 100.00% | 0.04% | 0.04% | 0.05% | 0.05% |
上段:pxとして数値化した残存寒天数の中央値と四分位範囲(左から順に中央値,第1四分位数,第3四分位数)。
下段:未加温のpxに対する相対値。
残存寒天数は,80℃では加温15分後で811,568(730,074–971,593)px,加温30分後で829,693(806,374–845,212)px,加温45分後で806,039(776,597–865,498)px,加温60分後で785,470(749,056–803,576)pxであった。90℃では加温15分後で557,462(451,040–648,655)px,加温30分後で478,129(410,389–591,672)px,加温45分後で498,185(394,196–572,950)px,加温60分後で457,090(412,599–528,597)pxであった。未加温および98℃の結果は検討1と同様。
また,各温度条件の未加温のpxに対する相対値は,80℃では加温15分後で89.17%,加温30分後で91.16%,加温45分後で88.56%,加温60分後で86.30%であった。90℃では加温15分後で61.25%,加温30分後で52.53%,加温45分後で54.73%,加温60分後で50.22%であった。98℃の結果は検討1と同様。
中性多糖類の「アガロース」と酸性多糖類の「アガロペクチン」よりなる寒天は,ガラクトースを基本骨格とする直鎖の多糖類で20),21),冷水やアルデヒド系固定液のホルマリン液,エタノール・キシレンなどの有機溶媒に難容性であるが,水に浸漬すると吸水・膨潤し90℃以上の加熱で融解する特性を持っており,従来PAS法標本中の寒天はパラフィン包埋から薄切を経て染色に至る過程において,水洗工程で吸水・膨潤が起こるものの寒天の多くは消失に至らず標本中に残存していた。
検討1の結果から,温度条件98℃における残存寒天数は,未加温のpxと比較して,加温0.5 min後で99%以上の減少を示した。この結果より,温度条件98℃では標本中の寒天は温水への標本浸漬直後から融解・消失することが明らかとなった。またその後加温15 min後までは緩やかにpxが減少するものの,加温15 min後以降では0.05%以下で一定を示しており,このことは加温0.5 min後に対して統計処理で差を認めた最短の加温時間条件である加温15 min後を完全融解最短時間とした結果とも合致していた。
検討2の結果から,温度条件80℃では,加温15分後から加温60分後の間で91.16%から86.30%の残存を示した。この結果より,温度条件80℃では温水による寒天の吸水・膨潤促進に伴う一時的な寒天の物理的脱落が残存寒天数に影響を及ぼす要因と推察された。温度条件90℃では,加温15分後から加温60分後の間で61.25%から50.22%の残存を示した。この結果より,寒天融解温度境界域である温度条件90℃では寒天の部分融解が生じると共に,温水による寒天の吸水・膨潤促進に伴う一時的な寒天の物理的脱落が残存寒天数に影響を及ぼす要因と推察された。温度条件98℃では,すべての加温時間条件(15分,30分,45分,60分)で0.05%以下の残存を示した。この結果より,寒天融解温度域である温度条件98℃では,加温による融解が残存寒天数に影響を及ぼす要因と推察された。埋橋ら22)は,寒天を融解するためには,三次元の網目構造に絡み合った分子同士を解離し,さらにヘリックス構造のジッパーを開ける必要があることから,沸騰状態まで温度を上げるような熱力学的にも大きなエネルギーを必要とすると述べており,今回の我々の検討でも温度条件98℃では加温15分後の残存寒天数が0.05%以下を示すのに対して,加温60分後であっても温度条件90℃では50.22%,温度条件80℃では86.30%に留まっており,このことは前述の熱力学的エネルギーの差より生じる結果として矛盾しないと考える。また有賀ら23)は,アガロースを切断する寒天分解酵素を使うことによって寒天オリゴ糖を効率的に生産することが可能となると述べており,我々の今後の課題としては未だ明らかではない加温温度条件や加温時間条件の違いが細胞形態や標本の染色性に及ぼす影響を検証すると共に,より低温での処理が期待できる寒天分解酵素を用いた寒天の消失条件についても追加検討を行いたい。
寒天の完全融解に必要とされる温度条件は98℃で,その完全融解最短時間は加温15分後であることが明らかとなった。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。