Abstract
目的:膵癌の長期生存を可能とする治療法は根治的な切除と考えられるが,治療成績は著しく不良である.癌遺残度(residual tumor;以下,Rと略記)は切除例の予後因子だが,R0切除後でも予後・再発予測の指標が必要である.膵癌切除後に腫瘍マーカー(tumor marker;以下,TMと略記)が正常化しないことがあり,予後不良であると報告されている.今回アンケートで切除後TM正常化の有無と臨床病理学的因子の関係を解析し,予後因子としての意義を明らかにした.対象:宮城肝胆膵癌化学療法研究会参加21施設を対象に,2003年1月から2007年12月までの5年間に切除された膵癌333例中,組織学的に通常型膵癌で,TMが測定された294例を対象とした.方法:年齢・性・術式・TM・補助療法などを問うアンケートを集計し,術前TM非上昇,術後正常化・非正常化の3群に分け解析した.結果:CA19-9が67%,その他を含めると80%の症例で上昇を認め,上昇例の約半数で切除後TM非正常化が認められた.術前非上昇例,切除後正常化例の生存期間中央値が36.4,24.5か月に対し,非正常化例では16.8か月で有意に予後不良であった.多変量解析では,病期と術後TMが有意な予後因子として選別され,R0切除サブ解析でも,術後TM非正常化では有意に予後不良であった.結語:膵臓癌切除後腫瘍マーカー非正常化は重要な予後因子である.
はじめに
膵癌の長期生存を可能とする唯一の治療法は根治的な切除と考えられているが,切除例の大部分が再発し,その成績は著しく不良である1)2).切除例の予後因子として,進行度(stage)1)2)・腫瘍径1)2)・組織型(histological grade)1)~3)・癌遺残度(residual tumor;以下,Rと略記)4)などが報告されている.最も代表的な切除例の予後規定因子はRであり,R0切除は病理学的検索で癌遺残のない切除が行われたことを意味する5).R0切除例は,R1,2切除例に比べ有意に生存期間が長いことが報告されている4)ものの,一方でR0切除後にも再発が生じることはまれではない1)2)4).Rはあくまで手術野局所の評価であり,手術時に既に存在すると考えられる不顕性の微小転移の存在を示唆する報告6)から,R0切除後においても予後・再発予測の指標が必要である.
進行膵癌患者では,血清中にCA19-9などの糖鎖抗原が上昇することが知られており,腫瘍マーカーとして診療に用いられている6)~8).早期診断への寄与は少ないものの,良悪性の鑑別・切除能の判断・予後予測・治療効果のモニタリングなどに重要と考えられている7)8).一般に悪性固形腫瘍において,治療前に上昇していた腫瘍マーカーは,根治切除あるいは化学療法や放射線化学療法による完全奏効(complete response;以下,CRと略記)となれば,正常化するとされる9).しかし,膵癌切除後に腫瘍マーカーが正常化しないことがある事実は,多数報告されており6)10)~13),Ferroneら10)は,切除後CA19-9値のカットオフを200 U/mlとし,切除後にカットオフ値以上を示す例で有意に生存期間が短いことを報告している.同様に,Kinsellaら11)は,同様のカットオフを70 U/mlとすることで予後に有意な差を認めることを報告している.最近の報告ではいわゆる基準値とされる37 U/mlをカットオフとする報告が多く6)12)13),いずれにしても切除後の腫瘍マーカー高値は予後不良因子である.
今回,我々は膵癌切除後の腫瘍マーカーのカットオフ値を,通常用いられる正常上限値として,正常化の有無を判定することとした.また,時期による治療法の差をできるかぎり排除し,多数例で検討するために,アンケート調査で切除後腫瘍マーカー正常化の有無と臨床病理学的因子の関係を解析し,予後因子としての意義を明らかにすることを目的とした.
対象と方法
宮城肝胆膵癌化学療法研究会(Miyagi-HBPCOG)構成施設で,2003年1月1日から2007年12月31日までの5年間に切除され,術後の病理組織学的検索にて通常型膵癌と診断された症例を対象とした.研究会構成21施設(東北大学病院肝胆膵外科,仙台医療センター,仙台オープン病院,仙台厚生病院,山形県立中央病院,石巻市立病院,塩竈市立病院,坂総合病院,東北労災病院,仙台赤十字病院,東北厚生年金病院,宮城社会保険病院,仙台逓信病院,仙台徳洲会病院,宮城県立がんセンター,宮城県南中核病院,東北中央病院,白河厚生総合病院,十和田市立病院,仙北組合病院,総合磐城共立病院)に通常型膵癌切除例と腫瘍マーカーに関する®Microsoft Excel formatのアンケートを送付し,連結可能匿名化dataを事務局に返送してもらい,333例の集計を行った.アンケートは,2008年3月および追加予後調査を2009年3月,2011年3月に実施した.19施設より回収した333例の中で,術後腫瘍マーカー未測定・病理診断不備(病期・組織型)が確認できなかった39例を除く,294例(88%)を対象として解析を行った.
収集された臨床病理学的データは,手術時年齢・性別・治療前腫瘍マーカー(CA19-9,CEA,DUPAN-II,Span-1)上昇の有無とその値・手術術式・組織型・進行度・癌遺残度・切除術後腫瘍マーカー値・術後補助療法の有無・生存日数・転帰である.記載方法は,膵癌取扱い規約第6版5)に準拠した.切除後の腫瘍マーカー値は,切除2か月以内に測定したものとし,複数の腫瘍マーカーが正常上限値を超えて上昇している場合には, 最も上昇度 (実測値/正常上限値) の大きいものを, その症例の腫瘍マーカーとして術後正常化・非正常化の判定に用いた.CA19-9,CEA,DUPAN-II,Span-1のカットオフ値は,おのおの37 U/ml,5 ng/dl,150 U/ml,80 U/mlである.
得られた臨床データを周術期の腫瘍マーカー値の推移から,術前に測定された全ての腫瘍マーカーがカットオフ未満であったもの(非上昇群),術前に腫瘍マーカーのカットオフを超える上昇を認め切除後にカットオフ未満に低下したもの(正常化群),切除後もカットオフを超える腫瘍マーカーの上昇を認めたもの(非正常化群),の3群に分けて解析を行った.
統計学的解析は統計解析ソフトウェア(®JMP5.0.1J,SAS Institute. Cary,NC,USA)を用い,連続データはUnpaired Student-T検定およびMann-Whitney U検定,カテゴリカルデータに対してはχ2検定を行った.生存期間の分析は,Kaplan-Meier法により生存曲線を作成し,log-rank testで有意差検定を行った.いずれもP<0.05で有意差ありと判断した.多変量解析は,Cox比例ハザードモデルを用いた.
結果
1. 腫瘍マーカー値測定
294例の術前腫瘍マーカー値測定の結果をTable 1に示す.CA19-9はほぼ全例に,CEAも3/4の症例で測定されていた.CA19-9の陽性率は76%であり,CEAの陽性率29%に比べ有意に高率であった(P<0.0001,χ2検定).DUPAN-II,Span-1はそれぞれ37%,13%でのみ測定されており,陽性率はCEAより高いものの,未測定例が多かった(Table 1).
Table 1
Evaluation of the pre-operative serum tumor markers
| Markers |
Assessed |
Not assessed |
% evaluated*1 |
% elevated*2 |
| Elevated |
Not elevated |
| CA19-9 |
222 |
71 |
1 |
100 |
76 |
| CEA |
63 |
156 |
75 |
74 |
29 |
| DUPAN-II |
36 |
42 |
216 |
37 |
46 |
| Span-1 |
21 |
16 |
257 |
13 |
57 |
*1 evaluation means the number of assessed/ total number.
*2 elevated means the number of elevated/ the number of assessed.
294例の背景因子(年齢・性・術前CA19-9上昇の有無・手術術式・進行度・組織型・癌遺残度・術後補助化学療法の有無)をTable 2に示す.癌遺残度(R0切除率)は,非上昇群82%,正常化群87%であったが,非正常化群は70%で有意に低かった(P=0.013,χ2検定).年齢・性・手術術式・進行度・組織型・術後補助化学療法の有無では,3群間に有意な差は認めなかった.術前CA19-9上昇頻度は,正常化群と非正常化群で比較して有意差を認めなかった(Table 2).
Table 2
Baseline demographics
| Demographics |
Groups by Tumor marker status |
Total cohort |
P-value |
| No increase before surgery |
Within Normal limit after surgery |
Above Normal limit after surgery |
| n |
48 |
126 |
120 |
294 |
— |
| Age (Median, range) |
65 (26–88) |
68 (34–86) |
68 (42–87) |
68 (26–88) |
0.083*1 |
| Gender (Male:Female) |
29:19 |
74:52 |
72:48 |
175:115 |
0.97*2 |
| Pre-operative CA19-9 increase (%) |
0 (0) |
110 (87) |
111 (93) |
221 (75) |
0.14*2 |
Types of Resection
(Head:Body-Tail:Total) |
32:14:2 |
88:31:7 |
70:44:6 |
190:89:15 |
0.35*2 |
| Stage (I:II:III:IV) |
1:7:16:24 |
3:9:50:64 |
3:5:37:75 |
7:21:103:163 |
0.34*2 |
| Histological type (well:mod:por:others) |
10:26:5:7 |
24:79:9:14 |
23:74:13:10 |
57:179:27:31 |
0.95*2 |
| R0 resection(%) |
31 (82) |
90 (87) |
77 (70) |
198 (79) |
0.013*2 |
| Adjuvant therapy (%) |
35 (74) |
98 (78) |
98 (82) |
231 (79) |
0.45*2 |
*1: Unpaired Student-T test
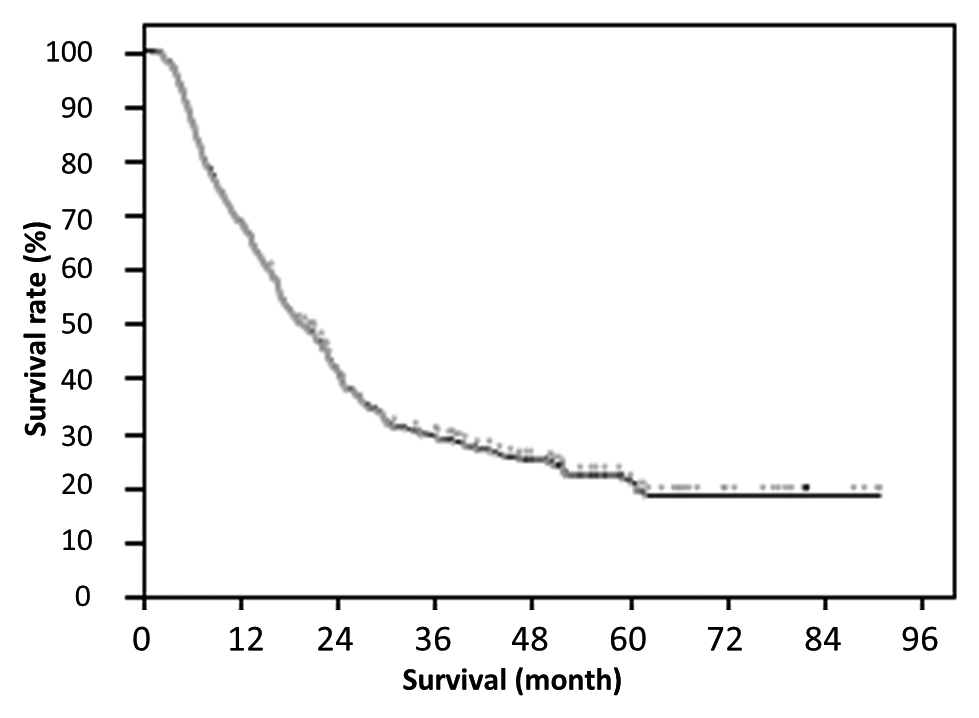
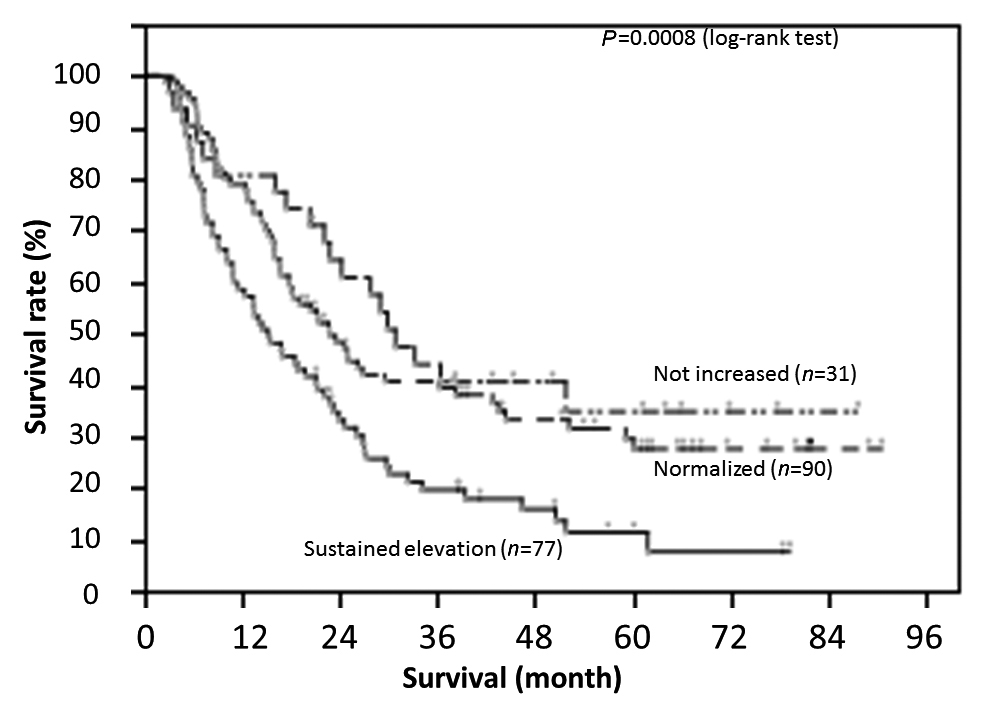
294例の生存曲線を,Fig. 1に示す.生存期間中央値は684日で,5年全生存率は24.4%であった.3群で生存曲線を比較すると,各群の1,3,5年全生存率は,非上昇群で84.8,48.0,43.6%,正常化群で78.9,42.0,31.7%,非正常化群で61.6,18.4,9.0%であり,生存期間中央値は,非上昇群で1,092日,正常化群で736日,非正常化群で505日であった.非正常化群で,有意に生存期間が短く,予後不良であった(Fig. 2,P<0.0001,log-rank test).
4. 多変量解析による予後因子の抽出
年齢・性・術前腫瘍マーカー・術式・進行度・組織型・癌遺残度・術後腫瘍マーカー・術後補助療法の各因子で,Cox比例ハザードモデルを用い解析した.単変量解析では,術前腫瘍マーカー(CA19-9上昇>非上昇例),術式(膵全摘>膵頭切除),進行度(stage 4>stage 3かつstage 1–2>stage 3),癌遺残(R1-2>R0),術後腫瘍マーカー(非正常化>非上昇例)が有意な予後因子として抽出された.それら単変量解析で有意であった因子を用いて多変量解析を行うと,進行度,術後腫瘍マーカーが有意な予後規定因子として選別された(Table 3).
Table 3
Univariate and multivariate analysis for factors for survival
| Prognostic factors |
Definition |
Univariate analysis |
Multivariate analysis |
| P-value |
HR (95%CI) |
P-value |
HR (95%CI)* |
| Age |
Under 70 |
|
1 |
|
|
|
Over 70 |
0.74 |
1.02 (0.89–1.18) |
|
|
| Gender |
Female |
|
1 |
|
|
|
Male |
0.090 |
1.143(0.98–1.32) |
|
|
| Pre-ope TM elevation |
None |
|
1 |
|
|
|
CA19-9 |
0.044 |
1.19 (1.00–1.43) |
0.91 |
1.01 (0.83–1.24) |
|
Other markers |
0.39 |
1.07 (0.92–1.24) |
|
|
| Types of resection |
PD |
|
1 |
|
|
|
DP |
0.29 |
0.92 (0.78–1.07) |
|
|
|
TP |
0.030 |
1.44 (1.04–1.89) |
0.073 |
1.38 (0.97–1.86) |
| Stage |
Stage 1–2 |
0.0009 |
0.50 (0.27–0.78) |
0.0060 |
0.51 (0.25–0.85) |
|
Stage 3 |
|
1 |
|
|
|
Stage 4 |
0.0001 |
1.34 (1.16–1.57) |
0.0017 |
1.29 (1.10–1.52) |
| Histology |
Well |
0.15 |
0.87 (0.71–1.05) |
|
|
|
Moderate |
|
1 |
|
|
|
Poorly |
0.064 |
1.28 (0.98–1.62) |
|
|
|
Others |
0.63 |
1.06 (0.83–1.33) |
|
|
| Residual tumor |
R0 |
|
1 |
|
|
|
R1–2 |
0.0009 |
1.36 (1.14–1.61) |
0.12 |
1.16 (0.96–1.37) |
| Post-ope TM elevation |
No increase |
|
1 |
|
|
|
Normalized |
0.21 |
1.16 (0.92–1.47) |
|
|
|
Elevated |
<0.0001 |
1.64 (1.32–2.01) |
0.0008 |
1.32 (1.12–1.56) |
| Adjuvant therapy |
Yes |
|
1 |
|
|
|
No |
0.32 |
0.90 (0.73–1.10) |
|
|
* HR (95%CI): Hazard ratio with 95% confidence interval
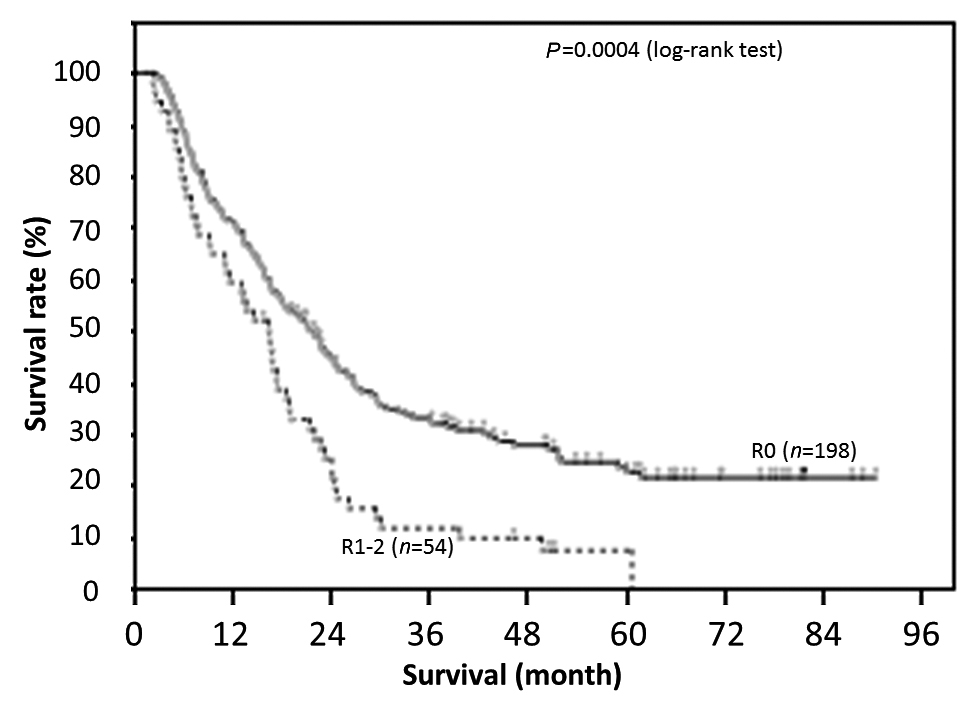
R0切除とR1–2切除となった例の生存曲線を示す.R0切除の生存期間中央値は704日に対し,R1–2切除では505日とR0切除で有意に生存期間が長かった(Fig. 3,P=0.0004,log-rank test).
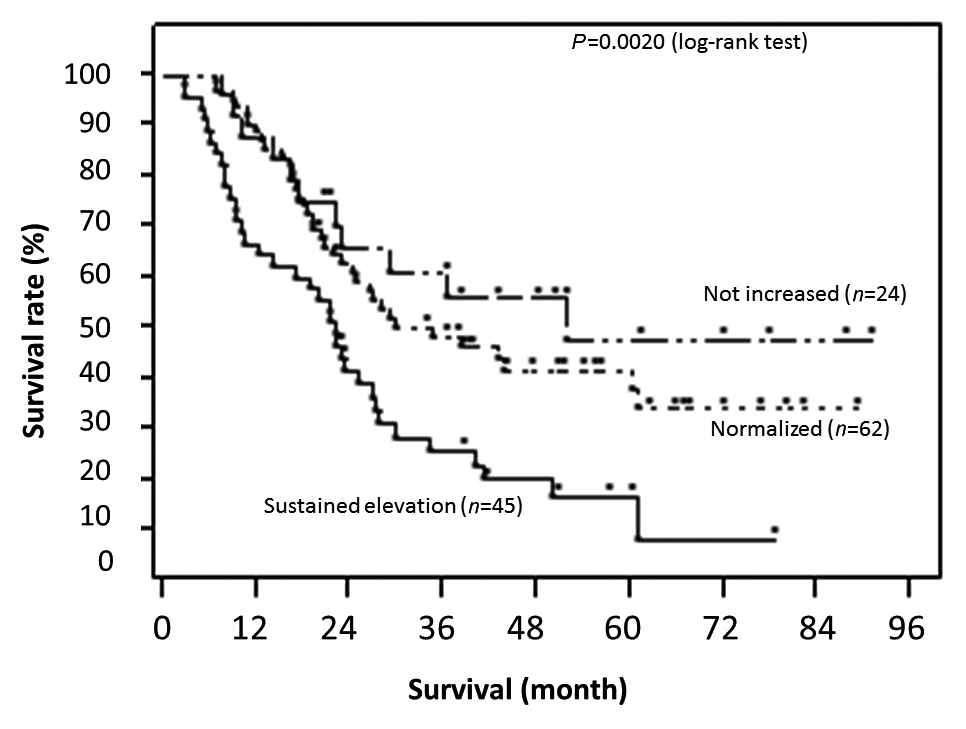
R0切除例の中で,非上昇群・正常化群・非正常化群の生存期間を比較すると,生存期間中央値は非上昇群で997日,正常化群で735日,非正常化群で554日であった.3群で生存曲線を比較すると,各群の1,3,5年全生存率は,非上昇群で86.7,45.9,39.4%,正常化群で79.8,41.9,32.2%,非正常化群で61.9,21.7,12.6%であり,生存期間中央値は,非上昇群で1,092日,正常化群で736日,非正常化群で505日であった.非正常化群で,有意に生存期間が短く,予後不良であった(Fig. 4,P=0.0017,log-rank test).
6. 進行度別切除後腫瘍マーカーによる生存期間の比較
単変量・多変量解析(Table 3)から,比較的生存期間の長いstage I–III(n=163)における切除後腫瘍マーカーによる生存曲線を示す.生存期間中央値は非上昇群で1,554日,正常化群で1,030日,非正常化群で662日であった.各群の1,3,5年全生存率は,非上昇群で87.5,55.9,47.9%,正常化群で88.7,48.3,34.1%,非正常化群で66.7,26.0,16.9%であり,非正常化群で,有意に生存期間が短く,予後不良であった(Fig. 5,P=0.0020,log-rank test).
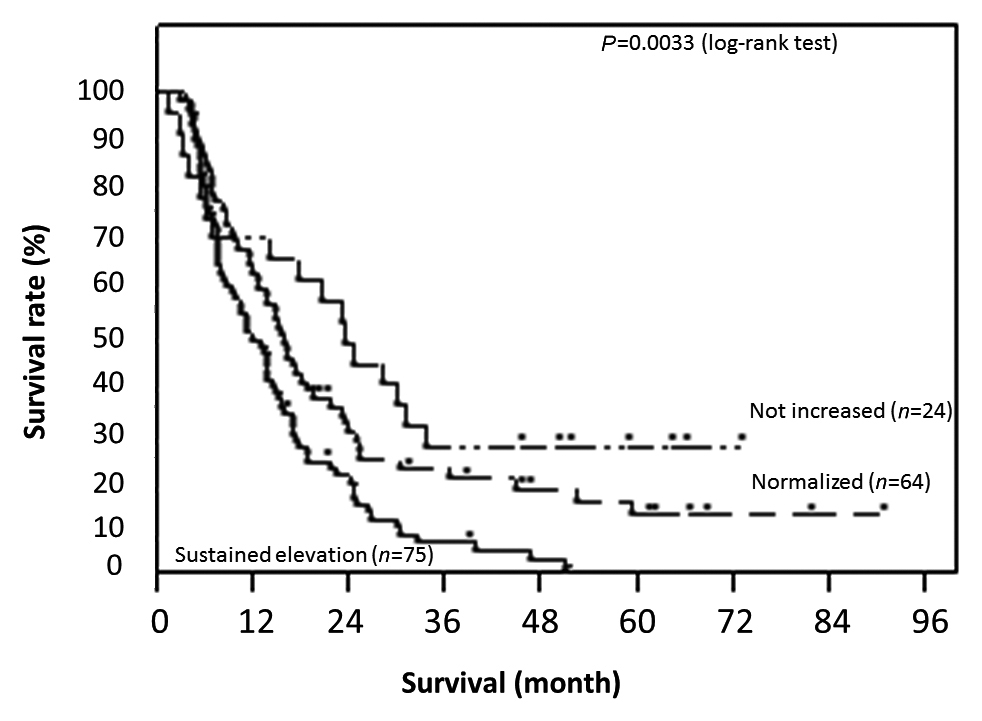
Stage IV(n=131)において同様に比較すると,非上昇群・正常化群・非正常化群の生存期間中央値は,各々,713.5日,475日,385日であった.各群の1,3,5年全生存率は,非上昇群で70.8,29.2,29.2%,正常化群で64.1,23.0,15.6%,非正常化群で50.7,10.2,1.7%であり,非正常化群で,有意に生存期間が短く,予後不良であった(Fig. 6,P=0.0033,log-rank test).
考察
これまで,膵癌切除治療の評価としては局所癌遺残度の評価であるresidual tumor(R)が主に用いられ,R1,2切除はR0切除に比べ予後不良であることが報告されている14)~16).今回の294例での検証でも,Rは単変量解析で有意な予後因子として抽出されており(Fig. 3,Table 3),過去の報告と一致した.切除の際,予防的な拡大郭清による生存期間延長効果は否定的であるものの17),早期診断が困難な現状では,進行癌に対してR0を目指した切除を行うこと18)が,妥当であることを裏付けている.しかし,「R0切除=癌の根治」とはならないことも厳然たる事実である.R0切除が行われても過半数で再発・癌死することから15),Rのみで手術の効果を評価することは不十分であり,Rに変わる,あるいはRに加えて,より精確に予後を反映する基準が求められている.
膵癌診療における腫瘍マーカー測定の意義は,診断・治療効果のモニタリングで重要であることが報告されている19)~21).治療効果モニタリングの面では,主に化学療法の効果判定における副指標の報告が多いが20)21),今回の検討で,切除後の腫瘍マーカー正常化の有無は,これまで報告されてきた代表的な予後因子である進行度,組織型,癌遺残とは独立した予後規定因子であることが示された(Fig. 4~6, Table 3).最近の複数の報告8)12)21)22)で膵癌切除後に腫瘍マーカーが正常化しない例が少なからずあり,それらの予後が不良であることが示されている.また,前立腺癌23),性腺細胞癌24),甲状腺髄様癌25)などの他癌腫でも,切除後の腫瘍マーカー正常化の有無が強力な予後因子であることが報告されており,膵癌に対する切除治療の評価として「切除後の腫瘍マーカー(の正常化の有無)」は重要であると考えられる.
固形癌に対する化学療法や放射線治療の効果判定基準であるRECISTガイドライン9)では,腫瘍の消失を示すcomplete response(CR)の判定の際には,治療前に上昇していた腫瘍マーカーの正常化が必須とされている.であるならば,化学療法・放射線治療がCRを治療効果の指標にするのと同様,外科治療の評価においても,R因子に「腫瘍マーカーの正常化」という条件を加えることで,より確実に効果(長期生存)を判定できると考えられる.実際,今回のシリーズでR0切除がなされた症例であっても,切除後の腫瘍マーカー正常化の有無により,生存曲線は明瞭に区別され有意差を認めており(Fig. 4),腫瘍学的な評価としてR因子に腫瘍マーカー正常化の有無を加えることの有用性が示唆される.元井ら6)26)は,単施設の後方視的検討の結果から,RとTMを組み合わせた治療効果の指標を提唱し,その有効性を検証した.今回のデータは,アンケート調査であるものの,時代的な治療変遷の少ない短期間・多施設・多数例の集積である.過去の報告6)26)と比較し,術前診断法,術後補助療法の施行が一定である条件下でも,「切除後の腫瘍マーカーが正常化するか否か」が生存期間に影響を及ぼすことが確認されたと考えられる.
個体から腫瘍の完全摘除がなされた場合,腫瘍由来と考えられる血清腫瘍マーカーは正常化するはずであるが,今回のシリーズでは,80%以上の症例で術前に腫瘍マーカーが上昇しており,その約半数で切除後も腫瘍マーカーが正常化していなかった(Table 2).CA19-9の半減期は,6.5時間(実験レベル)27)~12時間程度28)と推察されているが,切除後の推移は2相性を呈するとの指摘28)もある.いずれにせよ,今回術後1~2か月の腫瘍マーカー値で評価しているため,腫瘍遺残がなければ正常化していると考えられる.非正常化例で,R0切除率がやや低いものの,79%の症例でR0切除がなされていた(Table 2)ことを考えると,局所での癌遺残よりは,むしろ不顕性の転移性・播種性病変の存在を示唆する.膵癌の再発形式では,局所再発も無視できないものの,肝転移・腹膜播種が高頻度に認められることから26)29),切除後も腫瘍マーカーが正常化していない症例は,切除範囲外に存在する,画像で同定されない微小病変が遺残している可能性がある.単施設の検討では,腫瘍マーカー非正常化例で,正常化例に比べて,有意に肝再発の頻度が高かったことが報告されているが6)26),今回のアンケート調査では,再発時期・再発形式まで十分に検証することができなかった.今後,腫瘍マーカーの推移と再発の関係をより明らかにする必要がある.
膵癌切除術後の補助化学療法により生存期間を延長することが複数の無作為比較試験で示され14)~16),本邦の膵癌診療ガイドラインでも推奨されている30).今回の検討では,術後補助化学療法の有無が生存期間に及ぼす効果を検出できなかった(Table 3).理由として,術後補助化学療法が標準治療として確立した時期(2003~2007年)を主に対象としたため,大部分(80%)の症例で補助療法が行われていることが挙げられる(Table 2).またアンケートで,補助療法の種類・治療期間・投薬量などが十分に調査できなかったため,より詳細なデータが得られれば,補助療法の役割をより明確にできたかもしれない.また,腫瘍マーカーの反応(治療前後でのマーカー値の推移)が化学療法の効果予測になるという報告19)20)もあることから,術後腫瘍マーカーが正常化しなかった症例に対して補助療法を行った場合も,腫瘍マーカーが効果指標になるか検証する必要がある.術後補助療法は標的病変がなく,再発の有無が唯一の有効性の指標であるため,治療期間の決定や治療薬剤の選択に用いる指標がない.予後不良な腫瘍マーカー非正常化症例において,腫瘍マーカーの反応性が指標になれば,術後補助療法を行ううえでの臨床的インパクトが大きいであろう.また,非正常化例の予後が不良な(Fig. 2, 4)ことから,これらの症例を再発高危険群として,標準治療より強力な術後補助療法が必要かもしれない.
膵癌治療の臨床試験,特に術後補助療法の比較試験を行う場合,切除後の腫瘍マーカー値は重要な意味を持つ.膵癌術後補助療法としての塩酸ゲムシタビンの有用性を示したCONKO-001試験15)では,切除後腫瘍マーカー値がベースラインの2.5倍以上の症例が対象から除外されている.また,Maiseyら31)は,CA19-9値が膵癌の重要な予後因子であることから,臨床試験では腫瘍マーカー値をもとに層別化して行うべきであると考察している.特に手術を含む膵癌の臨床試験では,切除後の腫瘍マーカー値を基準として対象の厳格化・層別化を行うことで,より的確な比較が可能だと考えられる.一方,非正常化例の中でも少数ではあるが長期生存例が存在した(3年生存15例,うち5年生存4例).Stage I–IIIがやや多く,R0切除がなされた症例が多いが,少数例であるため統計学的に有意な特徴は抽出できなかった.今後は,前向き試験のデータから,切除後の腫瘍マーカー非正常化の意義を更に明らかにする予定である.
なお,本稿の要旨は,第64回日本消化器外科学会総会(2009年7月,大阪)で発表した.本稿を終えるにあたり,アンケート調査にご協力いただきました宮城肝胆膵癌化学療法研究会(Miyagi-HBPCOG)参加施設である,福原賢二先生(塩竈市立病院),阿南陽二先生(坂総合病院),武者宏昭先生(東北労災病院),遠藤公人先生(仙台赤十字病院),中村隆司先生(東北厚生年金病院),丹野弘晃先生(宮城社会保険病院),坂本宣英先生(仙台逓信病院),阿部忠義先生(仙台徳洲会病院),高橋道長先生(宮城県南中核病院),浅沼拓先生(東北中央病院),竹村真一先生(白河厚生総合病院),杉田純一先生(十和田市立病院),小野文徳先生(仙北組合病院)に,深甚の謝意を表します.
利益相反:なし
文献
- 1) 日本膵臓学会膵癌登録委員会.膵癌登録報告2007.膵臓.2007;22(1):e1–e427.
- 2) Matsuno S, Egawa S, Fukuyama S, Motoi F, Sunamura M, Isaji S, et al. Pancreatic Cancer Registry in Japan: 20 years of experience. Pancreas. 2004;28(3):219–30.
- 3) Lüttges J, Schemm S, Vogel I, Hedderich J, Kremer B, Klöppel G. The grade of pancreatic ductal carcinoma is an independent prognostic factor and is superior to the immunohistochemical assessment of proliferation. J Pathol. 2000;191(2):154–61.
- 4) Neoptolemos JP, Stocken DD, Dunn JA, Almond J, Beger HG, Pederzoli P, et al. Influence of resection margins on survival for patients with pancreatic cancer treated by adjuvant chemoradiation and/or chemotherapy in the ESPAC-1 randomized controlled trial. Ann Surg. 2001;234(6):758–68.
- 5) 日本膵臓学会編.膵癌取扱い規約.第6版.東京:金原出版;2007. p. 14.
- 6) Motoi F, Rikiyama T, Katayose Y, Egawa S, Unno M. Retrospective evaluation of the influence of postoperative tumor marker status on survival and patterns of recurrence after surgery for pancreatic cancer based on RECIST guidelines. Ann Surg Oncol. 2011;18(2):371–9.
- 7) Duffy MJ, Sturgeon C, Lamerz R, Haglund C, Holubec VL, Klapdor R, et al. Tumor markers in pancreatic cancer: a European Group on Tumor Markers (EGTM) status report. Ann Oncol. 2010;21(3):441–7.
- 8) Goonetilleke KS, Siriwardena AK. Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer. Eur J Surg Oncol. 2007;33(3):266–70.
- 9) Therasse P, Arbuck SG, Eisenhauer EA, Wanders J, Kaplan RS, Rubinstein L, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst. 2000;92(3):205–16.
- 10) Ferrone CR, Finkelstein DM, Thayer SP, Muzikansky A, Fernandez-delCastillo C, Warshaw AL. Perioperative CA19-9 levels can predict stage and survival in patients with resectable pancreatic adenocarcinoma. J Clin Oncol. 2006;24(18):2897–902.
- 11) Kinsella TJ, Seo Y, Willis J, Stellato TA, Siegel CT, Harpp D, et al. The impact of resection margin status and postoperative CA19-9 levels on survival and patterns of recurrence after postoperative high-dose radiotherapy with 5-FU-based concurrent chemotherapy for resectable pancreatic cancer. Am J Clin Oncol. 2008;31(5):446–53.
- 12) Kondo N, Murakami Y, Uemura K, Hayashidani Y, Sudo T, Hashimoto Y, et al. Prognostic impact of perioperative serum CA 19-9 levels in patients with resectable pancreatic cancer. Ann Surg Oncol. 2010;17(9):2321–9.
- 13) Abdel-Misih SR, Hatzaras I, Schmidt C, Saab TB, Klemanski D, Muscarella P, et al. Failure of Normalization of CA19-9 Following Resection for Pancreatic Cancer is Tantamount to Metastatic Disease. Ann Surg Oncol. 2011;18(4):1116–21.
- 14) Butturini G, Stocken DD, Wente MN, Jeekel H, Klinkenbijl JH, Bakkevold KE, et al. Influence of resection margins and treatment on survival in patients with pancreatic cancer: meta-analysis of randomized controlled trials. Arch Surg. 2008;143(1):75–83.
- 15) Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 2007;297(3):267–77.
- 16) Neoptolemos JP, Stocken DD, Bassi C, Ghaneh P, Cunningham D, Goldstein D, et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA. 2010;304(10):1073–81.
- 17) Michalski CW, Kleeff J, Wente MN, Diener MK, Büchler MW, Friess H. Systematic review and meta-analysis of standard and extended lymphadenectomy in pancreaticoduodenectomy for pancreatic cancer. Br J Surg. 2007 Mar;94(3):265–73.
- 18) 元井 冬彦, 力山 敏樹, 片寄 友, 江川 新一, 海野 倫明.進行癌の治療戦略.膵癌の治療戦略.術前治療とR0切除をめざした後腹膜一括郭清.外科.2010;72(7):734–42.
- 19) Lundin J, Roberts PJ, Kuusela P, Haglund C. The prognostic value of preoperative serum levels of CA 19-9 and CEA in patients with pancreatic cancer. Br J Cancer. 1994;69(3):515–9.
- 20) Halm U, Schumann T, Schiefke I, Witzigmann H, Mössner J, Keim V. Decrease of CA 19-9 during chemotherapy with gemcitabine predicts survival time in patients with advanced pancreatic cancer. Br J Cancer. 2000;82(5):1013–6.
- 21) Ko AH, Hwang J, Venook AP, Abbruzzese JL, Bergsland EK, Tempero MA. Serum CA19-9 response as a surrogate for clinical outcome in patients receiving fixed-dose rate gemcitabine for advanced pancreatic cancer. Br J Cancer. 2005;93(2):195–9.
- 22) Berger AC, Garcia M Jr, Hoffman JP, Regine WF, Abrams RA, Safran H, et al. Postresection CA 19-9 predicts overall survival in patients with pancreatic cancer treated with adjuvant chemoradiation: a prospective validation by RTOG 9704. J Clin Oncol. 2008;26(36):5918–22.
- 23) Pound CR, Partin AW, Eisenberger MA, Chan DW, Pearson JD, Walsh PC. Natural history of progression after PSA elevation following radical prostatectomy. JAMA. 1999;281(17):1591–7.
- 24) Habuchi T, Kamoto T, Hara I, Kawai K, Nakao M, Nonomura N, et al. Factors that influence the results of salvage surgery in patients with chemorefractory germ cell carcinomas with elevated tumor markers. Cancer. 2003;98(8):1635–42.
- 25) Cohen R, Campos JM, Salaün C, Heshmati HM, Kraimps JL, Proye C, et al. Preoperative calcitonin levels are predictive of tumor size and postoperative calcitonin normalization in medullary thyroid carcinoma. Groupe d’Etudes des Tumeurs a Calcitonine (GETC). J Clin Endocrinol Metab. 2000;85(2):919–22.
- 26) 元井 冬彦, 力山 敏樹, 片寄 友, 江川 新一, 海野 倫明.新規抗癌剤の導入で膵癌治療はどう変わるか?RECIST基準に準じた膵癌切除治療の効果判定 切除完全奏効率からみた術前治療の有効性評価.癌の臨床.2009;55(3):191–7.
- 27) Klung TL, Salzman S, Quinn A, Melincoff GA, Sedmak DD, Tubbs RR, et al. Tumorigenicity in athymic mice of the human colon carcinoma cell line SW1116 expressing the tumor-associated antigenic determinant CA19-9. Cancer Res. 1984;44(11):5212–8.
- 28) Yoshimasu T, Maebeya S, Suzuma T, Bessho T, Tanino H, Arimoto J, et al. Disappearance curves for tumor markers after resection of intrathoracic malignancies. Int J Biol Markers. 1999;14(2):99–105.
- 29) Raut CP, Tseng JF, Sun CC, Wang H, Wolff RA, Crane CH, et al. Impact of resection status on pattern of failure and survival after pancreaticoduodenectomy for pancreatic adenocarcinoma. Ann Surg. 2007;246(1):52–60.
- 30) 日本膵臓学会 膵癌診療ガイドライン改訂委員会編.科学的根拠に基づく膵がん診療ガイドライン2009年版.東京:金原出版;2009. p. 136–8.
- 31) Maisey NR, Norman AR, Hill A, Massey A, Oates J, Cunningham D. et al. CA19-9 as a prognostic factor in inoperable pancreatic cancer: the implication for clinical trials. Br J Cancer. 2005;93(7):740–3.