Abstract
症例は36歳の男性で,健診の胸部X線検査にて異常陰影を指摘された.精査にて左横隔膜上に5 cm大の腫瘍を認めたが,腫瘍発生臓器の特定は困難であった.潜在的悪性度を考慮し手術行った.腹腔鏡下観察困難にて開腹移行し,経食道裂孔的に食道左側に突出する腫瘍を同定した.食道憩室を基部とした腫瘍と判断し,憩室切除に準じ腫瘍切除を行った.免疫組織学的検索にて中リスク群gastrointestinal stromal tumor(以下,GISTと略記)と診断した.手術所見,術後検査結果から,食道GISTの存在が憩室形成に関与した可能性を考えた.食道GISTは術前確定診断困難な場合も多く,その解剖学的特性のため切除方法も個々の症例においてさまざまである.本症例は特殊な発生様式であったため,食道温存術式にて完全切除可能であった.我々は食道憩室を併発したまれな食道GISTの1例を経験したので考察を加えて報告する.
はじめに
Gastrointestinal stromal tumors(以下,GISTと略記)は頻度の多い消化管原発間質性腫瘍として知られている.しかし,胃や小腸およびその間膜を原発とすることが多く,食道原発GISTは1–2%程度とまれである1).食道原発GISTは漿膜を有さないその構造的特性および解剖学的位置により,手術侵襲が大きなものとなることが多く,切除方法に苦慮する症例が少なくない2).また,術前に病理診断および悪性度を正確に判断することは困難であることから定型的な切除術式は確立していない3)4).我々は横隔膜上食道憩室を併発した食道GISTに対し憩室切除にて摘出しえた,まれな1例を経験したので,文献的考察を加えて報告する.
症例
症例:36歳,男性
主訴:胸部異常陰影
既往歴・家族歴:特になし.
現病歴:会社健診にて胸部X線異常陰影を指摘され,精査のため当院を受診した.理学的所見,血液生化学所見ではCEA,CA19-9を含め,異常所見を認めなかった.
胸部X線検査所見:左横隔膜上に心陰影と重なる腫瘤影を認めた(Fig. 1).
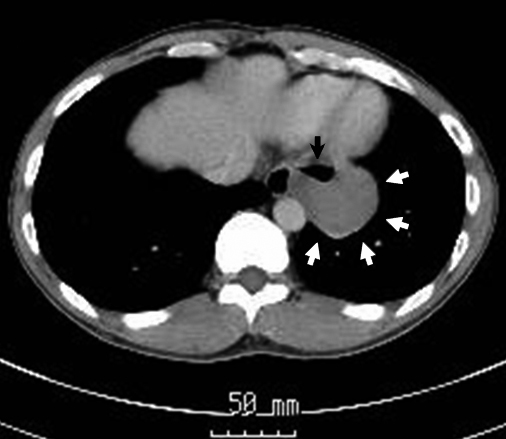
胸腹部CT所見:食道左側に消化管腔を認めた.この背側に左横隔膜,心膜,臓側胸膜に接する5 cm大の軽度造影効果を認める腫瘤像を認めた.裂孔ヘルニアにより縦隔に脱出した胃底部の腫瘍を疑う所見であった.その他に遠隔転移巣を示唆する所見は認めなかった(Fig. 2).
上部消化管内視鏡検査所見:腫瘍性病変は同定されず,胃食道接合部直上左側への内腔の突出を認めた.突出した内腔の観察は十分できなかったが,胃食道接合部胃粘膜の突出腔内への引き込み所見を認めたため,食道裂孔ヘルニアと診断した(Fig. 3).
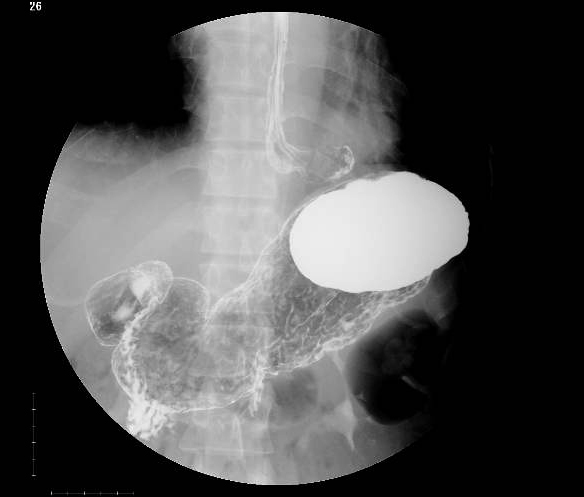
上部消化管造影検査所見:腫瘍による通過障害,壁外圧排像は認めなかった.横隔膜上左側の消化管突出腔は内視鏡所見と総合し,傍食道型食道裂孔ヘルニアと診断した(Fig. 4).
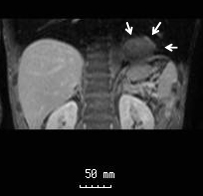
胸腹部MRI所見:CTで指摘された腫瘤影はT1WIでやや高信号,T2WIでは等信号を呈する造影効果軽度の57×30 mmの腫瘤像として描出された.また,MRI上は腹腔内より横隔膜を経由して胸腔内に突出しているようにも認められ,横隔膜ヘルニアに合併した腫瘍の可能性も示唆された(Fig. 5).
PET-CT所見:既知腫瘍にSUVmax 3.5のFDG集積を認めた.その他に転移巣,重複癌を疑うFDG集積は認めなかった.
術前画像所見からの原発特定は困難であったが,第一鑑別疾患として食道裂孔ヘルニアに合併した胃GISTを考えた.また,横隔膜,心膜,胸膜原発の潜在的悪性度を持った間質系腫瘍も考慮にいれ,手術加療の方針とした.
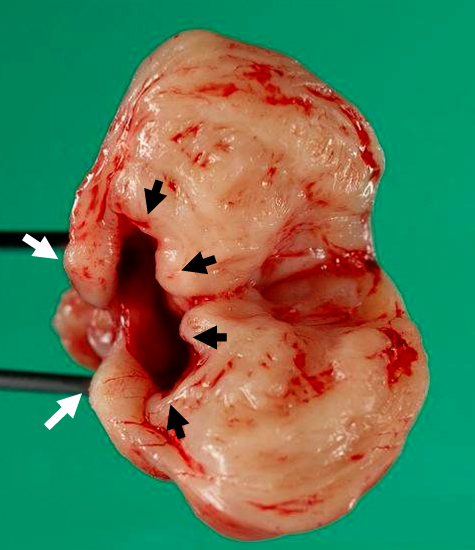
まず,腫瘍発生部位特定のため腹腔鏡下での観察を先行したが,食道裂孔や横隔膜を介したヘルニアの所見を認めなかったため,病変発生部が食道裂孔より頭側よりに位置していると考えた.腫瘍の潜在的悪性度を考慮し,腹腔鏡下操作では播種を含めた腫瘍遺残をもたらす可能性があると判断したため,開腹術に移行した.食道裂孔周囲を剥離し,裂孔を開大すると,下縦隔の指触診にて下部食道左側に突出する腫瘍を触知した.腫瘍表面は平滑で周囲への浸潤,癒着を認めなかったため,容易に腹腔内に誘導することが可能であった(Fig. 6).食道壁の一部が左側に突出し,突出した食道壁を基部として浸潤傾向の乏しい6 cm大の腫瘍の発生を認めた.以上の術中所見より,術前検査で食道裂孔ヘルニアを疑った胃食道接合部直上の内腔突出部を食道憩室と考え,横隔膜上食道憩室を発生母地とした腫瘍であると判断した(Fig. 7).食道を温存し,憩室切除のみを行う切離線で腫瘍切除断端の確保が可能であると考え,自動縫合器を用いた憩室切除を行うことで腫瘍を切除した.術前に通過障害は認めなかったため,筋層切開,逆流防止手技の追加は行わなかった.摘出腫瘍切離断端は全層を有した食道壁であり,断端に肉眼的な腫瘍の露出は認められなかった(Fig. 8).
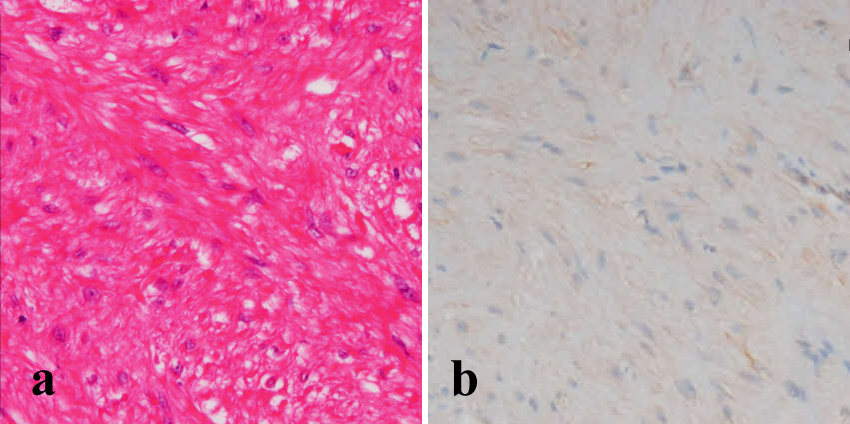
病理組織にて食道左側へ突出した憩室は食道筋層を有する真性憩室として認められた.摘出腫瘍は憩室壁筋層と連続性を認めた.腫瘍径6 cm,CD117/c-kit弱陽性,50HPF(high-power fields)中の核分裂像は5個未満であり,Fletcher分類による中リスク群GISTと診断された(Fig. 9).術後経過良好にて,術後10日目に退院した.食道狭窄症状なく,術後1か月に消化管透視および内視鏡検査,食道内圧測定を施行したが,形態的・機能的な異常所見は認めなかった.現在術後1年7か月であるが再発所見なく,外来経過観察中である.
考察
GISTの主な発生部位としては胃(約50%)に続き,小腸や結腸(20%程度)と報告されており,食道原発のものはGIST症例の1–2%と比較的まれである1).GISTは細胞増殖のシグナル経路に関するチロシンキナーゼレセプターであるCD117/c-kitの発現により,免疫組織学的にその他の非上皮性腫瘍と鑑別されるが,臨床的画像検査所見では粘膜下腫瘍として,平滑筋腫や神経鞘腫,平滑筋肉腫などと類似点も多い.術前診断についてはEUSガイド下生検の有用性も報告されている5)が,播種や周囲との癒着を懸念する報告も散見され2),手術を経ずして確定診断を得ることは必ずしも容易ではない.加えて,本症例では傍食道型食道裂孔ヘルニアの合併という術前診断の誤りがあり,食道憩室を合併した腫瘍であったことがさらに診断を難しくさせた.傍食道型食道裂孔ヘルニアの診断は上部消化管造影検査および内視鏡検査を施行した内科医により最終診断されたが,後ろ向きに検討すると上部消化管造影検査所見にて横隔膜上食道憩室の診断が可能であったと考える.
「gastrointestinal stromal tumor」,「GIST」,「食道」,「憩室」をキーワードに医学中央雑誌にて1983年から2011年まで,同じく「gastrointestinal stromal tumor」,「GIST」,「esophagus」,「diverticulum」をkey wordにPubMedにて1950年から2011年まで検索した結果,食道平滑筋腫に関連した食道憩室,食道偽アカラシアの報告6)~8)は散見されたが,c-kit陽性の狭義GIST症例の同様な報告は認めなかった.Mainprizeら9)の報告した食道偽アカラシアを呈したGISTの症例は,免疫染色所見上アクチン,ビメンチン陽性を示されているが,CD117/c-kitに関しては検討されておらず,狭義GISTであったかどうかは不明である.逆に,過去の症例でGISTの疾患概念が確立していなかったためにGISTと診断されていない症例も混在している可能性があると考える.食道憩室での上皮系悪性腫瘍合併の報告も散見10)~12)されており,食道憩室を腫瘍の発生母地として認識することは非常に重要と思われた.
GISTは生物学的に良性に近いものから極めて悪性のものまで多岐にわたり,手術に際しては腫瘍破裂を来すことなく完全切除することが極めて重要である13).FDG-PETを用いてGISTの潜在的な悪性度を予測できるとの報告もあり14),本症例では軽度ながらもFDG集積を認めたことや腫瘍径を考慮し,悪性腫瘍である可能性を重視して,手術に臨んだ.食道GISTsはその解剖学的特性により他の消化管のような部分切除が困難なため,位置や腫瘍径,局所進展により核出術から食道抜去術,食道切除術,周囲臓器合併切除まで個々の症例で切除方法を検討する必要がある2)~4).また,部位によっては腫瘍への到達法として,開腹,開胸アプローチ,または,胸腔鏡下,腹腔鏡下アプローチなどを検討可能である.本症例は当初,胃原発腫瘍の可能性を最も考えていたことから腹腔鏡下アプローチによる観察を先行した.術前から腹腔鏡下での摘出が困難と考えられた場合を想定し,開腹,開胸いずれのアプローチも検討した結果,最も柔軟な対応が可能と考えられる開腹アプローチを行う予定で手術に臨んだ.術中所見にて腹腔鏡下では腫瘍周囲の状況が十分把握困難な縦隔内腫瘍であると判断したため,腫瘍損傷の可能性を考慮し,開腹アプローチに変更した.周囲臓器への浸潤,癒着を認めず,幸運にも横隔膜上食道憩室を腫瘍発生母地としていたため,食道を温存する憩室切除に準じた腫瘍切除が可能であった.Blumら2)は自験例を含めた食道GIST33例の検討にて,核出術を施行された8例中5例に局所再発を認めていることを報告している.漿膜構造を有さないその構造など食道GIST切除における断端確保の困難性を指摘し,NCCNガイドラインで容認されている2 cm以下の比較的小さな食道GISTを除いては核出術による局所切除や胸腔鏡下手術は推奨されないと主張している.個々の症例での検討が必要であるが,食道GISTに対する胸腔鏡下および腹腔鏡下アプローチや食道温存術式の選択には慎重でなければならないと考えられる.
食道憩室は発生機序によって圧出性憩室と牽引性憩室に分けられる.横隔膜上食道憩室は通常食道右側に発生し,食道運動壁運動異常などを伴った圧出性憩室であることが知られている.本症例の横隔膜上食道憩室はまれな左側憩室であること,腫瘍が周囲への浸潤,癒着するなどの牽引性因子を認めないこと,術後の食道内圧検査にて下部食道括約筋圧の増高や静止圧の弛緩不全など食道運動機能異常所見を認めなったことから,固有筋層から発生したGISTの存在が食道壁の脆弱性を誘導した結果,圧出性に横隔膜上食道憩室を形成した可能性を考えた.
GISTsは核分裂像と腫瘍径が悪性度予測因子として挙げられており,本症例は若年男性に発生した中リスク群GISTに分類される.3 cm以上のGISTではimatinib mesylateによる術後補助療法による無再発期間の延長が報告されている15)が,中リスク群での補助療法に対しては否定的な見解も散見される16)17).本症例は本人の希望により術後補助療法を行わず経過観察しているが,今後再発や転移の可能性を考慮し,厳重な経過観察が必要と考えている.
本論文要旨は第65回日本消化器外科学会総会(2010年7月,下関)において発表した.
利益相反:なし
文献
- 1) Dan D, Seetahal S, Persad R. Gastrointestinal stromal tumor of the esophagus. J Natl Med Assoc. 2009 May;101(5):462–5.
- 2) Blum MG, Bilimoria KY, Wayne JD, de Hoyos AL, Talamonti MS, Adley B. Surgical considerations for the management and resection of esophageal gastrointestinal stromal tumors. Ann Thorac Surg. 2007 Nov;84(5):1717–23.
- 3) Fang FC, Tzao C, Cheng YL, Chan DC, Nieh S, Lee SC. Surgical treatment of gastrointestinal stromal tumor in the esophagus: report of three cases. Z Gastroenterol. 2007 Dec;45(12):1252–6.
- 4) Gouveia AM, Pimenta AP, Lopes JM, Capelinha AF, Ferreira SS, Valbuena C, et al. Esophageal GIST: therapeutic implications of an uncommon presentation of a rare tumor. Dis Esophagus. 2005;18(1):70–3.
- 5) Hoda KM, Rodriguez SA, Faigel DO. EUS-guided sampling of suspected GI stromal tumors. Gastrointest Endosc. 2009 Jun;69(7):1218–23.
- 6) Bozorgi S, Migliorelli FA, Cook WA. Leiomyoma of the esophagus presenting as a bleeding epiphrenic diverticulum. Chest. 1973 Feb;63(2):281–4.
- 7) Suzuki I, Oho K, Ariizumi K, Nakayama S, Tamura K, Serizawa H. [A case report of giant esophageal leiomyoma associated with an epiphrenic esophageal diverticulum]. Nihon Kyobu Geka Gakkai Zasshi. 1994 Jun;42(6):931–5.
- 8) Pistorius GA, Hegenauer K, Pahl S, Feifel G. Intrathoracic diverticulum caused by a leiomyoma: a rare case of spontaneous oesophageal rupture. Eur J Surg. 2000 May;166(5):426–8.
- 9) Mainprize KS, Dehn TC. Laparoscopic management of pseudoachalasia, esophageal diverticulum, and benign esophageal stromal tumor. Dis Esophagus. 2001;14(1):73–5.
- 10) Kimura H, Konishi K, Tsukioka Y, Muraoka K, Yabushita K, Maeda K, et al. Superficial esophageal carcinoma arising from the diverticulum of the esophagus. Endoscopy. 1997 Nov;29(9):S53–4.
- 11) Lai ST, Hsu CP. Carcinoma arising from an epiphrenic diverticulum: a frequently misdiagnosed disease. Ann Thorac Cardiovasc Surg. 2007 Apr;13(2):110–3.
- 12) Hung JJ, Hsieh CC, Lin SC, Wang LS. Squamous cell carcinoma in a large epiphrenic esophageal diverticulum. Dig Dis Sci. 2009 Jun;54(6):1365–8.
- 13) Das A, Wilson R, Biankin AV, Merrett ND. Surgical therapy for gastrointestinal stromal tumours of the upper gastrointestinal tract. J Gastrointest Surg. 2009 Jul;13(7):1220–5.
- 14) Sakai M, Kato H, Saito K, Tanaka N, Inose T, Kimura H, et al. Clinical applications of 18F-fluorodeoxyglucose positron emission tomography in gastrointestinal stromal tumor of the esophagus. Int Surg. 2008 Jul–Aug;93(4):209–13.
- 15) Dematteo RP, Ballman KV, Antonescu CR, Maki RG, Pisters PW, Demetri GD, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet. 2009 Mar 28;373(9669):1097–104.
- 16) Joensuu H. Predicting recurrence-free survival after surgery for GIST. Lancet Oncol. 2009 Nov;10(11):1025.
- 17) Hohenberger P. Adjuvant imatinib in GIST: a self-fulfilling prophecy, or more? Lancet. 2009 Mar 28;373(9669):1058–60.