2014 Volume 47 Issue 11 Pages 734-739
2014 Volume 47 Issue 11 Pages 734-739
症例は64歳の女性で,直腸癌に対して腹腔鏡下直腸低位前方切除術を施行した.術後診断はtub2,pT2(MP),pN2(6/15),cH1,cP0,cM0,fStage IV,EGFR 陽性,K-RAS 変異株であった.第32病日よりXELOX+Bevacizumab(以下,Bevと略記)を開始した.開始9日目より下痢・嘔吐が頻回となり(grade 2),11日目よりカペシタビンの内服を中止としたが,39°Cの発熱と下痢・嘔吐の増悪(grade 3)ならびに重篤な白血球減少(grade 4),血小板減少(grade 4)を認めた.G-CSF投与,血小板輸血,抗生剤・抗真菌薬投与にて症状は改善に向かったが,その後も下痢と発熱が継続しサイトメガロウイルス(cytomegalovirus; CMV)腸炎ならびに薬剤性腸炎と診断した.全身状態の改善後に肝切除術,CPT-11+Bev投与を行ったが,腫瘍の進行により術後1年3か月後に永眠された.本症例は末梢血単核球dihydropyrimidine dehydrogenase(以下,DPDと略記)活性の低下を認め,DPD欠損症と診断した.本邦においてDPD欠損症は非常にまれであり,診断やスクリーニングの方法は確立されていない.フッ化ピリミジン系抗癌剤の投与により重篤な有害事象を招く危険があり,疑われた場合には速やかな対応が必要である.
フッ化ピリミジン系抗癌剤(以下,5-FUと略記)は,消化器領域の悪性腫瘍に頻用される薬剤である.欧米では以前より,5-FUの不活性化代謝の律速酵素であるdihydropyrimidine dehydrogenase(以下,DPDと略記)を欠損した患者に5-FUを使用した場合,重篤な副作用が発症することが報告され1)2),近年本邦においても同様の報告がされている.今回,我々はXELOX+Bevacizumab(以下,Bevと略記)投与により重篤な有害事象を来した症例を経験したので報告する.
患者:64歳,女性
主訴:下痢・嘔吐
家族歴:特記事項なし.
既往歴:特記事項なし.
現病歴:2011年4月に下血の精査にて直腸癌と診断され,同年6月に腹腔鏡下直腸低位前方切除術を施行した.術前の腹部CTにてS7に2 cm大の肝転移を指摘されていたが,多発肝転移の可能性も考慮し,術後に化学療法(XELOX+Bev 3コース)を施行し,肝転移巣を再評価したのちに可能であれば切除の方針であった.術後診断はtub2,pT2(MP),pN2(6/15),cH1,cP0,cM0,fStage IV,EGFR 陽性,K-RAS変異株であった.術後経過は良好で第13病日に退院となった.第32病日より化学療法を開始した.投与量は,カペシタビン2,000 mg/m2,L-OHP 130 mg/m2,Bev 7.5 mg/kgとした.カペシタビン内服開始9日目より下痢・嘔吐が頻回となり(grade 2),11日目より内服を中止としたが,39°Cの発熱と下痢・嘔吐の増悪(grade 3)を認め,13日目に緊急入院となった.
入院時現症:身長155 cm,体重54.0 kg,血圧122/99 mmHg,脈拍95回/分,体温38.9°C.口内炎(grade 2)と嘔吐・下痢(grade 3)を認めた.
入院時血液検査所見:著明な骨髄抑制はみられず,CRPの軽度上昇のみであった(Table 1).
| WBC | 4.2×103/μl | T-Bil | 1.11 mg/dl |
| Neu | 73.0% | LDH | 175 IU/dl |
| RBC | 492×104/μl | BUN | 33.7 mg/dl |
| Hb | 14.9 g/dl | Cr | 0.67 mg/dl |
| PLT | 14.1×104/μl | Na | 131 mEq/l |
| Alb | 3.8 g/dl | K | 3.7 mEq/l |
| AST | 11 IU/l | Cl | 97 mEq/l |
| ALT | 11 IU/l | CRP | 3.13 mg/dl |
入院後経過:汎血球減少が急速に進行し,抗生剤,抗真菌剤,G-CSF,血小板輸血を行ったが,内服開始18日目にはWBC 110/μl,好中球0.0/μl,PLT 2.2×104/μlにまで低下した.DPD欠損症を疑い,末梢血単核球(以下,PBMCと略記)中のDPD活性を測定したところ,9.5 pmol/min/mg/proteinと著しい低値であった.徐々に汎血球減少は改善したが,下痢と発熱が継続し,51日目にサイトメガロウイルス(Cytomegalovirus;以下,CMVと略記)抗原が陽性となり,CMV腸炎と診断し,ガンシクロビルを投与したところ,炎症所見は改善した.その後も食事を再開すると下痢と発熱が増悪するため,87日目に大腸内視鏡を施行したところ,結腸に多発する縦走潰瘍を認め,薬剤性腸炎と診断した.ペンタサ錠500 mgの内服にて徐々に症状も改善し,内服開始117日目に退院した(Fig. 1, 2).その後,肝転移巣に対し,肝切除術,化学療法(CPT-11+Bev)を施行するも,腫瘍の進行により初診時から1年3か月後に永眠された.

Clinical course (7/4~7/31).

Clinical course (8/1~9/5).
5-FUは消化器領域において抗癌剤治療の中心となる薬剤の一つである.DPDは5-FU代謝において不活化の第一段階を担う律速酵素であり,代謝の80~90%を担っている(Fig. 3)3).したがって,DPDの先天的な欠損は5-FU投与において重篤な有害事象を招くと考えられている.DPD欠損症は1985年にTuchmanら1)により初めて報告され,本邦では1998年のKouwakiら4)の報告以来,1983年から2012年3月までの医学中央雑誌で「DPD欠損」をキーワードとして検索(会議録を除く)した結果,10例が報告されている(Table 2)4)~13).完全欠損型と考えられるDPD活性が10%以下である頻度は,日本人では0.7%14),白色人種では0.1%以下15)と比較的まれで,Luら16)の報告によると,平均活性の10%以下の完全欠損型では死亡,30%以下の部分欠損型では重篤な副作用が起こるとされている.確立した診断法はなく,遺伝子解析やDPD酵素活性測定などが直接的な検出法として,血中・尿中5-FU濃度や尿中uracil/dihydrouracilや尿中thymine/dihydorothymineが間接的な指標として補助的に用いられている.DPDはあらゆる正常組織や腫瘍内に存在するが,肝臓が全体の約80%を占めており,PMBC中のDPD活性は肝DPD活性と相関する17)とされているため,PMBC中のDPD活性を診断の指標とすることが多い.
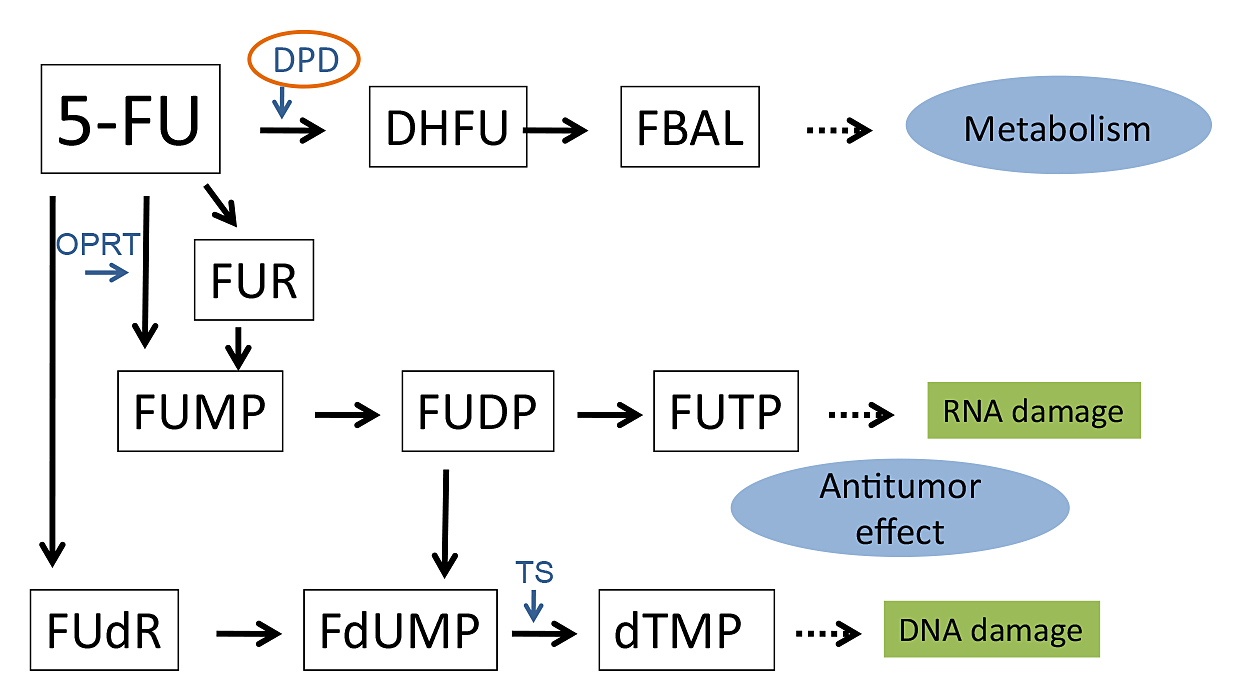
Metabolic pathway of 5-FU. DPD: dihydropyrimidine dehydrogenase, OPRT: orotate phosphoribosyl transferase, TS: thymidylate synthase
| No | Author/Year | Patient | Chemotherapy | Side effect | Onset day from initial dose | Diagnosis | Prognosis |
|---|---|---|---|---|---|---|---|
| 1 | Kouwaki4)/1998 | Breast cancer, 57, F | CAF, 5'-DFUR | Leukocytopenia (grade 4), Thrombocytopenia (grade 4) | 7 | DPD gene mutation, DPD activity in PMCB ↓, Uracil in urine ↑, Thymine in urine ↑ | unknown |
| 2 | Kobayashi5)/1998 | Gastric cancer, 65, F | 5-FU, LV, CDDP | Stomatitis (grade 3), Desquamation (grade 3) | 16 | Dihydrouracil in urine ↓ Dihydrothymine in urine ↓ | death |
| 3 | Inada6)/1999 | Gastric cancer, 44, F | MMC, 5-FU | Nausea (grade 4), Granurocytopenia (grade 3) | 12 | DPD activity in PMCB ↓ Uracil in urine ↑ | death |
| 4 | Godai7)/2002 | Breast cancer, 71, F | 5-FU, MTX, CPA | Leukocytopenia (grade 4), Thrombocytopenia (grade 4) | 5 | DPD activity in PMCB ↓ | recover |
| 5 | Komuro8)/2004 | Breast cancer, 60, F | 5-FU | Mucositis (grade unknown), Myelosupression (grade unknown) | 8 | Uracil in serum ↑ Dihydrouracil in serum ↓ DPD activity of the liver ↓ DPD-mRNA ↓ | death |
| 6 | Hashimoto9)/2006 | Gastric cancer, 39, M | S-1, UFT | Anorexia (grade 2), Fever (grade 1) | 5 | DPD activity in PMCB ↓ | death |
| 7 | Takaba10)/2008 | Rectal cancer, 72, M | UFT, LV | Leukocytopenia (grade 4), Thrombocytopenia (grade 4), Mucositis (grade 3) | 6 | Uracil in urine ↑ Dihydrouracil in urine ↓ DPD activity in PMBC ↓ | death |
| 8 | Kai11)/2008 | Colon cancer, 75, M | UFT, LV | Nausea (grade 4), Mucositis (grade 3), Leukocytopenia (grade 4), Thrombocytopenia (grade 3) | 7 | Uracil in urine ↑ Dihydrouracil in urine ↓ DPD activity in PMBC ↓ | recover |
| 9 | Iwamoto12)/2010 | Rectal cancer, 75, M | UFT, LV | Mucositis (grade 3), Leukocytopenia (grade 4), Thrombocytopenia (grade 3) | 7 | DPD activity in PMCB ↓ | recover |
| 10 | Arakane13)/2010 | Gastric cancer, 70, F | S-1 | Leukocytopenia (grade 4), Thrombocytopenia (grade 4), Dehydration (grade 4) | 14 | DPD-mRNA ↓ | death |
| 11 | Our case | Rectal cancer, 64, F | capecitabin, L-OHP, Bevacitzumab | Vomition (grade 4), Diarrhea (grade 4), Leukocytopenia (grade 4), Thrombocytopenia (grade 4) | 9 | DPD activity in PMCB ↓ | recover |
Oguraら14)によると日本人150人のPBMC中DPD活性の平均値は173 pmol/min/mgとされ,本症例のDPD活性はその5.5%であり完全欠損型と考えられる.本邦報告症例10例中6例が死亡していることを考えると,重篤な副作用を発症したものの,救命できたことはまれであると考えられる.本症例では全身状態は改善したものの,長期にわたり下痢が継続し,大腸内視鏡所見上薬剤性腸炎が広範囲に認められ,ペンタサ錠内服にて症状が改善した.また,5-FUが使用できないこと,下痢が続いていたためにCPT-11が使用しづらい点から,肝切除術を施行したものの,curativeな切除はできず,下痢の改善を待ってCPT-11+Bevの投与を行ったが,新たな肝転移・肺転移を認め,初診時から1年3か月後に永眠された.5-FUは大腸癌において化学療法の中心的な薬剤であるため,DPD欠損症の患者では治療方針の選択も困難であると思われる.また,肝転移巣の切除時期に関しても議論がなされているところであるが,本症例のようなDPD欠損症症例では,初回の手術の際に抗癌剤投与の副作用の危険性を考慮して肝転移巣の同時切除を行うという選択肢も考えられる.
近年,切除不能・再発症例だけでなく,補助化学療法としても抗癌剤投与の機会はますます増加しており,DPD欠損症の患者に5-FU系抗癌剤が投与されるリスクも高まると考えられるため,投与前のスクリーニングを含めたDPD欠損症の診断,検査方法の開発が望まれる.鷲見ら18)は5-FU系抗癌剤投与前に尿中uracil/dihydrouracil分析などの簡便な尿のスクリーニング検査を行うことを推奨しており,異常があれば,さらに遺伝子解析や酵素活性などの信頼性のある検査を行うべきだと述べている.また,最近では同位体元素で標識した[13C] uracilを用いた方法が報告されている19)20)が,実用化には至っていない.一部のDPD欠損症は常染色体劣性遺伝をすることがわかっており21),詳細な問診から血縁者に重篤な副作用を経験している患者への投与はDPD活性の測定を含め,十分な注意が必要である.また,こういった疾患を念頭に置くことで,副作用の早期発見・早期治療が可能ではないかと考える.
利益相反:なし