Abstract
症例は56歳の男性で,検診で指摘された肝機能異常の精査目的で高次医療機関を受診した.腹部CTでは,肝前区域を主座とする20 cm径の腫瘤性病変を認め,肝外側区域と膵体部に転移病変が疑われた.肝生検にて孤立性線維性腫瘍(solitary fibrous tumor;以下,SFTと略記)と診断され,手術加療目的で当院へ紹介となった.治療は腫瘍縮小と出血制御を目的にTAEを先行処置した後に,拡大中央2区域切除,外側区域部分切除にて肝主病巣と肝内転移巣を切除し,9か月後に膵頭部新規病変を含む膵転移巣を切除した.術後補助療法は施行せず,現在30か月無再発生存中である.肝原発悪性SFTはまれであり,また膵転移を伴った症例は自験例のみである.遠隔転移を有する悪性症例についても病巣の完全摘除により長期無再発生存が可能であることが示唆された.
はじめに
孤立性線維性腫瘍(solitary fibrous tumor:以下,SFTと略記)は胸膜から発生する比較的まれな腫瘍である1)~4).胸膜外発生例も散見されるが,肝原発のSFTは極めてまれである.また,多くは良性であり,局所浸潤や再発,転移を来すことは少ないとされている.今回,同時性肝内転移,膵転移を伴う肝原発SFTに対して,二期的に肝切除,膵切除を施行し,以後無再発で良好に経過している1例を経験したので,若干の文献的考察を加えて報告する.
症例
患者:56歳,男性
主訴:なし(検診時,肝機能異常).
家族歴:特記すべきことなし.
既往歴:脳髄膜腫(20年前,14年前に摘出手術)
生活歴:飲酒なし.喫煙30本/日,40年間.
現病歴:検診で肝機能異常を指摘されたため,精査目的に紹介医を受診した.画像検査にて肝右葉に長径20 cmの巨大な腫瘤を認めた.肝細胞癌とは造影パターンも異なり,腫瘍マーカーの上昇も認めなかったことから,肝腫瘤の生検を施行した.病理組織学的検査所見において,細胞密度が高く,比較的均一な紡錘形細胞の錯綜した増生がみられ,上皮性成分の含有は確認されなかった.免疫組織染色検査の結果と合わせSFTと診断し,手術目的にて当院紹介となった.
入院時現症:身長172 cm,体重67 kg,血圧132/78 mmHg,脈拍72回/分.腹部は平坦,軟であり,右季肋部に弾性硬の腫瘤を触知した.自覚症状は認めなかった.
入院時血液検査所見:ALP 378 IU/lと軽度の胆道系酵素の上昇を認めた程度で,他腫瘍マーカー検査(AFP,PIVKA-II)を含め異常値を認めなかった.背景肝は正常であり,肝予備能はChild-Pugh分類ではA分類(5点)であった.
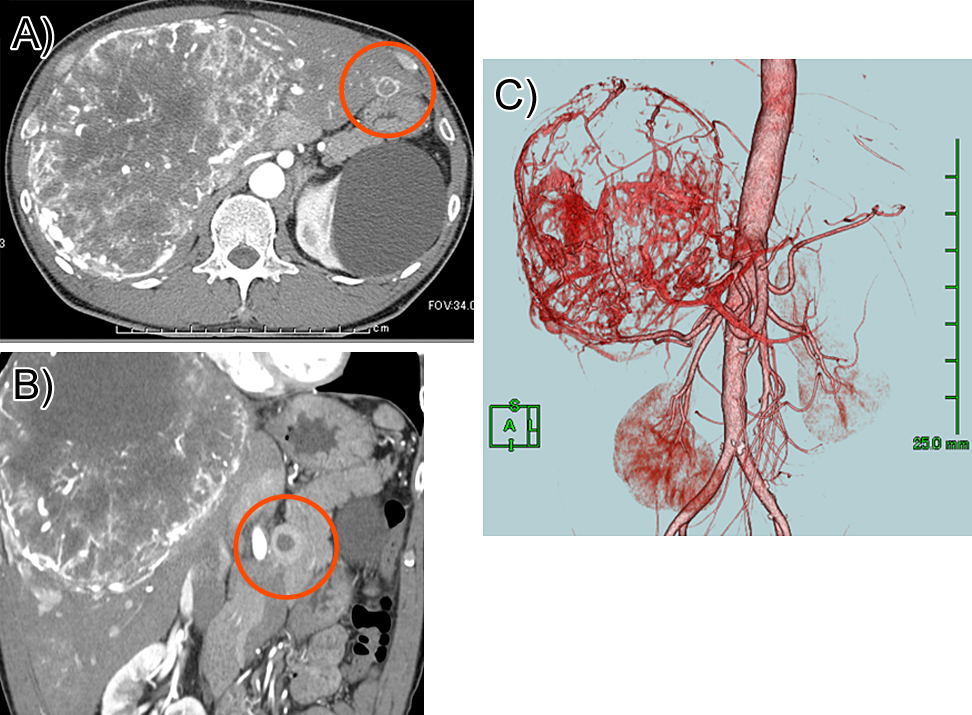
腹部CT所見:肝前区域を主座とする20 cm径の腫瘍を認めた.腫瘍は前区域のほぼ全域を占拠し,内側区域に進展する様相であった.形態は,被膜を有さない充実性腫瘍で,内部に広汎な壊死を伴っていた.造影早期相では,辺縁を主体とした不均一な濃染を呈し,遅延相で洗い出しを認めた.また,一部充実成分は平衡相にかけて,緩徐な濃染パターンを呈していた.主要脈管との関係については,グリソン臍部,ならびに後区域枝は圧排を受けているものの脈管の内腔変化を認めず,直接浸潤よりも圧排を主体とした進展と判断された.肝左葉に15 mm径,膵体部に16 mm径の主腫瘤と同様の造影所見を呈する腫瘤を認めた(Fig. 1).
腹部MRI所見:主病巣は,早期相で拡張した血管像が目立つものの腫瘍自体は緩徐に造影され,hemangiopericytic patternを主体とするSFTに合致する所見と考えられた.腫瘍内部には中心壊死と思われる造影不良域を広範に認め,高悪性度のSFTを示唆していた.その発生母地は,肝血管とのシャント形成が目立つこと,肝自体の圧排性変化に乏しいことから,横隔膜からの由来よりも,肝臓由来の腫瘍が考えられた.肝左葉S2の腫瘤についても同様の信号パターンを示し,主病巣,娘病巣ともに肝細胞造影相でガドキセト酸ナトリウムの取り込みを認めなかった.膵体部病巣も同様の信号パターンと中心壊死を認め,また拡散強調画像で高信号を示すことから,転移が示唆された.
以上より,肝内と膵体部に同時性転移を有する,肝原発悪性SFTと診断した.術前の問題点として,血流の豊富な巨大腫瘍であること,および腫瘍の肝門部進展が挙げられ,出血制御と手術操作性の向上を考慮し,術前にTAEを施行し,待機後に肝切除,膵切除の方針とした.
腹部血管造影検査所見:栄養動脈は右下横隔動脈,右肝動脈,中肝動脈であり,そのうち,右肝動脈前区域枝が主要供給路と考えられた.併せて,胸腔内との血管交通は描出されなかった.右肝動脈および中肝動脈よりTAEを2回施行し,塞栓前と比較して腫瘍濃染の描出は減少した(Fig. 2).
第一期手術(肝拡大中央2区域切除術,S2部分切除術):肝右葉前区域占拠し,内側区域に展開する腫瘍は,グリソン左右枝を著明に圧排していたため,グリソン個別処理の方針とした.グリソン右枝を開放し肝動脈処理を先行した後に,門脈前区域枝の切離を試みたが困難であった.このため,グリソン臍部外側から右側方向へ切離を進め,中央二区域を頭側へ挙上しつつ,グリソン前区域枝を処理した.肝静脈は中肝静脈,右肝静脈を切離し,右側残肝の静脈還流路として右下肝静脈を温存する方針とした.拡大中央2区域切除術を完遂した後に,S2領域の転移巣を部分切除した(手術時間:13時間15分,Pringle遮断:1時間30分,出血量11,135 ml).転移病巣を含めた肝病巣切除に相応の過大な侵襲を要したため,膵病変切除を見合わせ二期的切除の方針とした.
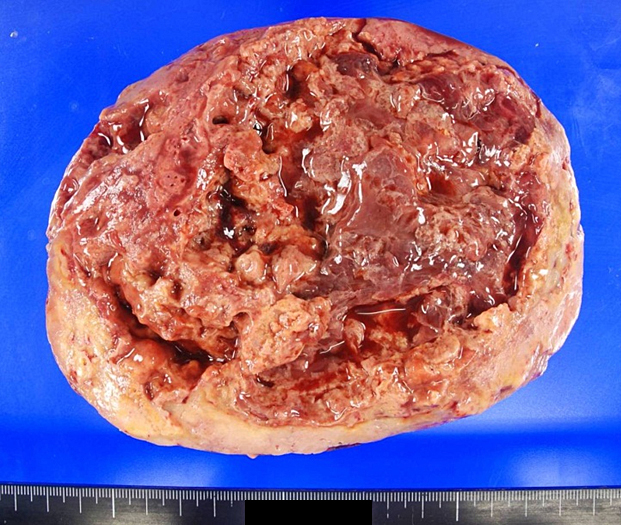
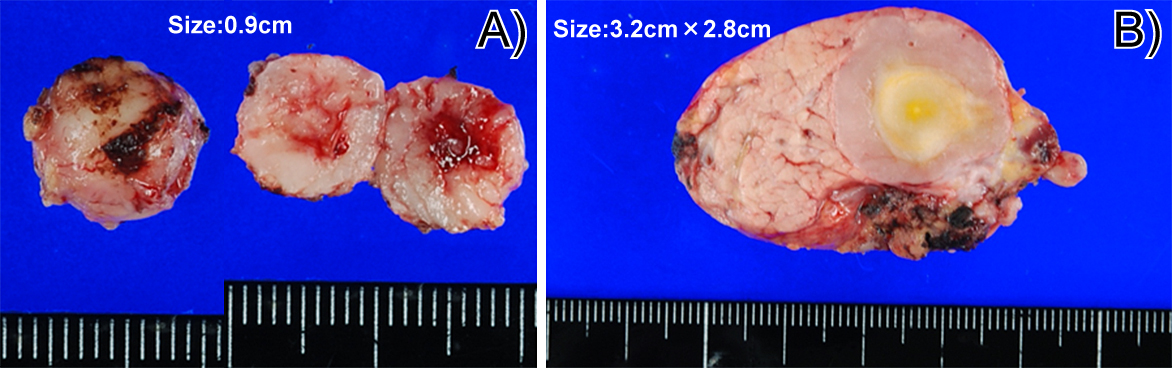
摘出標本肉眼所見:切除肝重量は3,156 g,主病巣は最大腫瘍径17 cmの被膜を有さない充実性腫瘍であり,内部に広汎な壊死を伴っていた(Fig. 3).
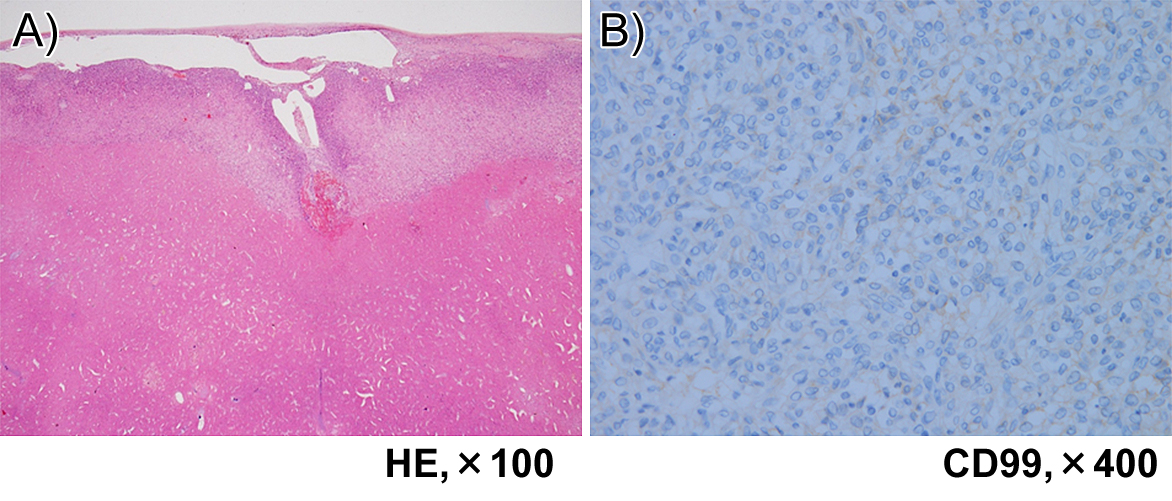
病理組織学的検査所見:主病巣は,小型円形核を有する細胞がstag-horn patternを呈する血管を伴って密に増生する腫瘍で,核分裂像はほとんど認めなかったが,地図状に壊死巣が存在していた(Fig. 4A).明らかな血管浸潤や胆管浸潤は認めなかった.免疫染色検査ではcytokeratin,α-smooth muscle actin,CD34は陰性であり,CD99は一部の細胞に陽性であった(Fig. 4B).CD34は陰性であったが,組織像と合わせてSFTと考えられた.肝S2の病巣についても同様の組織像を認め,転移と診断した.
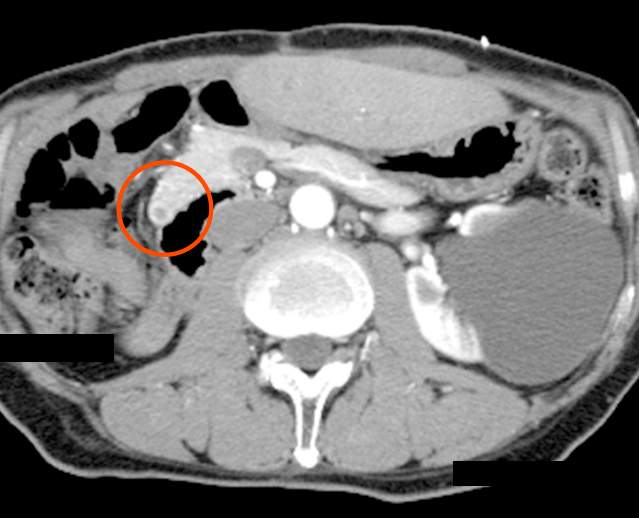
術後経過:術後,広範なグリソン鞘剥離面に起因する難治性胆汁漏の管理に難渋するも,軽快退院の運びとなった.術後7か月目に施行した画像検査において,膵頭部にも新規の転移性病変の出現が確認され(Fig. 5),初回手術から9か月後,膵頭部新規病変を含む膵転移巣に対して手術の運びとなった.
第二期手術(膵体尾部切除術,膵頭部腫瘍核出術):膵体部病変については,膵病変の病理学的診断を得ていないこと,ならびにその腫瘍局在より標準手術の方針とし,膵体尾部切除術を施行した.膵頭部病変については,病状経過からSFTの転移を第一に考え,縮小・機能温存手術の適応があると判断し,腫瘍核出術を施行した.切除標本の肉眼所見は,肝病巣と同様に,中心壊死を伴う充実性腫瘍であった(Fig. 6).
病理組織学的検査所見:紡錘状~類円形の腫瘍細胞が膵実質内で充実性に増生する像を認めた.細胞密度の高い領域では核分裂像も散見され,内部には壊死を伴っていた.免疫染色検査ではCD34,CD99がともに一部陽性となることから,原発巣SFTからの転移として矛盾のない像であった.
術後経過は良好であり,第二期手術後第28病日に軽快退院となった.以後,外来で経過観察しており,現在術後30か月が経過し,無再発生存中である.なお,術後補助療法は施行していない.
考察
SFTは1931年にKlempererら1)によって初めて報告された,まれな紡錘形細胞腫瘍である.胸膜や腹膜などの中皮は,最表面を被覆する1層の中皮細胞と,その直下の疎な結合組織で構成されており,SFTの多くはその結合組織内間葉系細胞に由来し,胸膜に関連した胸腔内病変として数多く報告されている2)~4).近年,胸腔外発生例の報告が散見されており,その部位は眼窩,唾液腺,上気道,腹膜,後腹膜,骨髄腔,髄膜,脊髄,甲状腺,肝臓,腎臓,副腎,精索,膀胱,前立腺,子宮頸部,骨膜,軟部組織など多岐にわたる5)~7).とりわけ,肝原発のSFTは極めてまれであり,PubMedにおいて「solitary fibrous tumor of the liver」をキーワードとし,1950年より2012年の発刊期間で検索したところ肝原発SFTについては95例の報告があり,さらに「malignant」に絞った場合,悪性肝原発SFTは28例の報告であった.それら全ての報告の中で,膵転移を伴った悪性肝原発SFTの報告はなかった.本症例では,主病巣の組織標本において,明らかな血管浸潤や胆管浸潤を認めておらず,同時多発の可能性も完全には否定できない.また,膵原発SFTからの肝転移の可能性も考慮された.しかしながら,術後経過の中で,術後遠隔期に異時性に新規膵病変の発生を認めたことから,肝原発病変からの同時性・異時性膵転移と判断した.本疾患に特徴的な理学所見や血液学的所見は明らかになっていない.CTやMRIでは内部不均一な造影効果を有する境界明瞭な腫瘍として描出されることが多いが,これらはSFTに特徴的な所見ではなく,現段階での術前画像診断は極めて困難であり,確定診断には病理組織学的検査が必須と考えられる.病理組織学的検査では,紡錘形~多形性の細胞が特徴的な配列をなさずに錯綜するpatternless patternと,腫瘍内に血管が細長く伸びて分枝状に拡張した血管外皮腫様外観を呈するhemangiopericytoma-like patternの二つが挙げられる5)8)9).免疫組織化学的染色検査を施行すると,SFTは間葉系細胞のマーカーであるvimentinが81~100%の症例で陽性3)10)~15),CD34も80~100%の症例で陽性となり10)~18),この両者が全例で陽性であったという報告が多い.その他にもCD99,vimentin,bcl-2などのマーカーが陽性を示す19).SFTは軟部腫瘍新WHO分類では,良性腫瘍と悪性腫瘍の間に位置する良悪性中間的腫瘍群のうち,低頻度転移群(rarely metastasizing group:転移頻度2%以下)に分類されている20)21).また,原発性肝腫瘍の扱いとしては,2010年に10年ぶりに改訂されたWHO histological classification of tumours of the liver and intrahepatic bile ductsにおいてmiscellaneous tumorのカテゴリーに分類されている.悪性のSFTでは細胞充実性が高く,広範囲の壊死を伴い,核分裂数が多く,核の多形がある22).SFTの悪性化の指標としてYokoiら23)は,CD34陽性細胞の減少や陰性化,p53の過剰発現を報告している.また,Englandら3)は組織学的悪性度の基準として,①高い細胞密度,②強拡大10視野中4個以上の核分裂像,③核異型,④出血や壊死の存在を挙げている6)24)25).今回の症例では,核分裂像や核異型は認めないものの,肝病巣についてはCD34陰性,膵病巣については一部陽性であり,肝病巣,膵病巣ともに中心壊死像と高い細胞密度を呈していたことから,比較的悪性度の高いSFTと考えられた.肝臓の主病巣については壊死がTAEによる影響も考慮すべきであるが,TAE施行前の画像検査において壊死像を認めた部位と一致した切片では,embolizationに伴う壊死部と様相が異なり,悪性を示唆する腫瘍壊死と判断した.胸膜発生SFTの場合,悪性は12~37%2)3)で,悪性の50%が再発,転移を来し,その38%が2年以内に死亡し,良性でも5%が再発するとされ26)27),胸腔外発生SFTでは悪性は10.8%16),後腹膜では12%28),腹膜では27%29)とされている.しかし,病理組織学的悪性所見と臨床経過が一致しないという報告も散見されており11)16)30),治癒切除を行った病理組織学的良性所見の症例でも再発や転移は起こりうるとも考えられ,また,術後31年目に再発した報告例31)もあることから,本疾患は長期間の慎重な経過観察が重要と考えられる.SFTの治療は外科的切除が第一選択であり3)4)24)32),予後にもっとも関与するのは,手術での腫瘍の完全摘出の成否にあるとされ3),術後補助療法を含め,化学療法や放射線療法の有効性は確立されていない.本症例においては,巨大腫瘍による手術操作の困難性と術中手術操作に伴う大量出血が危惧された.そのため,両手術リスク軽減のために腫瘍容積の縮小と腫瘍栄養血管の先行処理を目的として段階的TAEを施行した.TAEの効果としては,著明な腫瘍縮小効果を認めることは叶わなかったが,摘出病理より壊死組織も確認されており一定の効果は期待できる.出血制御の意義としては,胸壁由来SFTに対して術前TAEが奏効したとの報告もあるが33),肝臓原発SFTについては自験例も踏まえてその効果について今後も検証していく必要がある.再発治療について,Saynakら34)は外科切除後に再発した胸腔内原発SFTに対し放射線治療が奏効したと報告している.また,最近では,somatostatin analog剤での治療について35),抗腫瘍効果を選択的かつ特異的に向上させるため,腫瘍のsomatostatin receptor assayを行うことや,新たな放射性同位元素で標識して放射線治療を行うことなどが注目されている36)37).また,本邦でも悪性軟部腫瘍に対する分子標的治療薬として,VEGFR,PDGFR,c-Kitに対し阻害作用を有するマルチキナーゼ阻害剤であるpazopanibが2012年より承認され,SFTに対しても使用可能となっている.今回の症例では,悪性度の高いSFTであったが,二期的に完全摘出することが可能であったため,術後の補助療法は施行していない.術後30か月が経過した現在まで無再発生存中であるが,今後,本症例が再発した場合には,pazopanibの使用についても選択肢の一つとして積極的に検討したい.
本症例は,同時性肝内転移,膵転移および異時性膵転移を伴う肝原発SFTに対して,二期的に肝切除,膵切除を施行し,以後無再発で良好に経過している1例である.SFTは診断,治療,予後などに関していまだ不明確な点が多く残されている疾患であり,更なる症例の蓄積と検討が望まれる.
利益相反:なし
文献
- 1) Klemperer P, Rabin CB. Primary neoplasm of the pleura; A report of five cases. Arch Pathol. 1931;11:385–412.
- 2) Briselli M, Mark EJ, Dickersin GR. Solitary fibrous tumors of the pleura: eight new cases and review of 360 cases in the literature. Cancer. 1981 Jun;47(11):2678–2689.
- 3) England DM, Hochholzer L, McCarthy MJ. Localized benign and malignant fibrous tumors of the pleura. A clinicopathologic review of 223 cases. Am J Surg Pathol. 1989 Aug;13(8):640–658.
- 4) Magdeleinat P, Alifano M, Petino A, Le Rochais JP, Dulmet E, Galateau F, et al. Solitary fibrous tumors of the pleura: clinical characteristics, surgical treatment and outcome. Eur J Cardiothorac Surg. 2002 Jun;21(6):1087–1093.
- 5) 長谷川 匡.【新しい線維性腫瘍の特徴と問題点】孤立性線維性腫瘍及び類似病変.病理と臨床.2000;18(2):117–122.
- 6) 広松 孝, 秋田 昌利, 長谷川 洋, 坂本 英至, 小松 俊一郎, 河合 清貴,ほか.後腹膜原発巨大solitary fibrous tumorの1例.日本消化器外科学会雑誌.2006;39(10):1604–1610.
- 7) Neeff H, Obermaier R, Technau-Ihling K, Werner M, Kurtz C, Imdahl A, et al. Solitary fibrous tumour of the liver: case report and review of the literature. Langenbecks Arch Surg. 2004 Aug;389(4):293–298.
- 8) 関 崇, 河野 弘, 三輪 知弘, 佐竹 立成.肝原発malignant solitary fibrous tumorの1例.日本消化器外科学会雑誌.2008;41(5):521–526.
- 9) 久岡 正典, 橋本 洋.【骨軟部腫瘍 新WHO分類をふまえて 軟部腫瘍】孤立性線維性腫瘍とその類縁腫瘍.病理と臨床.2004;22(2):132–139.
- 10) 池田 智弘, 和田 奈緒子, 野村 眞欣, 田宮 貞宏, 牛島 正人.全身転移を来たし悪性の経過を辿ったsolitary fibrous tumorの1例.日本呼吸器学会雑誌.2011 Dec;49(12):913–916.
- 11) Hasegawa T, Matsuno Y, Shimoda T, Hasegawa F, Sano T, Hirohashi S. Extrathoracic solitary fibrous tumors: Their histological variability and potentially aggressive behavior. Hum Pathol. 1999 Dec;30(12):1464–1473.
- 12) Hanau CA, Miettinen M. Solitary fibrous tumor: Histological and immunohistochemical spectrum of benign and malignant variants presenting of different sites. Hum Pathol. 1995 Apr;26(4):440–449.
- 13) Suster S, Nasciment AG, Miettinen M, Sickel JZ, Moran CA. Solitary fibrous tumors of soft tissue. A clinicopathologic and immunohistochemical study of 12 cases. Am J Surg Pathol. 1995 Nov;19(11):1257–1266.
- 14) Fukunaga M, Naganuma H, Nikaido T, Harada T, Ushigome S. Extrapleural solitary fibrous tumor: A report of seven cases. Mod Pathol. 1997 May;10(5):443–450.
- 15) Sun Y, Naito Z, Ishiwata T, Maeda S, Sugisaki Y, Asano G. Basic FGF and Ki-67 proteins useful for immunohistological diagnostic evaluations in malignant solitary fibrous tumor. Pathol Int. 2003 May;53(5):284–290.
- 16) Vallat-Decouvelaere AV, Dry SM, Fletcher CD. Atypical and malignant solitary fibrous tumors in extrathoracic locations. Am J Surg Pathol. 1998 Dec;22(12):1501–1511.
- 17) Hasegawa T, Matsuno Y, Shimoda T, Hirohashi S, Hirose T, Sano T. Frequent expression of bcl-2 protein in solitary fibrous tumors. Jpn J Clin Oncol. 1998 Feb;28(2):86–91.
- 18) 長谷川 匡.各臓器・領域で用いられる抗体とその応用骨軟部組織.病理と臨床.2000;18(増):184–6.
- 19) 佐々木 貴浩, 小林 慎二郎, 小泉 哲, 渡邉 泰治, 中野 浩, 大坪 毅人.脾破裂を契機に発見された悪性孤立性線維性腫瘍の1例.日本臨床外科学会雑誌.2009;70(3):859–864.
- 20) 廣瀬 隆則.新WHO分類に基づく良悪性中間的軟部腫瘍.Medical Technology.2006;34(2):118–119.
- 21) Fletcher CD. The evolving classification of soft tissue tumours: an update based on the new WHO classification. Histopathology. 2006 Jan;48(1):3–12.
- 22) Hiraoka K, Morikawa T, Ohbuchi T, Katoh H. Solitary fibrous tumors of the pleura: clinicopathological and immunohistochemical examination. Interact Cardiovasc Thorac Surg. 2003 Mar;2(1):61–64.
- 23) Yokoi T, Tsuzuki T, Yatabe Y, Suzuki M, Kurumaya H, Koshikawa T, et al. Solitary fibrous tumor: significance of p53 and CD34 immunoreactivity in its malignant transformation. Histopathology. 1998 May;32(5):423–432.
- 24) 山梨 高広, 鳥海 史樹, 矢作 雅史, 白鳥 史明, 五十嵐 一晴, 西 知彦,ほか.再発を来した膵原発malignant solitary fibrous tumorの1例.日本消化器外科学会雑誌.2012;45(9):961–969.
- 25) 佐藤 太一, 橋口 陽二郎, 上野 秀樹, 神藤 英二, 島崎 英幸, 小泉 和也,ほか.骨盤内solitary fibrous tumorの1例.日本消化器外科学会雑誌.2011;44(10):1328–1333.
- 26) de Perrot M, Fischer S, Bründler MA, Sekine Y, Keshavjee S. Solitary fibrous tumors of the pleura. Ann Thorac Surg. 2002 Jul;74(1):285–293.
- 27) 守本 芳典, 岩垣 博巳, 堀木 貞幸, 河本 和幸, 庭野 元孝, 朴 泰範,ほか.低血糖発作にて発見された後腹膜原発悪性solitary fibrous tumorの1例.日本消化器外科学会雑誌.2008;41(1):158–164.
- 28) Nakatani T, Tamada S, Iwai Y, Tanimoto Y. Solitary fibrous tumor in the retroperitoneum: a case with infiltrative growth. Hinyokika Kiyo. 2002 Oct;48(10):637–641.
- 29) Tanaka M, Sawai H, Okada Y, Yamamoto M, Funahashi H, Hayakawa T, et al. Malignant solitary fibrous tumor originating from the peritoneum and review of the literature. Med Sci Monit. 2006 Oct;12(10):CS95–8.
- 30) Brunnemann RB, Ro JY, Ordonez NG, Mooney J, El-Naggar AK, Ayala AG. Extrapleural solitary fibrous tumor: a clinicopathologic study of 24 cases. Mod Pathol. 1999 Nov;12(11):1034–1042.
- 31) Goodlad JR, Fletcher CD. Solitary fibrous tumor arising at unusual sites: analysis of a series. Histopathology. 1991 Dec;19(6):515-522.
- 32) Gold JS, Antonescu CR, Hajdu C, Ferrone CR, Hussain M, Lewis JJ, et al. Clinicopathologic correlates of solitary fibrous tumors. Cancer. 2002 Feb;94(4):1057–1068.
- 33) 西尾 渉, 坪島 顕司, 若原 鉄平.術前に経皮的動脈塞栓術を施行した胸壁由来,孤立性繊維性腫瘍の1切除例.日本呼吸器外科学会雑誌.2006;20(4):23–28.
- 34) Saynak M, Bayir-Angin G, Kocak Z, Oz-Puyan F, Hayar M, Cosar-Alas R, et al. Recurrent solitary fibrous tumor of the pleura: significant response to radiotherapy. Med Oncol. 2010 Mar;27(1):45–48.
- 35) Perros P, Simpson J, Innes JA, Teale JD, McKnight JA. Non-islet cell tumour-associated hypoglycaemia: 111In-octreotide imaging and efficacy of octreotide, growth hormone and glucocorticosteroids. Clin Endocrinol (Oxf). 1996 Jun;44(6):727–731.
- 36) Oberg K. Somatostatin-receptor mediated diagnosis and treatment in gastrointestinal neuroendocrine tumours (GEP-NET’s). Rocz Akad Med Bialymst. 2005;50:62–68.
- 37) Kvols LK, Woltering EA. Role of somatostatin analogs in the clinical management of non-neuroendocrine solid tumors. Anticancer Drugs. 2006 Jul;17(6):601–608.