2014 Volume 47 Issue 4 Pages 230-237
2014 Volume 47 Issue 4 Pages 230-237
症例は69歳の男性で,前医において上行結腸の2型進行癌,および肝両葉に最大径8 cm,計4か所の同時性肝転移を認めたため,切除せずにベバシズマブ+FOLFOXを12クール施行された.大腸内視鏡検査では原発巣は消失し,CT上,肝転移巣は全て縮小し,切除可能と判断され,肝切除目的に当院を紹介受診した.肝後区域+前区域背側切除,肝S2亜区域切除術を施行した.なお,消失した原発巣は,切除しなかった.術後経過は良好で術後9日目に退院した.病理組織学的検査所見では,肝病変は全て壊死組織に置き替わっており,腫瘍細胞を認めなかったため,病理学的完全奏効と診断した.術後補助化学療法は行っていないが,術前化学療法終了から3年6か月,肝切除後3年3か月無再発である.原発巣を切除せずに肝転移巣のみ切除し,術後補助療法を行わず,長期無再発で経過を観察している点において極めて興味深い.
大腸癌症例の23~29%は経過中に肝転移を経験するとされる1).近年の化学療法の著しい進歩に伴い,診断時に切除不能とされた肝転移が画像的に完全に消失する症例(画像的完全奏効(complete response;以下,CRと略記))や病理組織学的にも腫瘍の消失が確認される症例(病理学的CR)を臨床的にしばしば経験するようになった2).一方で,肝転移巣が画像的CRを得ても38~79%の症例で同じ部位に再発することが知られており3)~6),このような症例の外科治療については,いまだ確立した方針はない.
今回,我々は切除不能と診断された同時性両葉多発肝転移を伴う結腸癌に対し,術前化学療法を行った結果,切除肝転移巣の病理学的CRならびに原発結腸癌の臨床的CRを得た症例を経験した.本症例は原発巣を切除せず,画像で残存する肝転移巣のみ切除し,さらに,術後の補助化学療法を行っていないにもかかわらず,長期無再発生存中である点において,極めて興味深い症例である.
患者:69歳,男性
主訴:心窩部不快感
既往歴:早期胃癌EMR後
現病歴:心窩部不快感のため,近医を受診した.腹部CTで上行結腸の壁肥厚と肝の多発腫瘤を指摘され前医紹介受診となった.
現症:腹部は平坦,軟.
受診時血液検査所見:ALP 493 IU/l,γGTP 182 IU/lと胆道系酵素は高値を示していたが,肝機能,総ビリルビン値に異常を認めなかった.腫瘍マーカーのCEAは479.6 ng/mlと上昇していた.
注腸検査所見:上行結腸に2型の潰瘍性病変を認めた.腫瘍の大きさは1/3から1/2周を占めると見られ,腸管径は保たれていた.
大腸内視鏡検査所見:上行結腸に半周性2型の潰瘍性病変を認めた(Fig. 1a).生検では,癌細胞が索状構造や充実胞巣を形成して増殖していた.細胞はやや小型で核はクロマチンに富み,一見カルチノイド様に見える部位もあったが,同一胞巣内に腺管構造を認めたため,低分化型腺癌と診断した.印環細胞や粘液細胞は認めなかった.

a) Before the chemotherapy, colonoscopy showed a type 2 tumor in the ascending colon. b) After the chemotherapy, the lesion of the ascending colon disappeared.
腹部造影CT所見:肝S2,S5,S6,S8に合計4個,最大径8 cmの造影効果の乏しい境界不明瞭な腫瘍を認めた.腫瘍はそれぞれが巨大で肝外側区域,前区域,後区域を占拠していたため前医において切除不能多発肝転移と判断された.その他,肺転移,リンパ節転移を疑う所見はなかった(Fig. 2).

Enhanced abdominal CT scans. (A, B) Before the chemotherapy, four liver metastases were found in S2, S5, S6, S8. (C, D) After the chemotherapy, each of the metastases decreased in size. (Partial response)
以上の所見から,同時性多発肝転移を伴う上行結腸癌(cT3 cN0 cH2 cStage IV)と診断され,前医においてベバシズマブ+FOLFOXが施行された.化学療法中はgrade 3の白血球減少と食思不振で1回のみ入院を要した.その他に,grade 3の末梢神経障害を認めたが,重篤な副作用なく安全に施行された.化学療法開始後速やかにCEAが低下し,8クール終了時にはCEA 4.8 ng/mlと正常化,12クール終了時にはCEA 2.6 ng/mlであった.腹部造影CTを行い,肝転移が切除可能になったと判断され,肝切除目的に当院へ紹介受診となった.
化学療法後腹部CT所見:肝臓の多発転移は最大径5 cmに縮小した(部分奏効(partial response;以下,PRと略記)).化学療法前には辺縁から中心に向けて不均一に造影されていた腫瘍内部は造影効果の乏しい均一な組織に置き換わっていた.腫瘍の平均CT値は造影前,動脈相,静脈相の順に化学療法前では36.2,44.8,54.1 HUだったが,化学療法後は37.5,40.0,38.0 HUと有意な造影効果を認めなかった(Fig. 2).
化学療法後大腸内視鏡検査所見:全大腸に粘膜病変を認めなかった.前医内視鏡検査における原発巣は完全に消失し,その正確な存在部位は不明であった.瘢痕を疑わせる数か所から生検を行ったが悪性所見を認めなかった(Fig. 1b).
以上より,同時性多発肝転移を伴う上行結腸癌が,術前化学療法によって原発巣は臨床的CRに,肝転移巣は画像的PRになったと診断した.原発巣に関しては前医で診断された上行結腸癌が検査所見上は完全に消失しており,正確な部位も定かではなかったため,術中所見において癌の遺残が疑われる場合に切除する方針とし,最終化学療法から70日後に肝後区域・前区域背側切除(右肝静脈還流域切除),肝S2亜区域切除術を予定した.肝予備能は,化学療法後の障害肝であったため,ICG-R15分値は16.9%,ICG-K値は0.132であった.CT volumetryでは腫瘍容積を除く肝切除率は50.2%,予測残肝ICG-K値は0.066と見積もった.
手術所見:開腹時,腹膜播種や腹水は認めなかった.上行結腸,周囲間膜には視触診上,腫瘍,リンパ節腫脹を認めなかったため結腸切除は行わなかった.背景肝は外見上blue liverで,肝臓の4か所の転移巣の漿膜は硬く黄白色調であった.肝後区域・前区域背側切除(右肝静脈還流域切除),肝S2亜区域切除術を施行した.手術時間141分,出血量1,100 gであった.
摘出標本肉眼所見:肝臓の4か所の腫瘍は全て被膜に覆われ,内部は充実性,黄白色調であった(Fig. 3).

Macroscopic view of the cut surface of the resected specimen. Each tumor was yellowish-white in color and covered by a capsule.
病理組織学的検査所見:腫瘍細胞は全て壊死し,生存している腫瘍細胞は認められなかった.また,背景肝には中心静脈周囲から小葉辺縁に沿って肝細胞索の萎縮,類洞拡張が見られ,化学療法関連肝障害の所見が認められた.肝転移巣に対する化学療法組織学的効果はgrade 3と判定し,病理学的CRと診断した(Fig. 4).
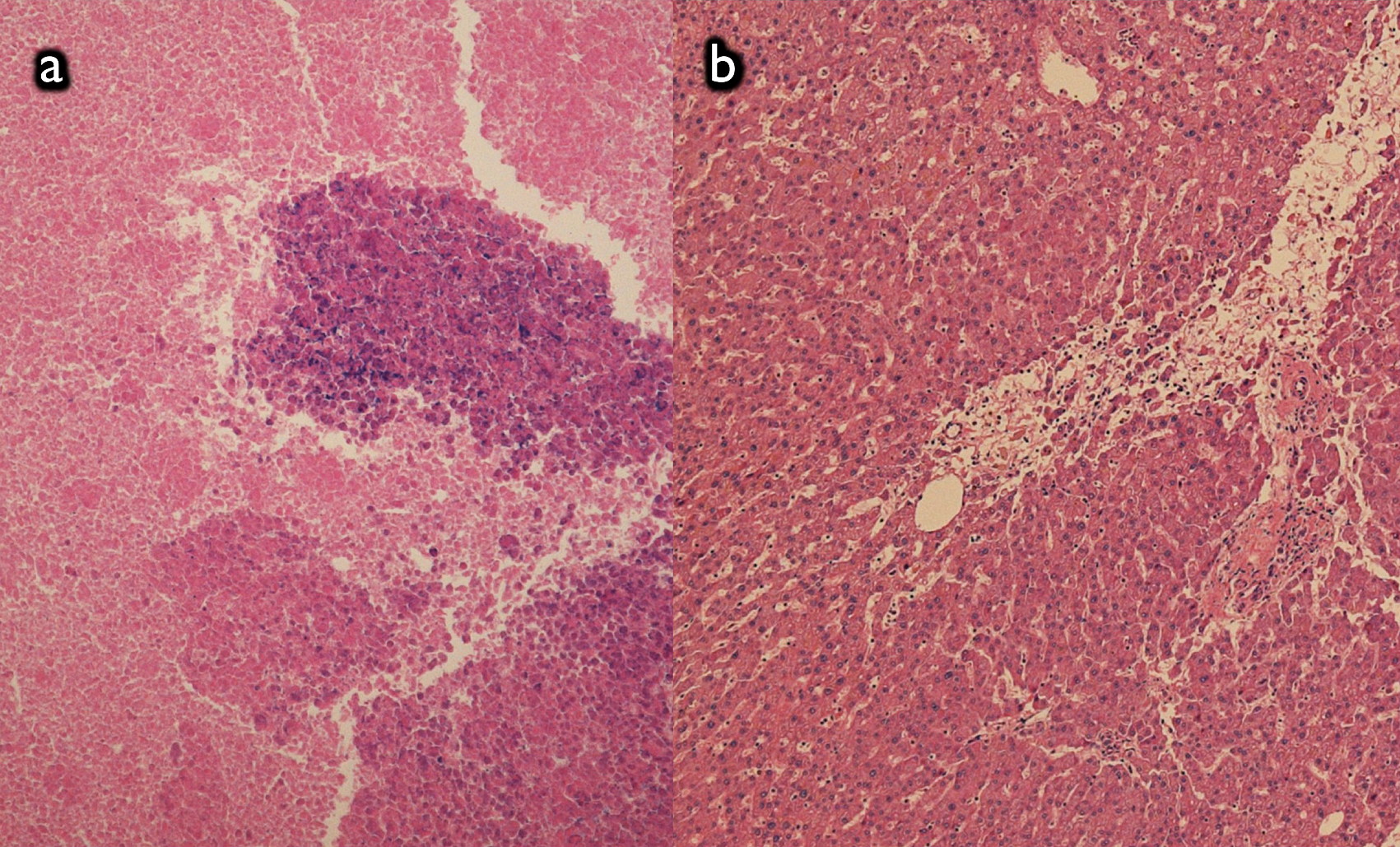
Pathological findings. a) All tumor cells became necrotic and no viable cells were found in the tumor. H&E, 40×. b) Hepatic plate atrophy and sinusoidal dilatation was seen around the central veins and the interlobular areas.
術後経過:経過は良好で,術後9日目に退院した.術後は化学療法を行わず,1年に2回の大腸内視鏡検査など注意深い経過観察を行っている.術前化療終了後3年6か月,肝切除術後3年3か月の現在,無再発生存中である.
大腸癌肝転移では,根治的肝切除が長期生存のための有力な治療である7).しかし,分子標的薬の登場など近年の化学療法の著しい進歩に伴い,以前は化学療法しか選択肢のなかった切除不能大腸癌肝転移に対して,化学療法後に外科切除が可能となる症例が増加した8)~10).自験例も,初診時には切除不能であった大腸癌肝転移が,術前化学療法によって切除可能となった,いわゆるconversion症例である.しかも,それが長期生存に寄与している.また,我々の症例では,化学療法が奏効したにもかかわらず,画像上,肝転移巣が比較的大きな腫瘤として描出され,さらに,それらの腫瘤が組織学的には全て壊死していたことが注目に値する.
Adamら2)の報告によると,大腸癌肝転移に対し術前化学療法を行い,画像的PRであった274症例のうち,23例(8.4%)が病理学的CRであった.このため,画像的PRのおよそ8.4%に自験例のような病理学的CRが存在すると考えられる.このように画像的にはPRであったが,肝切除後に病理学的CRであったと診断された症例では,自験例の肝切除標本のように腫瘍の壊死組織が残存したために画像的CRにならなかったと考えられる.
自験例ではベバシズマブを併用した化学療法が施行されたが,分子標的薬であるベバシズマブを使用すると腫瘍壊死率が上昇するという報告がある.切除不能大腸癌肝転移に対し,術前化学療法後に肝切除を行った症例を対象に,肝切除直前にベバシズマブを含むレジメンを使用した67例とこれまでにベバシズマブを使用したことのない97例についてレトロスペクティブに比較したWichertsら11)による報告では,切除された肝転移の腫瘍壊死率が50%以上の症例がベバシズマブ使用群で57%であったのに対し,ベバシズマブ非使用群で23%であった.このようにベバシズマブを使用した症例では,腫瘍の壊死組織がすぐには消失せず,そこに残存するため,病理学的CRでも,CTなど画像に描出される可能性がある.また,大腸癌肝転移に対する18-fluoro-2-deoxy-D-glucose positron emission tomography(以下,FDG-PETと略記)とCTの有用性について比較すると,化学療法前ではFDG-PETの感度はCTより優れるが,化学療法後は取り込みが低下し12),CTよりも感度が低下する13)と報告されている.このように,化学療法後の肝転移の病理組織学的検査所見を画像診断から評価することは難しいといえる.したがって,画像的PRの症例では,切除可能となった時点で肝切除することが妥当であると考える.
大腸癌肝転移切除術後の補助化学療法において,現在のところ生存期間を延長したレジメンは報告がなく,大腸癌治療ガイドライン7)においても肝切除後の補助化学療法を積極的な適応とはしていないのが現状である.したがって,副作用によるQOL低下も考慮し,自験例では術後補助化学療法を選択しなかった.
結腸癌の原発巣におけるCRは報告例が非常に少なく,その予後や再発形式などは明らかでない.医学中央雑誌における1983年から2013年3月までの「結腸癌」,「化学療法」,「CR」(会議録除く,症例報告のみ)をキーワードにした検索では,結腸癌肝転移におけるCRの報告が多く,(直腸癌を除いた)結腸癌の原発巣のCRについて報告したものは自験例を含め,わずか6例のみであった(Table 1)14)~18).そのうち4例では結腸切除術を行い,病理組織学的にCRが確認されているが,自験例と水島ら14)の報告では結腸切除術を行わず経過観察中である.直腸癌では術前化学放射線療法(chemoradiation therapy;以下,CRTと略記)で臨床的CRを得た症例に対し,再発が認められるまで非切除で注意深く経過観察するnon-operative managementが検討されている19).術前CRT後に根治切除を行い,切除標本の病理組織学的検索から病理学的CRと診断された症例とnon-operative managementを行った症例を比較して,予後は同等であったとする報告もある19)が,CR後の大腸を切除するべきか,切除不要かについてはいまだコンセンサスは得られていないのが現状である20).原発巣における術前の病理学的CRの正確な評価は困難だが,結腸癌の場合も,臨床的CRとなるような抗癌剤の効果が期待できる症例においては直腸癌におけるnon-operative management同様,再発が確認されてから手術を行っても予後は変わらない可能性がある.
| No | Author (Year) |
Age/Sex | Primary tumor location | Preoperative chemotherapy | Cycles | Diagnosis | Postoperative chemotherapy | Prognosis after the diagnosis of CR |
|---|---|---|---|---|---|---|---|---|
| 1 | Mizushima14) (2004) |
79/M | T | 5-FU+LV | 4 | Clinical CR | — | 5 months, alive |
| 2 | Mizukami15) (2007) |
56/M | S | CRT(39.6Gy+5-FU)+FOLFOX | 3 | Pathological CR | — | 3 months, alive |
| 3 | Nakamura16) (2008) |
54/F | S | CPT-11+5-FU+l-LV | 20 | Pathological CR | UFT/LV | 14 months, alive |
| 4 | Suzuki17) (2011) |
36/M | S | FOLFOX | 4 | Pathological CR | Capecitabine | 12 months, alive |
| 5 | Kubo18) (2012) |
61/F | S | BV+FOLFOX | 6 | Pathological CR | BV+XELOX | 4 months, alive |
| 6 | Our case | 69/M | A | BV+FOLFOX | 12 | Clinical CR | — | 42 months, alive |
A: ascending colon, T: transverse colon, S: sigmoid colon, 5-FU: 5-fluorouracil, LV: leucovorin, CPT-11: irinotecan, BV: bevacizumab, CRT: chemoradiotherapy
自験例の上行結腸癌原発巣の治療方針については,当院で施行した化学療法後の大腸内視鏡検査で,上行結腸に粘膜病変はなく,瘢痕を疑わせる部位も前医内視鏡検査所見の腫瘍部位に一致するかは不確かであった.右半結腸切除術を行えばもともと原発巣のあった結腸を確実に切除範囲に入れることができたが,検査所見上,消失したと思われた病変に対する手術としては切除範囲が大きくためらわれた.化学療法前の初診時CTでリンパ節腫大を認めなかった(cN0)こともあり,今回の手術では切除はせず,厳重な経過観察を行って再発が確認された時点で切除,化学療法などを行う方針を選択した.しかし,臨床的CRと判断した大腸癌症例に対し非切除で経過観察することに関しては現時点で根拠に乏しいといわざるをえない.結果的には術後3年3月の現在,無再発生存中であるが,今後も注意深く外来で経過観察を行っていく予定である.
利益相反:なし