Abstract
ミスマッチ修復遺伝子の一つであるMSH6の変異を原因とするリンチ症候群大腸癌を経験したので報告する.症例は25歳の女性で,便潜血陽性と貧血を主訴とし受診した.家族歴では,父方の祖父が大腸癌,祖母が膵臓癌,母方の祖母が子宮内膜癌に罹患していた.2型横行結腸癌に対し,結腸部分切除(D3)を施行した.病理組織学的検索では,T3N0M0 stage IIの低分化腺癌で,術後6か月間,UFT/LVによる補助化学療法を行った.改訂ベセスダガイドラインの3項目を満たすことから,リンチ症候群のスクリーニングとしてマイクロサテライト不安定性(microsatellite instability;MSI)検査を行ったところ,高頻度マイクロサテライト不安定(microsatellite instability high;MSI-H)であった.ミスマッチ修復タンパクに対する免疫染色検査では,大腸癌細胞の核でMSH6タンパクのみが欠失していた.遺伝学的検査では,MSH6のexon 5,codon 1087にフレームシフト変異が認められた.術後3年5か月経過した現在,無再発生存中である.
はじめに
リンチ症候群(Lynch syndrome;以下,LSと略記)は,ミスマッチ修復(mismatch repair;以下,MMRと略記)遺伝子の生殖細胞系列変異を主な原因とする常染色体優性遺伝の疾患群で,原因遺伝子としてMLH1,MSH2,MSH6,PMS2などが同定されている1).欧米の報告では,LSに随伴する大腸癌は全大腸癌の2~5%2)~9)の頻度と報告され,このうちMSH6遺伝子の生殖細胞系列変異を原因とするLSは6.4~9.9%程度10)~13)と比較的まれである.MLH1やMSH2遺伝子の生殖細胞系列変異を原因とする場合と比較して,MSH6遺伝子の生殖細胞系列変異が原因の場合は,関連腫瘍の種類や発症年齢・累積発生率など,表現型が異なることが知られている.一方,我が国では,確定診断に必要な遺伝学的診断を日常診療の中で行える十分な体制が整備されておらず,その実態は明らかではない.今回,MSH6遺伝子の生殖細胞系列変異を認められたLSの1例を経験したので,文献的考察を加えて報告する.なお,大腸癌に関する記載は大腸癌取扱い規約第8版14),家系図の記載は遺伝性大腸癌診療ガイドライン15),遺伝子変異の記載法はden Dunnenら16)の報告に従った.
症例
症例:25歳,女性
既往歴:特記事項なし.
家族歴:患者は1男2女の長女で,父方祖父が大腸癌,祖母が膵臓癌,母方祖母が子宮内膜癌の既往歴を有していた(Fig. 1).
現病歴:職場の健診で便潜血陽性と貧血を指摘され,精査目的に紹介となった.血液生化学検査では,Hbが5.8 g/dlと貧血が認められたが,CEAやCA19-9などを含め,その他の検査値は基準値範囲内であった.下部消化管内視鏡では,横行結腸に全周性の2型腫瘍が認められ,生検結果は低分化腺癌であった.胸腹部造影CTでは,明らかなリンパ節転移,肝転移および遠隔転移所見は認められず,結腸部分切除(D3)14)を施行した(Fig. 2).
病理組織学的検査所見:低分化腺癌(por1)が充実性に漿膜下層まで浸潤していた.リンパ管侵襲(ly2),静脈侵襲(v1)ともに陽性であったが,リンパ節転移は認められずn0(0/49),病理組織学的進行度分類はstage II14)であった.
術後経過:再発リスクの高いstage II大腸癌として,十分なインフォームドコンセントのもと,術後6か月間レボホリナート・テガフール・ウラシル療法(以下,UFT/LV療法と略記)を行った.
【LSの診断】
遺伝性大腸癌診療ガイドライン15)の発刊を契機に,LSと考えられる個人の同定を目的として当診療科の大腸癌手術症例を後方視的に再検討した17).
病歴・家族歴の再検討:本症例は,①50歳未満で診断された大腸癌で,②第1度あるいは第2度近親者の2人以上にLS関連腫瘍の家族歴を有していた.
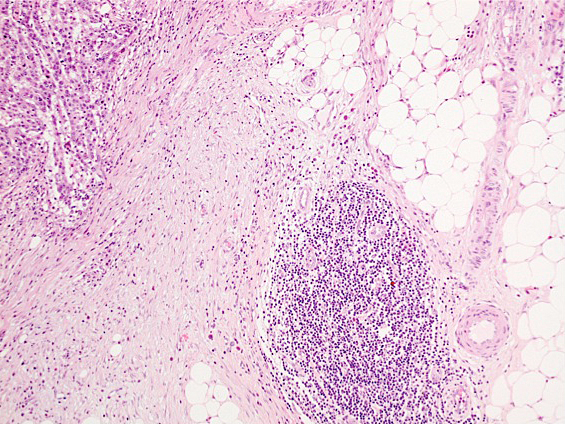
病理組織学的検査所見の再検討:病理組織学的検査所見を再検討したところ,腫瘍部分に③リンパ球浸潤(tumor infiltrating lymphocyte;以下,TILと略記)18)と,癌周囲にクローン病様のリンパ球反応を伴っていた(Fig. 3,4).
マイクロサテライト不安定性検査所見:病歴・家族歴および病理組織学的検査所見の再検討により,改訂ベセスダガイドライン(revised Bethesda guidelines)19)の5項目中,①50歳未満で診断された大腸癌,②第1度あるいは第2度近親者の2人以上にLS関連腫瘍の家族歴を有する,③60歳未満で診断されたMSI-Hの組織学的所見を有する大腸癌(リンパ球浸潤,Crohn様リンパ球反応)の3項目を満たすことから,パラフィン固定標本を用いてマイクロサテライト不安定性(microsatellite instability;以下,MSIと略記)検査を施行した.National Cancer Institute panel(以下,NCIパネルと略記)の五つのマーカーのうち,モノヌクレオチドマーカーであるBAT25,BAT26を含む3マーカーで大腸癌組織において非癌部大腸粘膜と異なるマイクロサテライト領域の反復回数を示し,高頻度マイクロサテライト不安定(microsatellite instability high;以下,MSI-Hと略記)と診断した(Fig. 5).
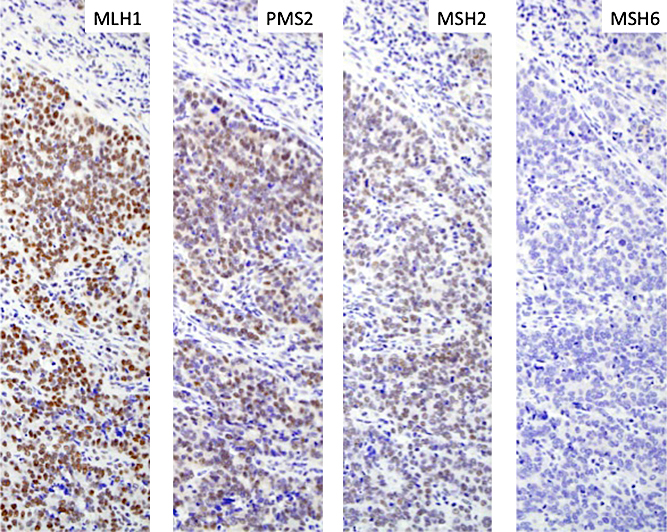
免疫組織化学検査所見:MSI検査の結果からLSが強く疑われたため,原因遺伝子の絞りを目的としてMLH1,MSH2,MSH6,PMS2の4種類のMMRタンパクに対する免疫組織化学検査(immunohistochemistry;以下,IHCと略記)を行った.MLH1,MSH2,PMS2タンパクは,正常細胞および腫瘍細胞核内の両方で発現を認めたが,MSH6タンパクのみが癌細胞の核において欠失していた(Fig. 6).
遺伝学的検査所見:遺伝カウンセリングを行い,十分な理解と同意の上で,遺伝学的検査を行った.末梢血白血球からDNAを抽出し,MSH6遺伝子の生殖細胞系列変異をダイレクト・シークエンス法で検索したところ,exon 5,1087番目のコドンでシトシンの重複によるフレームシフト変異が認められた(Fig. 7).この変異は,アミノ酸1092番目でタンパク合成が中断し,truncateされたMSH6タンパクが合成される遺伝子変異で,国際消化管遺伝性腫瘍学会(International Society for Gastrointestinal Hereditary Tumors:InSiGHT)のデータベースに既知の病的遺伝子変異として登録されており,本症例がLSと確定診断された.術後3年5か月経過した現在,無再発生存中である.
家族(血縁者)への対応:患者の両親に対して遺伝カウンセリングを行い,同意の上でMSH6遺伝子のみをダイレクト・シークエンス法で検索したが,変異は確定されなかった.これにより症例は新生発端者であることが考えられたため,血縁者に対するLSとしてのサーベイランスは行っていない.
なお,本症例に行ったMSI検査,IHC,遺伝学的検査の全ては埼玉医科大学の倫理委員会の承認のもとに,本人の承諾を得て行った.
考察
LSは,原因遺伝子が同定される以前,あるいはその後しばらくの期間遺伝性非ポリポーシス大腸癌(hereditary non-polyposis colorectal cancer;以下,HNPCCと略記)と呼称されることが多かったが,本疾患が大腸以外の多臓器に発がんする特徴を有することや,HNPCCの臨床基準とされたアムステルダム基準I,II20)21)を満たしてもMMR遺伝子の生殖細胞系列の変異を認めない患者・家系の存在が明らかになったことから,現在はMMR遺伝子の生殖細胞系列における異常が同定される場合のみをLSとする考え方が一般的である15).
原因であるMMR遺伝子の異常は,欧米ではpopulation-basedで370人に1人に認められると推測されている22)が,我が国での実態は明らかにされていない.
LS関連腫瘍の生涯発症リスク,いわゆる浸透率は癌腫およびMMR遺伝子変異ごとに異なる23).最近の検討では,MLH1およびMSH2遺伝子に変異を有する場合のリスクは男性で66~69%,女性で43~52%4)24),MSH6遺伝子に変異を有する場合の80歳までに発症するリスクは男性で44%,女性で20%25)と報告されている.最も生涯発症リスクの高い大腸癌では,MLH1あるいはMSH2遺伝子変異を原因とするものが70~90%前後を占め,一方MSH6遺伝子変異の割合は,6.4~9.9%程度10)~13)である.近年報告された100例以上のLS大腸癌におけるMMR遺伝子変異の割合と,スクリーニング基準などの内訳をTable 111)~13)に示した.
Table 1
The proportion of the Lynch syndrome attributable to each of the four major mismatch repair genes
| No |
Author |
Year |
Number of cases |
Country |
MLH1 |
MSH2 |
MSH6 |
PMS2 |
Selection criteria |
| 1 |
Barrow11) |
2009 |
121 |
England |
51 (42.2%) |
59 (48.7%) |
11 (9.1%) |
NA |
Revised Amsterdam or revised Bethesda guidelines |
| 2 |
Shia12) |
2013 |
124 |
America |
66 (53.2%) |
24 (19.4%) |
8 (6.4%) |
26 (21%) |
Revised Bethesda guidelines only |
| 3 |
Schofield13) |
2014 |
111 |
Australia |
40 (36.0%) |
51 (45.9%) |
11 (9.9%) |
9 (8.1%) |
Population-base in Western Australia |
MSH6遺伝子がLSの原因となることは,我が国のMiyakiら26)によって初めて明らかにされ,Utsunomiyaら27)によって臨床情報を含む2家系が報告された.しかし,その後のMSH6遺伝子変異を原因とするLS大腸癌の報告は少数で,大腸癌研究会の「HNPCCの登録と遺伝子解析プロジェクト」28)では,MMR遺伝子変異を認めた85例中2例のみ,近年ではTeruiら29)が,大腸癌手術症例1,720中9例のMSH6遺伝子変異とその臨床病理学的特徴についた検討を報告しているにすぎない.
このようにMSH6遺伝子変異を原因とするLS大腸癌の報告例は少数で,その臨床的特徴は十分には明らかにされていないが,MSH6遺伝子変異陽性のLS大腸癌は,MLH1やMSH2遺伝子変異に比べて,累積がん発症リスクは低く23),診断時年齢平均は51~57歳で,MLH1またはMSH2遺伝子の43~46歳より高年齢で診断されることが報告されている1).また,MLH1とMSH2遺伝子変異陽性の大腸癌が右側結腸に好発する19)のに対して,MSH6遺伝子変異陽性大腸癌は左側結腸有意に好発する29)30)ことが報告されている.本邦でも同様の傾向が報告されている29)が,我々が経験した症例は,右側結腸発症で,診断時年齢が25歳と国内の最年少例である41歳より若年者であることなど,Teruiら29)が報告した特徴と必ずしも合致しなかった.これらLSの表現型については人種や環境因子の影響があると考えられており9),我が国の報告と欧米の報告の違いが人種や環境の違いで説明できるか否かは,今後の症例の集積が必要と考えられる.
もう一点,特記すべき表現型の違いとして,MSH6遺伝子の生殖細胞変異を有するLS大腸癌では,MLH1やMSH2遺伝子の生殖細胞変異を有するLS大腸癌に比べてMSI-Hを示さない頻度が高いことが挙げられ30)31),Berendsら30)は,MSH6遺伝子の病的変異を持つ症例の50%にしかMSI-Hを示さなかったと報告している.一般的にMSH6タンパクは機能的に1塩基のミスマッチを認識するMMRタンパクで,主にモノヌクレオチドの修復に関わる.このため,世界で標準的に用いられているNCIパネルの3種類がジヌクレオチドマーカーであることから,これらのマーカーではマイクロサテライトの異常を示さないことが多いと考えられている.また,MSH6タンパクの機能は,MSH3タンパクで補完されるため同様にマイクロサテライトの異常を示さずMSI-Hとならないことがあると考えられている32).本症例は,MSI-Hを示し,モノヌクレオチドマーカーのBAT25,BAT26のほかに,ジヌクレオチドマーカーのD2S123でもマイクロサテライト不安定が認められた.その理由として,本症例のMSH6タンパクがジヌクレオチドマーカーの修復にもかかわっていた可能性や,別の(ジヌクレオチドのミスマッチ修復に関わる)MMR遺伝子の体細胞変異をじゃっ起した可能性が考えられる.ちなみに,Teruiら29)の報告でも9例中4例でジヌクレオチドマーカーにマイクロサテライト長の異常を検出している.いずれにしても,MSH6遺伝子に変異がある場合には,腫瘍がMSI-Hにならない可能性を十分認識し,IHCの併用でMSH6遺伝子変異例を見落とさないことは重要と思われる.
病理組織像からLSを疑うことも重要である.今回の症例ではMSI-H結腸癌に特徴的なTILとクローン病様リンパ球反応が認められたが,これらの特徴は病理診断報告書に指摘されていなかった.我が国の大腸癌取扱い規約にMSI-Hを疑う病理組織学的検査所見は記載されておらず,一般病理医の関心も高くないと推定され,Jass33)が報告しているとおり,臨床情報が得られないとLSを認識できない可能性がある.今回の症例からLSあるいはMSI-H大腸癌の病理組織像について,臨床医と病理医の共通した認識や連携が必要であることを認識させられた.
LS大腸癌は,大腸癌の多発や他臓器の癌の発生にもかかわらず,一般の散発性大腸よりも予後が良好で,遠隔転移が少ない34)~40)ことが知られているが,その多くの症例がMSI-Hである.LS大腸癌におけるMSI-Hの頻度は90%以上と報告されているが41),散発性大腸癌での頻度は,欧米の報告では12~16%42)43),我が国を含むアジア諸国からの報告では5~9%44)~46)と低く,人種や民族による差が報告されている(Table 2).
Table 2
Ethnic differences in the frequency of MSI-H colorectal cancer
| No |
Author |
Year |
Number of cases |
Country or ethnic group |
Microsatellite markers |
Frequency of MSI-H, n (%) |
| 1 |
Hatch42) |
2005 |
262 |
Americans |
Bethesda panel |
26 (10.0%) |
| 2 |
Kim43) |
2007 |
542 |
Americans |
Bethesda panel |
98 (18.1%) |
| 3 |
Meng44) |
2007 |
128 |
Chinese |
Bethesda panel |
12 (9.3%) |
| 4 |
Asaka45) |
2009 |
940 |
Japanese |
Bethesda panel |
55 (5.9%) |
| 5 |
Oh46) |
2012 |
1,435 |
Koreans |
Bethesda panel |
79 (5.5%) |
予後に関しても大腸癌に対する大規模解析からMSI-Hは,stage IIIよりもstage IIの大腸癌で多くみられ47),stage IVにおいてはわずか3.5%48)で,MSI-H大腸癌においては転移を起こす可能性が低く,これには何らかの免疫応答機構が関与している可能性が指摘されている49)50).さらに,腫瘍のMSIの状態に従って評価したstage IIおよびstage III結腸癌の患者を長期間追跡した後方視的研究51)では,MSI-Hの腫瘍を有する患者に対する5-FUベースの補助化学療法による全生存期間の上乗せ効果は認められず,むしろ手術のみの患者より5年生存率が低い傾向(P=0.10)が報告されている.現在,NCCNガイドライン52)や他の報告53)~56)でも,stage II結腸癌に対しては遺伝学的検査を行った上で,MSI-Hであれば経過観察することが推奨している.一方,MSI-Hのstage III結腸癌の補助化学療法はNCCNガイドライン52)では言及されていない.しかしながら,stage III結腸癌においては,オキサリプラチンベースの補助化学療法の効果とMSIのstatusは関係がないとする報告がなされている57)58).したがって,MSI-Hのstage III結腸癌に対して,オキサリプラチンベースの補助化学療法を行うことは選択肢の一つと考えられる.今回の症例では,後方視的に検討すればLSを強く疑う臨床病理学的特徴が存在したが,手術時にはそのような認識ができず,一般的なハイリスクstage II結腸癌として6か月間のUFT/LV療法を行った.この補助化学療法の妥当性については,LSの確定診断が保険診療で行うことができない我が国の医療事情のなかでは議論の余地があると思われるが,2007年6月から保険収載されたMSI検査を行って,LSの疑いが濃厚であれば,あえて補助化学療法を行わない選択肢もあると考えられる.
LSの確定診断を行うにはMMR遺伝子の生殖細胞系列変異を同定することが必要である.次世代シークエンサーが我が国にも普及しはじめ,今後は短時間で多数の遺伝子変異が検索可能な時代になると考えられるが,現段階でLSの遺伝学的検査を外注している検査会社は限られており,サンガ―シークエンス法で疑いのある遺伝子に対する解析を一つ一つ行っているのが実情である.この方法はコストがかかり,患者や血縁者が遺伝学的検査を受ける障害になっている.本症例の場合は,IHCの結果をふまえてMSH6遺伝子のみの遺伝学的検査を診療科の研究費で行った.
今後,我が国における遺伝性腫瘍に対する遺伝学的診断に関し,サポート体制の整備が必要と思われる.
謝辞:病理組織学的検査所見にご教示頂いた当院病理部の東守洋先生とMSI検査結果についてご教示頂いた埼玉県立がんセンター腫瘍診断・予防科の赤木究先生に深謝致します.
利益相反:なし
文献
- 1) Peltomaki P. Lynch syndrome genes. Fam Cancer. 2005;4(3):227–232.
- 2) de la Chapelle A. The incidence of Lynch syndrome. Fam Cancer. 2005;4(3):233–237.
- 3) Vasen HF, Moslein G, Alonso A, Bernstein I, Bertario L, Blanco I, et al. Guidelines for the clinical management of Lynch syndrome (hereditary non-polyposis cancer). J Med Genet. 2007;44(6):353–362.
- 4) Hampel H, Stephens JA, Pukkala E, Sankila R, Aaltonen LA, Mecklin JP, et al. Cancer risk in hereditary nonpolyposis colorectal cancer syndrome: later age of onset. Gastroenterology. 2005;129(2):415–421.
- 5) Barnetson RA, Tenesa A, Farrington SM, Nicholl ID, Cetnarskyj R, Porteous ME, et al. Identification and survival of carriers of mutations in DNA mismatch-repair genes in colon cancer. N Engl J Med. 2006;354(26):2751–2763.
- 6) Hampel H, Frankel WL, Martin E, Arnold M, Khanduja K, Kuebler P, et al. Feasibility of screening for Lynch syndrome among patients with colorectal cancer. J Clin Oncol. 2008;26(35):5783–5788.
- 7) Lynch HT, de la Chapelle A. Hereditary colorectal cancer. N Engl J Med. 2003;348(10):919–932.
- 8) Aaltonen LA, Salovaara R, Kristo P, Canzian F, Hemminki A, Peltomaki P, et al. Incidence of hereditary nonpolyposis colorectal cancer and the feasibility of molecular screening for the disease. N Engl J Med. 1998;338(21):1481–1487.
- 9) Hampel H, Frankel WL, Martin E, Arnold M, Khanduja K, Kuebler P, et al. Screening for the Lynch syndrome (hereditary nonpolyposis colorectal cancer). N Engl J Med. 2005;352(18):1851–1860.
- 10) Kohlmann W, Gruber SB. Lynch Syndrome. In: GeneReviews(R) [Internet]. Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJH, et al., eds. Seattle (WA): University of Washington, Seattle; 1993-2015. [cited 2004 Feb 5, updated 2014 May 22]. PMID: 20301390 [PubMed].
- 11) Barrow E, Robinson L, Alduaij W, Shenton A, Clancy T, Lallo F, et al. Cumulative lifetime incidence of extracolonic cancers in Lynch syndrome: a report of 121 families with proven mutations. Clin Genet. 2009;75:141–149.
- 12) Shia J, Zhang L, Shike M, Guo M, Stadler Z, Xiong X, et al. Secondary mutation in a coding mononucleotide tract in MSH6 causes loss of immunoexpression of MSH6 in colorectal carcinomas with MLH1/PMS2 deficiency. Mod Pathol. 2013;26:131–138.
- 13) Schofield L, Grieu F, Amanuel B, Carrello A, Spagnolo D, Kiraly C, et al. Population-based screening for Lynch syndrome in Western Australia. Int J Cancer. 2014;135:1085–1091.
- 14) 大腸癌研究会.大腸癌取扱い規約第8版.東京:金原出版;2013. p. 1–104.
- 15) 大腸癌研究会.遺伝性大腸癌診療ガイドライン2012年版.東京:金原出版;2012. p. 1–73.
- 16) den Dunnen JT, Antonarakis SE. Nomenclature for the description of human sequence variations. Hum Genet. 2001;109(1):121–124.
- 17) Tajima Y, Kumamoto K, Takeuchi I, Baba H, Ishibashi K, Tsuji Y, et al. Analysis of KRAS status in cancer tissue with submucosal or deeper invasion in patients with familial adenomatous polyposis. Gan To Kagaku Ryoho. 2013;40(12):2047–2049.
- 18) Jass JR. HNPCC and sporadic MSI-H colorectal cancer: a review of the morphological similarities and differences. Fam Cancer. 2004;3(2):93–100.
- 19) Umar A, Boland CR, Terdiman JP, Syngal S, de la Chapelle A, Ruschoff J, et al. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst. 2004;96(4):261–268.
- 20) Vasen HF, Mecklin JP, Khan PM, Lynch HT. The International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum. 1991;34(5):424–425.
- 21) Vasen HF. Clinical diagnosis and management of hereditary colorectal cancer syndromes. J Clin Oncol. 2000;18(21):81–92.
- 22) Hampel H, de la Chapelle A. The search for unaffected individuals with Lynch syndrome: do the ends justify the means? Cancer Prev Res (Phila). 2011;4(1):1–5.
- 23) Bonadona V, Bonaiti B, Olschwang S, Grandjouan S, Huiart L, Longy M, et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA.2011;305(22):2304–2310.
- 24) Stoffel E, Mukherjee B, Raymond VM, Raymond VM, Tayob N, Kastrinos F, et al. Calculation of risk of colorectal and endometrial cancer among patients with Lynch syndrome. Gastroenterology. 2009;137(5):1621–1627.
- 25) Baglietto L, Lindor NM, Dowty JG, White DM, Wagner A, Gomez Garcia EB, et al. Risks of Lynch syndrome cancers for MSH6 mutation carriers. J Natl Cancer Inst. 2010;102(3):193–201.
- 26) Miyaki M, Konishi M, Tanaka K, Kikuchi-Yanoshita R, Muraoka M, Yasuno M, et al. Germline mutation of MSH6 as the cause of hereditary nonpolyposis colorectal cancer. Nat Genet. 1997;17(3):271–272.
- 27) Utsunomiya J, Miyaki M. Studies of hereditary nonpolyposis colorectal cancer in Japan. Int J Clin Oncol. 1998;3:53–74.
- 28) 古川 洋一, 吉田 輝彦, 中村 祐輔, 森谷 宜皓.HNPCCの登録と遺伝子解析プロジェクト.家族性腫瘍.2007;7(1):2–7.
- 29) Terui H, Tachikawa T, Kakuta M, Nishimura Y, Yatsuoka T, Yamaguchi K, et al. Molecular and clinical characteristics of MSH6 germline variants detected in colorectal cancer patients. Oncol Rep. 2013;30(6):2909–2916.
- 30) Berends MJ, Wu Y, Sijmons RH, Mensink RG, van der Sluis T, Hordijk-Hos JM, et al. Molecular and clinical characteristics of MSH6 variants: an analysis of 25 index carriers of a germline variant. Am J Hum Genet. 2002;70(1):26–37.
- 31) Ku JL, Yoon KA, Kim DY, Park JG. Mutations in hMSH6 alone are not sufficient to cause the microsatellite instability in colorectal cancer cell lines. Eur J Cancer. 1999;35(12):1724–1729.
- 32) Senter L, Clendenning M, Sotamaa K, Hampel H, Green J, Potter JD, et al. The clinical phenotype of Lynch syndrome due to germ-line PMS2 mutations. Gastroenterology. 2008;135(2):419–428.
- 33) Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology. 2007;50(1):113–130.
- 34) Gryfe R, Kim H, Hsieh ET, Aronson MD, Holowaty EJ, Bull SB, et al. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med. 2000;342(2):69–77.
- 35) Elsaleh H, Joseph D, Grieu F, Zeps N, Spry N, Iacopetta B. Association of tumour site and sex with survival benefit from adjuvant chemotherapy in colorectal cancer. Lancet. 2000;355(9217):1745–1750.
- 36) Elsaleh H, Shannon B, Iacopetta B. Microsatellite instability as a molecular marker for very good survival in colorectal cancer patients receiving adjuvant chemotherapy. Gastroenterology. 2001;120(5):1309–1310.
- 37) Elsaleh H, Powell B, Soontrapornchai P, Joseph D, Goria F, Spry N, et al. p53 gene mutation, microsatellite instability and adjuvant chemotherapy: impact on survival of 388 patients with Dukes’ C colon carcinoma. Oncology. 2000;58(1):52–59.
- 38) Samowitz WS, Curtin K, Ma KN, Schaffer D, Coleman LW, Leppert M, et al. Microsatellite instability in sporadic colon cancer is associated with an improved prognosis at the population level. Cancer Epidemiol Biomarkers Prev. 2001;10(9):917–923.
- 39) Watanabe T, Wu TT, Catalano PJ, Ueki T, Satriano R, Haller DG, et al. Molecular predictors of survival after adjuvant chemotherapy for colon cancer. N Engl J. 2001;344(16):1196–1206.
- 40) Buckowitz A, Knaebel HP, Benner A, Blaker H, Gebert J, Kienle P, et al. Microsatellite instability in colorectal cancer is associated with local lymphocyte infiltration and low frequency of distant metastases. Br J Cancer. 2005;92(9):1746–1753.
- 41) Aaltonen LA, Peltomaki P, Mecklin JP, Canzian F, Hemminki A, Peltomaki P, et al. Replication errors in benign and malignant tumors from hereditary nonpolyposis colorectal cancer patients. Cancer Res. 1994;54(7):1645–1648.
- 42) Hatch SB, Lightfoot HM, Garwacki CP, Moore D, Calvo B, Woosley T, et al. Microsatellite instability testing in colorectal carcinoma: choice of markers affects sensitivity of detection of mismatch repair-deficient tumors. Clin Cancer Res. 2005;11(6):2180–2187.
- 43) Kim GP, Colangelo LH, Wieand HS, Paik S, Kirsch I, Wolmark N, et al. Prognostic and predictive roles of high-degree microsatellite instability in colon cancer: a National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project Collaborative Study. J Clin Oncol. 2007;25(7):767–772.
- 44) Meng WJ, Sun XF, Tian C, Wang L, Yu YY, Zhou B, et al. Microsatellite instability did not predict individual survival in sporadic stage II and III rectal cancer patients. Oncology. 2007;72(1):82–88.
- 45) Asaka S, Arai Y, Nishimura Y, Yamaguchi K, Ishikubo T, Yatsuoka T, et al. Microsatellite instability-low colorectal cancer acquires a KRAS mutation during the progression from Dukes’ A to Dukes’ B. Carcinogenesis. 2009;30(3):494–499.
- 46) Oh JR, Kim DW, Lee HS, Lee HE, Lee SM, Jang JH, et al. Microsatellite instability testing in Korean patients with colorectal cancer. Fam Cancer. 2012;11(3):459–466.
- 47) Roth AD, Tejpar S, Delorenzi M, Yan P, Fiocca R, Klingbiel D, et al. Prognostic role of KRAS and BRAF in stage II and III resected colon cancer: results of the translational study on the PETACC-3, EORTC 40993, SAKK 60-00 trial. J Clin Oncol. 2010;28(3):466–474.
- 48) Koopman M, Kortman GA, Mekenkamp L, Ligtenberg MJ, Hoogerbrugge N, Antonini NF, et al. Deficient mismatch repair system in patients with sporadic advanced colorectal cancer. Br J Cancer. 2009;100(2):266–273.
- 49) Banerjea A, Bustin SA, Dorudi S. The immunogenicity of colorectal cancers with high-degree microsatellite instability. World J Surg Oncol. 2005;3:26.
- 50) Banerjea A, Ahmed S, Hands RE, Huang F, Han X, Shaw PM, et al. Colorectal cancers with microsatellite instability display mRNA expression signatures characteristic of increased immunogenicity. Mol Cancer. 2004;3:21.
- 51) Ribic CM, Sargent DJ, Moore MJ, Thibodeau SN, French AJ, Goldberg RM, et al. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med. 2003;349(3):247–257.
- 52) Burt RW, Barthel JS, Dunn KB, David DS, Drelichman E, Ford JM, et al. NCCN clinical practice guidelines in oncology. Colorectal cancer screening. J Natl Compr Canc Netw. 2010;8(1):8–61.
- 53) Sargent DJ, Marsoni S, Monges G, Thibodeau SN, Labianca R, Hamilton SR, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol. 2010;28(20):3219–3226.
- 54) Bertagnolli MM, Redston M, Compton CC, Niedzwiecki D, Mayer RJ, Goldberg RM, et al. Microsatellite instability and loss of heterozygosity at chromosomal location 18q: prospective evaluation of biomarkers for stages II and III colon cancer—a study of CALGB 9581 and 89803. J Clin Oncol. 2011;29(23):3153–3162.
- 55) Mouradov D, Domingo E, Gibbs P, Jorissen RN, Li S, Soo PY, et al. Survival in stage II/III colorectal cancer is independently predicted by chromosomal and microsatellite instability, but not by specific driver mutations. Am J Gastroenterol. 2013;108(11):1785–1793.
- 56) Saridaki Z, Souglakos J, Georgoulias V. Prognostic and predictive significance of MSI in stages II/III colon cancer. World J Gastroenterol. 2014;20(22):6809–6814.
- 57) des Guetz G, Mariani P, Cucherousset J, Benamoun M, Lagorce C, Sastre X. Microsatellite instability and sensitivitiy to FOLFOX treatment in metastatic colorectal cancer. Anticancer Res. 2007;27(4C):2715–2719.
- 58) Muller CI, Schulmann K, Reinacher-Schick A, Andre N, Arnold D, Tannapfel A. Predictive and prognostic value of microsatellite instability in patients with advanced colorectal cancer treated with a fluoropyrimidine and oxaliplatin containing first-line chemotherapy. A report of the AIO Colorectal Study Group. Int J Colorectal Dis. 2008;23(11):1033–1039.