Abstract
症例は64歳の男性で,心窩部痛を主訴に来院した.精査にて下部胆管に腫瘍を認め,生検にてrosette様配列を呈する腫瘍細胞を認めた.免疫染色検査にてchromogranin A,synaptophysinが陽性であり胆管原発の神経内分泌癌(neuroendocrine carcinoma;以下,NECと略記)を疑い亜全胃温存膵頭十二指腸切除術を施行した.腫瘍細胞のKi-67指数は40%であり胆管原発large cell NEC(以下,LCNECと略記),pT3aN0M0 stage IIA(胆道癌取扱い規約第6版)と診断した.術後はtegafur/gimeracil/oteracil(S-1)による補助化学療法を行い24か月間無再発生存中である.胆管原発NECの本邦報告例は51例とまれであり,さらに本症例は極めてまれなLCNECであり貴重な症例と考えられるため報告する.
はじめに
神経内分泌腫瘍(neuroendocrine tumor;以下,NETと略記)は比較的まれな疾患であるが,WHO分類1)が作成されて以降疾患概念が広く認識されるようになり,発生頻度の高い膵・消化管NETに関しては本邦でも2015年にガイドラインが作成されるまでに至っている2).しかし,胆管原発のNETはまれであり,その中でもNECは早期に血行性転移を来しその予後は不良である.今回,我々は極めてまれな胆管原発LCNECの1例を経験したので文献的考察を加え報告する.
症例
患者:64歳,男性
主訴:心窩部痛
既往歴:特記すべき事項なし.
現病歴:上記を主訴に当院を受診した.眼球結膜の黄染を認め,血液検査所見では肝胆道系酵素が上昇しており閉塞性黄疸の診断で精査加療目的に入院となった.
入院時血液検査所見:T.bil 8.4 mg/dl,AST 169 U/l,ALT 305 U/l,ALP 2,330 U/l,γGTP 1,044 U/lと肝胆道系酵素の上昇を認めた.腫瘍マーカーはCA19-9 13,347 U/ml,DUPAN-2 1,360 U/ml,Span-1 1,680 U/ml,pro-gastrin-releasing peptide(Pro-GRP)209 pg/mlと高値であった.CEA,神経特異エノラーゼ(neuron specific enolase;以下,NSEと略記)は正常範囲内であった.なお,血中ホルモン値ではインスリン20.1 μU/ml,ガストリン215 pg/mlとそれぞれ軽度高値であったが,低血糖や消化性潰瘍症状は認めず,またカルチノイド症候群様の症状も認めなかった.
腹部造影CT所見:下部胆管に動脈相で最も強く造影される比較的内部均一な20 mm大の腫瘍を認めた.胆管側の辺縁は平滑であったが,膵臓・十二指腸との境界は不明瞭であった.総胆管〜肝内胆管は拡張していた(Fig. 1).明らかなリンパ節腫大や遠隔転移は認めなかった.
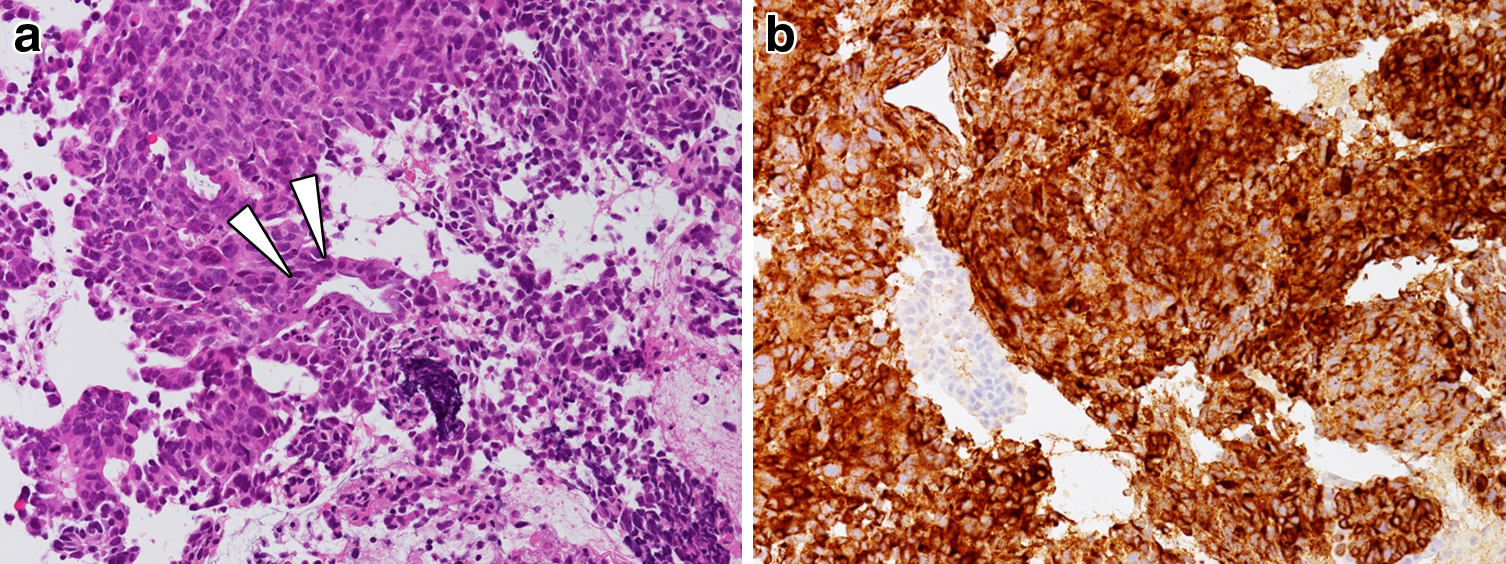
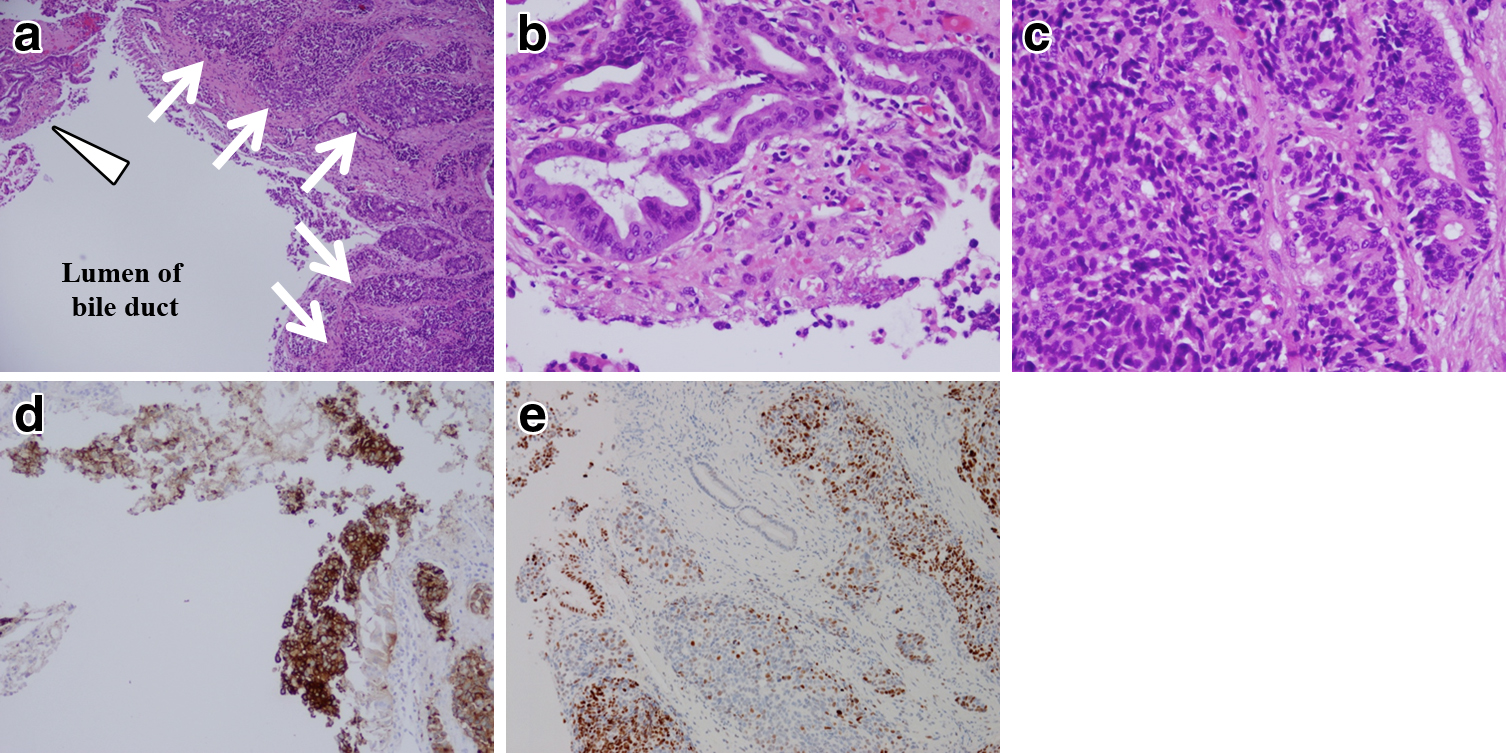
ERCP所見:下部胆管に陰影欠損を認め(Fig. 2a),胆管腔内超音波検査(intraductal ultrasonography;以下,IDUSと略記)では一部で最外層の境界が不明瞭であり膵浸潤を疑う所見であった(Fig. 2b).ERC下の生検では,腫瘍細胞の核は大型でクロマチンに富み,N/C比が高く,rosette様配列が認められた.また,ごく一部に腺管様配列を認めた(Fig. 3a).免疫組織化学染色にて腫瘍細胞はchromogranin A,synaptophysin,NSEに陽性であった(Fig. 3b).
以上より,下部胆管原発の神経内分泌癌,または混合型腺神経内分泌癌を疑い,経鼻的胆道ドレナージにて減黄後に手術を施行した.胆道ドレナージ後の再検にてCA19-9は99 U/mlまで低下した.
手術所見:亜全胃温存膵頭十二指腸切除,D2リンパ節郭清,Child変法再建を施行した.
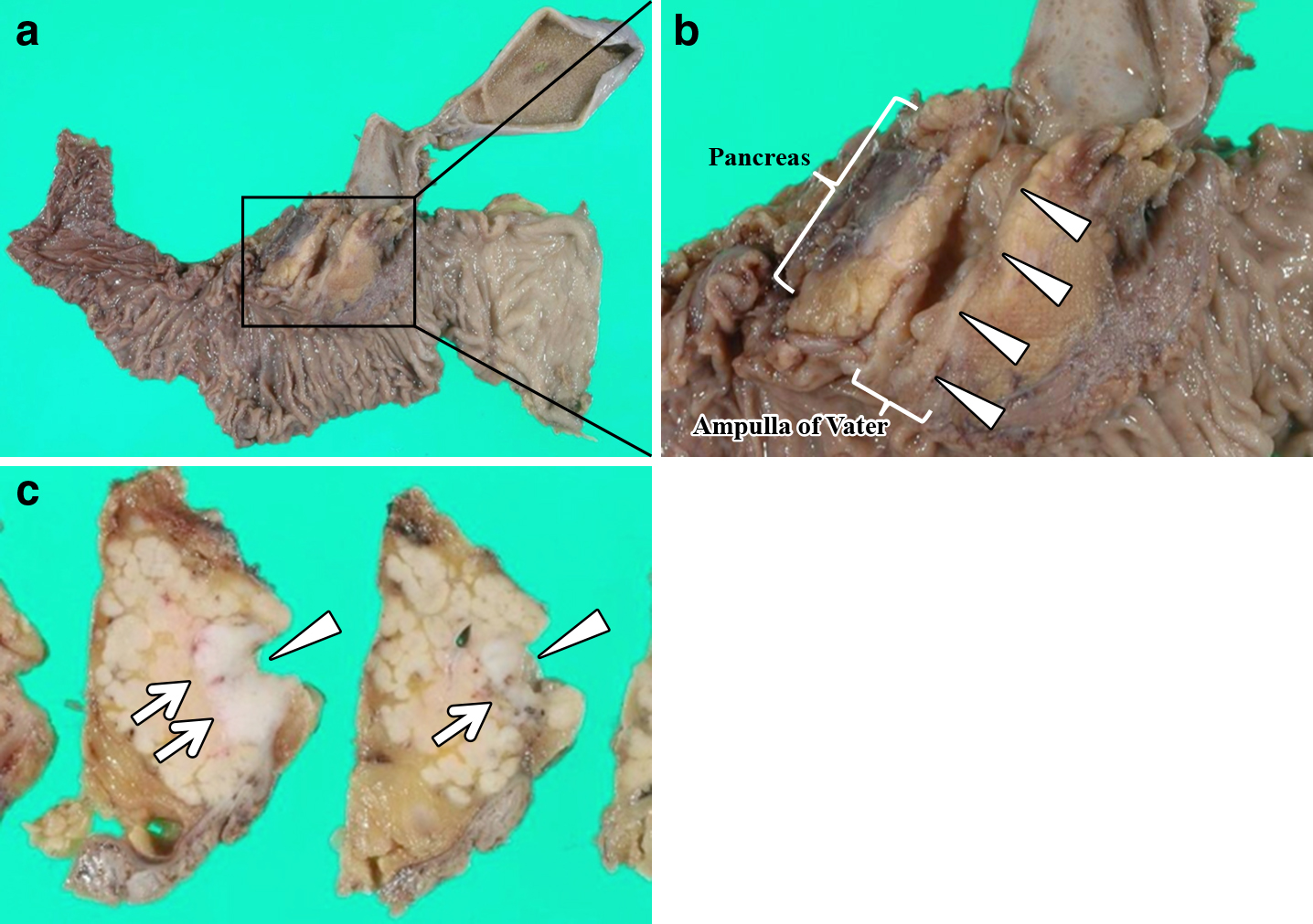
摘出標本所見:下部胆管内に21 mm大の白色腫瘤を認めた(Fig. 4).
病理組織学的検査所見:腫瘍細胞は生検検体と同様の異型細胞が索状またはrosette配列を呈しつつ増殖し,膵臓・十二指腸へ浸潤していた.胆管側の一部で腺腔を形成しており胆管原発の腫瘍と判断した.腺癌成分の比率は1~2%と僅少であった.免疫組織化学染色にて生検検体同様にchromogranin A,synaptophysinが陽性,NSEが一部陽性であり,Ki-67指数は40%であった(Fig. 5).神経内分泌マーカー陽性の異型大型細胞よりなる腫瘍であり,Ki-67指数が20%以上,腺癌成分が30%未満であることから,胆管原発large cell NEC,BdA,結節浸潤型,pT3a(膵臓,十二指腸),pN0,sM0,pDM0,pHM0,pEM0,pPV0,pA0,R0,stage IIA(胆道癌取扱い規約第6版)3)と診断した.組織所見はint,INFβ,ly0,v2,ne1であった.なお,UICC TNM分類では肝外胆管-遠位,T3(膵臓・十二指腸),N0,M0,Stage IIA,2010年WHO分類ではNEC,G3,large cell typeに相当した.
術後経過:術後は合併症なく経過し第31病日に退院となった.術後補助化学療法としてS-1を2年間投与し,現在術後24か月経過しているが再発所見は認めていない.
考察
神経内分泌細胞からなる腫瘍は従来カルチノイドとして報告されてきたが,種々の悪性度を呈する疾患群であることが明らかとなりNETの名称が汎用されている4).NETは比較的まれな腫瘍であるが近年急速に罹患数が増加している5).発生頻度の高い膵・消化管原発のNETに関してはヨーロッパ神経内分泌腫瘍学会(European Neuoroendocrine Tumor Society;以下,ENETSと略記)により核分裂数が予後と相関することが明らかとなり,またENETSによるTNM分類も作成されるなど解析が大きく進んできた6).2010年にはKi-67指数,核分裂数に基づきgradingされたWHO分類が公表されさらなる解析が進み1),膵・消化管原発のNETに関してはENETS,National Comprehensive Cancer Network(NCCN)だけでなく,本邦でも診療ガイドラインが作成されるに至っている2)6)7).
一方,胆道原発のNETの発生頻度は非常にまれであり,消化管NETの0.2~2%や8),肝外胆管原発小細胞癌は全胆管悪性腫瘍の0.19%とされ9),小規模な検討や症例報告が散見されるのみである.WHO分類では膵・消化管NETと同様にKi-67指数,核分裂数によりgradingされているが,各種ガイドラインにも胆道NETに関する記載はなく確立された治療指針がないのが現状である.
本邦での肝外胆管原発NECの症例は,医中誌Webで1977〜2014年までの期間で「胆管」または「内分泌細胞癌」をキーワードとした検索結果を元に集計したところ(会議録を除く),加納ら10)の31例の報告(カルチノイドとして報告された1例は除外)に自験例を含む22例を加えた計53例10)~38)の報告があった.組織型は胆道癌取扱い規約第5版39)に準じて記載されているものが多く,内訳は小細胞癌(small cell carcinoma;以下,scと略記)が22例,腺内分泌細胞癌(adenoendocrine cell carcinoma;以下,aecと略記)が31例(自験例を含む)であった.胆道癌取扱い規約第6版3)では腺癌成分・内分泌細胞癌成分の比率について,それぞれの成分が30%以上存在するものを混合型腺神経内分泌癌(mixed adenoneuroendocrine carcinoma;以下,MANECと略記)と規定しているが,成分に関する記載があるものは53例中26例で,aecと報告された31例中,自験例を含む11例は腺癌成分を一部に認めるのみでありNECの診断となる.また,Ki-67指数または核分裂数について明記され,WHO分類(2010年)による分化度の評価が可能な症例は53例中13例のみであり,その内訳はNET G1:1例15),NET G2:1例16),NEC:11例14)18)~21)29)31)33)~35)37)であった.以上から,WHO分類(2010年)に基づく検討は困難であるため,NET G1・G2の2例を除いた51例について胆道癌取扱い規約第6版3)に基づきstagingを行い検討した(Table 1).
Table 1
Clinicopathological details of patients with biliary NEC
| Median age |
|
69 (28–85) | |
No. of each stage (the 6th edition); I/II/III/IV: 2/25/1/9 (ND: 14) |
| Male:Female |
|
32:19 | |
Recurrent sitea |
liver |
31 |
| Location |
Bp |
9 | |
|
lymph node |
9 |
|
Bd |
39 | |
|
bone |
6 |
|
ND |
3 | |
|
adrenal gland |
3 |
| Pre-operative diagnosis |
BD Ca |
29 | |
|
peritoneum |
4 |
|
aec |
2 | |
|
pleura |
3 |
|
sc |
10 | |
|
brain |
3 |
|
others |
5 | |
|
pancreas |
2 |
|
ND |
5 | |
|
lung |
2 |
| Operation method |
PD |
34 | |
|
local site |
2 |
|
BDR |
5 | |
|
others |
5 |
|
H+BDR |
4 | |
Chemoradiotherapyb |
|
others |
3 | |
Neoadjuvant |
|
|
not done |
4 | |
|
platinating agent base |
3 (3) |
|
ND |
1 | |
|
antipyrimidinee and/or GEM base |
0 |
| Pathology (WHO 2010) |
SCNEC |
3 | |
|
other |
0 |
|
LCNEC |
2 | |
Adjuvant |
|
|
MANEC |
1 | |
|
platinating agent base |
7 |
|
NEC |
5 | |
|
antipyrimidine and/or GEM base |
2 |
|
ND |
40 | |
|
other |
1 |
| Macroscopic type |
P |
12 | |
No curative resection or after recurrence |
|
|
N |
20 | |
|
platinating agent base |
5 (3) |
|
other |
1 | |
|
antipyrimidine and/or GEM base |
7 (1) |
|
ND |
18 | |
|
others |
11 (2) |
| Median size (mm) |
(n=44) |
28 (3–65) | |
|
not done |
10 |
| | | | | ND |
16 |
a. Overlapped data. b. Overlapping data including arterial infusion therapy. Number of patients whose tumor shrinkage was confirmed shown in parentheses. ND: not described, BD Ca: bile duct carcinoma, aec: adenoendocrine cell carcinoma, sc: small cell carcinoma, PD: pancreatoduodenectomy (included pylorus preserving pancreatoduodenectomy and subtotal stomach preserving pancreatoduodenectomy), BDR: bile duct resection, H: hepatectomy, LCNEC: large cell neuroendocrine carcinoma, MANEC: mixed adenoneuroendocrine carcinoma, SCNEC: small cell neuroendocrine carcinoma, NEC: neuroendocrine carcinoma (not described about cell form or the ratio of adenocarcinoma component), P: papillary type, N: nodular type, GEM: gemcitabine
年齢分布は28〜85歳(中央値:69歳),男女比は32:19で男性に多かった.占居部位は遠位側胆管が多く76%を占めており,そのため術式は膵頭十二指腸切除が最も多く施行されていた.術前の細胞診・組織診は30例に施行され,内分泌細胞成分を検出できたのは疑診例を含めて12例であった.腺癌の診断で治療を行われている症例が多く,術前診断は比較的困難であるといえる.最大腫瘍径中央値は28 mmであり,肉眼型は結節型が多かった.転帰の記載のある49例中24例は術後または診断後1年以内に死亡しており予後は不良である.肉眼的根治切除(R0・R1)後の再発は31例中18例(58%)と高率に認めたが,1年以上の生存期間が明記されている22例中18例(82%)は,再発の有無にかかわらず根治的な初回手術が施行されていた.再発形式としては肝転移再発が最も多かった.
肺小細胞癌や消化管原発のNECに比べ肝胆膵領域のNECは化学療法に抵抗性であり予後不良とされ40),胆管原発NECに対する確立された薬物療法はない.過去の報告では小細胞肺癌に準じた白金製剤をベースとしたレジメン(cisplatin+irinotecan,cisplatin+etoposide)や,胆道癌に準じたレジメン(gemcitabine,S-1)が比較的多く使用されていた.標的病変が存在する状態(術前,非根治切除後,または再発後)で施行されたレジメンの中で,奏効率が最も高かったレジメンは白金製剤ベースのもの(cisplatin+irinotecan,cisplatin+etoposide,carboplatin+etoposide,tegafur/uracil+cisplatin)であり,8例中6例(75%)で腫瘍縮小効果が認められた.
次に胆管原発のLCNECについて検討を行った.NECは細胞形態によりLCNECまたはsmall cell NEC(以下,SCNECと略記)に分類されるが1),胆管原発NECの報告例の多くはSCNECでありLCNECは極めてまれである.胆管原発のLCNECは,PubMedで1950〜2014年までの期間で「bile duct」または「large cell」または「neuroendocrine carcinoma」をキーワードとして検索したところ,英文での報告は6例のみであり21)41)~45),本症例を加えた7例について検討した(Table 2).胆管原発LCNECの7例と本邦における胆管原発NECの51例(そのうち少なくとも36例がsmall cell type)を比較すると,年齢・性差・発生部位・術前診断の困難さ・使用された化学療法レジメンについては同様の傾向がみられた.生存期間は全体的に短く,7例中5例は6か月以内に死亡していた.根治切除が施行された場合でも自験例以外は全例転移・再発を来し6例とも原病死していた.胆囊原発NECにおいてはSCNECに比べLCNECは予後不良であるとの報告があるが46),胆管原発NECにおいても同様な傾向がみられた.本症例は検索しえたかぎりでは胆管原発LCNECの初の比較的長期生存例であり,極めて予後不良な胆管原発LCNECにおいても長期生存を期待するには根治切除は不可欠と考える.
Table 2
6 cases of large cell neuroendocrine carcinoma of the extrahepatic bile duct reported in the international literature and our case
| No |
Author/
Year |
Age |
Sex |
Location |
Pre-operative
diagnosis |
Operation
method |
Ratio of
adenocarcinoma |
Proliferation kinetics |
Pathology
(WHO 2010) |
Macroscopic
type |
Size
(mm) |
Pathology
(the 6th edition) |
Curative
resectiona |
Chemotherapy |
Recurrent and/or metastatic site
(Period of recurrence) |
Outcome |
| Ki-67 index |
Mitosis |
T |
N |
M |
Stage |
| 1 |
Sato21)/
2006 |
68 |
M |
Bd |
BD Ca |
PD |
20% |
71.4% |
43/10HPF |
LCNEC |
N |
20 |
3a |
0 |
0 |
IIA |
+ |
CDDP+VP-16 (after recurrence) |
liver (2M) |
3M (D) |
| 2 |
Kohashi41)/
2009 |
77 |
M |
Bd |
BD Ca |
PD |
ND |
67% |
60/HPF |
LCNEC |
P |
18 |
T2 |
0 |
0 |
IB |
+ |
not done |
liver, lung, local (3M) |
3M (D) |
| 3 |
Samad42)/
2012 |
67 |
F |
Bp-dC |
LCNEC |
not done |
ND |
70% |
numerous |
LCNEC |
ND |
ND |
T3-4 |
1 |
1 |
IVB |
− |
CBDCA+VP-16 |
lung, LN, peritoneum (autopsy) |
<1M (D) |
| 4 |
Sasatomi43)/
2013 |
76 |
M |
Bp |
BD Ca |
H+BDR |
0% |
70–80% |
15–18
/10HPF |
LCNEC |
ND |
50 |
T4b |
1 |
1 |
IVB |
− |
not done |
LN (0.3M) |
0.7M (D) |
| 5 |
Wysocki44)/
2014 |
65 |
M |
Bp |
others |
BDR |
ND |
80% |
ND |
MANEC |
P |
36 |
T2a |
x |
0 |
II–IIIB |
− |
not done |
ND |
5M (D) |
| 6 |
Park45)/
2014 |
75 |
F |
Bd |
BD Ca |
BDR |
0% |
ND |
ND |
LCNEC |
ND |
27 |
T2 |
1 |
0 |
IIB |
+ |
5-FU+epirubicin+CDDP (adjuvant) |
liver, local (7M) |
12M (D) |
| 7 |
Our case |
64 |
M |
Bd |
AECC |
PD |
1–2% |
40% |
23/10HPF |
LCNEC |
N |
21 |
3a |
0 |
0 |
IIA |
+ |
S-1 (adjuvant) |
— |
24M (A) |
a. Defined as macroscopically curative condition (i.e., R0 and R1)
今回の検討から現時点で推奨される肝外胆管原発NECの治療方針の原則は,SCNEC・LCNECを問わず膵・消化管NECと同様にリンパ節郭清を伴う定型的切除により根治切除を目指すべきである.また,本症例では患者が入院や点滴処置を要する化学療法は希望されなかったため術後補助化学療法としてS-1を選択したが,これまでの知見を総合すると膵・消化管NECと同様に小細胞肺癌に準じた白金製剤ベースのレジメンが推奨されると考えられる.したがって,切除不能例において内分泌細胞成分が検出できていない場合は,有効な化学療法レジメンが選択できないことが問題となる.増殖能や腺癌成分の分布には不均一性があるため,生検検体から悪性度を含めた正確な診断を得ることは事実上不可能ではあるが,神経内分泌細胞としての性格を示唆する核クロマチン所見やrosette形成などの特徴的な細胞配列を認めた際には,積極的に免疫組織化学的検索を施行し確認すること,および可及的に悪性度を評価し治療方針を検討することが重要である.今回検討した症例中には,WHO分類,および膵・消化管NETガイドラインにおいて必要とされる病理学的項目が欠けている症例も多くNET G1・G2症例が含まれている可能性がある.胆管原発NET症例の治療成績の向上,および標準治療の確立のためには,詳細な病理学的記載を含む症例の集積が必要と考える.
利益相反:なし
文献
- 1) Bosman FT, Carneiro F, Hruban RH, Theise ND, editors. WHO classification of tumours of the digestive system. Lyon: IARC Press; 2010. p. 274–276.
- 2) 日本神経内分泌腫瘍研究会(JNETS)膵・消化管神経内分泌腫瘍診療ガイドライン作成委員会編.膵・消化管神経内分泌腫瘍(NET)診療ガイドライン.第1版.東京:金原出版;2015.
- 3) 日本胆道外科研究会編.臨床・病理 胆道癌取扱い規約.第6版.東京:金原出版;2013.
- 4) 佐野 壽明.胆道系の神経内分泌腫瘍.胆と膵.2007;28:169–172.
- 5) Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, et al. One hundred years after “Carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26(18):3063–3072.
- 6) Rindi G, Kloppel G, Alhman H, Caplin M, Couvelard A, de Herder WW, et al. TNM staging of foregut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Arch. 2006;449(4):395–401.
- 7) Kulke MH, Benson AB 3rd, Bergsland E, Berlin JD, Blaszkowsky LS, Choti MA, et al. Neuroendocrine tumors. J Natl Compr Canc Netw. 2012;10(6):724–764.
- 8) Chamberlain RS, Blumgart LH. Carcinoid tumors of the extrahepatic bile duct. A rare cause of malignant biliary obstruction. Cancer. 1999;86(10):1959–1965.
- 9) Albores-Saavedra J, Batich K, Hossain S, Henson DE, Schwartz AM. Carcinoid tumors and small-cell carcinomas of the gallbladder and extrahepatic bile ducts: a comparative study based on 221 cases from the surveillance, epidemiology, and end results program. Ann Diagn Pathol. 2009;12:378–383.
- 10) 加納 正人, 片山 外大, 中右 雅之, 洲崎 聡, 柳橋 健.術後5年無再発生存中の肝外胆管原発小細胞癌(内分泌細胞癌)の1例.日本消化器外科学会雑誌.2010;43(3):253–258.
- 11) Yamamoto M, Nakajo S, Tahara E, Miyoshi N. Endocrine cell carcinoma of extrahapatic bile duct. Acta Pathol Jpn. 1986;36(4):587–593.
- 12) 元島 幸一, 入江 真, 日浅 厚則, 須藤 隆一郎, 松川 俊一, 高山 和之,ほか.肝外胆管原発の小細胞性未分化癌の1例.胆と膵.1989;10(2):225–228.
- 13) 横山 久光, 渡辺 洋一, 佐々木 昭, 斎藤 公男, 國友 忠義, 溝渕 光一.多彩な神経症状の先行した先天性総胆管拡張症に原発したHCG産生内分泌細胞癌(小細胞癌・カルチノイド・高分化腺癌複合腫瘍)の1例.岡山赤十字病院医学雑誌.1991;2(1):28–34.
- 14) 瀧本 篤, 遠藤 格, 疋田 草生子, 渡会 伸治, 仲野 明, 嶋田 紘,ほか.胆管原発小細胞癌(神経内分泌癌)の1例.胆道.1966;10(5):390–396.
- 15) Oikawa I, Hirata K, Katsuramaki T, Mukaiya M, Sasaki K, Satoh M. Neuroendocrine carcinoma of the extrahepatic biliary tract with positive immunostaining for gastrin-releasing peptide: report of a case. Surg Today. 1998;28:1192–1195.
- 16) Edakuni G, Sasatomi E, Satoh T, Tokunaga O, Miyazaki K. Composite glandular-endocrine cell carcinoma of the common bile duct. Pathol Int. 2001;51:487–490.
- 17) 櫻井 博文, 上垣外 明子, 保坂 典子.総胆管原発神経内分泌細胞癌の1例.日本臨床細胞学会雑誌.2003;42(3):235–238.
- 18) 沖村 明, 西上 隆之, 中正 恵二, 高梨 忠朗, 大江 正之, 嵯峨山 健,ほか.総胆管下部に発生した腺内分泌細胞癌の1例.診断病理.2003;20(1):50–54.
- 19) Kuraoka K, Taniyama K, Fujitaka T, Nakatsuka H, Nakayama H, Yasui W. Small cell carcinoma of the extrahepatic bile duct: case report and immunohistochemical analysis. Pathol Int. 2003;53:887–891.
- 20) 佐藤 勝明, 上見 嘉子, 河村 常作, 谷本 一夫, 岡崎 恵子, 上田 善道,ほか.大細胞神経内分泌成分を伴う下部胆管原発線内分泌細胞癌の1例.日本臨床細胞学会雑誌.2005;44(5):314–318.
- 21) Sato K, Waseda R, Tatsuzawa Y, Fujinaga H, Wakabayashi T, Ueda Y, et al. Composite large cell neuroendocrine carcinoma and adenocarcinoma of the common bile duct. J Clin Pathol. 2006;59:105–107.
- 22) 星川 竜彦, 古内 孝幸, 種田 靖久, 幕内 博康, 佐久間 正祥.先天性胆道拡張症に合併した肝内胆管原発小細胞癌の1例.日本臨床外科学会雑誌.2006;67(3):701–706.
- 23) Hosonuma K, Sato K, Honma M, Kashiwabara K, Takahashi H, Takagi H, et al. Small-cell carcinoma of the extrahepatic bile duct: a case report and review of the literature. Hepatol Int. 2008;2:129–132.
- 24) 桜井 直樹, 飯澤 肇, 田村 元.胆管腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2009;70(4):1177–1180.
- 25) 山田 達治, 上松 俊夫, 根東 順子, 平田 明裕.下部胆管に発生した腺内分泌細胞癌の1例.胆と膵.2009;30(8):907–912.
- 26) 山口 由美, 清水 浩幸, 米田 栄子.CPT-11とCDDPによる肝動注化学療法が奏効した胆管原発内分泌細胞癌術後再発の1例.癌と化学療法.2009;36(5):823–825.
- 27) Okamura Y, Maeda A, Matsunaga K, Kanemoto H, Boku N, Furukawa H, et al. Small-cell carcinoma in the common bile duct treated with multidisciplinary management. J Hepatobiliary Pancreat Surg. 2009;16:575–578.
- 28) 吉田 龍一, 八木 孝仁, 貞森 裕, 松田 浩明, 篠浦 先, 楳田 祐三,ほか.下部胆管原発腺内分泌細胞癌の一例.外科治療.2010;102(4):416–418.
- 29) 菅野 敦, 佐藤 賢一, 廣田 衛久, 正宗 淳, 高舘 達之, 力山 敏樹,ほか.術前に診断し得た下部胆管原発腺内分泌細胞癌の1例.胆道.2010;24(5):714–722.
- 30) 小倉 俊郎, 中村 典明, 入江 工, 田中 真二, 有井 滋樹.胆管原発内分泌細胞癌の1例.日本臨床外科学会雑誌.2011;72(9):2360–2364.
- 31) 馬場 英, 古家 乾, 小泉 忠史, 葛西 健二, 定岡 邦昌, 関谷 千尋,ほか.長期生存が得られている胆道系に発生した神経内分泌癌の2例.日本消化器病学会雑誌.2012;109:1598–1607.
- 32) 荒川 和久, 小川 哲史, 安東 立正, 富澤 直樹, 須納瀬 豊, 竹吉 泉.肝腸間膜動脈幹由来の総肝動脈が膵内を走行した胆管腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2012;73(3):673–676.
- 33) 濱中 美千子, 中平 伸, 武田 裕, 革島 洋志, 向井 洋介, 金村 剛志,ほか.胆管原発神経内分泌癌の1例.癌と化学療法.2012;39(12):2125–2127.
- 34) Takahashi K, Sasaki R, Oshiro Y, Fukunaga K, Oda T, Ohkohchi N. Well-differentiated endocrine carcinoma originating from the bile duct in association with a congenital choledochal cyst. Int Surg. 2012;97:315–320.
- 35) 下平 悠介, 塩崎 弘憲, 須藤 一起, 鈴木 高祐, 小野寺 久.下部胆管を原発とする内分泌細胞癌の1例.日本臨床外科学会雑誌.2013;74(1):190–195.
- 36) 二宮 理貴, 小澤 文明, 三井 哲弥, 駒込 昌彦, 佐藤 彰一, 赤松 延久,ほか.胆管小細胞癌(神経内分泌癌)の1例.癌と化学療法.2013;40(12):1765–1767.
- 37) 徳安 成郎, 遠藤 財範, 吉本 美和, 渡邉 浄司, 坂本 照尚, 奈賀 卓司,ほか.化学療法が奏効し根治手術を施行しえた肝門部神経内分泌細胞癌の1例.日本消化器外科学会雑誌.2013;46(8):579–585.
- 38) Onishi I, Kitagawa H, Harada K, Maruzen S, Sakai S, Makino I, et al. Intraductal papillary neoplasm of the bile duct accompanying biliary mixed adenoneuroendocrine carcinoma. World J Gastroenterol. 2013;19(20):3161–3164.
- 39) 日本胆道外科研究会編.外科・病理 胆道癌取扱い規約.第5版.東京:金原出版;2003.
- 40) Terashima T, Morizane C, Hiraoka N, Tsuda H, Tamura T, Shimada Y, et al. Comparison of chemotherapeutic treatment outcomes of advanced extrapulmonary neuroendocrine carcinomas and advanced small-cell lung carcinoma. Neuroendocrinology. 2012;96(4):324–332.
- 41) Kohashi T, Matsugu Y, Nakahara H, Ohmori I, Egi H, Urushihara T, et al. Large-cell neuroendocrine carcinoma of the distal bile duct. Clin J Gastroenterol. 2009;2:291–295.
- 42) Samad A, Kaplan A, Arain M, Attam R, Jessurun J, Manivel JC, et al. Endoscopic ultrasound-guided fine-needle aspiration diagnosis of large cell neuroendocrine carcinoma of the gallbladder and common bile duct. Diagn Cytopathol. 2012;41(12):1091–1095.
- 43) Sasatomi E, Nalesnik MA, Marsh JW. Neuroendocrine carcinoma of the extrahepatic bile duct: case report and literature review. World J Gastroenterol. 2013;19(28):4616–4623.
- 44) Wysocki J, Agarwal R, Bratton L, Nguyen J, Weidenhaft MC, Shores N, et al. Mixed large cell neuroendocrine carcinoma and adenocarcinoma with spindle cell and clear cell features in the extrahepatic bile duct. Case Rep Pathol. 2014;2014:347949.
- 45) Park SB, Moon SB, Ryu YJ, Hong J, Kim YH, Chae GB, et al. Primary large cell neuroendocrine carcinoma in the common bile duct: first Asian case report. World J Gastroenterol. 2014;20(47):18048–18052.
- 46) Iype S, Mirza TA, Propper DJ, Bhattacharya S, Feakins RM, Kocher HM. Neuroendocrine tumours of the gallbladder: three case and a review of the literature. Postgrad Med J. 2009;85:213–218.