2017 Volume 50 Issue 1 Pages 73-78
2017 Volume 50 Issue 1 Pages 73-78
症例は脳梗塞治療中の69歳の男性で,突然の腹痛で当院を受診した.造影CTにて小腸壁の造影不良と上腸間膜動脈(superior mesenteric artery;以下,SMAと略記)の閉塞を認め,血管造影検査にてSMA塞栓症と診断した.さらに,血管攣縮を認め非閉塞性腸管虚血症(non-occlusive mesenteric ischemia;以下,NOMIと略記)様の病態を合併していた.検査中に腹膜刺激症状が出現したため緊急手術を施行した.壊死腸管を切除後,一期的に吻合し手術を終えた.術中からプロスタグランディンE1(prostaglandin E1;以下,PGE1と略記)の静脈内持続投与を開始し,術後は動脈内持続投与に切り替え,縫合不全を合併することなく救命しえた.腸間膜動脈閉塞症に対しても,PGE1を早期に投与することにより,併存するNOMI様の病態や潜在的な血管攣縮による腸管虚血発症のリスクを下げ,結果的に急性腸間膜血行不全症全体の予後改善に寄与しうると考えられた.
急性腸間膜血行不全症(acute mesenteric ischemia;以下,AMIと略記)は,上腸間膜動脈(superior mesenteric artery;以下,SMAと略記)血栓症や塞栓症などの閉塞症と,主幹動静脈に器質的な閉塞を伴わない非閉塞性腸管虚血症(non-occlusive mesenteric ischemia;以下,NOMIと略記)に大別され,いずれも死亡率は60~90%と高い1).さらにNOMIは特徴的な症状に乏しく診断が困難であることから,治療成績向上のためには早期診断・治療が重要である.今回,我々はSMA末梢に生じた塞栓症を契機にNOMI様の病態を呈した症例を経験し,プロスタグランディンE1(prostaglandin E1;以下,PGE1と略記)の静脈内,動脈内大量持続投与により救命しえたので報告する.
症例:69歳,男性
主訴:突然発症した腹痛
既往歴:心房細動,高血圧症,慢性心不全,69歳時に脳梗塞
現病歴:2014年9月突然発症した腹痛のため当院救急外来を受診した.腹痛の訴えはあったが腹膜刺激症状は認めなかった.腹部CTでSMA塞栓症と診断したため緊急入院となった.
入院時現症:血圧182/92 mmHg,脈拍62回/分,体温36.6°C,腹部平坦軟,臍部〜右下腹部に圧痛を認めたが反跳痛は認めなかった.
入院時検査所見:白血球19,800/ml,CRP 0.14 mg/dl,Dダイマー9.3 mg/ml以外は正常であった.
腹部CT所見:SMAに塞栓を示唆する低吸収域がみられ,同一スライス内で一部の小腸壁は造影不良であった(Fig. 1).
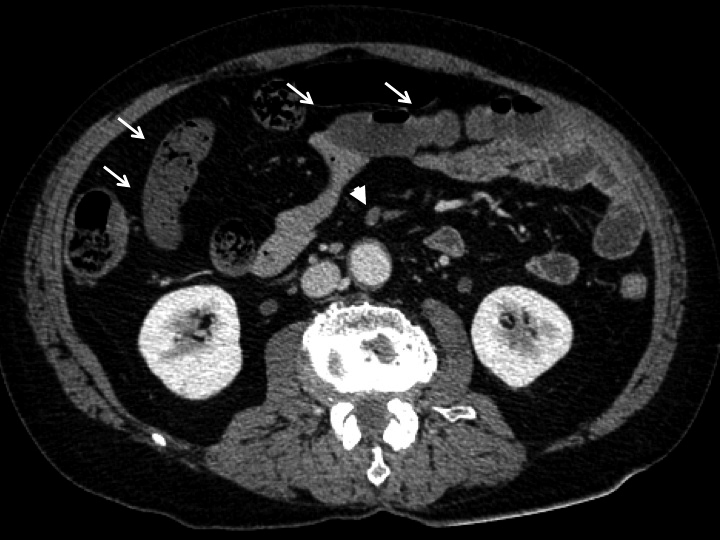
Enhanced abdominal CT image shows intestinal ischemic signs (arrows) and SMA obstruction in the periphery (arrowhead).
入院後経過:血栓溶解療法を目的に緊急腹部血管造影を施行したところ回腸動脈が閉塞していた(Fig. 2).さらに,NOMIに特徴的とされる血管攣縮によるソーセージサインを認めていた(Fig. 2).NOMI様の血管攣縮を呈したSMA塞栓症と診断したが,検査中から腹膜刺激症状が出現したため,腸管壊死または腸管穿孔を疑い,直ちに緊急手術を施行した.NOMIの治療を念頭に置き術中からPGE1(0.01 μg/kg/min)の静脈内持続投与を開始した.
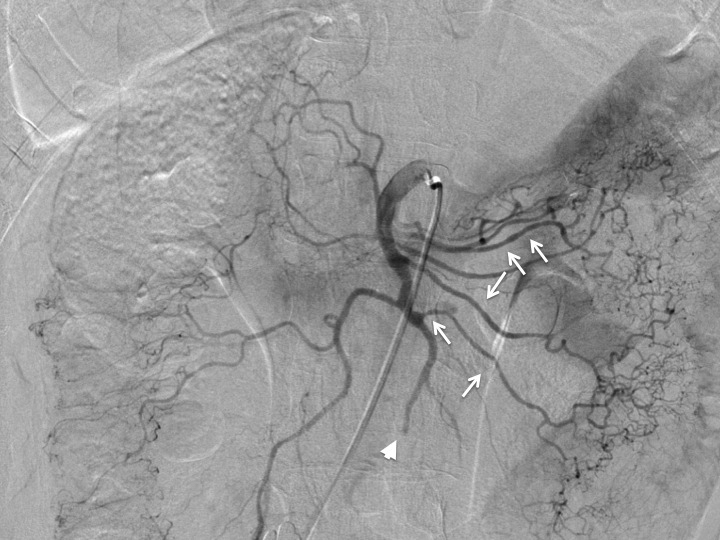
Angiography image shows SMA obstruction (arrowhead) and branching artery spasm (arrows, sausage string sign).
手術所見:開腹すると大量の血性腹水を認めた.Treitz靱帯から200 cmの部位の小腸からまだらに分節状に非連続性の虚血性変化を認めたが,腸間膜には虚血性変化はみられなかった.壊死腸管の範囲が肉眼的に明らかであったため,盲腸・上行結腸を含む回腸を切除後,一期的に吻合し手術を終えた.
切除標本肉眼所見:回腸は80 cmにわたって壊死しており,回腸・結腸の一部は分節状の虚血性変化を認めた(Fig. 3).

The macroscopic view of the resected specimen shows discontinuous segmental intestinal ischemia.
切除標本組織所見:回腸壁全層が凝固壊死に陥り,炎症細胞浸潤はほとんどみられず,腸管梗塞の所見であった(Fig. 4).他の腸管には分節状に固有筋層の壊死を認めた.

The microscopic view of the resected jejunum shows coagulative necrosis of all layers with no infiltration of inflammatory cells.
術後経過:ICU帰室後から動脈留置カテーテルからのPGE1動脈内持続投与(0.02 μg/kg/min)に切り替えた.さらに,ヘパリン投与も行った.翌日に血管造影を施行したところ,血管攣縮は消失していた(Fig. 5).術後4日目までPGE1動脈内持続投与を行い,術後7日目までPGE1静脈内持続投与を行った.ワーファリン投与に変更し,幸いにして縫合不全を発症することなく,術後42日目軽快退院した.
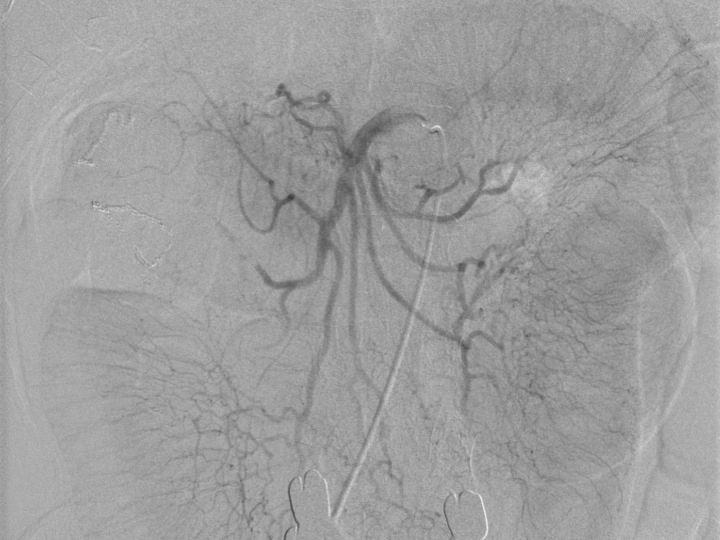
After administrating continuous intravenous and intra-arterial high-dose PGE1, no spasm of the branching artery was found.
SMA塞栓症は,血栓症と同様に心房細動などの心血管疾患を既往に認める場合が多く,初期症状として突然の激しい腹痛で発症することが多い2).また,本例のように主幹動脈に器質的な閉塞を伴う.
一方,NOMIは急性腸間膜動脈閉塞症とは異なり,主幹動脈に器質的な閉塞はなく,血管攣縮により腸間膜血流が減少し,非閉塞性に腸管が壊死に至る.NOMIには特徴的な症状に乏しいためにその診断と治療が遅れ,致命率は極めて高い疾患である3).
NOMIの診断には腹部血管造影検査が診断法のゴールドスタンダードとされ,Boleyら4)はNOMIに伴う血管攣縮の所見として,上腸間膜動脈根部の狭小化,string of sausage sign(上腸間膜動脈分枝の攣縮と拡張が交互に発生し,ウィンナーソーセージ様の形態をとる),腸管辺縁動脈の攣縮像,腸管壁内血管の描出不良などをあげている.このような特徴的な血管の造影所見が得られればNOMIと診断することは可能である.
本例は術前の血管造影検査でstring of sausage signを認めNOMI様の病態の関与も疑った.開腹時の所見では,広範な腸間膜壊死は認めず,腸管壊死が分節状・非連続性に起こっていたが,病理学的には80 cmにわたって回腸壁全層が凝固壊死に陥っており,回腸壊死に関してはSMA末梢での塞栓やシャワーエンボリズムの可能性も考えられた.さらに,腸管虚血の結果,血管攣縮が起こり二次的にNOMI様の病態を呈したと考えられた.SMA閉塞症とNOMIの病態が同時期に発症した例は,医学中央雑誌で「SMA閉塞症」および「非閉塞性腸管虚血症」をキーワードに1977年より2015年5月まで検索した結果,光吉ら5)の報告以外にはなく,他にはSMA閉塞症発症後7か月でNOMI様所見がみられた報告6)があるのみである.また,SMA閉塞症のみに目を奪われてNOMI様の血管攣縮合併を見逃していた可能性が考えられるため,SMA閉塞症の診断には末梢血管の所見にも留意する必要があると考えられる.
NOMIの治療に関しては,腸管の壊死や穿孔を疑った場合には,緊急手術の適応となり,壊死腸管の切除が原則である7)~9).また,壊死や穿孔が除外できる症例に対しては,動脈留置カテーテルからの血管拡張薬の持続投与が有効とされている10).しかし,NOMIの治療成績は非常に不良なまま現在に至っているのが現状である.そこで,我々はNOMIの新しい診断・治療法を提唱11)し(Fig. 6),国内外でこの方法を用いてNOMIの早期診断・治療の報告が散見されるようになった12)13).つまり,高齢者の心血管術後や維持透析後など脱水に陥っている可能性があり,①腹痛や嘔気など何らかの腹部症状から腸閉塞への移行,②カテコールアミンを使用中,③低血圧のエピソード,④徐々にトランスアミナーゼ上昇,の4項目中3項目以上を満たす場合はNOMIを発症していることを強く疑い,診断のための詳しい検査よりも,まず大量輸液により脱水を補正し,PGE1の静脈内大量持続投与を行いつつ検査を進めるというものである.PGE1は末梢血管拡張作用としての強力な血管平滑筋弛緩作用,血小板凝集抑制作用,赤血球変形能改善作用,活性酸素産生抑制作用を持つ.PGE1の静脈内大量持続投与を行えば腸管での血流改善効果が期待できる14).本例では,直ちに緊急手術となったため術中からPGE1の静脈内大量持続投与を開始した.術後には動脈留置カテーテルからのPGE1動脈内大量持続投与へ切り替えた.このように腹部血管造影検査を施行した場合には,動脈内にカテーテルを留置し今後の治療に備える必要があろう.また,本例は壊死腸管切除後に一期的に吻合し,幸いにして縫合不全を発症しなかった.NOMIは反復し発症するため,術中に壊死腸管切除の範囲を決定することは難しく,血流不良による縫合不全を防止するためにも,一期的に腸管吻合は避けるのが無難であろう9)14).さらに,漿膜に血行障害を疑う所見がないにもかかわらず,触診にて腸管壁が菲薄化し粘膜面が壊死に陥っていた症例を経験したこともあり,壊死腸管か否かの評価に関しては腹腔鏡ではなく開腹手術による視触診も加えて判断したほうが良いと考えられる14).

We propose new strategy for NOMI. Early administration of continuous intravenous high-dose PGE1 could contribute to improved survival in NOMI.
PGE1の静脈内,動脈内大量持続投与を開始するまでのゴールデンタイム,初期投与量に関しては明らかな指標はない14)15).PGE1の初期投与量としては,術中異常高血圧症の治療薬として用いる0.05~0.1 μg/kg/minより少量での設定としている.本例に関しては,PGE1投与は我々の提唱したアルゴリズムに則りNOMIを疑った時点で速やかに0.01 μg/kg/minから静脈内大量持続投与を開始し,術後は動脈留置カテーテルからの投与に変更し,全身循環動態に影響を及ぼさない範囲で漸増し,腹部症状が改善するまでの持続投与とした.その結果,縫合不全を来すことなく救命しえたと考えている.
SMA閉塞症とNOMIは動脈硬化や虚血性心疾患など発症背景が類似しており,SMA閉塞症に二次的にNOMI様の腸管虚血を呈することは十分に有りうる.また,血栓・塞栓を除去したにもかかわらず,SMA閉塞症の治療成績が現在に至るまで不良なのは,合併した二次的なNOMIを見逃している可能性がある.そのため,SMA閉塞症の治療時には,二次的なNOMIの合併に留意する必要がある.SMA閉塞症に対してもPGE1の早期投与により,潜在的な血管攣縮による腸管虚血発症のリスクを下げ,AMI全体の予後改善に寄与しうると考えられた.
本稿を終えるにあたり,本症例の病理組織所見について御教示頂いた,当院病理診断科濱田新七部長に深謝致します.
利益相反:なし