Abstract
症例は黄疸の精査目的に来院した71歳の女性で,遠位胆管癌の診断で膵頭十二指腸切除術を施行した.病理組織学的検査では,異型腺管構造を呈する低分化腺癌の成分に加え,N/C比の高い腫瘍細胞が混在しており,後者は免疫染色検査の結果,neuroendocrine carcinoma(以下,NECと略記)と診断された.各々の成分が30%以上を占めており,最終的にmixed adenoendocrine carcinoma(以下,MANECと略記)と診断された.術後はCPT-11/CDDPを用いた化学療法を施行し,術後13か月生存中である.胆管原発MANECはまれな疾患であり,治療に関してコンセンサスは得られていない.過去の報告例から胆管原発MANECの悪性度はNECに規定されると推察され,完全切除が得られた場合でも術後にNECに準じた化学療法の導入が有用と思われた.
はじめに
2013年に改訂された胆道癌取扱い規約第6版1)では,2010年WHO分類2)に準じて,神経内分泌癌(neuroendocrine carcinoma;以下,NECと略記)と腺癌が混在し,各々の成分が30%以上存在する腫瘍を,混合型腺神経内分泌癌(mixed adenoendocrine carcinoma;以下,MANECと略記)と定義した.肝外胆管原発MANECはまれな疾患であり,予後不良と考えられている3)4).今回,我々は術後に化学療法を施行し,比較的良好な予後が得られている肝外胆管原発MANECを経験したので,これまでの報告例の検討,および文献学的考察を加え報告する.
症例
患者:71歳,女性
主訴:皮膚の黄染
既往歴:高血圧症,高脂血症
現病歴:2014年夏,上記既往症に対し通院治療中に全身の皮膚の黄染を指摘された.精査の結果,遠位胆管癌の診断を受け,減黄処置後に手術目的に当科紹介となった.
入院時現症:身長141 cm,体重40 kgで眼球結膜および眼瞼結膜に貧血や黄染は認めなかった.腹部は平坦で軟らかく,腫瘤は触知しなかった.
血液検査所見:末梢血検査は全て正常範囲内であった.AST 35 IU/l,ALT 39 IU/lと正常範囲内であったが,T-Bil 1.3 mg/dl,D-Bil 0.9 mg/dlと軽度上昇を認め,ALP 760 IU/l,γ-GTP 316 IU/lと胆道系酵素の上昇を認めた.腫瘍マーカーはCA19-9 99 U/ml,Span-1 50 U/mlとそれぞれ高値を示していた.
腹部造影CT所見:遠位胆管に,25 mm大の胆管内腔に隆起する造影効果を伴った腫瘤を認めた(Fig. 1a).腫瘤は膵実質との境界が不明瞭で,膵浸潤が疑われた(Fig. 1b).明らかな遠隔転移やリンパ節腫大は認めなかった.
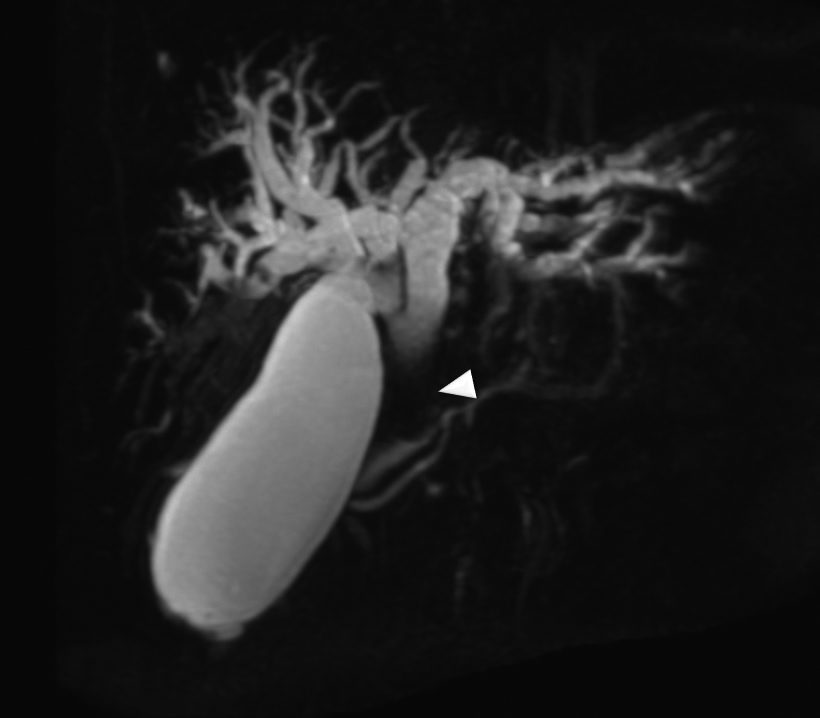
MRCP所見:総胆管の拡張を認め,遠位胆管に腫瘍性の狭窄を認めた.腫瘍の進展範囲は膵上縁から胆囊管合流部までと考えられた(Fig. 2).
経乳頭的胆道鏡検査所見:遠位胆管に主座を置き内腔に突出する腫瘤性病変を認めた.左右肝管分岐部,膵内胆管に病変は明らかではなかった.同時に施行した腫瘍生検で低分化型腺癌の診断を得た.
以上より,胆道癌取扱い規約第6版1)に従いcStage IIAの遠位胆管癌と診断し,手術を施行した.
手術所見:腹腔内観察では,腹水,肝転移,腹膜播種病変は認めず,腫瘍は膵上縁の遠位胆管に主座を置き,明らかな漿膜浸潤を認めなかった.また,肝動脈浸潤ならびに遠隔転移を認めなかったため切除可能と判断し,領域リンパ節郭清を伴う亜全胃温存膵頭十二指腸切除術(IIA-1)を施行した.左右肝管合流部で総肝管を切離し,術中迅速病理診断にて断端陰性を確認した.再建はChild変法にて施行した.手術時間は5時間41分で,出血量は640 mlであった.
切除標本所見:遠位胆管に主座を置く28×25 mmの腫瘍が認められた.腫瘍は乳頭状結節を形成し,一部膵浸潤が疑われた(Fig. 3a, b).
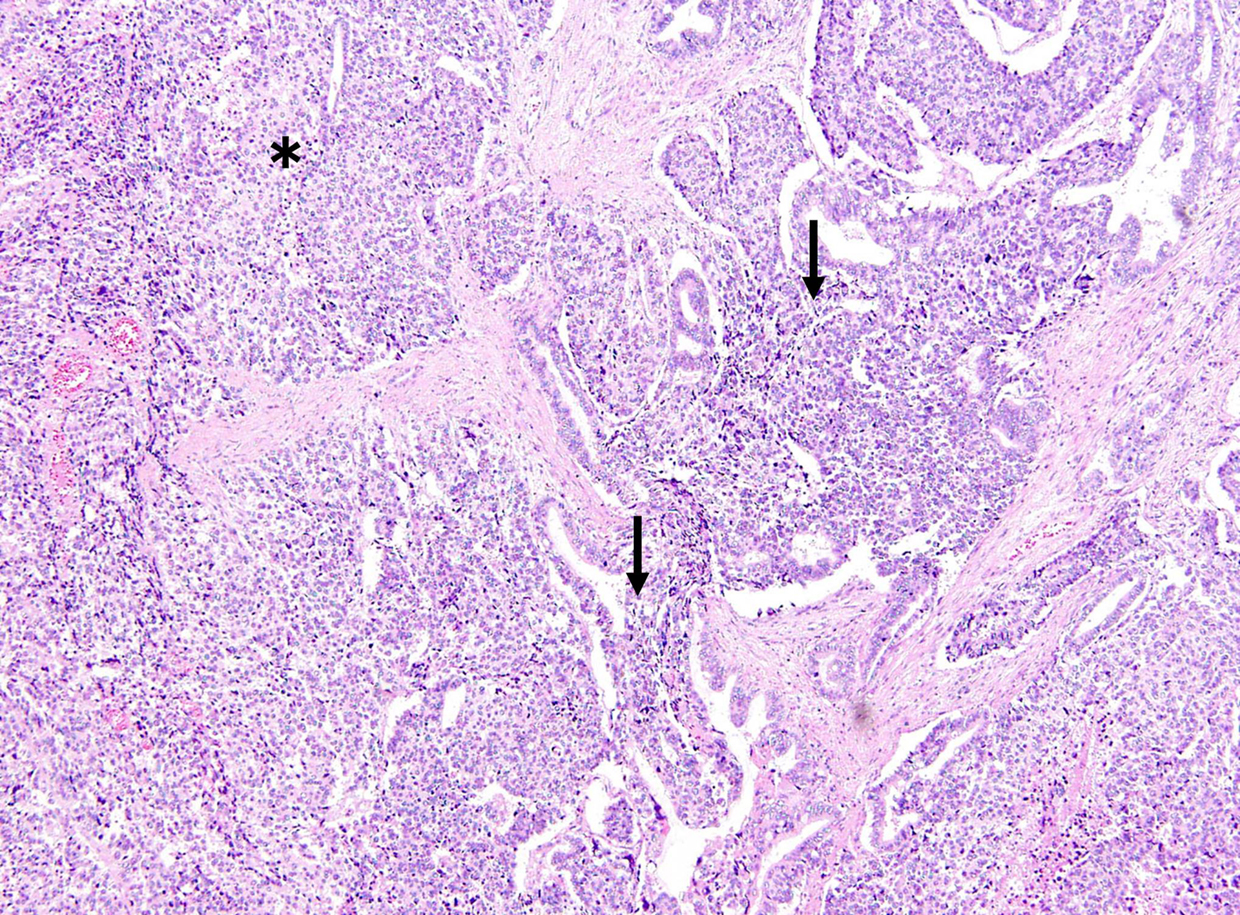
病理組織学的検査所見:腫瘍は異型腺管構造を呈する低分化腺癌の成分に加え,N/C比の高い腫瘍細胞が充実性,一部索状に増生する成分が混在していた(Fig. 4).後者の免疫組織染色検査では,chromogranin A,synaptophysin,NCAM,およびp53が陽性,Ki-67 indexは90%以上であり,NECと診断された(Fig. 5a~d).また,腫瘍成分のうち腺癌成分とNEC成分がそれぞれ30%以上を占めていたことより,最終的に,MANEC,BdPhC,circ,papillary-infiltrating type,28×25 mm,pT3a(panc),med,INFb,ly2,v1,ne3,pN1(17a:2/3),DM0,HM0,EM0,PV0,A0,R0,fStage IIBと診断された.
術後経過:術後合併症を認めず,術後27日目に退院した.腫瘍遺残は認めなかったものの,NEC成分を有することからNECに対する補助化学療法が必要と判断された.化学療法は肺小細胞癌治療に準じてCPT-11 60 mg/m2(day 1,8,15),およびCDDP 60 mg/m2(day 1)を用いた2剤併用療法を選択した.上述の化学療法を8コース施行した後に,腹部造影CTで肝転移再発を認めたため,化学療法をgemcitabine 1,000 mg/m2(day 1,8),CDDP 25 mg/m2(day 1,8)へ変更した.術後13か月を経過した現在,外来化学療法継続中である.
考察
消化管,肺,膵臓に発生する神経内分泌腫瘍は以前よりカルチノイドの亜群に分類されてきたが,2010年WHO分類2)で,神経内分泌細胞由来の腫瘍はneuroendocrine neoplasmsと定義された.また,同腫瘍は,悪性度の差を反映させるために,mitonic countとKi-67 indexから①NET G1(mitonic count<2/10 high power field(以下,HPFと略記)and/or Ki-67 index≤2%),②NET G2(mitonic count 2~20/10 HPF and/or Ki-67 index 3~20%),③NEC(mitonic count>20/10 HPF and/or Ki-67 index>20%)の3分類に加え,腺癌成分とNEC成分がそれぞれ30%以上の割合で混在する④MANECと,⑤過形成および前腫瘍病変の計五つに分類された.本邦の胆道癌取扱い規約において,MANECと同様の性質を持った腫瘍は以前から腺内分泌細胞癌と呼称されていた.2003年に改訂された胆道癌取扱い規約第5版5)で腺内分泌細胞癌は内分泌細胞癌と腺癌とが相接し,または混在している癌と定義され,それぞれの成分の多寡は問わないとされた.2013年に改訂された胆道癌取扱い規約第6版1)において,2010年WHO分類に準じてMANECが導入された.
MANECの発生機序に関しては,一般に以下の四つの可能性が考えられている.①同時性に二つの異なった細胞成分からなる腫瘍が発生する,②一つの多分化能細胞から二つの成分を含んだ腫瘍が発生する,③腺癌の一部がNECへ変化する,④NECの一部が腺癌へ変化する.これらの説の中では,腺癌成分は主に原発巣に近い粘膜内に存在し,NEC成分は粘膜下層以深で認められることが多いことから粘膜に発生した腺癌が増殖浸潤の過程でNECへ変化する③の説が有力とされている6).また,石井ら7)は電子顕微鏡を用いて腺内分泌細胞癌を観察したところ,二つの成分の境界部で腺癌成分が内分泌細胞の構造を持つことを証明し,③の説を支持している.
肝外胆管原発MANECの報告例は少なく,医学中央雑誌で1977年から2015年までの期間で「内分泌細胞癌」,「腺内分泌細胞癌」,「混合型腺内分泌細胞癌」,「肝外胆管」をキーワードとして,またPubMedで1950年から2015年までの期間で 「mixed adenoneuroendocrine carcinoma」,「adenoendocrine cell carcinoma」,「extrahepatic bile duct」 をキーワードとして検索を行ったところ(会議録は除く),NECと腺癌の両方を含む腫瘍の報告例として,自験例を含め34例が検索しえた(Table 1)3)4)8)~35).年齢中央値は66歳(41~85歳),男女比は23:11であった.予後に関して記載があったのは30例で,術後生存期間中央値は9か月(3~80か月)であった.全例に手術療法が施行されており,根治度評価に関して記載のあった26例中,R0切除は18例(69%)で達成されており,そのうち予後の記載のあった15例の術後生存期間中央値は13か月(3~47か月)であった.
Table 1
Reported cases of mixed adenoneuroendocrine carcinoma and adenoendocrine cell carcinoma of the extrahepatic bile duct
| No |
Author |
Year |
Age/Sex |
Location |
Operation |
Pathology |
Lymph node metastasis |
R |
Postoperative chemotherapy |
Recurrent pattern |
Prognosis |
| 1 |
Miyoshi8) |
1994 |
75/F |
BdPh |
PD |
AECC |
− |
0 |
ND |
Liver |
9M Death |
| 2 |
Takimoto9) |
1996 |
65/M |
BpdC |
PD |
AECC |
ND |
2 |
not done |
— |
3M Death |
| 3 |
Tanaka10) |
1999 |
62/M |
Bd |
ND |
AECC |
ND |
ND |
ND |
Liver, Brain |
80M Alive |
| 4 |
Nishie11) |
2000 |
67/M |
Bd |
PPPD |
AECC |
+ |
0 |
ND |
Liver, Diaphragm, Subcutaneous tissue |
47M Alive |
| 5 |
Edakuni12) |
2001 |
82/F |
BdPh |
PPPD |
AECC |
+ (NET, AC) |
0 |
not done |
— |
45M Alive |
| 6 |
Kaito13) |
2001 |
64/F |
Bd |
PD |
AECC |
ND |
ND |
not done |
Liver |
9M Death |
| 7 |
Ohta14) |
2001 |
74/M |
Bd |
PPPD |
AECC |
− |
0 |
ND |
— |
22M Alive |
| 8 |
Ueshima15) |
2003 |
71/M |
Bp |
PD |
AECC |
ND |
ND |
ND |
Liver |
6M Death |
| 9 |
Okimura16) |
2003 |
53/M |
Bd |
PPPD |
MANEC |
ND |
ND |
ND |
Liver |
3M Death |
| 10 |
Nishimura17) |
2004 |
62/M |
BpdC |
PPPD |
AECC |
+ |
0 |
not done |
Liver |
7M Death |
| 11 |
Shinchi18) |
2005 |
73/M |
Bp |
PD |
AECC |
− |
0 |
UFT |
Liver |
4M Death |
| 12 |
Sato19) |
2005 |
68/M |
Bd |
PD |
AECC |
− |
0 |
ND |
Liver |
3M Death |
| 13 |
Mori20) |
2005 |
76/F |
Bpd |
BDR |
AECC |
+ (NEC) |
1 |
UFT |
Liver |
22M Death |
| 14 |
Kurozumi21) |
2006 |
59/M |
Bd |
PPPD |
AECC |
+ (NEC) |
0 |
ND |
— |
14M Alive |
| 15 |
Mikami22) |
2006 |
75/F |
BdPh |
PD |
AECC |
− |
0 |
not done |
— |
28M Alive |
| 16 |
Endo23) |
2008 |
66/M |
Bd |
PD |
AECC |
− |
0 |
GEM |
Liver |
34M Alive |
| 17 |
Yamada24) |
2009 |
64/M |
Bd |
PPPD |
AECC |
− |
0 |
ND |
Liver |
12M Death |
| 18 |
Sakurai25) |
2009 |
65/F |
Bpd |
HBR |
AECC |
− |
2 |
not done |
Diaphragm, Remnant liver, Pancreas, Rt. Adrenal gland |
5M Death |
| 19 |
Yamada26) |
2009 |
58/M |
Bd |
PD |
AECC |
− |
2 |
GEM |
— |
9M Death |
| 20 |
Kanno27) |
2010 |
62/M |
BdPhD |
PD |
AECC |
+ (NEC) |
2 |
GEM |
Liver |
5M Death |
| 21 |
Yoshida28) |
2010 |
63/F |
Bd |
PPPD |
AECC |
− |
0 |
CE |
Liver, Bone |
13M Alive |
| 22 |
Masui29) |
2011 |
82/M |
Bdp |
BDR |
MANEC |
− |
0 |
ND |
Liver |
6M Death |
| 23 |
Arakawa30) |
2012 |
85/M |
Bd |
PD |
AECC |
+ |
1 |
ND |
— |
3M Alive |
| 24 |
Harada3) |
2012 |
60/M |
ND |
ND |
MANEC |
+ (NET) |
ND |
ND |
ND |
ND |
| 25 |
Harada3) |
2012 |
80/F |
ND |
ND |
MANEC |
− |
ND |
ND |
ND |
ND |
| 26 |
Onishi31) |
2013 |
74/F |
Bd |
PPPD |
MANEC |
− |
ND |
ND |
ND |
ND |
| 27 |
Lee32) |
2014 |
75/M |
Bpd |
HBR |
MANEC |
− |
ND |
ND |
— |
11M Alive |
| 28 |
Wakabayashi4) |
2014 |
75/M |
Bp |
HPD |
MANEC |
+ (NEC) |
0 |
GEM |
Liver |
5M Death |
| 29 |
Hong33) |
2015 |
59/M |
Bd |
BDR |
MANEC |
− |
0 |
ND |
ND |
ND |
| 30 |
Hong33) |
2015 |
41/F |
BdPh |
PD |
MANEC |
+ |
0 |
ND |
ND |
ND |
| 31 |
Hong33) |
2015 |
57/M |
Bd |
BDR |
MANEC |
− |
0 |
ND |
ND |
ND |
| 32 |
Shinoto34) |
2015 |
78/M |
BdPhD |
SSPPD |
AECC |
+ (NEC) |
2 |
not done |
Liver |
5M Death |
| 33 |
Waku35) |
2015 |
62/M |
Bd |
PD |
MANEC |
− |
1cis |
CDDP+5-FU |
Liver |
6M Death |
| 34 |
Our case |
|
71/F |
BdPhC |
SSPPD |
MANEC |
+ (AC) |
0 |
CDDP+CPT-11 |
Liver |
13M Alive |
PD: pancreatoduodenectomy, PPPD: pylorus preserving pancreatoduodenectomy, BDR: bile duct resection, HBR: hepatectomy and bile duct resection, HPD: hepatopancreatoduodenectomy, SSPPD: subtotal stomach-preserving pancreaticoduodenectomy, AECC: adenoendocrine cell carcinoma, MANEC: mixed adenoneuroendocrine carcinoma, NEC: neuroendocrine carcinoma, NET: neuroendocrine tumor, ND: not described
報告例34例の中で,Ki-67 indexと各成分比率が記載されており,肝外胆管原発MANECと診断可能な報告例は,自験例も含め12例であった.12例中10例に術式に関する記載があり,膵頭十二指腸切除術(幽門輪温存膵頭十二指腸切除術,亜全胃温存膵頭十二指腸切除術を含む)が5例と最も多かったが,肝切除術+胆管切除術から胆管切除術まで多様であり,腫瘍の主座と根治性を考慮し選択されたものと推察された.術後化学療法に関して,12例中3例で記載があり,gemcitabine単剤,CDDP+5-FU,もしくはCPT-11と内容は全て異なるものであった.予後に関して,12例中6例で記載があり,術後生存期間中央値は6か月(3~13か月)であった.また,再発形式に関して,12例中5例で記載があり,全て肝転移再発であった.
消化器に発生したNECの予後が悪いことは以前から多数の報告がなされている36).今回の検討では,肝外胆管原発で腺癌とNECが混在した症例の生存期間中央値は9か月(3~80か月)と予後不良であった.一方,若林ら4)の報告では肝外胆管原発NEC 37例を検討しており,その中で腺癌の混在を認めないもののうち予後に関して記載のあった12例の術後生存期間中央値は9か月(2~20か月)であった.これらのことより,腺癌を含むか否かは予後に大きく影響せず,NEC成分の存在が予後を規定しているものと考えられた.ただし,腺内分泌細胞癌の報告例の中には45~80か月の長期にわたり生存した報告例11)~13)を認めた.治療に関して詳細な記載がない例もあり単純に比較はできないが,MANECの報告例には同様の長期生存例は認めず,前述の長期生存報告例にはKi-67 indexの値が低い低悪性度の腫瘍が含まれていた可能性や,悪性度の高いNEC成分の割合が少なく胆道癌取扱い規約第6版1)では腺癌と分類される腫瘍が含まれている可能性が考えられた.
NECの治療に関して,本邦では2015年に膵・消化管神経内分泌腫瘍診療ガイドライン37)が作成されており,海外においては米国を中心とした多施設が共同でガイドライン38)を作成している.いずれのガイドラインにおいても同様の治療が推奨されており,膵・消化管NETに対しては,治癒切除可能な場合は,リンパ節郭清を伴う定型的切除術が推奨されており,同NECに対しては小細胞肺癌に準じ,白金製剤をベースとする併用療法が治療選択肢に挙げられている.NECに対する化学療法についての検討は,消化管NECに対する治療成績をまとめたNORDIC NEC study39)や,本邦の多施設での治癒切除不可能な消化器NECに対する化学療法の成績をまとめたYamaguchiら40)の報告があり,プラチナ製剤を用いた,CPT-11+CDDP(以下,IP療法と略記)などの肺小細胞癌に対する治療に準じた化学療法の有効性を報告している.しかし,今回検索しえた症例の中で,肝外胆管原発MANECに対してIP療法を施行している症例は自験例のみであった.自験例が報告例の術後生存期間中央値を超えて,術後13か月時点で生存していることを考慮すると肝外胆管原発MANECに対しても他の消化管NECと同様にIP療法が有効である可能性が示唆された.
MANECは深部にNEC成分が含まれていることが多く,擦過細胞診などの術前検査でNEC成分が検出されることはまれである25).自験例においても術後に経乳頭的胆道鏡下腫瘍生検の組織像を再検討したが,NEC成分は認められなかった.この理由から肝外胆管原発MANECに対して多くの症例で胆管癌の術前診断で,手術加療が先行されているが,再発率の高さや,根治術施行(R0切除)が可能な症例においても予後が数か月程度である症例が多いことを考慮すると,術後速やかにNECに準じた化学療法を導入することが極めて重要と思われた.一方,馬場ら41)は切除不能胆道系NECに対して,化学放射線療法施行後に根治術を施行し,長期生存が得られている症例を報告しており,治癒切除不能なNECに対する手術治療を含めた集学的治療の有用性を論じている.このことも踏まえ,術前にNEC細胞が証明された場合には,治癒切除可能であっても化学療法によるsystemic therapyを行い,病勢コントロール可能な症例に対して手術治療を施行するといった治療方法も肝外胆管原発MANECの治療方針として検討されるべきと考えられた.
稿を終えるにあたり,本論文の病理学的所見についてご教示,ご指導いただいた弘前大学大学院医学研究科病理生命科学講座の吉澤忠司先生,鬼島 宏先生に深謝いたします.
利益相反:なし
文献
- 1) 日本肝胆膵外科学会編.胆道癌取扱い規約.第6版.東京:金原出版;2013. p. 40–45.
- 2) Bosman FT, Carneiro F, Hruban RH, Theise ND, editors. WHO classification of tumours of the digestive system. 4th ed. Lyon: IARC Press; 2010.
- 3) Harada K, Sato Y, Ikeda H, Maylee H, Igarashi S, Okamura A, et al. Clinicopathologic study of mixed adenoneuroendocrine carcinomas of hepatobiliary organs. Virchows Arch. 2012;460(3):281–289.
- 4) 若林 俊樹, 佐藤 勤, 新保 知規, 藤田 正太, 太田 栄, 伊藤 誠司,ほか.広範囲胆管癌に発生した混合型腺神経内分泌癌の1例.日本臨床外科学会雑誌.2014;75(7):1994–2000.
- 5) 日本肝胆膵外科学会編.胆道癌取扱い規約.第5版.東京:金原出版;2003. p. 55–58.
- 6) 岩渕 三哉, 佐野 壽昭.消化管(肝,胆管を含む)の内分泌細胞腫瘍.病理と臨床.1999;17:1253–1262.
- 7) 石井 龍宏, 上平 裕樹, 渡辺 良平, 大森 克介, 宮田 信熈, 園部 宏,ほか.早期発見しえた胆嚢原発腺内分泌細胞癌の1例.日本消化器外科学会雑誌.2000;33(3):352–356.
- 8) 三好 広尚, 中澤 三郎, 山雄 健次, 乾 和郎, 印牧 直人, 藤本 正夫,ほか.明瞭な画像が得られた胆管小細胞癌の1例.腹部画像診断.1994;14:1136–1142.
- 9) 瀧本 篤, 遠藤 格, 疋田 草生子, 渡会 伸治, 仲野 明, 嶋田 紘,ほか.胆管原発小細胞癌(神経内分泌癌)の1例.胆道.1996;10(5):390–396.
- 10) Tanaka M, Shibui S, Nomura K, Nakanishi Y. Brain metastases from adenoendocrine carcinoma of the common bile duct: a case report. Jpn J Clin Oncol. 1999;29(5):252–255.
- 11) 西江 浩, 水澤 清昭, 小川 東明, 渡部 博昭, 坂谷 貴司.PTCD経路に播種性転移をきたした胆管内分泌細胞癌の1例.日本臨床外科学会雑誌.2000;61(4):1044–1047.
- 12) Edakuni G, Sasatomi E, Satoh T, Tokunaga O, Miyazaki K. Composite glandular-endocrine cell carcinoma of the common bile duct. Pathol Int. 2001;51(6):487–490.
- 13) 海渡 裕郎, 鳥居 明, 藤川 透, 中村 剛, 小山 隆三.CKアノマリー,NSE著明高値を示した総胆管原発腺内分泌細胞癌の1例.日本内科学会雑誌.2001;90(8):1525–1527.
- 14) 太田 岳洋, 吾妻 司, 高崎 健, 板橋 正幸.胆管腺内分泌細胞癌の1例.胆道.2001;55:2115–2120.
- 15) 植嶋 しのぶ, 植嶋 輝久, 山村 章次, 山根 哲実, 工藤 浩史.PTCD細胞診で診断し得た総胆管腺内分泌細胞癌の1例.鳥取赤十字病院医学雑誌.2003;12:33–36.
- 16) 沖村 明, 西上 隆之, 中正 恵二, 高梨 忠朗, 大江 正之, 嵯峨山 健,ほか.総胆管下部に発生した腺内分泌細胞癌の1例.診断病理.2003;20:50–54.
- 17) 西村 淳, 河内 保之, 永橋 昌幸, 牧野 成人, 新国 恵也, 清水 武昭.胆管腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2004;65(6):1659–1662.
- 18) 新地 洋之, 高尾 尊身, 前村 公成, 瀧川 譲治, 大井 恭代, 愛甲 孝.総胆管原発の腺内分泌細胞癌の1例.日本消化器外科学会雑誌.2005;38(2):179–184.
- 19) 佐藤 勝明, 上見 嘉子, 河村 常作, 谷本 一夫, 岡崎 恵子, 上田 善道,ほか.大細胞神経内分泌癌成分を伴う下部胆管原発腺内分泌細胞癌の1例.日本臨床細胞学会雑誌.2005;44(5):314–318.
- 20) 森 俊治.中部胆管原発の腺内分泌細胞癌.胆道.2005;19(4):477–481.
- 21) 黒住 和史, 小関 萬里, 畑中 信良, 森藤 清彦, 本下 潤一, 谷山 清己.胆管腺内分泌細胞癌の1例.外科.2006;68(3):347–351.
- 22) 三上 和久.膵腫瘍との鑑別が困難であった胆管原発内分泌細胞癌の1切除例.胆と膵.2006;27:335–341.
- 23) 遠藤 良幸, 中村 泉, 小山 善久.症例 下部胆管に発生した腺内分泌細胞癌の1例.癌の臨床.2008;54(3):209–214.
- 24) 山田 恭子, 永野 靖彦, 國崎 主税, 池 秀之, 今田 敏夫, 嶋田 紘.下部胆管原発腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2009;70(1):184–189.
- 25) 桜井 直樹, 飯澤 肇, 田村 元.胆管腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2009;70(4):1177–1180.
- 26) 山田 達治, 上松 俊夫, 根東 順子, 平田 明裕.下部胆管に発生した腺内分泌細胞癌の1例.胆と膵.2009;30:907–912.
- 27) 菅野 敦, 佐藤 賢一, 廣田 衛久, 正宗 淳, 高舘 達之, 力山 敏樹,ほか.術前に診断し得た下部胆管原発腺内分泌細胞癌の1例.胆道.2010;24(5):714–722.
- 28) 吉田 龍一, 八木 孝仁, 貞森 裕.臨床の実際 下部胆管原発腺内分泌細胞癌の一例.外科治療.2010;102(4):416–418.
- 29) Masui T, Doi R, Kawaguchi Y, Iwanaga Y, Ito T, Koizumi M, et al. Adenoendocrine cell carcinoma of the extrahepatic bile duct: a case report and review of the literature. Clin J Gastroenterol. 2011;4(3):174–178.
- 30) 荒川 和久, 小川 哲史, 安東 立正, 富澤 直樹, 須納瀬 豊, 竹吉 泉.肝腸間膜動脈幹由来の総肝動脈が膵内を走行した胆管腺内分泌細胞癌の1例.日本臨床外科学会雑誌.2012;73(3):673–676.
- 31) Onishi I, Kitagawa H, Harada K, Maruzen S, Sakai S, Makino I, et al. Intraductal papillary neoplasm of the bile duct accompanying biliary mixed adenoneuroendocrine carcinoma. World J Gastroenterol. 2013;19(20):3161–3163.
- 32) Lee SW, Lee IS, Cho YK, Park JM, Kim SW, Choi MG, et al. A case of mixed adenoneuroendocrine carcinoma of the common bile duct. Korean J Pathol. 2014;48(6):466–468.
- 33) Hong N, Kim HJ, Byun JH, Kim SY, Kim KW, Kim JH, et al. Neuroendocrine neoplasms of the extrahepatic bile duct: radiologic and clinical characteristics. Abdom Imaging. 2015;40(1):181–191.
- 34) 篠藤 浩一, 大島 郁也, 尾崎 正彦.下部胆管原発腺内分泌細胞癌の1例.外科.2015;77(6):735–738.
- 35) 和久 利彦, 大多和 泰幸, 藤本 善三, 佐藤 直広, 鷲尾 一浩, 神原 健,ほか.下部胆管mixed adenoneuroendocrine carcinomaの1例.胆と膵.2015;36(2):183–188.
- 36) 岩渕 三哉, 渡辺 英伸.消化管カルチノイド腫瘍 最近の考え方.外科.1996;58:1305–1312.
- 37) 日本神経内分泌腫瘍研究会(JNETS),膵・消化管神経内分泌腫瘍診療ガイドライン作成委員会編.膵・消化管神経内分泌腫瘍(NET)診療ガイドライン.第1版.東京:金原出版;2015. p. 58–121.
- 38) NCCN Clinical Practice Guideline in Oncology, neuroendocrine tumors [Internet]. Washington: National Comprehensive Cancer Network; 1998 Mar [cited 2016 Jan 29]. Available from: http://www.nccn.org/professionals/physician_gls/f_guidelines.asp
- 39) Sorbye H, Welin S, Langer SW, Vestermark LW, Holt N, Osterlund P, et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): The NORDIC NEC study. Ann Oncol. 2013;24:152–160.
- 40) Yamaguchi T, Machida N, Morizane C, Kasuga A, Takahashi H, Sudo K, et al. Multicenter retrospective analysis of systemic chemotherapy for advanced neuroendocrine carcinoma of the digestive system. Cancer Sci. 2014;105(9):1176–1181.
- 41) 馬場 英, 古家 乾, 小泉 忠史, 葛西 健二, 定岡 邦昌, 関谷 千尋,ほか.長期生存が得られている胆道系に発生した神経内分泌癌の2例.日本消化器病学会雑誌.2012;109(9):1598–1607.