Abstract
筋強直性ジストロフィー症(myotonic dystrophy;以下,MDと略記)は,全身麻酔下の手術で,呼吸器合併症を引き起こしやすいとされる.症例は51歳の女性で,食事摂取不良を主訴に近医受診した.既往にMDがあった.血液検査ではHb 8.0 g/dlと貧血を認めた.また,術前の呼吸機能検査ではVC 0.93 l,%VC 37.8と拘束性換気障害を認めた.精査にて臨床病期はcStage IIIAと診断し,治療は,食事摂取困難,貧血という症状を有することから,手術を選択した.胃全摘術,D1+郭清,Roux-en-Y再建,腸瘻造設を施行した.麻酔は,全身麻酔に硬膜外麻酔を併用した.プロポフォールで導入し,筋弛緩は導入時に単回投与で,手術終了時に抜管した.術後は第3病日から経管栄養開始,第5病日に食事開始し,特に合併症はなく,第16病日に退院した.MD患者に合併した胃癌手術例の報告はまれであり報告する.
はじめに
筋強直性ジストロフィー症(myotonic dystrophy;以下,MDと略記)は体幹,四肢近位筋の筋強直症状を主体とする疾患で,心肺疾患や腫瘍を含めさまざまな疾患を併存しやすいとされる1).石灰化上皮腫や耳下腺良性腫瘍などの併存が多く報告されるも2)3),悪性腫瘍などの併存の報告はまれである.また,全身麻酔下での手術では,呼吸器合併症を引き起こしやすく,慎重な麻酔管理を要する4)5).
今回,我々はMDに併存した胃癌の手術症例を経験したため,文献的考察を加え報告する.
症例
患者:51歳,女性
主訴:食事摂取不良
既往歴:20年程前にMDの診断.四肢筋力低下,歩行障害を認める.拘束性換気障害も指摘されていた.
家族歴:特記すべき事項なし.
現病歴:上記主訴あり,前医受診された.上部消化管内視鏡検査にて胃体中部に潰瘍性病変認め,生検group V,胃癌の診断で当科紹介された.
血液検査所見:Hb 8.0 g/dl.血液ガス所見:PO2 67.5 mmHg,PCO2 46.7 mmHg.
呼吸機能検査所見:1秒量0.86 l,1秒率95.6%,肺活量(VC)0.93 l,%VC 37.8と拘束性換気障害を認めた.
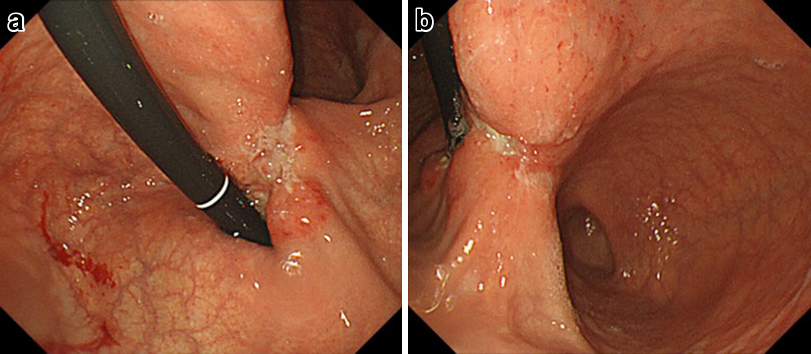
上部消化管内視鏡検査所見:胃角部に著明な小彎短縮と壁硬化,中心に潰瘍を伴う易出血性の辺縁不明瞭な陥凹性病変を認めた(Fig. 1).生検でAdenocarcinoma,por2>tub2であった.
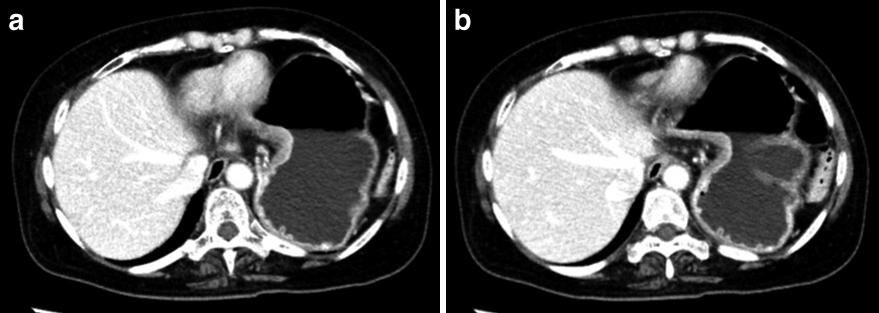
腹部CT所見:胃体部小彎に造影効果を伴う壁肥厚を認めた.胃小彎側には,小さいながらも転移を疑うリンパ節腫脹を認めた(Fig. 2).他臓器転移はなく,臨床病期はcStage IIIAと診断した.
治療:MDによる換気障害から,手術に伴う危険性は高かった.しかし,貧血や食事摂取不良といった症状を有すること,本人,家族ともに手術治療を希望されたことから,手術の方針とした.手術は胃全摘術,D1+郭清,Roux-en-Y再建,腸瘻造設を施行した.手術時間は2時間41分,術中出血量は25 gであった.
麻酔方法:全身麻酔に硬膜外麻酔を併用した.プロポフォールで導入し,筋弛緩は導入時に単回投与した.手術終了後,筋弛緩薬の拮抗薬を投与し,抜管後に集中治療室(intensive care unit;以下,ICUと略記)へ帰室した.
切除標本所見:胃体上部から中部に存在する65×40 mmの5型病変であった(Fig. 3).
病理組織学的検査所見:組織型Adenocarcinoma,por2>tub2>muc(undiff.).壁深達度はpT4a(SE)まで達していた(Fig. 4).リンパ節転移は#2,#3a,#3b,#4sb,#4d,#6,#7,#9に認めた(24/38,pN3b).以上から,総合病期Stage IVaであった.
術後経過:術前の換気障害から術当日~第2病日までICU管理を行った.術前から高度の換気障害を認めていたため,無気肺の遷延からの肺炎発症は致命的リスクと考え,術後抜管時に輪状甲状切開を行い,Mini-Trach II®を挿入し,咳嗽の誘発,頻回な吸痰を行った.呼吸状態や疼痛管理に問題のないことを確認し,一般病棟帰室とした.離床は,リハビリテーション科に術前から腹式呼吸法の指導を依頼し,さらに第1病日からリハビリテーションを再開した.また,今回の手術では,術前から食事摂取不良による低栄養があることや,術後も嚥下能の低下や,自力での経口摂取が困難になる可能性を考慮して,腸瘻を造設した.第3病日から経腸栄養を開始した.第5病日に経口摂取を開始し,呼吸器合併症を起こすことなく,第16病日に自宅退院となった.退院後2か月は経腸栄養を併用されていたが,その後は経口摂取のみで経腸栄養は中止可能となった.現在術後10か月経過も再発は認めず,前医で経過観察中である.
考察
MDは,罹患率は10万人に数人とまれな常染色体優性遺伝疾患であり,1909年にSteinertらにより初めて報告された筋強直・筋委縮を主体とする疾患である6).さらに,中枢神経障害(発達障害,認知障害),呼吸障害,心疾患(心伝導障害,心筋障害),眼症状(白内障,網膜変性症),内分泌異常(糖尿病,高脂血症)など多彩な全身症状を呈する.症状の程度には個人差があり,第19番染色体長腕のミオトニンキナーゼをコードしている遺伝子の3’側非翻訳領域内に存在する,CTGの反復数と臨床的重症度はほぼ相関するといわれている.
以前よりMDには腫瘍が併存しやすいといわれている.医学中央雑誌(1970年~2017年)において,「筋強直性ジストロフィー」,「腫瘍」で,会議録を除き検索したところ,石灰化上皮腫などの良性腫瘍を中心として97件の報告あり,関連性は高いと思われる.一方で,「筋強直性ジストロフィー」,「胃癌」で検索すると,自験例を含めて7例であった(Table 1)7)~12).日本の2017年胃癌罹患数は132,800人であり,総人口の0.1%になる.一方で,島ら13)は全国レベルのアンケート調査でMD患者1,873人中,胃癌は7例(0.4%)に併存したと報告している.MDの罹患自体が少ないため,本症例はMDと胃癌を併存した比較的まれな1例といえる.現在までにMDと発癌の遺伝的関連については明らかではない.
Table 1
Reported cases of MD with gastric cancer in the Japanese literature
| No. |
Author/Year |
Age/Sex |
Operative method |
Postoperative complication |
| 1 |
Yatabe7)/1999 |
49/M |
None |
None |
| 2 |
Kasai8)/2002 |
50/M |
Total gastrectomy |
None |
| 3 |
Suzuki9)/2003 |
50/M |
Distal gastrectomy |
None |
| 4 |
Taniguti10)/2010 |
61/M |
Distal gastrectomy |
Respiratory failure |
| 5 |
Shimada11)/2014 |
32/F |
Endoscopic resection |
Respiratory failure |
| 6 |
Umeda12)/2016 |
44/M |
Distal gastrectomy |
Respiratory failure |
| 7 |
Our case |
51/F |
Total gastrectomy |
None |
MD症例の死因のうち,悪性腫瘍による割合は5%で,肺炎や呼吸器合併症が最も多いと報告されている14).呼吸機能については呼吸筋の委縮のため,横隔膜挙上や拘束性換気障害などの特徴的な所見を認める.したがって,術後に慢性的呼吸抑制から無気肺を合併し,人工呼吸器管理の継続が必要となる場合が多い4).
本症例でも,前医に数年前から拘束性換気障害の合併を本人は知らされており,術後の肺炎は致死的な合併症になりうると考えていた.よって,術後肺炎予防のために,術前から当院口腔外科に受診し,周術期口腔ケアを行い,さらには術後抜管時に輪状甲状切開を行い,Mini-Trach II®の挿入をした.これにより,積極的に咳躁を促し,頻回に吸痰を行った.結果,肺炎など呼吸器疾患の合併なく経過した.
また,麻酔管理において,筋弛緩薬はMDの病期進行により,感受性が増加して作用が遷延しやすいため,投与量を減量する必要がある12)15).本症例においても麻酔導入時に通常量の3分の1程度の筋弛緩薬を投与するも,追加投与は行わなかった.長期人工呼吸器管理は,呼吸筋をより脆弱化する可能性もあるため,術後,術前同様の換気状態を確認し,麻酔科に抜管を依頼した.
吸入麻酔薬は,筋肉の不随意収縮から筋強直が誘発されることがあり,完全静脈麻酔を推奨される.プロポフォールが調節性にすぐれることから,MD患者に使用される報告が多い16).本症例においてもプロポフォールで導入,維持管理を行った.
全身麻酔下で悪性腫瘍の手術がされたMD患者で,術前はMDの診断がついておらず,術後にMDと診断された報告例を3例認めた(Table 1,No. 4,5,6.)が,その内3例とも術後の呼吸器合併症をきっかけとして,精査の結果MDと診断されていた.術前にMDと診断し,その重症度を判断のうえ,麻酔科と連携をとり,周術期管理を行うことが,合併症の軽減につながることが示唆される.MD患者における呼吸器合併症の危険因子としては,Mathieuら5)が「MD 219例における手術後呼吸器合併症の発生リスクに関する研究」を行い,術後呼吸器合併症を発症した16例のリスク因子として,①手術施行時の年齢が37歳以上,②近位筋に及ぶ筋力の低下,③上腹部手術の3項目をあげている.本症例は全項目に当てはまるも,こうしたリスクを術前に評価し,対策を行うことで,問題なく自宅退院可能であったと考えられる.
現在,MD患者の平均寿命が50歳半ばであることから13),年齢的に悪性腫瘍との併存が少なかったものと考えられる.一方で,今後呼吸循環管理の進歩により,MD患者の生存期間が延長した場合,本症例のような手術例に遭遇する機会が増加するものと思われ,対応を検討しておく必要があると考えられる.
利益相反:なし