2020 Volume 53 Issue 1 Pages 8-15
2020 Volume 53 Issue 1 Pages 8-15
ソマトスタチン受容体シンチグラフィ(somatostatin receptor scintigraphy;以下,SRSと略記)は神経内分泌腫瘍の診断に用いられるが,本邦での臨床経験はまだ少ない.今回,SRSで集積を示した腎癌膵転移の1例を経験した.症例は79歳の女性で,左腎癌に対して左腎摘出術を施行している.術後19年目の単純CTで膵体部に腫瘤性病変を認め,過去のCTを再検討したところ術後12年目のダイナミックCTで膵体部に動脈相で濃染する腫瘤性病変を認め,徐々に増大傾向を認めた.精査目的に施行したSRSで腫瘤全体に集積亢進を認めたため,膵神経内分泌腫瘍を第一に疑い膵体尾部切除術を施行した.組織学的には淡明な胞体を含む腫瘤で,腎癌(淡明細胞癌)の膵転移と診断した.SRSは,神経内分泌腫瘍以外の腫瘍にも集積を示すことがあり,腫瘍の鑑別診断に用いる際には注意する必要がある.
Somatostatin receptor scintigraphy (SRS) is used to diagnose neuroendocrine tumors, but its clinical use in Japan remains limited. We encountered a case of pancreatic metastasis of renal cancer showing accumulation on the SRS. A 79-year-old woman underwent a left nephrectomy for cancer of the left kidney. A simple CT follow-up conducted 19 years after the operation revealed a mass-like lesion in the pancreatic body, and previous CT images were reviewed. This review showed that the dynamic CT conducted 12 years after the operation, had revealed a mass-like lesion in the pancreatic body that was heavily stained in the arterial phase, which gradually increased over time. Close examination using SRS showed increased accumulation throughout the tumor. A pancreatic neuroendocrine tumor was first suspected, and a distal pancreatectomy was performed. Histologically, the tumor contained a clear vesicle, which was diagnosed as pancreatic metastasis of renal cancer (clear cell carcinoma). SRS could indicate the accumulation in tumors other than neuroendocrine tumors; hence, caution must be exercised during the differential diagnosis of tumors with SRS.
ソマトスタチン受容体シンチグラフィ(somatostatin receptor scintigraphy;以下,SRSと略記)は,ソマトスタチンアナログであるペンテトレオチドを放射線インジウム111(111In)で標識した放射線性薬剤を用いた検査である.SRSではソマトスタチン受容体(somatostatin receptor;以下,SSTRと略記)が高頻度に発現する神経内分泌腫瘍(neuroendocrine tumor;以下,NETと略記)に対して特異的集積を認めることから,諸外国においての診断に際して20年以上使用されてきた.本邦では長らく未承認であったが2016年1月より実施可能となった.他の画像診断でNETを疑う場合にSRSは行われ,病巣検出力が高いことから,術前の病巣診断や転移診断などに使われるが,疑陽性となる症例も存在する1).SRSで集積を示した腎癌膵転移の1例を経験したので報告する.
患者:79歳,女性
主訴:特になし.
既往歴:19年前,左腎癌に対して左腎摘出術を施行された.
現病歴:19年前,左腎癌に対して左腎摘出術を施行され,以後当院泌尿器科でCTによる定期フォローアップを受けていた.腎機能障害を認め,ダイナミックCTは腎癌術後12年目が最終であり,以後単純CTでのフォローアップとなっていた.今回,腎癌術後19年目の定期フォローCTで膵体部に23 mm大の腫瘤を認めた.過去のCTを再検討すると腎癌術後12年目のダイナミックCTで膵体部に動脈相で濃染する4 mm大の腫瘤を指摘することができ,術後14年目の単純CTでも膵体部に15 mm大の腫瘤性病変を指摘することができた.以後の定期フォローCTでは腫瘤の増大傾向を認めており,膵悪性腫瘍の疑いで当科紹介受診となった.
現症:身長142 cm,体重48.5 kg.結膜貧血なし.黄疸なし.心音整,呼吸音清.腹部に腫瘤を触れなかった.
検査所見:Hb 10.8 g/dlと軽度貧血とCr 1.19 mg/dl(eGFR:33.9 ml/min/1.73 m2)と腎機能障害を認めたが,他の生化学検査は異常を認めなかった.CEA,CA19-9は正常範囲内であった.グルカゴン,5-HIAA,インスリン,ガストリン,PTH intact,カルシトニンなどの内分泌学的検査も異常を認めなかった.
超音波内視鏡検査所見:膵体部に26 mm大の境界明瞭で内部が低エコーな腫瘤性病変を認めた.被膜は明らかではなかった.
腹部ダイナミックCT所見(腎癌術後12年目):膵体部に動脈相で濃染する4 mm大の腫瘤性病変を認めた(Fig. 1).

Abdominal dynamic CT (12th year after renal cell carcinoma surgery). A mass-like lesion that heavily stained in the arterial phase was observed in the pancreatic body.
腹部単純CT所見(腎癌術後19年目):膵体部に前方頭側に膨隆する23 mm大の腫瘤性病変を認めた.術後14年目の単純CTでも膵体部に15 mm大の腫瘤性病変を指摘でき,徐々に増大傾向を認めた(Fig. 2).
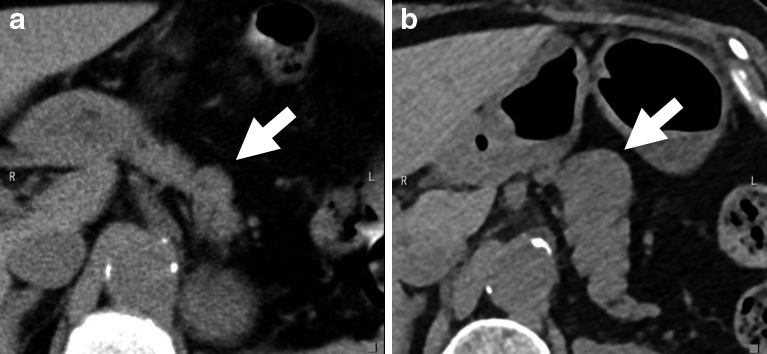
Abdominal CT. a: 14th postoperative year, b: 19th postoperative year. A mass-like lesion in the pancreatic body that bulged toward the anterior side of the head showed a gradual tendency to increase.
腹部MRI所見:膵体部に頭側へ突出する23 mm大のT2強調像で不均一な軽度高信号,T1強調像で等信号,拡散強調像で淡い高信号を呈す腫瘤を認めた(Fig. 3).脂質成分ははっきりしなかった.
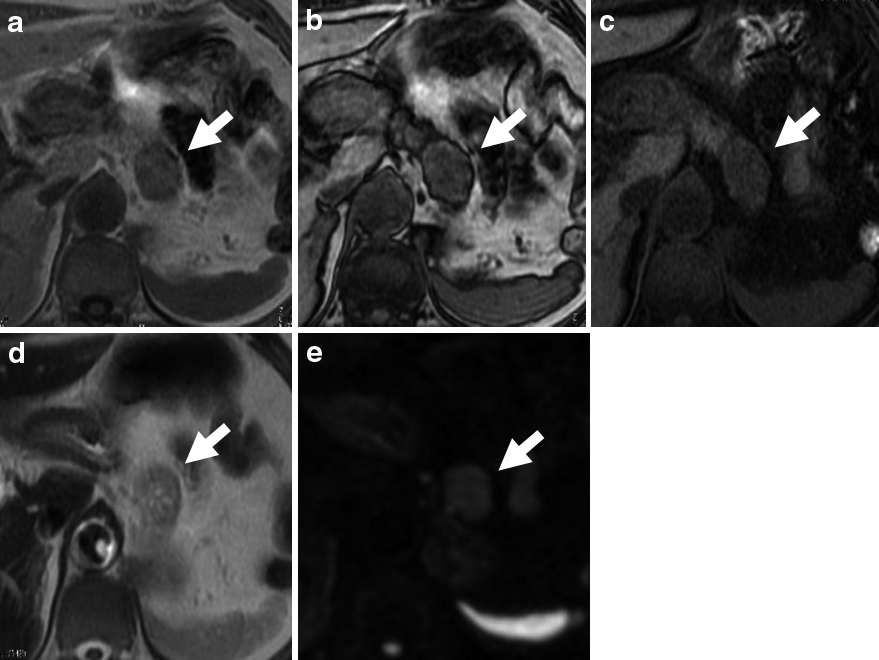
Abdominal MRI. a: T1-weighted image (in-phase). b: T1-weighted image (opposed-phase). c: Fat suppression T1-weighted image (CHESS), d: T2-weighted image. e: Diffusion weighted image. A 2.3 cm-sized mass protruding toward the head of the pancreatic body for which a nonuniform mild high signal intensity was noted on T2-weighted imaging, an iso-signal intensity on T1-weighted imaging, and a mild high signal intensity on diffusion-weighted imaging. The lipid component was unclear.
ソマトスタチン受容体シンチグラフィ所見:膵体部の腫瘤に一致し4時間後相,24時間後相で集積を認めた(Fig. 4).転移を疑う異常集積は認めなかった.
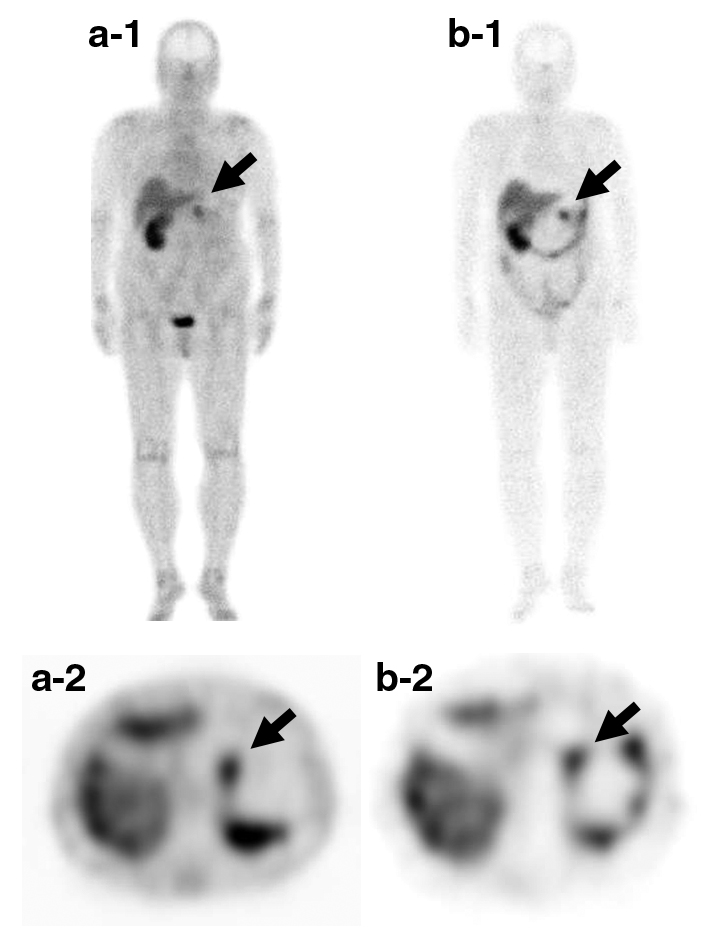
Somatostatin receptor scintigraphy. a-1, a-2: after 4 hours-phase. b-1, b-2: after 24 hours-phase. Accumulation was observed in the pancreatic body after a 4 hour- and 24-hour phase.
以上より,非機能性膵内分泌腫瘍を第一に疑い,脾合併膵体尾部切除術リンパ節郭清の適応とした.
手術所見:膵体部に20 mm程度の弾性,軟な腫瘍を認め脾合併膵体尾部切除術リンパ節郭清を施行した.また,胆囊結石があり,胆囊摘出術も施行した.手術時間は4時間39分,出血量は421 gであった.
病理組織学的検査所見:膵体部に25 mm大の境界明瞭な黄色の腫瘤を認め,組織学的には淡明な胞体にクロマチンの増量した腫大核をもった異型上皮がsinusoidal patternを示して増生しており,腫瘍は線維性被膜に囲まれていた(Fig. 5).CD10,CA9陽性,chromogranin,synaptophysin陰性,CK7,PAX8陰性でありrenal cell carcinoma,clear cell typeの転移と考えられた.他院でSSTR2,SSTR5の検索を行ったが発現は認められなかった.
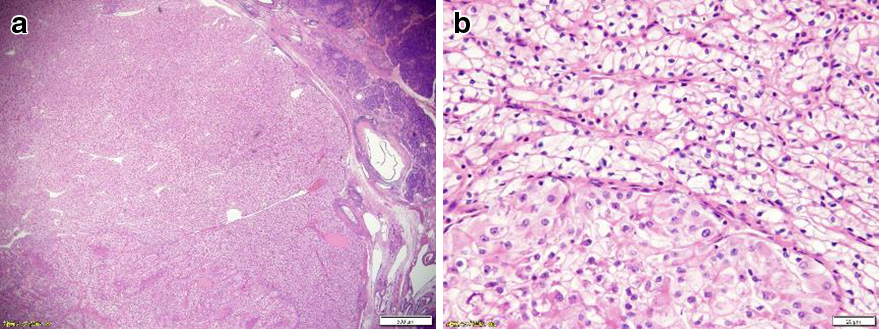
Pathological findings. a: HE (weak expansion). b: HE (strong expansion). Atypical epithelia with enlarged nuclei having increased chromatin in the clear endoplasmic reticulum were noted to be growing in a sinusoidal pattern, and the tumor was surrounded by a fibrotic capsule.
以上より,腎癌(淡明細胞癌)の膵転移と診断した.
術後:Clavien-Dindo分類におけるGrade IIIaの膵液瘻を認めたが,ドレーン交換含む保存的治療で軽快し,術後73日目に退院となった.
膵多血性腫瘍を認めた場合,膵内分泌腫瘍,膵漿液性囊胞腺腫,solid-pseudopapillary neoplasm,転移性膵腫瘍などが鑑別疾患として挙がる.このうち転移性膵腫瘍の頻度は少なく,膵悪性腫瘍全体の2%以下とされている2).しかし,転移性膵腫瘍の切除報告に限ってみると腎癌からの転移が最多である.また,腎細胞癌は,術後10年以上経過後の晩期再発例が11%と高率に認められるため,腎細胞癌術後に多血性膵腫瘍を認めた場合は,術後長期経過していても腎細胞癌の転移再発を疑わなければならない3)4).一方,膵内分泌腫瘍は多血性膵腫瘍の代表的疾患であり,その鑑別には既往歴を含めた臨床経過と膵産生ホルモンの確認が必要である.しかし,本症例のように術前に鑑別が困難な症例も多く,左腎癌術後で腎癌膵転移の可能性も疑ってはいたものの,腫瘍の鑑別と転移の検索目的に施行したSRSで膵体部の腫瘤に一致して集積を示したことから膵NETを第一に考えリンパ節郭清を伴う脾合併膵体尾部切除術の適応とした.当院ではリンパ節郭清を伴う膵体尾部切除術は腹腔鏡手術の適応とはしていないため開腹下に手術を施行した.
転移性膵腫瘍の診断では超音波内視鏡ガイド下穿刺吸引生検(endoscopic ultrasound-fine needle aspiration;以下,EUS-FNAと略記)が有用であるという報告が散見され5)6),EUS-FNAにより術前に転移性膵癌の診断を得たことで,膵全摘を回避しえたという報告もある7).一方で,穿刺に伴う播種のリスクがあり,EUS-FNAの穿刺ルートが切除範囲に入らない場合は特に適応を慎重に判断する必要がある8).本症例ではEUSは施行したもののEUS-FNAは行っていなかったが,有用な検査方法であり,今後鑑別により治療方針が変わってくる場合には考慮すべきであると思われる.
菰田ら9)の検討によると腎癌膵転移症例のうちリンパ節転移を伴うものは3.0%であったと報告されている.現時点では,腎癌膵転移症例に対してリンパ節郭清を行うかどうか,また行うとしたらどの程度行うかどうかというコンセンサスは得られていないが,腎癌膵転移ではリンパ節転移頻度は低いため,必ずしもリンパ節郭清は必要ないと考えられる.本症例のように高齢で明らかなリンパ節腫大を認めない症例では,術前にEUS-FNAを施行し腎癌膵転移と術前診断が得られた場合は周術期合併症の観点からもリンパ節郭清を省略した膵体尾部切除術が考慮され,またその場合は腹腔鏡手術も選択肢となりうると考えられる.
ソマトスタチンは,視床下部や消化管に分布する神経細胞や内分泌細胞において合成され,胃酸の分泌,膵外分泌,胆汁分泌,唾液腺分泌などの抑制作用,胆囊収縮抑制作用,内臓血流低下作用,消化管における吸収抑制作用などをもつことが知られている.ソマトスタチンは,標的細胞のSSTRに結合することで,初めて活性を示す.SSTRには5種類のサブタイプがあり,下垂体,膵臓,消化管などに主に存在しているが,NETを始め,さまざまな中枢神経腫瘍などに高率に発現していることが知られ,診断や治療の標的として検討されていた.1987年にSSTR2と5に強い親和性をもつオクトレオチドが合成され,その後診断においてはペンテトレオチドが合成された.ペンテトレオチドは,111Inで標識され,111Inペンテトレオチドとして開発され,特にNETの画像診断薬として有望であることが示された10).111Inペンテトレオチドの主な排泄経路は腎臓であり,6時間後に投与量の60%,24時間以内に73%が尿中に排泄される.また,胆道への排泄が2%程度認められる11).したがって,撮影時間により腎臓,膀胱,肝臓,胆道,消化管などに集積が認められ,読影上注意を要する.また,各臓器に発現するSSTRの多少により,脳,下垂体,消化管,膵臓,甲状腺,脾臓,腎臓,免疫細胞,血管などに生理的な集積がみられるため,これも注意が必要であり,また,NETとは異なり,髄膜腫,パラガングリオーマ,下垂体腺腫,肺小細胞がんなどの悪性腫瘍や,肺炎,放射線治療後の部位,最近の手術後の創部,授乳中の女性の乳房などの良性ないし,疾病のない場合も集積がみられることが知られている1).一方でSRSは,SSTRが発現していなければ,NETであっても集積は認められない.特にインスリノーマでは,SSTR2の発現が30~70%と報告されており,SRSによる集積も20~60%程度しか認められないと報告されている12)13).また,膵臓では,膵頭部や膵鉤部に生理的高集積がみられることが報告されている.Brabanderら14)によれば,膵臓や膵臓の近くに病変をもたない症例178例を対象として,膵頭部,膵鉤部へのSRSの集積の程度をレトロスペクティブに評価を行ったところ46例(26%)に集積がみられたと報告した.特に,糖尿病の患者では50%の症例で集積がみられた.このことはpancreatic polypeptide(PP)細胞に発現するSSTRが原因と推定されている.本症例ではSSTR2,SSTR5の検索を行い,どちらも発現は認められなかったにもかかわらずSRSで腫瘤に一致して集積を認めた.医学中央雑誌(1964年~2018年)で「腎癌膵転移」,「ソマトスタチン受容体シンチグラフィ」をキーワードとして検索したところ,本症例のように腎癌膵転移でSRSで集積を示した報告例は認めなかった.本症例においてSRSで集積を示した原因は不明であるが,SRSはSSTRをターゲットとしたシンチグラフィであり,検索は行っていないものの発現が認められなかったSSTR2,SSTR5以外のSSTRの発現が多く,それにより集積を示した可能性が考えられる.しかし,Hasegawaら15)は,病理学的評価が可能であった症例を対象に,SSTR2の発現を免疫組織化学的手法で評価を行いSRSの集積を比較したところ,93.8%と高率な一致が確認され,このことは,SRSの集積は腫瘍細胞におけるSSTR2の発現を反映していることが確認されたことを意味すると報告しており,本症例の結果とは矛盾するため今後も症例を重ねたさらなる検討が必要であると考える.本症例のようにSRSを腫瘍の鑑別診断に用いる際には十分注意する必要があり,用いる場合はCTやMRIなどの画像検査やEUS-FNAと併せて総合的に評価を行うべきである.
NETに対するSRSの検査意義は,EANM(欧州核医学会)のガイドラインでは,局所や転移病変に対する初期診断,術後などの経過観察,さまざまな治療効果のモニタリング,ペプチド受容体放射性核種療法(peptide receptor radio-nucleotide therapy;PRRT)適応症例の選択,治療反応性に基づく予後予測パラメーターとしての役割が明記されている16)が,NETと確定診断がついていない場合には慎重に判断する必要がある.
利益相反:なし