2020 Volume 53 Issue 10 Pages 800-807
2020 Volume 53 Issue 10 Pages 800-807
症例は66歳の男性で,上腹部膨満感と食欲低下を主訴に近医を受診した.腹腔内腫瘤の診断となり,精査・加療目的に当院を紹介受診した.腹部CTでは左後腹膜に局在する約25 cm大の巨大腫瘍を認めた.EUS-FNAによる病理所見では組織学的にgastrointestinal stromal tumor(以下,GISTと略記)の診断となった.手術リスクや臓器機能温存を考慮し,化学療法として,イマチニブとスニチニブをそれぞれ8週投与した.化学療法後のCTでは腫瘍の大きさは不変であり,治療継続による縮小効果は期待できないと判断し手術の方針とした.腫瘍は後腹膜に固定されており,膵体尾部との癒着は強く剥離は困難であったため,膵体尾部と脾臓を合併切除した.切除検体の病理組織学的検索により,後腹膜原発のGISTと確定診断した.術後3年間はイマチニブの投与を行い,術後5年経過した現在,無再発生存中である.
A 66-year-old man consulted a nearby doctor with the chief complaints of upper abdomen bloating and loss of appetite. He was diagnosed as having an abdominal mass, and was referred to our hospital for detailed examination and treatment. Abdominal CT showed a huge tumor measuring 25 cm in the retroperitoneal space. Based on EUS-FNA pathological findings, the tumor was diagnosed as a gastrointestinal stromal tumor (GIST). Preoperative chemotherapy with imatinib and sequential sunitinib was started in consideration of surgical risks and preservation of the surrounding organs. The size of the tumor did not change after chemotherapy. Since reduction of the tumor seemed to be not possible, surgical intervention was selected as the treatment choice. As the tumor originated from the retroperitoneum, and was severely adherent to the pancreas body and tail, it was extirpated with the distal pancreas and the spleen. The tumor was ultimately diagnosed as extragastrointestinal GIST by histopathological examination. Imatinib was subsequently administered for three years as an adjuvant therapy. The patient is alive without any recurrence 5 years after the surgery.
Gastrointestinal stromal tumor(以下,GISTと略記)は,主に消化管に発生する間葉系腫瘍である.しかし,まれに消化管外組織から発生するGISTも存在し,extragastrointestinal stromal tumor(以下,EGISTと略記)と呼称されている1).EGISTの多くは大網や腸間膜などの腹腔内臓器からの発生例が多く,後腹膜における発生はまれである.EGISTは長期予後や治療方針など未確定な点が多い.今回,化学療法による腫瘍縮小効果は得られなかったが,外科的切除後に長期無再発生存を継続中の症例を経験したので報告する.
患 者:66歳,男性
主 訴:上腹部膨満感,食欲低下
家族歴:特記事項なし.
既往歴:特記事項なし.
現病歴:上腹部膨満感と食欲低下を主訴に近医を受診し,腹腔内腫瘤の診断を受け,精査・加療目的に当院に紹介となった.
入院時現症:身長168 cm,体重68 kg,脈拍76回/分,血圧106/84 mmHg.左上腹部に弾性硬の腫瘤を触知した.
入院時血液検査所見:血算・生化学所見に異常を認めなかった.CEA,CA19-9などの腫瘍マーカーも正常範囲内であった.
造影CT所見:腹部中央より左側を占居する24.4×22.2×15.7 cm大の巨大腫瘍性病変を認めた.腫瘍内部のdensityは不均一で造影効果の増強はなく,出血壊死を来している可能性を考えた.周囲臓器との連続性は認めず,膵臓および脾動静脈が腹側に圧排されている所見から後腹膜に局在すると考えられた.また,腹部大動脈に広く接し,一部血管壁を圧排している部位も認めた(Fig. 1).
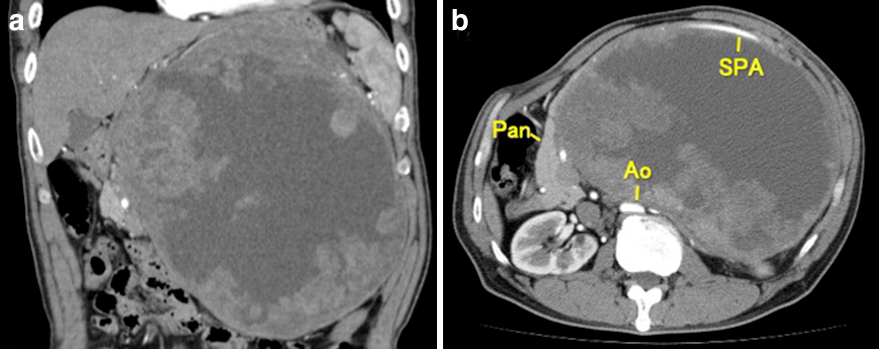
Enhanced abdominal CT scan showed a giant tumor 24.4×22.2×15.7 cm, which occupied the left side of the abdomen (a). Because the distal pancreas and the splenic artery were deviated ventricularly by the tumor, it was considered to be located in the retroperitoneum. It was widely abutted to the abdominal aorta (b). SPA: splenic artery, Pan: pancreas, Ao: abdominal aorta.
MRI所見:T1強調像で淡い低信号,T2強調像で高信号を示しており,CTと同様に腫瘍内部の出血壊死の所見と考えられた(Fig. 2).

MRI showed a low signal in T1-weighted image (a), and a mixture of high signals in the T2-weighted image (b). These findings were considered to indicate hemorrhage and necrosis inside the tumor.
生検による病理組織学的検査所見:EUS-FNAによる組織学的所見では紡錘形細胞が束状構造を呈して増殖していた.免疫組織化学染色検査ではc-kit陽性,CD34陽性,S-100陰性,desmin陰性,SMA陰性であり,組織学的にGISTとして矛盾しない所見であった.核分裂像は0%(0/4 HPF),Ki-67標識指数は1.07%(9/840)であった.
以上より,画像所見からは腫瘍の明らかな消化管や膵実質との連続性はなく,消化管外に発生したEGISTと診断した.腫瘍径は非常に大きく,大血管にも近接しており過大侵襲と出血リスクを伴う手術が予想されたため,初期治療としては外科的切除ではなくイマチニブ(400 mg/day)による化学療法を開始した.8週投与終了後のCTでは,腫瘍の大きさや腫瘍内部の造影効果に変化はなかった.その後,薬剤をスニチニブ(37.5 mg/day)へ変更し,8週間投与を行ったがCTで腫瘤の増大傾向は認めなかったが(Fig. 3),薬物療法の継続による腫瘍の縮小は期待できなかった.局所進展はコントロールされていたが,腫瘍による上腹部痛も徐々に増悪してきていたため,治療方針を再検討し外科的切除の方針とした.

There was no change in the size of the tumor and the imaging effect inside the tumor during 8 weeks of chemotherapy with sunitinib after 8 weeks of treatment with imatinib (a, b, c).
手術所見:手術は第8肋間から左斜め胴切りで開胸・開腹を行った.腫瘍は消化管や膵実質との連続性は認めず,膵背側の後腹膜に固定されており,後腹膜原発と診断した.周囲臓器との癒着は軽度で剥離は可能であったが,膵体尾部との癒着は強く剥離が困難であったため,膵体尾部と脾臓の合併切除を行った(Fig. 4).また,術前CTで腫瘍と近接していた腹部大動脈に関しても血管外膜を露出することなく安全に剥離可能であった.手術時間は373分,出血量は2,180 mlであった.

The tumor was fixed to the retroperitoneum on the dorsal side of the pancreas. It was diagnosed as having a retroperitoneal origin (a). The pancreatic body and tail and the spleen were resected together, because the adhesion with the pancreas was strong (b). The tumor was able to be removed from the aorta without exposing the adventitia. SPA: splenic artery, Pan: pancreas, Ao: abdominal aorta.
摘出標本所見:腫瘍は重さ4.9 kg,大きさ21.5×19.0×15.5 cmの厚い線維性被膜に覆われた病変で,内部は広範に変性壊死し暗赤色血性物を含んでいた(Fig. 5a).腫瘍は膵体尾部に広範に癒着していた(Fig. 5b).

The tumor was covered with a fibrous capsule weighing 4.9 kg and measuring 21.5×19.0×15.5 cm. The inside of the tumor was degenerating and necrotic (a). No continuity with the pancreas was observed (b). Pan: pancreas, Spl: spleen.
病理組織学的検査所見:腫瘍辺縁部に多形性に乏しい紡錘形細胞の増生を認めた.検索範囲内では,核分裂像は確認できず(Fig. 6a),膵組織への浸潤所見を認めなかった.免疫組織化学染色検査にて腫瘍細胞はc-kit陽性(Fig. 6b),CD34陽性(Fig. 6c)でありGISTと確定診断した.核分裂像は0%(0/50 HPF),Ki-67標識指数は1%未満であった.また,腫瘍の膵体尾部への浸潤は認めなかった(Fig. 6d).

Histopathological findings of the tumor were composed of growth of spindle cells and no mitotic figures (HE staining) (a). Immunostaining revealed CD34 (b) and c-kit positivity (c). Tumor invasion into pancreas was not observed (d).
術後経過:術後経過は良好であり,第13病日に退院した.術後補助化学療法としてイマチニブ(400 mg/day)を3年間投与した.術後5年を経過した現在,再発なく経過中である.
GISTは消化管間葉系腫瘍の80~90%を占め,消化管筋層に存在するカハール介在細胞(interstitial cells of Cajal;以下,ICCと略記)由来の腫瘍であると考えられている2).
GISTの発生部位は,胃40~70%,小腸25~36%,結腸5~7%,直腸5~10%,食道5%と報告されている3)~5).しかし,実際にはICCが存在しないとされている消化管外組織を原発とするGISTの症例がまれに認められる.Weissら1)は消化管以外の大網,腸間膜,後腹膜から発生し,免疫組織学的にGISTの像を呈する間葉系腫瘍をEGISTと提訴した.また,山元ら6)はEGISTと診断するの三つの条件,すなわち①腹腔内や後腹膜および骨盤内の軟部組織から生じており,かつ腸管壁および骨盤内臓器との連続性を認めない,②GISTと類似した組織像を示す,③免疫組織学的にKITが陽性である,を満たすものと定義している.本症例でもその全てを満たし,後腹膜原発のEGISTと最終診断した.
EGISTの多くは大網や腸間膜などの腹腔内での発生例が多く,後腹膜での発生はまれである.海外や本邦における過去の報告7)~12)では,EGISTを分類せずにひとまとめに検討されていることが多いため,後腹膜原発のEGISTのみに絞り検討した.
医学中央雑誌(1964年~2018年)で,「extragastrointestinal stromal tumor(EGIST)」,「gastrointestinal stromal tumor(GIST)」,「後腹膜」をキーワードとして検索したところ(会議録除く),報告例は自験例を含め9例13)~20)であった(Table 1).これらを集計すると,発症年齢は平均59(37~74)歳,男性4例,女性5例と男女比に差はなかった.腫瘍のサイズの平均は11.0(4.0~21.5)cmであった.通常の消化管原発のGIST症例では腫瘍径5 cm未満が半数近くを占め,10 cm未満が全体の3/4以上とされており21),EGISTの方が腫瘍径が大きい傾向にある.
| No. | Author | Year | Age/Sex | Tumor size (cm) | c-kit | Mitosis/HPF | MIB-1 index (%) | Risk (Fletcher) | Chemotherapy | Outcome |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Tambo13) | 2003 | 56/F | 7.5 | + | 3–4/50HPF | — | intermediate | — | 1Y2M alive |
| 2 | Yoshida14) | 2006 | 37/F | 18 | + | — | — | high | — | — |
| 3 | Takizawa15) | 2006 | 67/M | 5.5 | + | 10–15/50HPF | 3.0–5.0 | high | — | 1Y6M alive |
| 4 | Oga16) | 2008 | 55/F | 15 | + | 5/50HPF | — | high | adjuvant (Imatinib) | 1Y2M alive |
| 5 | Shirataki17) | 2009 | 51/F | 9 | + | 2/50HPF | — | high | — | 5M alive |
| 6 | Nishimura18) | 2011 | 74/F | 8 | + | 4/50HPF | 3.0 | intermediate | — | 2Y7M alive |
| 7 | Otubo19) | 2013 | 64/M | 4 | + | >10/50HPF | — | high | adjuvant (Imatinib) | 3M dead |
| 8 | Kanazawa20) | 2014 | 60/M | 11 | + | 4/50HPF | — | high | adjuvant (Imatinib) | 3Y alive |
| 9 | Our case | 66/M | 21.5 | + | 0/50HPF | <1.0 | high | adjuvant (Imatinib) | 5Y alive |
GISTの予後因子として腫瘍径と,病理組織における細胞増殖能の指標としての核分裂像数を組み合わせてリスク分類するFletcher分類が用いられている22).この分類に従うと,EGISTは核分裂数にかかわらず腫瘍径10 cm以上のものが多く,高リスク群に分類されるものが多い.しかしながら,山元ら6)は,EGISTに限定した場合,腫瘍径は予後と相関がなく,核分裂数高値(HPF 5/50以上)とKi-67標識指数高値(10%以上)の2項目が予後不良因子であったと報告している.これは,消化管原発のGISTと比べてEGISTは腫瘍の発育する空間が広く,症状の発現が遅いことから発見が遅れる傾向にあり,腫瘍径が生物学的悪性度を反映しないためと推測される.我々の集計でもFletcher分類に従って分類した結果,高リスク群は7例を占めるが,上記のEGISTにおける予後不良因子を含む症例は3例のみであり一致をみない.このようにGISTとEGISTのリスク分類の差異についてや,EGISTの悪性度や予後についての検討はいまだ十分になされていない.
EGISTの治療法については,GIST診療ガイドライン23)を参考にすれば切除可能である場合の第一選択は外科的切除である.外科的切除においては腫瘍周囲の偽被膜を損傷しない完全切除が原則であるが,前述したようにEGISTは腫瘍径が大きく,本例のような巨大腫瘍では,局所進行により他臓器浸潤を認める場合や,十分な切除断端を確保することは困難である.近年,GISTにおいては不完全切除が予測される場合や,臓器機能の大きな損失を伴うことが予測される場合は,術前化学療法を先行することで腫瘍を縮小させ,手術侵襲の低減や臓器温存を図ることの有効性が期待されるようになってきており,欧米ではいくつかの前向き試験が行われており,その有用性が確立されつつある24)~26).
EGISTにおける術前化学療法は確立していないが,自験例のような巨大腫瘍に対しては,GIST同様に化学療法が奏効すればより手術侵襲を低減した治療を施行できる可能性もあると考える.
GIST,EGISTともに治療の原則は腫瘍の完全切除ではあるが,それだけでは完治しない場合もある.実際,Fletcher分類において高リスク群に分類されるEGISTでは術後1年で約4割が再発し,最終的に7割以上が再発し,5年生存率は38.5%と報告されている27).GISTにおいては,イマチニブの術後補助化学療法により予後の改善を認め,その有効性が示されている28)29).そのため,EGISTであったが自験例でも術後補助化学療法としてイマチニブ400 mg/dayを3年間投与した.
自験例においては,初診時に腫瘍は巨大であり切除困難の診断であり,化学療法を開始したが,化学療法による腫瘍縮小効果は得られなかった.しかしながら,EUS-FNAによる生検の結果からは,腫瘍学的悪性度は低く,局所進展もコントロールされていたため,手術を行う方針とした.術前の化学療法に対しては著明な治療効果は得られなかったが,手術による腫瘍の完全切除に加えて,術後補助化学療法を行い,長期無再発生存を得られた症例であったと考えられる.
EGISTに対する化学療法の効果はいまだ不明であり,我々の集計でも症例の大半は2年以内(平均1.4年)までしか追跡されていないことから,実際の長期予後についても十分な検討がなされていない.EGISTに対する有効な治療法や長期予後については,今後も引き続き症例を蓄積し検討する必要があると考えられる.
利益相反:なし