2020 Volume 53 Issue 7 Pages 566-573
2020 Volume 53 Issue 7 Pages 566-573
症例は64歳の男性で,検診にて胃前庭部に全周性2型胃癌を指摘された.精査で6番リンパ節転移,肝S8に最大径9 cmの多発肝転移を伴う切除不能胃癌として化学療法(SOX)を開始した.SOX 10コース後効果判定で胃原発巣,肝転移巣の著明な縮小を認めpartial response(PR)と判断されたが副作用によりSOX継続困難であり,治療方針について検討しconversion surgeryを施行した.胃切除時の術中所見で肝転移以外の非治癒因子はなく,幽門側胃切除,D2リンパ節郭清を施行した.胃切除から2か月後に肝前区域切除,肝部分切除を施行し病理診断で胃原発巣,6番リンパ節,多発肝転移巣とも全て組織学的完全奏効であった.最大径9 cmの多発肝転移を伴う切除不能胃癌に対し化学療法著効によりconversion surgeryが施行でき,かつ組織学的完全奏効が得られていた症例を経験したため報告する.
A 64-year-old man was given a diagnosis of type 2 gastric cancer at the antrum on medical examination. The patient received SOX chemotherapy for unresectable stage IV gastric cancer of no. 6 lymph node and multiple liver metastases with a largest diameter of 9 cm. After 10 courses of SOX, the objective response according to the response evaluation criteria in solid tumors was determined as a partial response; however, he could not continue receiving chemotherapy due to side effects. We discussed the treatment plan and decided to perform conversion surgery. First, we performed distal gastrectomy with D2 lymph node dissection with no incurable factors except for liver metastases. We performed anterior liver resection and S6 partial liver resection 2 months after gastrectomy as radical resection. The pathological findings revealed that the gastric cancer and no. 6 lymph node metastasis exhibited a pathological complete response (pCR). Moreover, pathological findings revealed that all three metastatic lesions of S8, S5, and S6 were detectable in the resected specimen exhibited pCR. We report this case of stage IV gastric cancer with lymph node and multiple liver metastases treated with conversion gastrectomy and hepatectomy after SOX chemotherapy, the pathological findings of which revealed primary gastric cancer, and lymph node and multiple liver metastases exhibited pCR.
胃癌の多発肝転移は,胃癌治療ガイドライン(第5版)において,肝転移巣が少数の場合に切除が検討されることもあるが,通常切除不能と判断され化学療法による治療が選択される場合が多い1).しかし,近年の化学療法の進歩により,化学療法が著効し他の非治癒切除因子がない場合,根治を目的としてconversion surgeryが行われ長期生存が得られた報告も散見されるようになってきている2)3).この度,我々は最大径9 cmの同時性多発肝転移を伴う進行胃癌に対しSOXによる化学療法著効によりconversion surgeryとして胃切除,肝切除が施行でき,かつ多発肝転移巣を含め全て組織学的完全奏効(pathological complete response;以下,pCRと略記)が得られていた症例を経験したため,文献的考察を含め報告する.
患者:64歳,男性
主訴:なし.
既往歴:なし.
嗜好歴:飲酒:純アルコールにして140 g/日程度,喫煙:なし.
現病歴:2016年10月,当院関連施設の検診で胃前庭部に全周性の2型胃癌(組織検査:tubular adenocarcinoma(tub2))(HER 2:FISH陰性)を指摘された.精査で6番リンパ節転移,肝S8に最大径9 cmの同時性多発肝転移(S8,S5に各1か所,S6に3か所,計5か所)を伴う切除不能胃癌として当院関連施設等でSOX(S-1 120 mg/body day 1–14,L-OHP 100 mg/m2 day 1,1コース21日)による化学療法を開始した.10コース終了時点での諸検査で胃原発巣,肝転移巣とも著明に縮小し,新規病変を認めずpartial response(PR)と判断されたが,角膜,涙道障害の副作用によりキードラッグであるS-1継続も困難となってきており,以後の治療法選択を目的に2017年7月当院紹介となった.
血液検査所見:
前医初診時(SOX療法前);CEA 5.4 ng/ml,CA19-9 12.8 U/ml.
当院紹介時(SOX療法10コース後);WBC 5,800/μl,RBC 335×104/μl,Hb 9.2 g/dl,Ht 28.3%,PLT 34.3×104/μl,T-bil 0.5 mg/dl,AST/ALT 25/21 IU/l,ChE 187 IU/l,TP 7.3 g/dl,Alb 3.9 g/dl,PT% 100.2%,ICG R15 11%.HBs抗原陰性,HCV抗体陰性.
CEA 4.5 ng/ml,CA19-9 6.1 U/ml.
上部消化管内視鏡検査所見:SOX療法前,胃前庭部に全周性の2型進行胃癌を認めた.SOX療法10コース後胃前庭部に不正隆起を認めるが著明な縮小を認めた(Fig. 1a, b).
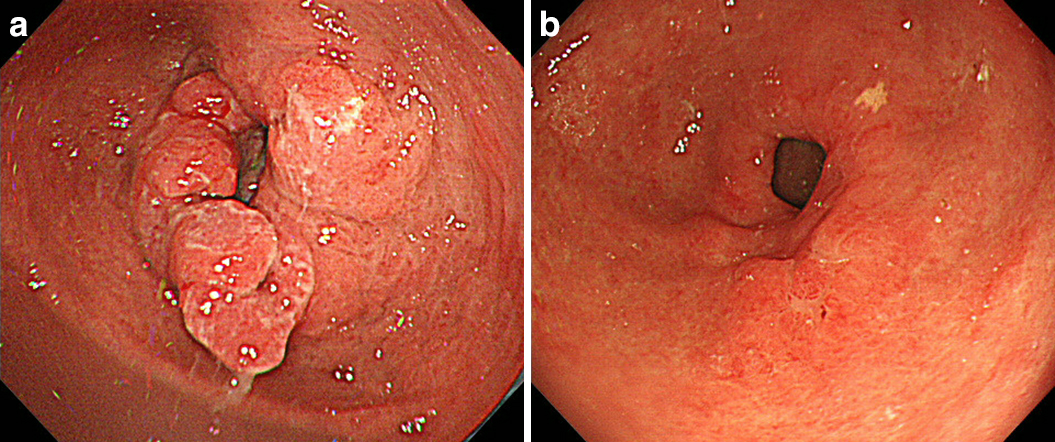
Esophagogastroduodenoscopic findings. a) Before SOX. b) After SOX. a) Esophagogastroduodenoscopy shows type 2 gastric cancer with circumferential involvement at the antrum. b) Remarkable improvement in gastric cancer was noted.
造影CT所見:SOX療法前,肝S8に径9 cm,S5に径3 cm,S6頭側よりに径2 cm,そのやや尾側に径1 cm,尾側端に径3.5 cmの転移巣を認めた.胃幽門部に壁肥厚を認め,膵臓への直接浸潤も否定できなかった.6番リンパ節の腫大を認めた(Fig. 2a~c).
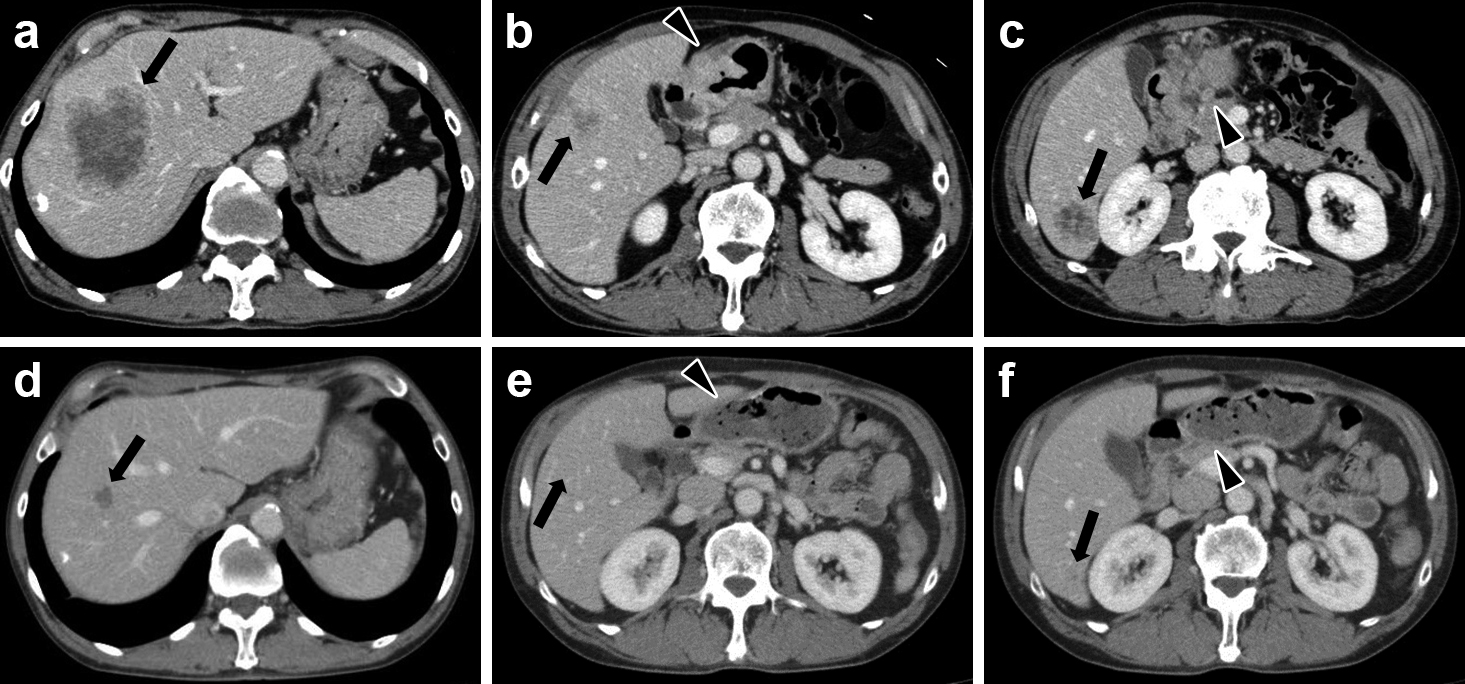
Enhanced CT findings. a–c) Before SOX. d–f) After SOX. Metastatic tumors, a) 9 cm in diameter, in S8 (arrow), b) 3 cm in diameter, in S5 (arrow), c) 3.5 cm in diameter, in the caudal edge of S6 (arrow) and 2 cm, 1 cm in diameter, in S6 of the liver were observed. d) Metastatic tumor in S8 was significantly reduced to 2 cm in diameter. e) Metastatic tumor in S5 became invisible (arrow). f) Metastatic tumor in the caudal edge of S6 was demonstrated as an obscure, low-density lesion, although other metastatic lesions of S6 became invisible. b) Wall-thickening was noted at the antrum of the stomach (arrowhead). e) Wall-thickening of the antrum was remarkably improved (arrowhead). c) No. 6 lymph node was swollen (arrowhead). f) No. 6 lymph node became invisible (arrowhead).
SOX療法後,S8の転移巣は径2 cmと著明な縮小を認めた.肝S6尾側端の転移巣が不明瞭なlow density areaとして認められたが,その他の転移巣は指摘困難であった.また,胃前庭部の壁肥厚は著明に縮小しており,6番リンパ節腫大も指摘できなくなった(Fig. 2d~f).その他,腹膜播種,腹水,肺転移などを認めなかった.
Gd-EOB-DTPA(プリモビスト)MRI所見:SOX療法後,肝細胞相で肝S8の転移巣は径2 cmのlow intensity areaとして描出された.また,S6最頭側と尾側端の転移巣が肝細胞相でlow intensity areaとして描出された.その他の転移巣は指摘困難であり,新規病変は認めなかった(Fig. 3a~c).
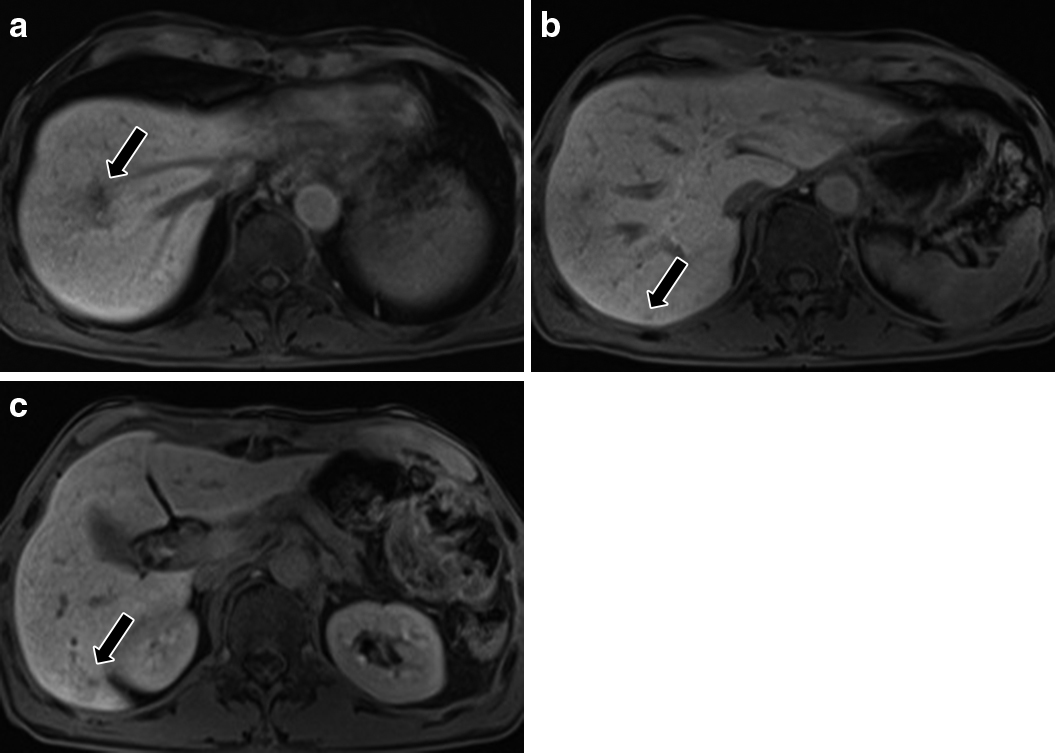
Gd-EOB-MRI findings. a–c) After SOX. a) S8 tumor was remarkably reduced to 2 cm in diameter (arrow). The tumors on the b) most cranial side (arrow) and c) caudal edge (arrow) in S6 were demonstrated as a small low-intensity area, although other lesions were invisible.
肝予備能検査でICG R15:11%と軽度肝機能障害を認めるが,肝前区域切除+肝部分切除(S6)で多発肝転移巣は切除可能と判断した.本人に残存する腫瘍に対する胃肝切除によるconversion surgery,レジメン変更による化学療法継続,化学療法中止による経過観察など治療法選択について説明のうえ,conversion surgeryを施行することとなった.まず,胃切除を計画し,胃切除が根治的であれば肝切除を計画することとした.
胃切除手術所見:上腹部正中切開で手術施行した.腹水,腹膜播種なし.迅速腹腔洗浄細胞診で悪性所見なし.胃前庭部を中心に硬結を触知するが著明な化学療法効果を認め,膵臓への直接浸潤はなく,幽門側胃切除,D2リンパ節郭清,Roux-en Y再建を施行した.
胃摘出標本病理組織学的検査所見:胃原発巣,転移が存在したと思われる6番リンパ節にも瘢痕状の強い繊維化があるが癌細胞の残存は認められなかった.ypT0,ypN0(0/45).組織学的効果判定Grade 3(Fig. 4a~c).

Macroscopic and histopathological findings of the resected stomach. a) The resected stomach had a shallow depressed lesion with a sharp border and fold convergence, 1 cm in diameter, on its antrum. Histopathological findings revealed b) gastric submucosal fibrous thickening and that c) a dissected No. 6 lymph node consisted of dense fibrosis had no cancer cell (HE 40×).
幽門側胃切除最終病理で胃原発巣,リンパ節とも癌細胞を認めずpCRであり根治的であったこと,また胃切除後の造影CT,プリモビストMRI再検査でも新規病変を認めなかったことから,胃切除から2か月後に肝切除による根治術を計画した.
肝切除手術所見:上腹部逆L字切開で開腹した.腹水,腹膜播種なし.前回の胃切除による上腹部の癒着を剥離し肝右葉を脱転した.術中エコーで腫瘍を確認するがいずれも縮小し,S8転移巣が不明瞭なlow echoic lesionとして描出されたが,S5転移巣は描出できなかった.S6転移巣はいずれも通常エコーで不詳であり,ソナゾイド造影エコーで最頭側の転移巣が不明瞭なlow echoic lesionとして描出されたため,同部を最頭側として肝部分切除(S6)と肝前区域切除を施行した.
肝切除標本病理組織学的検査所見:前区域切除標本には瘢痕,肉芽組織がS5,8の2か所に認められ,同部で凝固壊死に陥った腫瘍塊を含んでいるがviable cancer cellは認められなかった(その他転移巣とは無関係と思われる石灰化病変をS8に認めた).S6部分切除標本には1か所に胃と同様の強い繊維化病変が確認されたがviable cancer cellは認められなかった.組織学的効果はGrade 3と判定された(Fig. 5a~f).
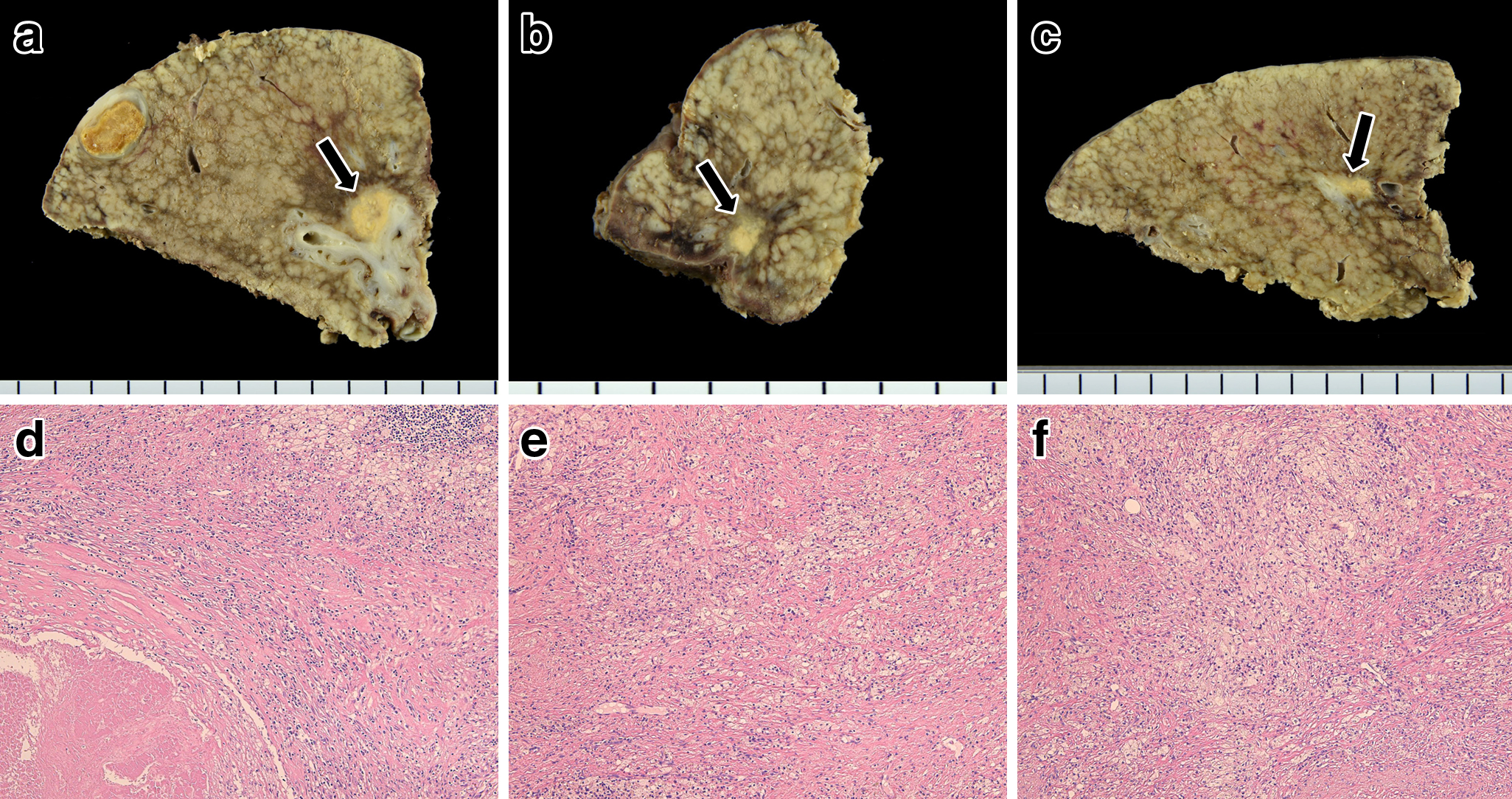
Macroscopic and histopathological findings of the liver nodules. Macroscopic findings showed liver nodules, a) S8, 10 mm (arrow), b) S5, 8 mm (arrow), c) S6, 5 mm (arrow) in diameter. Histopathological findings revealed that these nodules (d) S8, e) S5, f) S6) contained no cancer tissue except foamy cells, fibrotic and necrotic tissue (HE 100×).
肝切除後,副作用のためキードラッグであるS-1を含む化学療法の継続は困難であり,その他の化学療法への変更,継続も検討したが本人の希望に沿い化学療法は再開せず経過観察中である.胃癌多発肝転移の診断から3年2か月,胃切除および肝切除後2年2か月無再発生存中である.
肝転移や腹膜播種,傍大動脈リンパ節転移を含む遠隔転移を有する胃癌は,通常切除不能と判断される1).
肝転移を伴う胃癌に関しては,肝転移が両葉に多発する傾向があることや肝外にも転移巣を有する場合が多いことなどから肝切除の適応となる症例は少ない.また,肝転移巣に対する肝切除の意義についての前向きな臨床試験の報告はいまだなされていない.しかし,近年,後方視的な検討では,症例を選べば原発巣切除に加え,肝切除を行うことで長期生存が得られる可能性があることが示されてきており,肝切除が検討される場合もある1).Kinoshitaら4)は肝転移(同時性,異時性,単発,多発)を有するStage IV胃癌に対する肝切除256例を後方視的に解析し,5年生存率31.1%と比較的良好な治療成績を報告している.Okiら5),Songら6)もそれぞれ94例,96例に対する同様の検討を行い,胃癌肝転移に対する肝切除後5年生存率を42.3%,21.7%と報告している.しかし,これらの報告で,肝切除後予後不良因子として,2個以上の多発肝転移5)6),3個以上の多発肝転移4),肝転移腫瘍径5 cm以上4),N2(胃癌取扱い規約第13版)以上のリンパ節転移4),原発巣漿膜浸潤4)6)などが多変量解析で抽出されている.同時性多発肝転移を有する胃癌に限った治療成績に関する報告は少ないが,Shirasuら7)は,同時性多発肝転移(2~3個)を有する胃癌を,外科手術を先行した9人と化学療法を先行した15人で解析し,外科手術先行群では88.9%で再発したのに対し,化学療法を先行した群で手術を施行した3人に再発を認めなかったとし,多変量解析では先行化学療法と肝片葉の転移を予後良好な因子と報告している.以上の報告より,現時点では,同時性多発肝転移を有する胃癌では手技的に切除可能であっても切除成績は不良と判断され,化学療法先行が望ましいと思われる.本症例では,最大径9 cmを含む5か所の多発肝転移を認め切除不能と判断しSOXによる化学療法を施行した.
多発肝転移を含む切除不能胃癌に対する標準治療は化学療法であるが,化学療法単独での生存期間中央値は約13か月とされ十分な効果があるとは言いがたい8).しかし,近年強力な化学療法の開発に伴い,化学療法著効例に対し根治を目指したconversion surgeryとして外科切除介入が行われ,長期生存が得られる症例が胃癌においても報告されるようになってきている.Conversion surgeryとは「本来診断時には技術的にも腫瘍学的にも切除不能もしくは境界切除可能と思われた腫瘍に対して,化学療法が奏効し根治切除を目指して行う外科的治療」と定義される.Yoshidaら9)は,肝転移,大動脈周囲リンパ節転移,腹膜播種,腹腔洗浄細胞診陽性や複数の非治癒因子を有するなどさまざまな病態を含むStage IV胃癌に対するconversion surgeryの有用性を十分検討するうえでこれらの病態を四つのカテゴリーに分類することを提唱している.すなわちカテゴリー1(potentially resectable metastasis):技術的には切除可能な遠隔転移を有する胃癌,カテゴリー2(marginally resectable metastasis):技術的,あるいは腫瘍学的観点から切除が最適ではない遠隔転移を有する胃癌であり,本例の如く多発や腫瘍径5 cm以上の肝転移などが分類される,カテゴリー3(potentially unresectabale metastasis):他の非治癒因子をもたないが腹膜播種を認める胃癌,カテゴリー4(non-curable metastasis):腹膜播種に他の非治癒因子を合併する胃癌,である.Yoshidaら9)は,カテゴリー1は本来切除を前提に術前化学療法(neoadjuvant chemotherapy;NAC)がなされconversion surgeryの対象でなく,カテゴリー2,3,4に化学療法を行い,R0切除を目指した切除が行われた場合をconversion surgeryとして扱うことを提唱している.Conversion surgeryの有用性やその適応に関して,胃癌治療ガイドライン(第5版)においてもいまだ明確な言及はないが,近年,腹膜播種,腹腔洗浄細胞診陽性,大動脈周囲リンパ節転移といった非治癒因子をもつStage IV胃癌に対するconversion surgeryの有効性に関する報告がなされつつある10)~14).肝転移を有する胃癌のconversion sugeryの有用性についての前向き試験は報告されていないが,Yamaguchiら15)は,非治癒切除因子をもったStage IV胃癌259例に対しS-1をキードラックとした化学療法後にconversion surgeryを行った症例77例をYoshidaら9)の提唱するカテゴリー別に検討し,多発肝転移が分類されるカテゴリー2で化学療法のみの群に比べ生存期間の有意な延長を認めたことを報告している.
Stage IV胃癌に対し,化学療法奏効例にconversion surgeryが行われ,R0切除をしえた症例でさえ通常病理学的に癌細胞が残存していることが多い2)3).しかし,近年の強力な化学療法の開発により,化学療法後の切除標本で原発巣やリンパ節転移巣がpCRであった報告が散見されつつある16)~21).肝転移巣に関しては,肝転移巣が不可視となった場合や他の非切除因子があった場合切除対象とならないことなどから化学療法後の組織学的検索がなされた報告は少ないが,同時性,異時性肝転移に対し化学療法後にconversion surgeryを施行し,肝転移巣に関してもpCRが得られた報告が散見されつつある22)~26).この度の我々の症例は,最大径9 cmの多発肝転移を伴う進行胃癌に対しSOXによる化学療法後に胃切除,肝切除を行い,肝転移巣も含め全て病理学的にpCRが得られていた.同時性多発肝転移を伴う胃癌に対し化学療法後に肝切除を含めたconversion surgeryを行い病理組織学的検討がなされ,肝転移巣を含め全てpCRが得られていた報告は,医学中央雑誌(1964年から2019年12月)およびPubMed(1950年から2019年12月)で「胃癌」,「肝転移」,「pCR」をキーワードとして検索したところ(会議録を除く),S-1+CDDP後にconversion surgeryが施行された1例のみであり27),SOX後に関しては本症例のみであった.
我々のこの度の症例は,最大径9 cmの多発肝転移を伴う切除不能胃癌にSOXによる化学療法が著効し,conversion surgeryが施行可能となり,胃原発巣,リンパ節転移巣,多発肝転移巣の全ての部位でpCRが得られていた現時点ではまれな症例であったと思われた.
強力な化学療法の開発により,Stage IV胃癌に対しても化学療法が奏効した場合,根治を目指したconversion surgeryが行われ一定の有効性が報告されつつあり,ひいては病理学的にpCRが得られていた症例も報告されてきている.今後,同時性多発肝転移を含むさまざまな病態を有するStage IV胃癌について各病態ごとの有効な治療方針,化学療法,治療効果予測因子や予後因子などについて明らかにされることが望まれる.
利益相反:なし