2020 Volume 53 Issue 7 Pages 574-582
2020 Volume 53 Issue 7 Pages 574-582
消化器外科手術後に発生するリンパ漏は時に栄養障害,免疫能の低下を招き,早期に対処しなければ重篤化することがある.今回,我々は膵頭十二指腸切除術(pancreaticoduodenectomy;以下,PDと略記)後に発生した難治性リンパ漏が肝リンパ漏であると診断し,当初はオクトレオチドの持続皮下注およびエチレフリンの持続静注の保存的治療を行ったが軽快せずpreshock状態に陥ったため,直接肝リンパ漏を閉塞する目的で経皮経肝リンパ管造影(percutaneous transhepatic lymphography;以下,PTLと略記)を行いリンパの漏出が半減し,その後に選択的OK-432の腹腔内投与を行い著効した症例を経験した.PD後のリンパ漏に対してPTLとOK-432の腹腔内投与による治療例の報告はなく,術後難治性リンパ漏の治療において,それが肝リンパ漏に起因する場合には本法は有効な治療選択肢の一つになりうると考えたため報告する.
Lymphorrhea following gastrointestinal surgery may sometimes cause malnutrition and decreased immunity, and may become serious if not rapidly treated. We treated a patient in whom refractory lymphorrhea following pancreaticoduodenectomy (PD) was diagnosed as hepatic lymphorrhea. Conservative therapy with continuous subcutaneous octreotide and continuous intravenous etilefrine was initially provided, but the patient failed to improve and deteriorated to the pre-shock state. Percutaneous transhepatic lymphography (PTL) was performed with the aim of direct occlusion of the hepatic lymphorrhea, and the amount of lymph leakage was reduced by half. Selective OK-432 was then administered intraperitoneally, resulting in complete response. Rather than presenting this as a case report on the use of PTL and intraperitoneal OK-432 for treatment of lymphorrhea following PD, we consider this method to be an effective therapeutic option for cases of postoperative refractory hepatic lymphorrhea.
消化器外科手術後に発生するリンパ漏は保存的治療にて軽快することが多いが,まれに大量のリンパ液の漏出により栄養障害,免疫能の低下を招き,早期に対処しなければ重篤化することがある.しかし,リンパ漏出部位の同定が困難なことも多く,最適で効果的な治療を早期に施行できず難渋する場合も少なくない1).今回,我々は膵頭部分枝型intraductal papillary mucinous neoplasm(以下,IPMNと略記)に対する膵頭十二指腸切除術(pancreaticoduodenectomy;以下,PDと略記)後に発生した難治性リンパ漏に対して経皮経肝リンパ管造影(percutaneous transhepatic lymphography;以下,PTLと略記)とその後の選択的OK-432の腹腔内投与が著効した症例を経験した.これまで,PD後のリンパ漏に対してPTLとOK-432の腹腔内投与による治療を行った報告例はなく,術後難治性リンパ漏に対する有効な治療法の一つになりうると考えられるため,文献的考察を加えて報告する.
患者:66歳,男性
現病歴:膵頭部分枝型IPMNにて前医で経過観察されていたが,2017年4月より当院消化器内科での診療を依頼された.2018年3月の画像診断にて腫瘍径が34 mmと増大し,主膵管も9 mmに拡張してきたため(前医での腫瘍径は2016年で27 mmで主膵管の拡張なし)囊胞内に明らかな隆起性成分は認めないものの手術適応と判断し,2018年5月上旬に手術目的に入院した.
既往歴:chronic obstructive pulmonary disease(以下,COPDと略記,2007年に指摘され2015年より運動時のみの在宅酸素療法を行っている),脳梗塞(2016年,麻痺などの後遺症はなし)
生活歴:タバコ 20本/日(40年間),お酒 焼酎 4合/日,ADL自立
現症:身長164 cm,体重50 kg,BMI 18.5,腹部に所見なし.
検査所見:血液検査所見では肝機能,腎機能に異常を認めなかったが,白血球数9,090,CRP 5.0と軽度炎症反応の上昇を認めた.腫瘍マーカーはCEA,CA19-9ともに正常範囲内であった.呼吸機能検査にて肺活量は81%と正常であったが1秒率は35%と高度の閉塞性障害を認めた.
画像所見:MRCPにて膵頭部に径34 mm大の多房性の囊胞性腫瘍を認め,主膵管は径9 mmに拡張していた(Fig. 1).造影CTでも同様な所見であったが,囊胞内に隆起性成分は認められなかった.
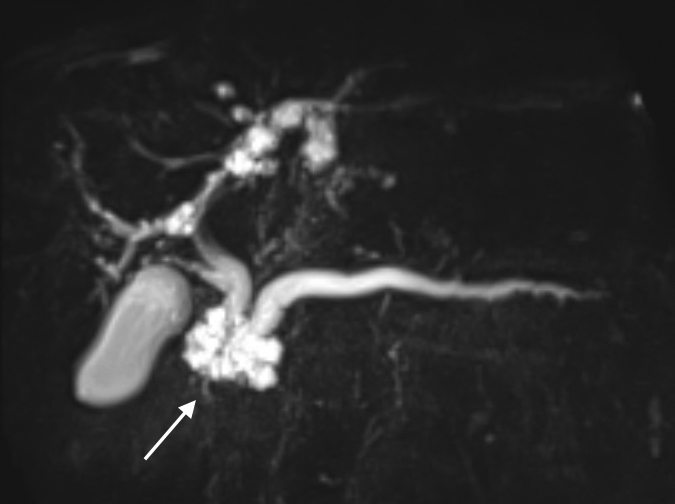
MRCP demonstrates an IPMN 34 mm in size at the head of the pancreas (arrow). The dilated main pancreatic duct was 9 mm in diameter.
手術所見:亜全胃温存膵頭十二指腸切除術,リンパ節郭清(D2),Child変法による消化管再建(膵空腸吻合はBlumgart変法にて施行),術中迅速組織診を施行した.リンパ節郭清に際してはルーペ(3.2倍)の視野下でリンパ管が含まれていると判断される組織は結紮した後に切離し,その他の部位では超音波凝固切開装置にてシーリング後に組織を切離した.術前診断で明らかな悪性を示す所見は見られなかったため上腸間膜動脈周囲神経叢の切除は行わずその外側で剥離操作を行った.また,腹部大動脈周囲に腫大リンパ節は存在しなかったため,そのサンプリングも施行しなかった.大酒家であったが肝臓はやや表面に凹凸あり,慢性肝障害の肉眼所見であった.手術時間は8時間36分で,出血量はリンパ液がやや多く含まれ,カウント上は1,540 mlであった.輸血は施行しなかった.
術後経過:当初の術後経過は比較的順調であり,術後6日目より経口摂取を開始し,食事は約半分量摂れていた.我々は膵空腸吻合部に留置したドレーンは早期抜去の方針としているが本症例では排液量がやや多かったため術後17日目に膵液漏のないことを確認後に抜去した.ただ,Winslow孔に挿入していたドレーンは無色透明な排液が1日500 ml以上持続していたため,挿入したままとしていた.排液のアミラーゼ値やビリルビン値は血清濃度以下で,乳糜を疑わせる白濁もないため,慢性肝障害に伴う腹水と考えていた.術後20日後からドレーンからの排液が1,000 ml以上に増加し,術後26日目に創が哆開したため再手術にて腹壁再縫合術を施行した.
再手術後経過:再手術後はICUに収容し,高度なCOPDを合併していることから人工呼吸器による呼吸管理を行った.また,低タンパク血症に対してアルブミン製剤の投与と利尿剤の投与を行い膠質浸透圧を維持することに務めた.しかし,初回手術28日目に血圧が80 mmHg台に低下し,大量輸液,昇圧剤(ドーパミン製剤,カテコラミン製剤)の投与を行ったが反応に乏しく,同日の尿量は330 mlと乏尿となりpreshock状態と判断した.初回手術29日目にはWinslow孔に挿入していたドレーンからの排液が1,500 mlと増加したため,そのアルブミン濃度を測定すると1.9 g/dl(同日の血清アルブミン値,2.2 g/dl)と高い値を示し,一方トリグリセリドは31 mg/dlと低値であった.以上より,ドレーンの排液は腹水ではなくリンパ漏であり,食事摂取中に全く白濁を認めなかったため乳糜を含む腸管由来のリンパ液ではなく,また大動脈周囲に手術操作が及んでいないため腸骨大動脈リンパ漏は考えにくく,障害肝からの肝リンパ漏の可能性が高いと考えた.そこで,初回手術30日目よりリンパ漏に対する対処としてオクトレオチド酢酸塩300 μg/日の持続皮下注射およびエチレフリン塩酸塩120 mg/日の持続静脈内投与を開始した.同日午後より,大量輸液とアルブミン製剤の積極的な投与がリンパ漏出による循環血漿量の減少に追いつき始めたため血圧は100 mmHg以上となり,尿量も1,000 ml以上確保された.しかし,以後もドレーンの排液は減少せず,初回手術34日目には再手術後経過中最も多い1日1,530 mlに達した.このため,このまま保存的な対処では再びショック状態に陥る危険があると判断し,初回手術36日目に直接肝臓のリンパ管を塞栓する目的でPTLを施行した.エコーガイド下に21 GのPTC針を前区域グリソンに穿刺し,透視下に造影剤イオパミドールを少しづつ注入しながら引き抜くと門脈,胆管が造影された後に肝リンパ管が造影されたため,約5 mlを急速注入した.さらに,リピオドールも続けて注入したが,呼吸性変動により針先が動き,多くは門脈と胆管に流れたが一部はリンパ管内に入ったため手技を終了した.イオパミドール注入後の画像を確認するとリンパ液漏出部位は判然としなかったが,肝前区域から肝門に至るリンパ管が網目状に造影されており,リンパ管の内膜の炎症じゃっ起には有効な手技ができたものと判断した(Fig. 2).また,その後のリピオドール注入後の画像では一部は肝門部から肝十二指腸間膜にかけてのリンパ管にリピオドールがまだらに残存しており,リンパ管の塞栓もなされたものと考えられた(Fig. 3).PTL翌日に撮影した単純CTにて肝十二指腸間膜内にリピオドールの貯留した蛇行するリンパ管が確認された(Fig. 4).PTL施行翌日の初回手術37日目以降はドレーンからの排液量はほぼ半減し,500~600 ml程度となりvital signも安定した.しかし,数日経過を見てもそれ以上の減少傾向を認めなかったため,初回手術42日目,44日目,47日目にWinslow孔ドレーンよりOK-432 10 KEを生理食塩水10 mlに溶かして注入し120分間クランプし,その後解放するという処置を行った.初回手術48日目から,それまでサラサラの無色透明なドレーン排液だったものにフィブリンが混じるようになり,初回手術49日目にドレーン排液が完全にゼロになった.ドレーンが閉塞したためと考えられ,その後軽度な腹部膨満が生じ,エコーで確認するとモリソン窩に液体貯留を認めたが徐々に軽快し,初回手術62日目にドレーンを抜去した.また,アルブミン製剤の投与は初回手術60日目に終了した.初回手術78日目から経口摂取を再開したが腹部膨満は認めず,以後はほぼ順調に経過し,呼吸器リハビリテーションに時間を要したが初回手術152日目に自宅に退院した.手術後の臨床経過をFig. 5に示した.
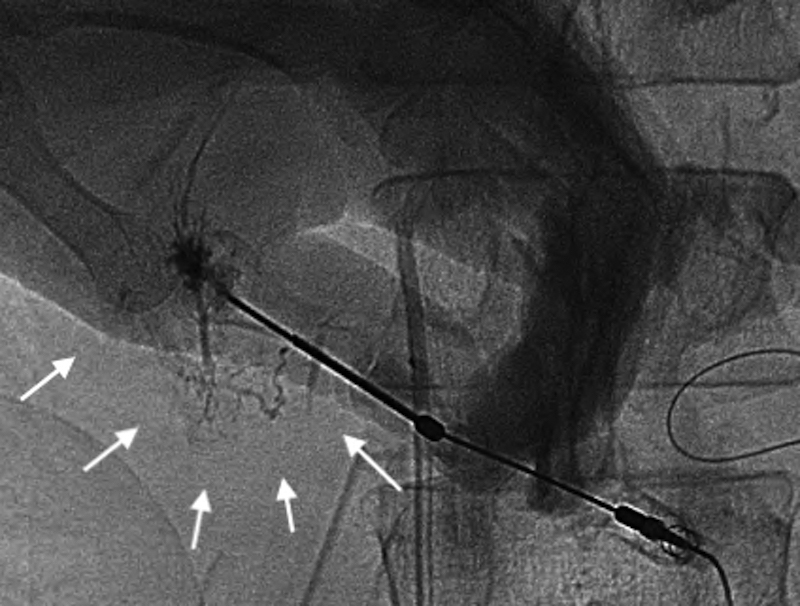
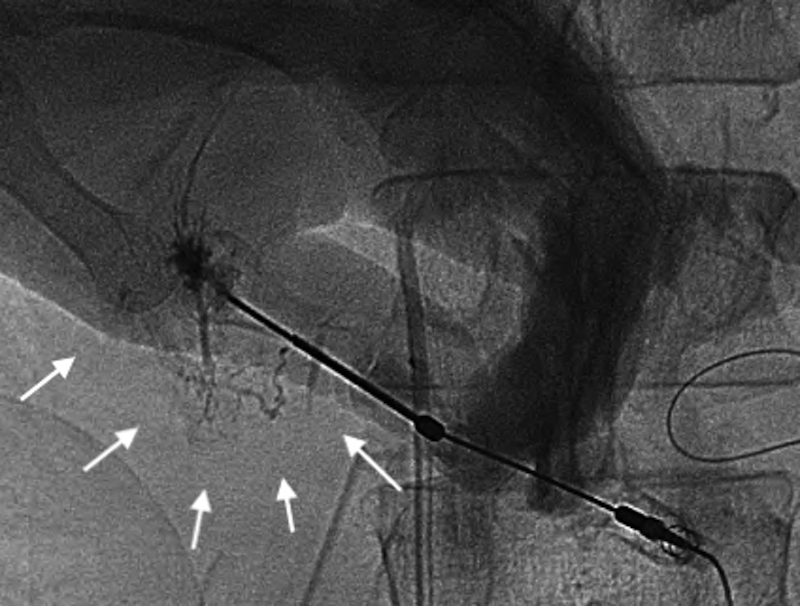
PTL shows a fine and tortuous network of intra-hepatic lymphatics toward the hepatic hilum (arrows).
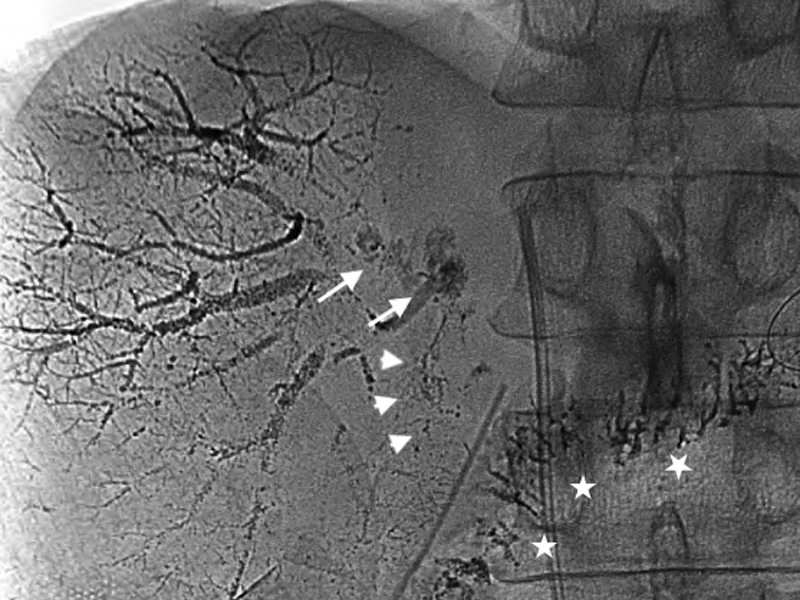
Fifteen minutes after injection of lipiodol, the injected lipiodol was directed to the hepatic hilum (arrows), and successively to the hepatoduodenal ligament (arrowheads). Most of the injected lipiodol flowed into the portal vein or the hepatic duct. Lipiodol in the jejunum via anastomosis of the hepatic duct and the jejunum was seen (asterisks).
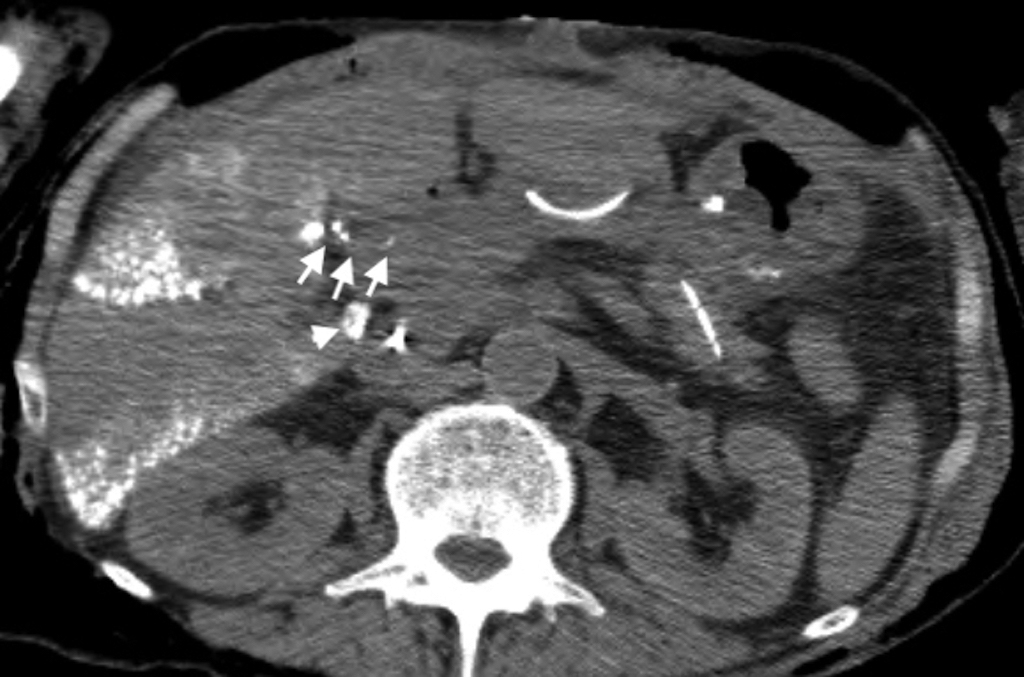
CT taken the next day after PTL demonstrates fine and tortuous lymphatics containing lipiodol at the hepatoduodenal ligament (arrows). The tip of the drainage tube was seen just behind the hepatoduodenal ligament (arrowhead).

Clinical course after surgery indicates that discharge from the drainage tube decreased quickly by almost half after PTL.
病理報告:病変部位は拡張した膵管内に鋸歯状または低乳頭状の上皮の増殖を伴っており,low gradeのadenoma相当の異型上皮であり,intraductal papillary mucinous adenomaの診断であった(Fig. 6).

Pathologically, the lesion was composed of proliferation of jagged or low-papillary epithelium which had atypia estimated as low-grade adenoma, so finally it was diagnosed as intraductal papillary mucinous adenoma.
術後リンパ漏の治療は絶食,中心静脈栄養,オクトレオチド持続皮下注射やエチレフリン持続静脈内投与などの保存的治療が行われ,多くは軽快する2).これらにて軽快しない難治性の場合にはリピオドールによるリンパ管造影がリンパ漏出部位の同定とともに治療効果を有すると報告されている3).また,胸管損傷による乳糜胸水の治療にはミノサイクリンやOK-432を用いた胸膜癒着療法が広く施行されている4).今回の報告ではオクトレオチドとエチレフリンによる保存的治療を6日間行い,リンパ漏の減少傾向が認められなかったため7日目にPTLを施行した.オクトレオチド単剤のリンパ漏に対する効果発現時期は7例の検討にて中央値2日(1~3日)と報告されており5),エチレフリンについては3例の検討にて効果発現の中央値1日(1~5日)と報告されており6),5日間の投与にて効果が見られない場合には次の治療を検討すべきと考える.
今回の報告例での難治性肝リンパ漏が発症した原因については術前の検査データや術中の肝肉眼所見以上に肝障害の程度が進行しており,肝リンパ流が増量しており,損傷したリンパ管の自然治癒が妨げられていたことが原因と考えられた.また,予防策としては症例報告の中で結紮と超音波凝固切開装置を適宜併用したことを記載したが,現時点では結紮とシーリングデバイスのどちらがリンパ漏の予防に有用かについては明らかにはなっていない7).今回の報告例を経験して肝障害を認める症例においては少なくとも肝十二指腸間膜郭清に際してはより結紮操作を優先させるべきかもしれないと考えている.さらに,リンパ漏の発見が遅れた原因は初回手術後の経過が比較的順調でWinslow孔に留置したドレーンから無色透明な廃液が500 ml/日程度流出していたが,経口摂取も進んでおり白濁することもなかったためアルコール性肝障害に伴う腹水と思い込んでいたためである.もう少し早い段階でドレーン廃液の生化学的検査を行っていれば肝リンパ漏と診断できた可能性はあると考えられた.
術後リンパ漏は大きく乳糜を含むものと含まないものに大別され,それは損傷部位によって規定される.前者は腸管リンパ管,乳糜槽,胸管の損傷により起こり,後者は腸骨大動脈リンパ管,肝十二指腸間膜内リンパ管の損傷により起こる8).また,乳糜の定義は白濁した液体でトリグリセリドを多く含むもの(典型的には200 mg/dl以上)とされる9).今回の報告例は食事を半分摂取していながら無色透明であり,そのトリグリセリド濃度も低値であり,手術操作は大動脈周囲に及んでいないことから肝リンパ漏と考えられた.リピオドールによるリンパ管造影は通常は鼠径部のリンパ管を染めてカニュレーションし造影剤を注入もしくはリンパ節を穿刺して行うものであり,腸骨大動脈リンパや腸管リンパの漏出,乳糜槽,胸管の損傷には有効であるが肝十二指腸間膜内のリンパ管の損傷に起因する肝リンパ漏には無効と考え,直接同部位のリンパ管の塞栓を目的にPTLを施行した.肝リンパ漏に対しては外科的治療という選択肢もあったが,術後肝リンパ漏について本邦報告例19例をまとめた報告を調べると,その内12例で再手術が行われていたがリンパ漏出部位が確認できたのは5例(46.7%)のみであり,4例では胆囊床付近の肝実質に色素を注入し初めて確認可能であったとされていた10).また,再手術でリンパ管の結紮のみで治癒したのは3例のみであり,再手術でリンパ漏を治癒できる確率は低く,かつ報告例の内15例は胃癌に対する胃切除例でありPD術後では再手術はより困難になることが想定されたため選択しなかった.PTLはイオパミドールを5 ml注入して施行したが,この造影のみでリンパ漏が治癒したという報告もあり,イオパミドールによりリンパ管内膜に炎症がじゃっ起され閉塞する機序が考えられている11).また,PTL時にリピオドールを使用した報告もあり7),今回我々も注入したが多くは門脈と胆管内に入り,一部のみがリンパ管内に入り翌日のCTでも停滞していることが確認された.肝リンパ管は門脈周囲にリンパ網を形成しており,慢性肝障害を有する患者では発達していると考えられているが12),エコーでも描出は不能なためPTLの手技はグリソン自体を穿刺し少量の造影剤を注入しつつ,ゆっくり引き抜きリンパ管が描出されるまで行うもので難易度が高い.実際今回の報告例でも3回目の穿刺で初めてリンパ管が造影された.しかし,PTL施行翌日には肝リンパ漏は半減し,以後の治療の成功につながったため,難治性肝リンパ漏の治療においては治療の選択肢の一つとして考慮すべきと考えられた.
本報告例ではPTL後もリンパ漏が持続したため,OK432の腹腔内投与も併用した.OK-432の作用機序は局所の炎症をじゃっ起することによりリンパ管を閉塞することと考えられている13).上記のようにOK-432によるリンパ漏の治療は乳糜胸の治療が多く報告されており,腹腔内投与はスペースが広いため薬剤が薄まり治療効果が低いと考えられていた7).しかし,リンパ漏出部位にカテーテルを誘導し,そこに選択的に投与を行い奏効したとする報告がある13).我々の報告例はドレーンの先端が肝十二指腸間膜の背側にあり(Fig. 4,arrowhead),まさにリンパ漏出部位のすぐ近くにOK-432を選択的に高濃度で投与することができた.今回はOK-432を10 mlの生理食塩水に溶かして投与を行ったが,これはこれまでの報告に比べかなり少ない量であるが上記のドレーンの位置よりこの量でリンパ漏出部位に確実に到達するものと考えた.OK-432による治療が成功するか否かはドレーンがリンパ漏出部位の近くにあるか否かで決まるとの報告もあり4),本報告の経過でかなり早い段階でリンパ漏が軽快したのはこのような要素も大きかったものと推測される.今までに報告されているOK-432の腹腔内投与の報告では1回の投与量は5~20 KE程度で,投与間隔は1~4日空けて,総投与回数は1~5回と報告されている.副作用については発熱,腹痛,癒着性イレウスが多く挙げられているが14),最近の報告で肺癌に対する肺切除後のリンパ漏に対する胸腔内投与例ではあるが重篤な急性肺障害を起こしたというものがあり15),その機序としてOK-432の全身の自然免疫を賦活して炎症性サイトカインを誘導する機序が原因と推定されており,その機序であれば腹腔内投与でも起こりうるため注意が必要である.また,OK-432を投与した後には強固な癒着がじゃっ起されるため,その後の再手術は不可能と考えられるため,そのことも十分考慮して使用に際しては慎重に検討する必要がある.
術後リンパ漏に対してPTLを施行したとの報告はごく限られており7)11)16),さらにOK-432の腹腔内への投与の報告も少ない17)18).PD後にPTLを行った報告は邦文で1例報告があるのみであり(英文はなし),膵臓癌に対するPD後にリンパ漏が発症し当初は旁大動脈リンパ節のサンプリングからのリンパ漏を疑い鼠径リンパ節穿刺によるリンパ管造影を行ったが効果がなく,次に肝リンパ漏を疑い術後19病日にPTLを行い,リピオドールを3 ml注入し,5日後にリンパ漏が消失したと報告されている7).この報告でPTLのみで治癒した要因としてリンパ漏の程度が我々の報告に比べて軽度であり(1日200~400 ml),またPTLも我々より早く行われていたことが考えられる.また,PD後にOK-432を投与したという報告も本邦で1例のみであった(英文はなし).その報告は胆管癌に対するPD後のリンパ漏で,術後27病日に再手術を行いリンパ漏出部位を検索するも同定することができず,広範な癒着の剥離過程で横行結腸壁を損傷したためそれ以上の副損傷は避けたいとの判断からモリソン窩と脾臓下極にそれぞれドレーンを留置し術中にOK-432を10 KEづつ注入し手術を終了し,術後にも4回OK-432をドレーンから投与して(合計60 KE)リンパ漏出が軽快したと報告されている19).医中誌Web(1964年~2019年)およびPubMed(1950年~2019年)で「膵頭十二指腸切除術」,「術後リンパ漏」,「経皮経肝リンパ管造影」,「OK-432」,「pancreaticoduodenectomy」,「postoperative lymphatic fistula」,「percutaneous transhepatic lymphography」をキーワードとして検索を行ったが(会議録を除く),PDの術後リンパ漏に対してPTLとOK-432の腹腔内投与を行った報告は認めなかった.PDはそれ自体侵襲が大きい手術でその術後に難治性リンパ漏を合併した場合には低栄養,免疫能低下,循環不全などの重篤な病態に至ることも想定される.本報告では肝リンパ漏と判断した後にPTLとOK-432の選択的腹腔内投与を迅速に行い,非常に有効であった.術後難治性リンパ漏に遭遇し,肝リンパ漏が疑われる場合にはPTLとOK-432の選択的腹腔内投与は有効な治療選択肢となる可能性がある.
利益相反:なし