2023 Volume 56 Issue 1 Pages 10-19
2023 Volume 56 Issue 1 Pages 10-19
症例は腎細胞癌術後11年目の61歳の男性で,便潜血陽性にてCTを施行し,膵体部と膵尾部および結腸肝彎曲部に腫瘍を認めた.下部内視鏡検査では大腸腫瘍は粘膜下腫瘍様の隆起性多血性病変であり生検では確定診断が得られなかったが臨床経過から腎細胞癌の膵,大腸転移再発と診断し開腹下で膵体尾部兼脾臓合併切除術および横行結腸部分切除術を施行した.術後は膵液瘻を認めその後に限局性腹膜炎,大網壊死,腹腔内膿瘍を発症した.CTガイド下ドレナージを含む保存的加療にて軽快し術後88日目に退院となった.腎細胞癌の大腸転移は極めてまれであり複数臓器の転移を認める場合が多い.治療戦略では外科的切除に加え免疫チェックポイント阻害剤による薬物療法が有効な症例もあり今後は見極めていく必要がある.外科的切除では大腸腫瘍が横行結腸に存在する場合,膵離断面と大腸吻合部が近接し,膵液瘻と感染の関連に寄与する可能性があり注意が必要である.
A 61-year-old man who had undergone surgery for renal cell carcinoma 11 years ago was found to be positive for fecal occult blood. CT was performed and tumors were found in the body and tail of the pancreas and liver flexure of the colon. Total colonoscopy showed that the colorectal tumor was a submucosal tumor-like protuberant hypervascular lesion, but a biopsy did not provide a definitive diagnosis. Based on the clinical course, recurrence of renal cell carcinoma with pancreas and colon metastasis was diagnosed. Distal pancreatectomy and partial resection of the transverse colectomy were performed. After surgery, a pancreatic fistula was found, followed by focal peritonitis, omental necrosis, and an intraabdominal abscess. The patient improved with conservative treatment including CT-guided drainage and was discharged from hospital on the 88th postoperative day. Colon metastasis from renal cell carcinoma is extremely rare and metastasis to multiple organs is often observed. In addition to surgical resection, drug therapy with immune checkpoint inhibitors is effective in some cases, but further investigation is needed. In surgical excision of a colorectal tumor in the transverse colon, the pancreatic transection and colonic anastomosis are close to each other, and this may contribute to the relationship between pancreatic fistula and infection.
腎細胞癌はR0手術を行ったとしても約20~40%で転移再発をすると報告され1),その遠隔転移先は主に肺,リンパ節,骨,肝臓と報告されているが2)膵転移は3~5%と比較的まれで3)大腸転移は1.2%と極めてまれである4).腎細胞癌の遠隔転移再発は外科的切除が望ましいが5),大腸転移は複数臓器の転移を認める場合が多く6),根治的切除不能である場合が少なくない.今回,我々は腎細胞癌術後の大腸および膵転移再発症例に対して同時切除を施行した症例を経験したので報告する.
患者:61歳,男性
主訴:便潜血陽性
既往歴:50歳時に右腎細胞癌(pT1bN0M0 pStage I,淡明細胞癌)に対して右腎摘出術を施行された.58歳時に左鼠径ヘルニアに対して根治術を施行された.
現病歴:腎細胞癌術後11年目に便潜血陽性のためCTを施行したところ膵体部と膵尾部および結腸肝彎曲部に多血性腫瘍を指摘され精査加療目的に当科紹介となった.
現症:身長174 cm,体重78.9 kg,腹部は平坦で軟.右側腹部に右腎細胞癌術後scarと左鼠径ヘルニアscarを認めた.
血液検査所見:Cre 1.23 mg/dl,eGFR 47.8 ml/minと軽度腎機能障害を認めた.腫瘍マーカーはCEA 1.2 ng/ml,CA19-9 5.2 U/ml,DUPAN-2 25 U/ml,SPAN-1 3.5 U/ml,IgG4 88.2 mg/dlでいずれも陰性であった.
造影CT所見:結腸肝彎曲部に径約40 mm大の早期濃染腫瘍を認めた.膵体部と膵尾部にそれぞれ径20 mm大の境界明瞭で早期濃染腫瘍を認めた.リンパ節腫大は認めなかった(Fig. 1).

Abdominal contrast CT. (a–c) Well-defined 20-mm tumors in the head (arrows) and tail of the pancreas (triangles). Both tumors showed an early contrast effect (a). The pancreatic body (b) and tail (c) tumors showed a milder contrast effect than the pancreatic parenchyma in the delayed phase. (d, e) Abdominal contrast CT showed a tumor of about 40 mm in size at the liver curvature (yellow arrows). The tumor showed an early contrast effect (d). The tumors showed wash out in the delayed phase (c).
MRI所見:結腸肝彎曲部腫瘍はT2WIで不均一な軽度高信号を示し,拡散低下を認めなかった.一方で膵腫瘍はT2WIで淡く高信号を示し,DWIは高信号に乏しく,ADC mapでは高信号を認め拡散低下は認めなかった.腫瘍はMRCPでは描出されず囊胞性膵腫瘍は否定的であった.主膵管が腫瘍の背側でやや不明瞭となり圧排狭小化が疑われた(Fig. 2).

MRI findings. (a) The colon liver flexure tumor showed heterogeneous mild hyperintensity on T2WI (arrow). (b) The pancreatic tumor showed a faint high signal on T2WI (triangle). (c) No pancreatic tumor was visualized by MRCP.
下部消化管内視鏡検査所見:結腸肝彎曲部に粘膜下腫瘍様の隆起性病変を認めた.通常の大腸癌と比較し表面は平滑で境界は明瞭であった.多血性であり生検時に出血を認めた.生検では炎症性肉芽性組織のみで悪性所見は認めなかった(Fig. 3).

Lower gastrointestinal endoscopy revealed a submucosal tumor-like elevated lesion in the liver curvature.
以上より,結腸肝彎曲部腫瘍は横行結腸癌,腎細胞癌局所再発,腎細胞癌大腸転移,消化管間質腫瘍,結腸神経内分泌腫瘍(neuroendocrine tumor;以下,NETと略記)が疑われた.一方,二つの膵腫瘍は画像上同様の造影パターンを示し同一組織型の腫瘍と思われた.診断としては腎細胞癌膵転移または膵NETが疑われた.最終的には臨床経過から大腸および膵腫瘍のいずれも腎細胞癌の転移を第一に考えた.多発病変であったが術前画像所見から膵体尾部兼脾臓合併切除術および横行結腸部分切除術でR0切除可能であり手術適応と判断し手術を施行した.先に膵体尾部兼脾臓合併切除術を施行し,続けて横行結腸部分切除術を施行した.術中所見では膵体部,膵尾部に約20 mm大の白色調腫瘍をそれぞれ認めた.いずれの腫瘍も定型的な膵体尾部兼脾臓合併切除術にて摘出可能であった.リンパ節郭清は施行しなかった.膵切離は切離予定部の中枢と末梢を小児用鉗子で5分間圧挫を施行したのち自動縫合器(SigniaTM black 60 mm)で切除した.結腸肝彎曲部腫瘍は横行結腸に存在し,腫瘍の漿膜露出を認めず粘膜下が主体と思われた.転移性大腸腫瘍または消化管間質腫瘍が疑われた.横行結腸切除は口側肛門側ともに自動縫合器(SigniaTM purple 60 mm)で切除した.再建は機能的端々吻合で施行した.自動縫合器(SigniaTM purple 60 mm)で吻合を行い,自動縫合器の挿入孔は自動縫合器(SigniaTM purple 60 mm)で閉鎖した.リンパ節郭清は施行しなかった.手術時間は4時間14分,出血は410 mlであった.ドレーンは膵離断面頭側,膵離断面足側,左横隔膜下に留置した(Fig. 4a).

Postoperative abdominal CT. (a) On postoperative day 3, the tip of the drain (arrow) was placed on the cranial side of the pancreatic stump via the anastomotic site (triangle). (b) On postoperative day 30, an intra-abdominal abscess was observed (arrow).
病理組織学的検査所見:大腸腫瘍は大腸漿膜下織から粘膜および大腸内腔にポリープ状に突出し40×27×29 mm大の腫瘍で小型~中型のクロマチンに富む類円形核を有する淡明な広い胞体を持つ細胞が充実性または腺房状構造を示しつつ増殖していた(Fig. 5).膵腫瘍は境界明瞭で黄色調の12×13 mm,13×15 mm大の腫瘍であり大腸腫瘍と類似の組織学的所見を認め淡明細胞癌型腎細胞癌の大腸および膵転移と診断した(Fig. 6).

Histopathological findings for the colon tumor. (a, b) The tumor protruded from the subserosal structure of the colon into the mucosa and the lumen of the colon in a polyp-like manner (arrows). The size was 40×27×29 mm. (c) Histologically, clear cells with small to medium-sized chromatin-rich round nuclei showed solid or acinar-like structures and proliferation (×100, HE stain).

Histopathological findings for the pancreatic tumors. (a, b) Macroscopically, the tumors were well-defined and yellowish in color. The tumor in the pancreas body was 12×13 mm (arrow). The tumor in the pancreas tail was 13×15 mm (triangles). (c) Histologically, clear cells proliferated to form the tumors, similarly to the colon tumor (×100, HE stain).
術後経過:術後3日目の採血で炎症所見高値を認めた.さらに,結腸吻合部のドレーン排液アミラーゼが10,424 U/lと高値を認めた(Fig. 7).CTでは膵離断面足側のドレーンは大腸吻合部を経由していた.液体貯留は認めなかったのでドレナージ治療を続けた.一時的に炎症所見およびドレーン排液アミラーゼが3,443 U/lと改善が見られたが,術後10日目に再度悪化し,ドレーン排液に混濁が見られ感染が疑われたため,CTを施行したところ結腸吻合部周囲の限局性腹膜炎の所見が認められた.術後13日目にCTを再検すると大網内airの増加を認め一連の経過からドレーンの逆行性感染を契機とした縫合不全と膵液瘻の悪化を疑った.人工肛門造設術を検討したが,術後の高度の癒着や瘻孔破壊のリスクなどを懸念し保存的加療の方針となった.その後,いったん解熱し炎症所見も改善傾向であったが術後30日目のCTで大網壊死によると思われる腹腔内膿瘍の形成を認め(Fig. 4b),CTガイド下ドレナージを施行した.細菌培養ではPsudomonas aeruginosa,Klebsiella pneumoniaeが検出された.その後はドレーン造影と交換を繰り返して瘻孔化を行い術後88日で退院となった.現在術後2年経過し無再発である.
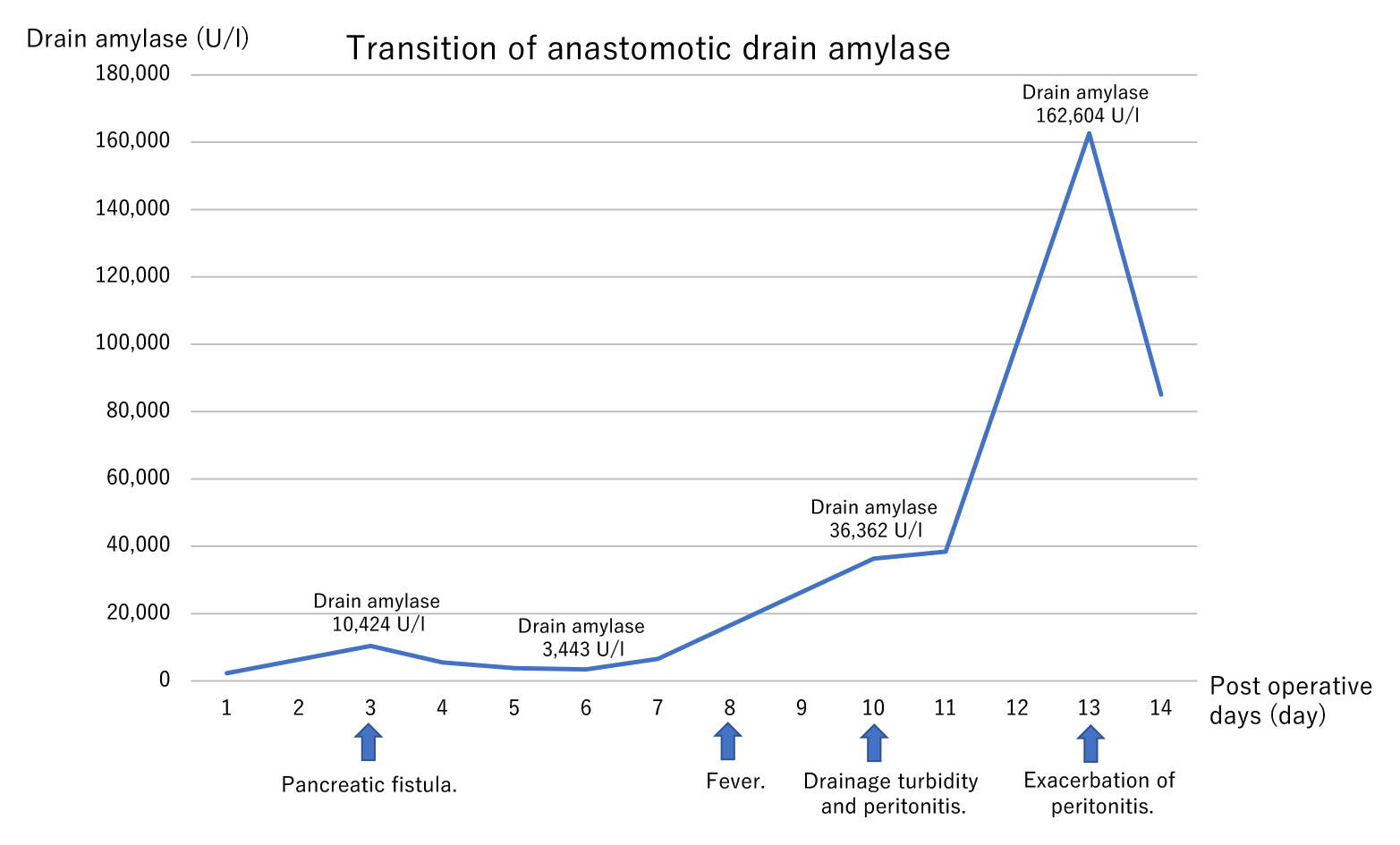
Clinical course and transition of anastomotic drain amylase.
腎細胞癌はR0手術を行ったとしても約20~40%で転移再発をすると報告され1),その遠隔転移先は肺76%,リンパ節66%,骨42%,肝臓41%と報告されている2)腎細胞癌遠隔転移再発の治療に関しては腎癌診療ガイドライン20175)では脳および骨転移を除き転移巣切除が推奨されている.複数の転移を認める場合も完全切除が予後改善の重要因子とされる.転移巣が切除された場合の全生存期間中央値は80.1か月と報告され良好である7).上記に述べたとおり再発および転移性腎細胞癌の治療は外科的切除が重要視されてきたが,2016年より免疫チェックポイント阻害薬の使用が可能となりその有用性が報告されている8).現在では抗PD-1抗体のニボルマブと抗CTLA-4抗体のイピリムマブ併用といった複合免疫療法が行われさらなる治療効果の改善が見込まれている.しかし,複合免疫療法は腎細胞癌の最も一般的な組織型である淡明細胞型に有効であることが示されるのみで,乳頭状型,嫌色素性型,肉腫様変化を伴うものなど約20%を占めるその他の組織型への有効性は明らかではない.今後は外科的切除で予後が得られる集団,免疫療法が有効な集団を見極めていく必要がある9)~11).
腎細胞癌膵転移は3~5%と比較的まれである3).腎細胞癌膵転移再発の切除例はこれまで比較的多くの報告が認められ,その特徴をまとめると10年前後と晩期再発の傾向を示し,無症状のうちに定期画像検査で指摘される場合が多い.術前診断は既往歴に腎細胞癌があり画像所見にて膵臓に多血性腫瘍を認めれば比較的容易に診断される.鑑別疾患は膵NETであるが,囊胞形成や石灰化を伴わない膵NETは非常に類似した画像所見を示し鑑別困難な場合が多い.膵NETの診断には超音波内視鏡下針生検(endoscopic ultrasonography guided fine needle aspiration;以下,EUS-FNAと略記)による組織診断が有用とされ12).しかし,腫瘍全体が多血性腫瘍のためEUS-FNAは出血の危険性が高いと判断されることもあり,自験例でもEUSは行ったが穿刺は施行されず確定診断をつけることは困難であった.治療に関しては,5年全生存率が膵切除例で72.6%,非膵切除例で14%と報告され5)外科的切除が第一とされる.術式に関しては病変の局在や大きさで腫瘍核出術や膵部分切除も選択可能であるが多くの症例で膵頭十二指腸切除術(pancreaticoduodenectomy;以下,PDと略記)や膵体尾部切除術(distal pancreatectomy;以下,DPと略記)などの定型手術が選択される場合が多い.血行性転移が多いため系統的リンパ節郭清は不要と考えられている13).腎細胞癌における根治的腎切除においてもリンパ節転移が疑われないかぎりリンパ節郭清は推奨されていない5).膵切除後の残膵再発は4%であり14),予後不良因子として転移巣病変の大きさが2.5 cm以上と複数転移が報告されている15).
一方で腎細胞癌大腸転移は1.2%と報告され極めてまれである4).切除報告例を医学中央雑誌(1964~2019年,会議録を除く)およびPubMed(1950年から2021年4月)で,それぞれ「腎細胞癌」,「大腸転移または結腸転移」と「renal cell carcinoma」,「colon metastasis」で検索したところ自験例を含め24例の症例を認めるのみであった(Table 1)4)6)16)~34).24名のうち18名が男性(不明2例)であり男性が多く,全例(不明3例)で腹痛,下血,血便などの症状を認め発見動機となる.再発期間は平均7.2(1~17)年(不明3例)と晩期再発の傾向は同様であった.腫瘍の部位に関してはいずれの結腸,直腸にも発生しており,肝彎曲部と脾彎曲部を含む横行結腸病変は8例で約33%であった.内視鏡所見は中心に陥凹あるいは潰瘍を有する隆起性病変あるいは1型腫瘍のような粘膜下腫瘍様の形態を示すパターンが多い25).易出血性で脆く,自験例のように生検では壊死組織のみで確定診断困難な場合が多い.画像所見は膵転移の画像所見と同様に血流が豊富であり多血性の腫瘍像を呈する.原発巣の組織型は淡明細胞型が最も多いが乳頭状型や嫌色素性型の場合もある34).術前診断は膵転移と同様に既往歴,内視鏡や画像所見にて疑うことは比較的容易であるが生検を施行しても確定診断に至る症例は少ない.予後に関しては再発が明らかな症例は2例のみであり,そのうち1例は原病死であったが,切除が施行できれば予後は良好と思われ,他臓器転移部位のうち大腸転移は予後が比較的良い可能性がある.孤立性転移が少なく複数臓器転移症例が多いとされる6).実際に切除報告例では複数臓器転移症例は自験例含め24例中6例であり,その割合は25%と比較的高い.よって他臓器転移を含めた治療戦略が重要である.大腸転移は貧血など有症状のため手術が必要となる場合がある.既報では切除例は自験例以外いずれも他臓器転移巣は切除不能であって大腸転移の切除のみ施行されていた.自験例は大腸,膵同時合併切除を行った初めての報告である.
| Case | Author | Year | Age | Gender | Symptoms | Period until recurrence (year) | Location | Other metastasis | Surgery | Recurrence | Outcome |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Thomason16) | 1991 | 71 | M | Hematochezia | 17 | Splenic flexure | NR | Left hemicolectomy | NR | NR |
| 2 | Tokonabe17) | 1996 | 83 | M | Melena | 7 | Transverse colon | — | Partial transverse colectomy | NR | NR |
| 3 | Avital18) | 1998 | 72 | F | Abdominal pain, anemia | 5 | Right colon | — | Right hemicolectomy | NR | NR |
| 4 | Hirayama19) | 1999 | NR | NR | NR | NR | NR | NR | NR | NR | NR |
| 5 | Harada20) | 2000 | NR | NR | NR | NR | NR | NR | NR | NR | NR |
| 6 | Fujita21) | 2002 | 59 | M | Melena | 5 | Descending colon | Lung, Bone, Pancreas | Descending colectomy | — | Alive (12 months) |
| 7 | Murata6) | 2008 | 79 | F | Melena | 1 | Descending colon | Lung | Descending colectomy | — | Alive (0.5 months) |
| 8 | Valdespino-Castillo22) | 2008 | 60 | M | Hematochezia | 8 | Splenic flexure | — | Left hemicolectomy | — | Alive (NR) |
| 9 | Yetkin23) | 2008 | 60 | M | Abdominal pain, anemia | 5 | Hepatic flexure | NR | Right hemicolectomy | NR | NR |
| 10 | Jadav24) | 2010 | 65 | F | Abdominal pain | 9 | Transverse colon | — | Transverse colectomy | — | Alive (54 months) |
| 11 | Ikehara25) | 2011 | 66 | M | Melena, undifferentiated dizziness | 2 | Ascending colon | — | Laparoscopically assisted right hemicolectomy | Lung, Pancreas, Adrenal glands | Alive (73 months) |
| 12 | Onakatomi26) | 2013 | 70 | M | Hematochezia | 12 | Rectum | Lung, Pancreas, Brain | Laparoscopically assisted high anterior resection | — | Alive (12 months) |
| 13 | Milovic27) | 2013 | 63 | M | Abdominal pain | 2 | Sigmoid colon | NR | Left hemicolectomy | NR | NR |
| 14 | Milovic27) | 2013 | 35 | M | Nausea, vomiting | 2 | Splenic flexure | Lung, Kidney | Right hemicolectomy | Bone, Brain | Dead (30 months) |
| 15 | Milovic27) | 2013 | 39 | M | Constipation | 4 | Ileocecal valve | — | Right hemicolectomy | — | Alive (9 months) |
| 16 | Vo28) | 2016 | 67 | M | Hematochezia | 9 | Rectum-sigmoid | — | Anterior resection | Liver | Alive (6 months) |
| 17 | Katayama29) | 2018 | 80 | M | Melena | 16 | Rectum | Lung | Resection | NR | NR |
| 18 | Zhang30) | 2019 | 84 | M | Hematochezia | 13 | Rectum-sigmoid | — | Anterior resection | — | Alive (9 months) |
| 19 | Subasi31) | 2019 | 63 | M | Hematochezia | 5 | Splenic flexure | — | Left hemicolectomy, splenectomy | — | Alive (6 months) |
| 20 | Honma4) | 2019 | 60s | M | Abdominal pain, vomiting, fever | 2 | Descending colon | — | Left hemicolectomy | NR | NR |
| 21 | Kataoka32) | 2020 | 65 | M | Arthritic pain | 1 | Ascending colon | — | Laparoscopic right hemicolectomy | — | Alive (3 months) |
| 22 | Okamoto33) | 2020 | 86 | M | NR | 16 | NR | NR | Resection | NR | Alive (12 months) |
| 23 | Saadaat34) | 2021 | 40 | F | Abdominal pain, constipation | NR | Rectum | — | Abdominoperineal resection | NR | NR |
| 24 | Our case | 61 | M | Fecal occult blood positive | 11 | Transverse colon | Pancreas | Partial transverse colectomy | — | Alive (14 months) |
NR: not reported.
腎細胞癌術後の大腸,膵同時性転移再発症例の治療戦略について検討する.治療方針の決定では第一に切除可能であるか判断を行い切除可能であれば外科的切除,切除不能であれば上述の免疫チェックポイント阻害剤による複合免疫療法など薬物療法を検討する.切除可能である場合,手術の原則は転移巣の完全切除でありそれをふまえ,症例に応じて適応術式やリンパ節郭清の施行を決定する.大腸手術は準清潔手術であり,大腸と膵臓の同時切除は膵切除単独よりも感染リスクが高い可能性がある.結果として術後合併症の発生リスクが上昇する可能性があり注意が必要である.膵切除での膵液瘻の発生率は3~30%と高率であり腹腔内膿瘍,縫合不全,腹腔内出血,胃排泄遅延などの合併症と関連性が報告されている35)36).膵切除での術式がPDの場合は細菌感染が膵液瘻のリスク因子と報告されているが37),一方で今回施行したDPでは術後膵液瘻が細菌感染との関連を示す報告は少ない.背景にはDPではPDのような胆管吻合での胆汁の暴露や胃空腸吻合での胃,腸液の暴露がないためと考えられる.感染に関連した膵液瘻の発生率は9.0~11%と報告されるが38)39),感染経路に関してはドレーンから膵液瘻への逆行性感染がInternational Study Group on Pancreatic Surgery国際基準40)Grade B/Cの原因であると報告されておりドレーン管理に注意する必要がある.Osakabeら41)はDPにおいてドレーン培養からStaphylococcus speciesやCorynebacterium speciesなど皮膚常在菌が検出されたことを根拠に,ドレーンから膵液瘻への逆行性感染を報告したが,自験例では腹腔内膿瘍から腸管の常在菌であるKlebsiella pneumoniaeが検出されていること,Fig. 4aで示したようにドレーンが吻合部を経由して膵切離面に留置されていたことから膵液瘻へ感染源として,大腸手術の関連が疑われる.しかし,ドレーン排液培養を検索しなかったため断定は不可能である.ドレーンの早期抜去とドレーン排液培養での感染管理が必要である.ドレーンの留置部位にも留意する必要がある.大腸腫瘍の位置は膵液瘻と感染の関連に寄与する可能性がある.自験例のように大腸腫瘍が横行結腸に存在にする場合,大腸吻合部が膵臓に物理的に近い位置に存在するため,膵断端への逆行性感染に関連する可能性があるが推測の域を出ない.ドレーンの位置や経路を慎重に決定することや膵離断面の感染に留意し頻回のドレーン排液培養をすべきであったと反省させられた症例であった.
利益相反:なし