2024 Volume 31 Issue 2 Pages 51-54
2024 Volume 31 Issue 2 Pages 51-54
脊髄刺激療法(spinal cord stimulation:SCS)は保存療法では効果が不十分な神経障害性疼痛に対して有効性が期待できる治療法の一つである.今回,アルコール性および栄養欠乏性神経障害による難治性の下肢痛に対しSCSを施行し,著効した症例を経験したので報告する.症例は40歳女性,拒食症やアルコール多飲の既往あり.2年前より両下肢の疼痛があった.紹介元で栄養欠乏性およびアルコール性神経障害による両下肢痛と診断され,補充療法によりビタミンは正常化したが症状改善なく,疼痛緩和目的で当科紹介となった.内服や光線療法による保存療法では疼痛コントロールが困難であった.SCS試験刺激を施行したところ,術後より症状の改善が得られたため,本植え込み術を施行した.糖尿病,ビタミン欠乏,アルコール依存などによって起こる代謝性/栄養欠乏性神経障害は原疾患の治療後も疼痛管理に難渋することがあるが,本症例のようにSCSが著効する場合があり,SCSは保存療法に抵抗性である症例に対して検討すべき治療法である.
Spinal cord stimulation (SCS) is considered to be an effective therapy for neuropathic pain that does not respond to conservative treatment. We report a case in which SCS effectively improved the chronic intractable lower leg pain due to nutritional and alcoholic neuropathy. A 40-year-old woman, with a history of alcoholism and anorexia. About two-years ago, she presented with lower leg pain. She was diagnosed with nutritional and alcoholic neuropathy by a neurologist and treated with vitamin supplementation. However, she was suffering from severe pain, and she was referred to our department. We treated with conservative treatments but they were not effective. Therefore, SCS was performed, and her symptoms improved after surgery. Metabolic neuropathy due to vitamin deficiency and alcoholism is occasionally accompanied by a form of intractable pain despite treatment of the primary disease. SCS treatment should be considered as an effective treatment for non-responders to conservative treatments.
脊髄刺激療法(spinal cord stimulation:SCS)は保存療法では効果が不十分な末梢神経障害性疼痛に対して有効性が期待できる治療法の一つであるが,栄養欠乏性およびアルコール性神経障害に対してSCSを行った報告は見当たらない.われわれは,栄養欠乏性およびアルコール性神経障害による下肢痛に対してSCSが著効した症例を経験したので報告する.
本報告に関しては,患者から書面による承諾を得ている.
患者:40歳,女性.身長157 cm,体重46 kg.既往歴として高血圧,拒食症,アルコール多飲があった.2年前より両下肢の疼痛があった.血液検査でビタミンB1 2.1 ng/ml(基準値24~66),葉酸3.0 ng/ml(基準値4.0以上),ビタミンB12は正常範囲内であり,紹介元の神経内科医により栄養欠乏性およびアルコール性神経障害による両下肢痛と診断された.ビタミン補充や対症療法を行い,ビタミンB1,葉酸は正常化したが症状改善はなく,当科紹介となった.
現症:両膝下より遠位,特に両足底に強い疼痛を認め,numerical rating scale(NRS)は9~10/10であり,冷感や悪天候により増悪した.明らかな感覚障害はなく,腱反射は低下していた.疼痛による睡眠障害は認めなかった.
治療経過:前医で処方されていたプレガバリン300 mg/日,トピラマート200 mg/日に加えて内服調整を試みたが,デュロキセチン,アセトアミノフェン,トラマドールは気分不良のため内服継続が困難だった.また,非ステロイド性抗炎症薬は効果がなかった.光線療法も効果が乏しく,疼痛コントロールが困難だった.このため,患者の希望にてSCSを試みることとした.本人に合併症を十分に説明した上で,試験刺激で効果判定し,効果がなければ中止し,効果があれば本植え込み術を行うこととした.硬膜外ブロックは施行していない.
試験刺激では,局所麻酔下にメドトロニック社製8極リード2本をL2/3より刺入し,足底をターゲットとしてパレステジアマッピングに基づきリード先端をTh12下端に留置し,刺入部を切開してアンカーを筋膜に固定した.試験刺激で疼痛は著明に改善し,試験刺激から7日後に全身麻酔下に植え込み術を施行した.前回の創部を切開し,試験刺激で留置したリードをエクステンションリードに接続し,脊髄刺激装置を右下腹部に植え込んだ(図1).試験刺激で有効であったパルス幅300 µsec,周波数10 Hz,出力4.0 mAのlow dose刺激で刺激を行ったところ,NRS 2/10まで疼痛緩和が得られた.刺激部位を図2に示す.術後合併症なく,本植え込み術から2日目に退院.SCS開始6カ月後も当科通院中であり,患者の希望のため内服薬は減量していないが,疼痛増強なく経過している.

リード留置後の画像
左は試験刺激,右は刺激装置植え込み後のX線画像.リードを経皮的にL2/3より刺入し,リード先端をTh12下端に留置した.
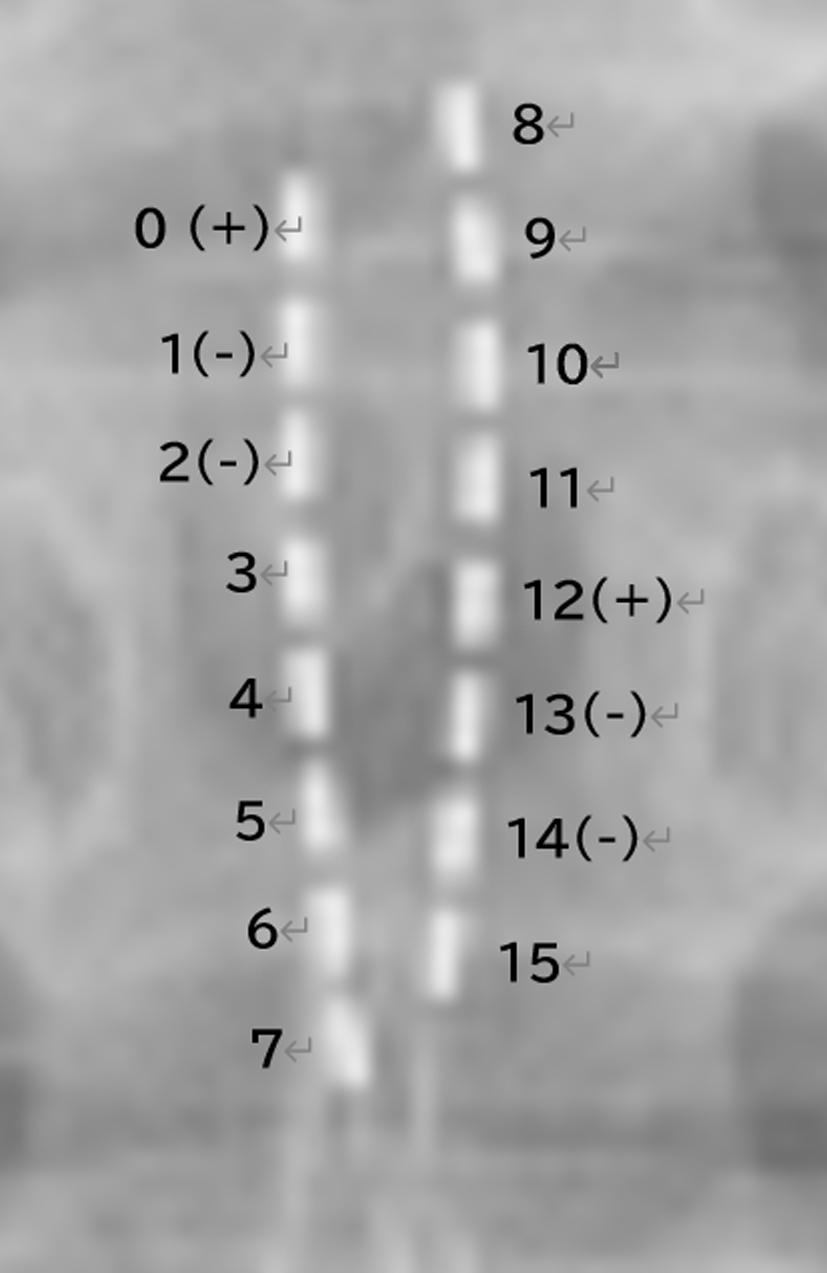
使用電極部位
計16カ所の刺激部位を組み合わせて刺激を行い,本症例での使用電極は0+1−2−12+13−14−とした.
日本神経学会では,糖尿病,ビタミン欠乏,アルコール依存症などによって起こる神経障害を代謝性/栄養欠乏性神経障害として同一カテゴリーで扱っている1).代謝性/栄養欠乏性神経障害の頻度は高く1),特に糖尿病患者の約30%に症候性の神経障害を合併する2).有痛性糖尿病性末梢神経障害(painful diabetic peripheral neuropathy:PDPN)に対するSCSの有効性を示した報告は散見されるが3–5),PDPN以外の代謝性/栄養欠乏性神経障害に対してSCSを行った報告は見当たらない.
PDPNは軸索障害性神経障害の所見を呈し,下肢優位に神経症状が出現する6,7).本症例の神経障害は,拒食症やアルコール多飲の既往があり,ビタミンB1欠乏性,葉酸欠乏性,アルコール性いずれの原因も考えられる.ビタミンB1欠乏性や葉酸欠乏性神経障害は,それらの摂取不足により神経障害が引き起こされるが,アルコール性に関しては,多量のアルコール摂取に伴いビタミンB1欠乏が生じる栄養欠乏性とは別に,エタノールやアセトアルデヒド等の代謝産物による神経に対する直接障害によって引き起こされると考えられている.そしてこれらビタミンB1欠乏性,葉酸欠乏性,アルコール性のいずれも下肢優位の軸索障害性神経障害を呈し8),その点でPDPNと類似している.
代謝性/栄養欠乏性神経障害は,早期診断,原疾患の治療介入により,進行の停止,改善が期待できる疾患である6,8)が,不可逆的な変化をきたすまで進行すると症状コントロールに難渋する.PDPNの第一選択薬は,Ca2+チャネルα2δリガンド,セロトニン・ノルアドレナリン再取り込み阻害薬,三環系抗うつ薬が挙げられ,効果不十分な時はトラマドール,メキシレチンなどが考慮される6).本症例ではPDPNの治療に倣い治療を行ったが,保存療法でのコントロールが困難であった.SCS施行後は下肢の疼痛が著明に改善した.
SCSの鎮痛機序に関しては,MelzackとWallにより提唱されたゲートコントロール理論の概念を基盤としてきた.これは,脊髄後角にある抑制性介在ニューロンが痛みの信号を伝達する伝達細胞に対してゲートを閉じる門番の働きをしており,触圧覚や深部覚を伝える太い線維(Aβ線維)は低閾値であるため,痛みを伝える細い線維(AδおよびC線維)よりも優先的に活性化され,AδおよびC線維の興奮を抑制するという説である9,10).しかしその後,ゲートコントロール理論だけでは説明ができないことが明らかになり,そのメカニズムは実際のところ明らかにされていない.ほかにSCSの鎮痛機序としては,下行性疼痛抑制系の賦活化,交感神経抑制作用,神経伝達物質の分泌などが考えられている11–13).
代謝性/栄養欠乏性神経障害の一つであるPDPNに対してSCSを行う推奨度は,慢性疼痛診療ガイドライン(2021年)では2B(施行することを弱く推奨する)とされている.PDPNに対するSCSの有効性を示したrandomized controlled trial(RCT)は二つある3,4)のみで,さらなる質の高いRCTが待たれる状況5)ではあるが,PDPNに対するSCSの有効性を示したコホート研究は多数ある5).一方でPDPN以外の代謝性/栄養欠乏性神経障害に対してSCSを行った報告は見当たらない.そのためか慢性疼痛治療ガイドラインではSCSの適応に関して代謝性/栄養欠乏性神経障害というくくりではなくPDPNに限定して記載されている.PDPN以外の代謝性/栄養欠乏性神経障害では原疾患の治療を優先することが多いが,原疾患のコントロールが行われた後も疼痛コントロールに難渋するケースが多い.また,本症例のように拒食症やアルコール多飲などの精神疾患を合併している場合,早期診断が難しく,SCSを行うこと自体がためらわれることもある.本症例は精神科に通院していなかったが,原疾患のコントロールが行われた上で,精神状態も安定していたためSCS施行可能であると判断した.しかし,状態によっては精神科と連携しながら導入時期を検討し,SCS施行後も定期的にフォローする必要性があると考えられる.また,今回のような若年者の場合,使用経過が長くなれば電池交換やリード断線が問題となりえる.本症例ではインテリスTMという充電式の刺激装置を使用しており,電池寿命は9年の規定であるが,9年経過しても刺激が出力できなくなるなどの制限はなく,基本的に植え込み後は半永久的に使用可能である.リード断線に関しては,活動度が高い患者では注意が必要である.しかし,British Pain Societyのガイドラインに示されているように,SCSは神経障害性疼痛に対して本来良い適応14)であり,本症例のように著効する症例もある.今後,SCSはPDPN以外の代謝性/栄養欠乏性神経障害による難治性疼痛に対しても検討すべき治療法と考える.
当院での試験刺激は,約1週間で効果判定を行っている.過去の症例は経皮的に行っていたため,効果判定後にリードを抜去し,効果があった場合は再入院して手術を行っていた.そのため,再び局所麻酔下にリードの挿入を行い,その後に全身麻酔下に刺激装置の植え込みを行っていた.その場合,硬膜外腔が癒着してリードの挿入に難渋したり,試験刺激の時と全く同じ位置にリード先端を誘導できず同等の効果が得られなかったりと,患者の満足度が低いことがあった.本症例では一度の入院中に試験刺激と本植え込み術の両方を行いたいという患者の希望もあり,外科的に試験刺激を行ったが,本植え込み術の際は始めから全身麻酔下で行うことができたため,患者の苦痛が少なく満足度も高かった.
栄養欠乏性およびアルコール性神経障害による下肢痛に対しSCSが有効であった1例を経験した.SCSは,PDPN以外の代謝性/栄養欠乏性神経障害による痛みに対しても検討すべき治療法である.
本報告の要旨は,日本ペインクリニック学会第56回大会(2022年7月,東京)において発表した.