2020 Volume 31 Issue 4 Pages 446-451
2020 Volume 31 Issue 4 Pages 446-451
抗リン脂質抗体症候群(antiphospholipid syndrome: APS)は,抗リン脂質抗体(antiphospholipid antibodies: aPL)と総称される数種の抗体群が関連する自己免疫性血栓症および妊娠合併症である1).多くの研究により,aPLは凝固促進および炎症誘発性状態を誘発する病原性自己抗体であると考えられている.例えば,aPLの力価と多様性に基づいて計算される定量的マーカーである抗リン脂質スコアは,血栓症の発症リスクと正の相関がある2).また,基礎研究においてはaPLが線溶活性を抑制し3),血管内皮細胞を活性化する4).マウスモデルでは,患者由来のaPLの注射により血栓形成が増強された5).これらの機能的所見とは対照的に,aPL産生の機序についてはほとんど知られていない.実臨床においても通常の免疫抑制療法では抗体価の抑制は必ずしも得られず,血栓再発予防にも効果は認められなかったと報告されている6).
本研究ではaPL産生機序の解明を目的として,まずAPS患者のリンパ球サブセット解析と一塩基多型(single nucleotide polymorphism: SNP)およびmRNA遺伝子発現との関連を評価した.次に,細胞のaPL産生能力を評価するex vivoアッセイを確立し,特定のリンパ球サブセットを除去することによりaPL産生に寄与するB細胞サブセットを調査した.
末梢血単核細胞(Peripheral Blood Mononuclear Cells: PBMC)におけるサブセット解析は,自己免疫疾患における特定のリンパ球の成熟と分化を明らかにする.これまでの研究では,制御性T(Regulatory T: Treg)細胞が種々の自己免疫性疾患において減少していることや7),形質芽細胞(Plasmablast)が免疫学的活性を反映し,SLEの早期バイオマーカーとなりうることが示された.これらのサブセット解析からの発見は疾患の病因の深い理解に貢献しただけでなく,新しい細胞ベースの治療アプローチも示唆している.
本研究では,26名の原発性APS(Primary APS: PAPS)患者,19名の全身性エリテマトーデス(systemic lupus erythematosus: SLE)合併続発性抗リン脂質抗体症候群(SLE/APS)患者,10名の健常者を対象にリンパ球サブセット解析を行った.それぞれの被験者のPBMCを分離し,フローサイトメーターを用いて20種のT細胞/B細胞サブセットについて比率を測定した.サブセットの分類についてはStandardizing immunophenotyping for the Human Immunology Projectのプロトコールに沿って行った8).
解析結果のうち,有意差が見られたサブセットを図1に示す.T細胞サブセット解析では,健常者と比較してPAPS及びSLE/APS患者でヘルパーT(Th)細胞,Th2細胞,Th17細胞が増加し,Treg細胞,resting Treg細胞,およびactivated Treg細胞が減少した(図1A).B細胞サブセットでは,健常者と比較してPAPS及びSLE/APS患者でtotal memory B細胞,pre-switched memory B細胞,post-switched memory B細胞が減少し(図1B),Plasmablastは増加した(図1C).
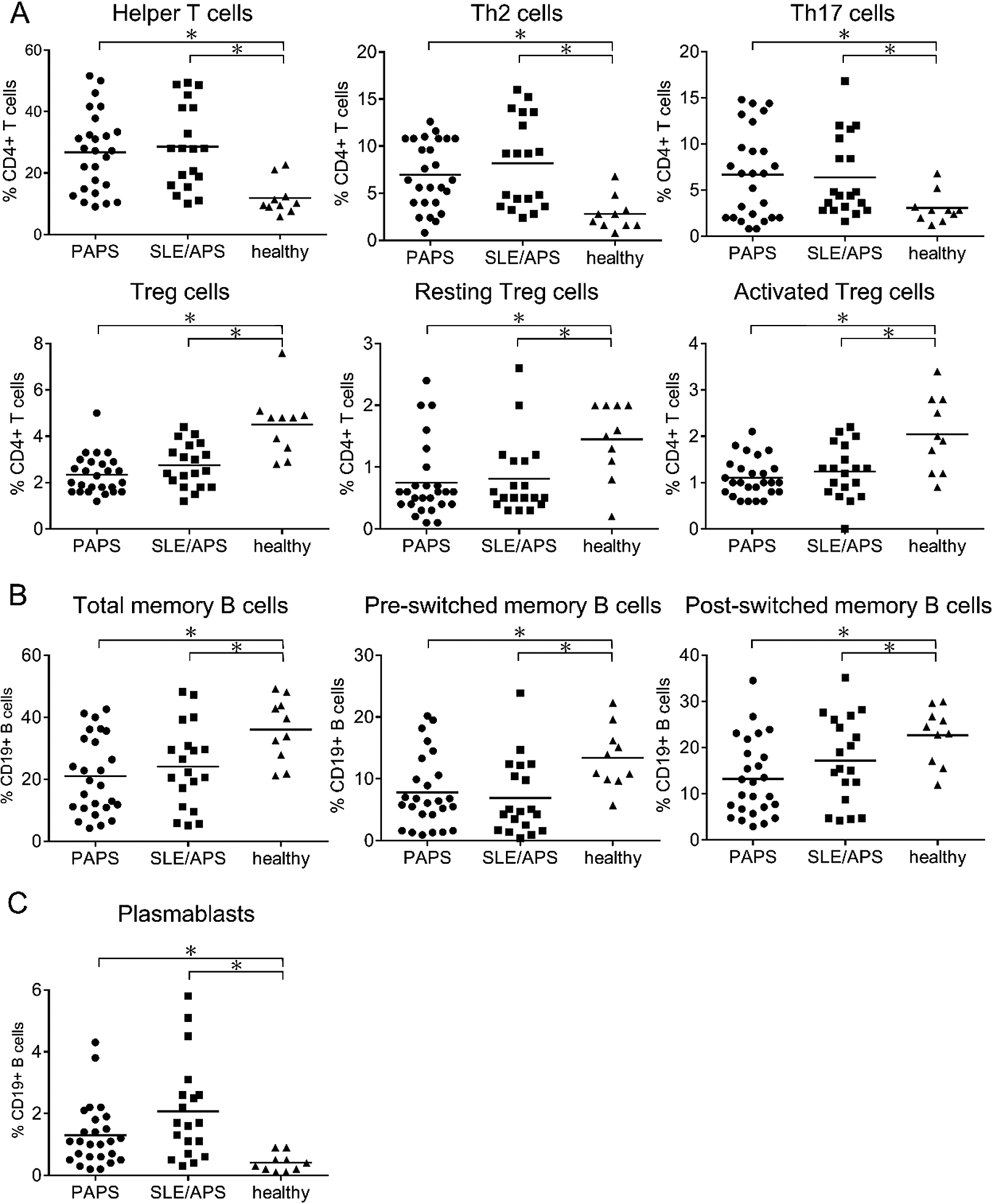
リンパ球サブセット解析結果
PAPS及びSLE/APS患者は健常者と比較してヘルパーT,Th2,Th17,Plasmablastが増加し,Treg,resting Treg,activated Treg,total memory B,pre-switched memory B,post-switched memory Bが減少した.
一方,total CD4+T細胞,Th1細胞,Follicular Th細胞,central memory T細胞,naïve T細胞,effector memory T細胞,effector T細胞,traditional B細胞,CD27-IgD-B細胞,naïve B細胞の割合には,3つのグループ間に有意差は見られなかった.
人の遺伝子を構成しているDNA塩基配列には個体差があり,一般に集団の1%以上のアレル頻度で見られるものを遺伝子多型(genetic polymorphism)と呼ぶ.特に,一塩基について存在する多型をSNPと呼び,遺伝子多型の中でも特に頻度が高いことから着目されている.人における個人差は,このSNPの違いにより大部分が決定されると推測されている.SNPの遺伝子機能や遺伝子発現に与える影響を解明することにより,個人の体質に合わせたより良い治療法,薬剤の選択や医薬品の開発が可能になると考えられている.近年では,リンパ球サブセットとSNPとの関わりが注目されている9).
そこで,APS患者における疾患関連のSNPとリンパ球サブセットとの関連を解析した.リンパ球サブセット解析を行った患者のうち,DNA取得の同意を得られた14名のPAPS患者について,過去にSLEやAPSで関連が報告されている20のSNPを測定した.その結果,Plasmablastの増加とmemory B細胞の減少がToll like receptor(TLR)7のSNP rs3853839と関連していた(図2A,B).その他のリンパ球サブセットとSNPの間には相関は見られなかった.

TLR7 SNP rs3853839とリンパ球サブセット,mRNA gene expressionの関連
TLR7 SNP rs3853839 GGアリルを有するPAPS患者はGCアリルを有する患者と比較してPlasmablastの増加,memory B細胞の減少,IFN scoreの上昇を認めた.
更に,TLR7 SNPの機能を分析するため,TLR7のmRNA発現レベルと,TLR7の下流にあたるI型IFN調節遺伝子であるLY6E,MX1,IFIT1,IFIT3の4つのmRNA発現レベルを使用して計算されるIFNスコア10)を測定した.TLR7 SNP rs3853839 GCアレルと比較して,リスクアレルGGを有している患者で有意にIFNスコアが高かった(図2D).TLR7の発現もTLR7 SNP GGアレルで高い傾向が見られたが,統計学的有意差は見られなかった(p=0.059)(図2C).
リンパ球サブセット解析でのPlasmablastの増加と,APSの遺伝的変異との関連を考慮すると,APSの病因におけるPlasmablastの重要な働きが推測された.Plasmablastは他のB細胞と異なりCD20の発現が無いことが特徴であり,CD20陽性及び陰性B細胞からのaPL産生をex vivoで比較することで,aPL産生サブセットの同定を試みた.
APS患者または健常者のPBMCをIL-6,IL-21,CD40リガンドおよびAPRILの存在下で培養し,培養上清中のaPLを測定した.aPLの測定はELISA法による抗カルジオリピン抗体(aCL)-IgG/IgMと,フローサイトメーターを用いた抗β2GPI/HLAクラスII複合抗体(aβ2GPI/HLA class II complexes-IgG/IgM)検出アッセイ11)の2つの方法で行った.
抗カルジオリピン抗体-IgGは,APS患者,特に血清aCL-IgGの力価が高い患者のPBMCの培養上清で検出されたが,健常者では検出されなかった(図3A).一方,aCL-IgMはAPS患者と健常者PBMCの両方の培養上清で検出されなかった(図3B).これは,aCL-IgMを検出するELISAの感度が比較的低いか,ex vivoでaCL-IgMを産生する能力が低いためと考えられる.
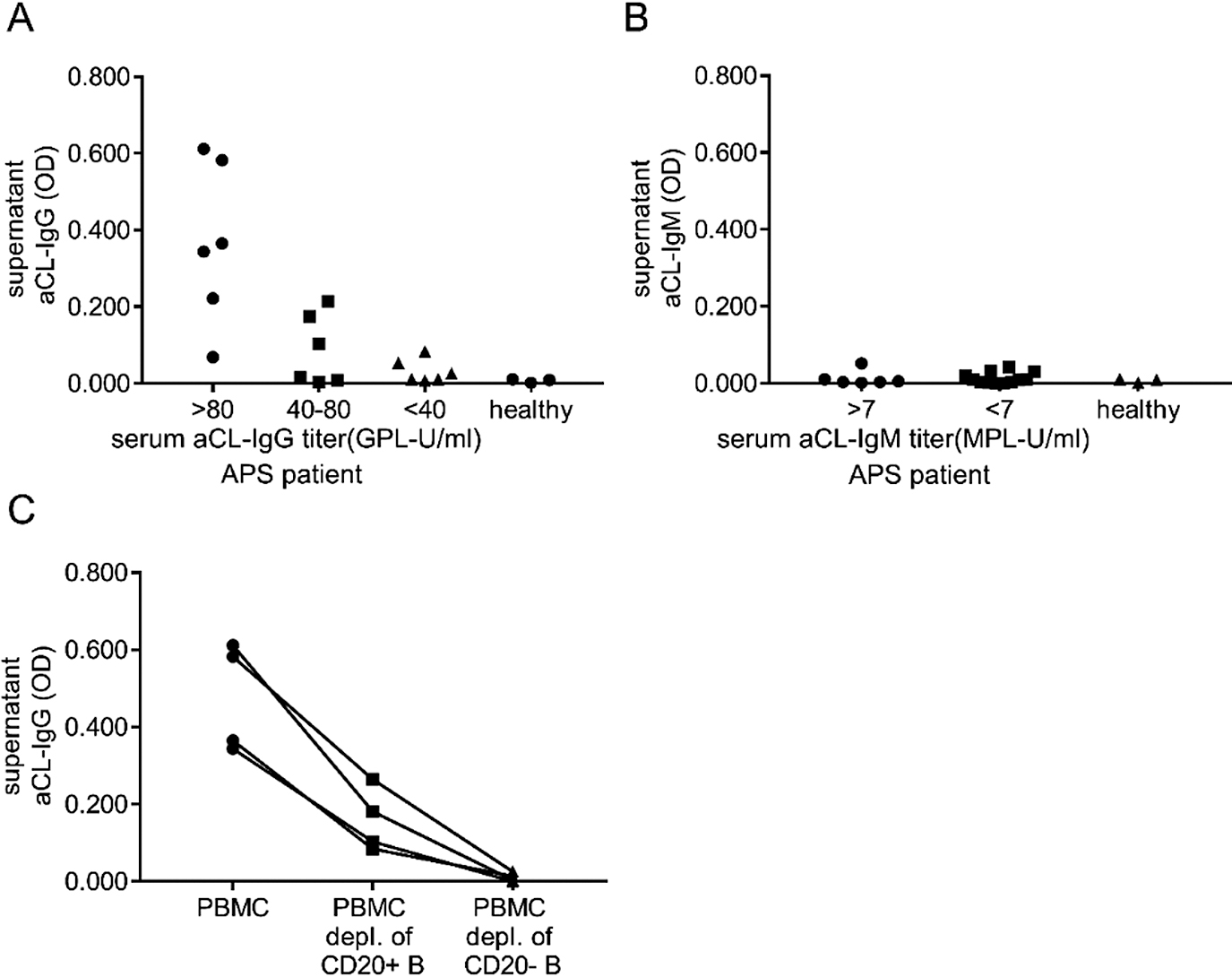
APS患者のPBMC培養上清中のaCL-IgG/IgM測定
CD20陰性B細胞を除去したPBMCの培養上清ではaCL-IgGは検出されなかった.
次に,APS患者のPBMCからCD20陽性B細胞(CD19+CD20+サブセット)またはCD20陰性B細胞(CD19+CD20–サブセット)をセルソーティングで除去した上で,同様の条件で培養上清のaPLを測定した.その結果,CD20陽性B細胞を欠くPBMCの培養上清中のaCL-IgGは検出可能であったが,CD20陰性B細胞を欠くPBMCの培養上清ではaCL-IgGは検出されなかった(図3C).
aPLを検出するためのもう1つのアッセイである抗β2GPI/HLAクラスII複合抗体アッセイでも検討を行った.aβ2GPI/HLA class II complexes-IgG/IgMはともにAPS患者血清でのみ検出可能であった(図4A,B).aβ2GPI/HLA class II complexes-IgMは,PBMCおよびCD20陽性B細胞を除去したPBMCの培養上清で検出されたが,CD20陰性B細胞を除去したPBMCの培養上清では検出されなかった(図4D).一方aβ2GPI/HLA class II complexes-IgGはいずれの細胞培養上清からも検出されなかった(図4C)が,これは検出アッセイ感度の問題と考えられる.

APS患者の血清およびPBMC培養上清中のaβ2GPI/HLA class II complexes-IgG/IgMの測定
CD20陰性B細胞を除去したPBMCの培養上清ではaβ2GPI/HLA class II complexes-IgMは検出されなかった.
これらの結果はaPL産生において,Plasmablastが多くを占めるCD20陰性B細胞の関与を強く示唆するものであった.
APSの病態生理は不明な点が多く,これまでの関連研究のほとんどは,aPL細胞の相互作用,細胞内シグナル伝達,それに続く組織因子などの凝固促進遺伝子の発現に焦点を当ててきた.しかし,高力価/多種類のaPLが血栓症の高リスクであることも考慮すると,どの細胞サブセットからaPLを産生しているか解明することは重要である.
興味深いことに,この研究で明らかになったAPS患者のT細胞およびB細胞サブセットは,Th2,Th17,Plasmablastの増加やTreg,memory B細胞の減少などSLE患者でこれまで報告されていたもの12–15)と同様であり,SLEとAPSの病態生理の類似性を示唆した.更に,Plasmablastは病原性サイトカインと自己抗体を産生することで自己免疫疾患の発症に関与している可能性が指摘されており16),本研究でもAPSにおける病因と自己抗体産生への関与が示唆された.また,PAPS患者においてTLR7 SNPとPlasmablast増加が関連しており,SLE等の自己免疫疾患の病因における中心的なメディエーターであるI型IFN関連遺伝子の発現とも相関することが示された.TLR7 SNPとI型IFN関連遺伝子との関連はSLE患者の既報においても同様の結果10)であった一方,Plasmablastとの関連については本研究が初めての報告である.一部のPAPS患者は長期経過後にSLEを発症することがあるが,これらの結果はSLEとAPSの類似性を強調する結果であった.
更に,B細胞は抗体産生において直接的,間接的に重要な役割を果たすことが知られており,間接的な役割には,細胞間相互作用や,濾胞ヘルパーT細胞などの非B血液細胞を活性化し,その後抗体産生の増加をもたらすサイトカイン産生が含まれる17).今回,CD20陰性B細胞を主要なaPL産生細胞サブセットとして特定した.Naïve B細胞,memory B細胞を含む末梢血B細胞の中でPlasmablastがCD20陰性B細胞の大多数を占めており18),Plasma cellなど他のCD20陰性B細胞は末梢血ではほとんど見られないため,aPL産生におけるPlasmablastの役割が強く示唆される.実際,抗CD20モノクローナル抗体であるリツキシマブは現在ANCA関連血管炎などのいくつかの自己免疫疾患の治療に使用されている19)が,APSにおいては第II相試験でリツキシマブ療法後にaPL力価の減少を観察できなかった20)ことも,CD20陰性B細胞の重要性を示している.通常のCD20陽性B細胞ではなく,CD20陰性細胞,特にPlasmablastを標的とする新しいAPSの治療戦略について,今後の更なる研究が望まれる.
本研究は,北海道大学院医学研究院免疫代謝内科学教室の渥美達也教授,加藤将助教のご指導をはじめ,教室員の皆様のご協力のもとで遂行されたものであり,この場を借りて深く御礼申し上げます.
本論文発表内容に関連して開示すべき企業等との利益相反なし