1.COVID-19とは
新型コロナウイルス感染(Coronavirus Disease 2019: COVID-19)は,Severe Acute Respiratory Syndrome Coronaviruses 2(SARS-CoV-2)に起因する感染症である.感染者の8割では軽症ないし無症状であるが,2割の感染者では重症化あるいは最悪の場合は,死に至る.男性に感染者が多いことや,高齢者や,合併症(心血管疾患,高血圧症,糖尿病,肥満など)を有している場合に重症化しやすいことは良く知られているが1–3),若年者や合併症のない場合でも重症化することがあり,どのような要素により,転帰が分かれるのか不明な点も多い.
何らかの遺伝的な要素もあると考えられる.実際,SARS-CoV-2に対する免疫学的反応の性差4),血液型O型での感染者が少ないこと5)が報告されている.
死因としては呼吸不全が最も多いが,過剰な免疫・炎症反応いわゆるサイトカインストームを伴った凝固活性化,血栓症や播種性血管内凝固(DIC)発症,多臓器不全への進展も死因となる6–10).特に,血栓症やDICは病態の急激な悪化につながる可能性がある.
2020年9月末の時点で,世界での死亡者数は100万人を超えている.2021年1月には死亡者数は300万人に達する可能性がある一方で,マスク,フェイスシールド,ソーシャルディスタンスなどの予防策の徹底で,死亡者数を大きく抑制できる可能性も指摘されている11).
2.これまでのCOVID-19の凝固検査と問題点
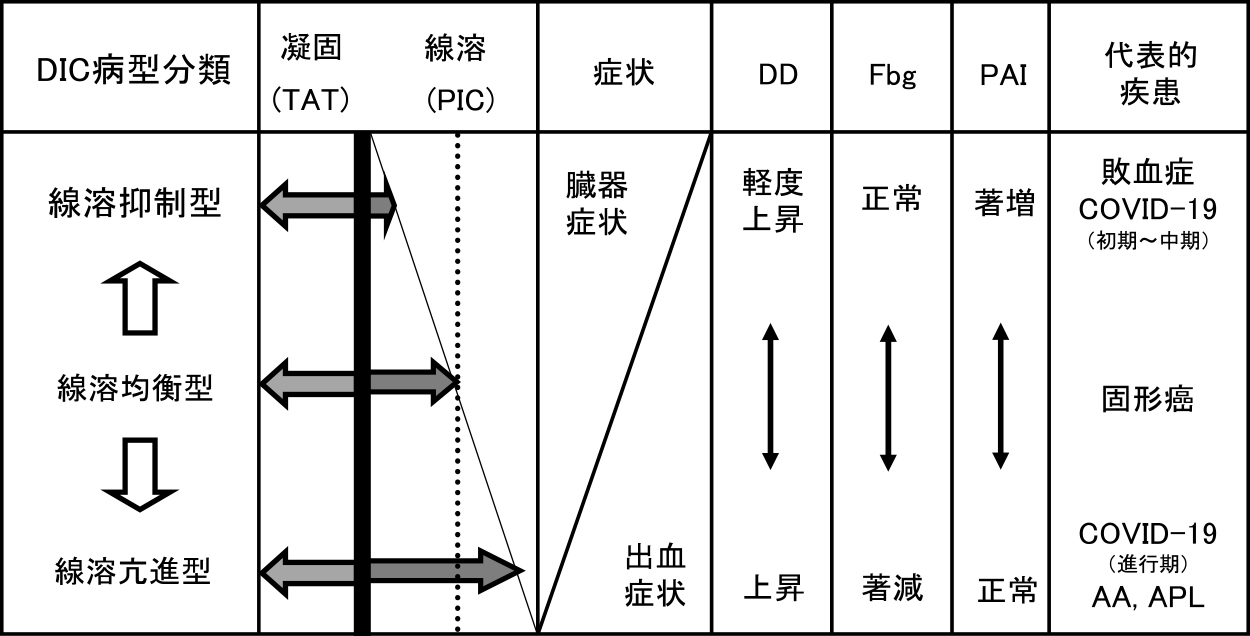
COVID-19の凝固線溶異常と関連して最も多くの報告が見られているのは,血中D-ダイマーの上昇である.D-ダイマーの上昇と,予後との関連を論じた報告は多い2, 12–14).多くの論文では,D-ダイマーの上昇は重症度と関連すると報告されているが,もし体内に大量の血栓形成が見られても溶解されない病態(生体にとっては最重篤)では,D-ダイマーの上昇は軽度にとどまる可能性がある.具体的には,敗血症に合併した線溶抑制型DIC15)では,死亡するような重症例でもD-ダイマー上昇は比較的軽度である.D-ダイマーの上昇度は重症度と相関すると短絡的に考えると,病態把握を見誤る可能性がある.
COVID-19の血栓性病態を評価する上で,確かにD-ダイマーは有用なマーカーであろう.しかし,これまでのCOVID-19における凝固線溶を論じた報告では,以下の問題点がある.
1)入院時のD-ダイマーのレベルで予後を推測できるとする報告がほとんどである(経時的な変化を論じた報告が少ない).
2)凝固線溶検査のうちD-ダイマー,PTの測定は多いが,フィブリノゲン,APTT,FDPの測定が比較的少ない.
3)凝固・線溶活性化をみる本質的マーカーであるトロンビン-アンチトロンビン複合体(TAT),プラスミン-α2プラスミンインヒビター複合体(PIC)を検討した報告が極端に少ない.可溶性フィブリン(SF)で評価した報告は皆無である.アンチトロンビン活性が低下した病態や,血中のアンチトロンビン活性の測定値が低下していなくても血管内皮障害のために血管内皮に結合したアンチトロンビンは少ない病態では,生体内でのトロンビン形成が亢進していてもTATがあまり上昇しない可能性もある.そのような場合に,SFによる評価が有効の可能性があるが,今後の検討課題である.
3.凝固線溶病態のダイナミックな変動
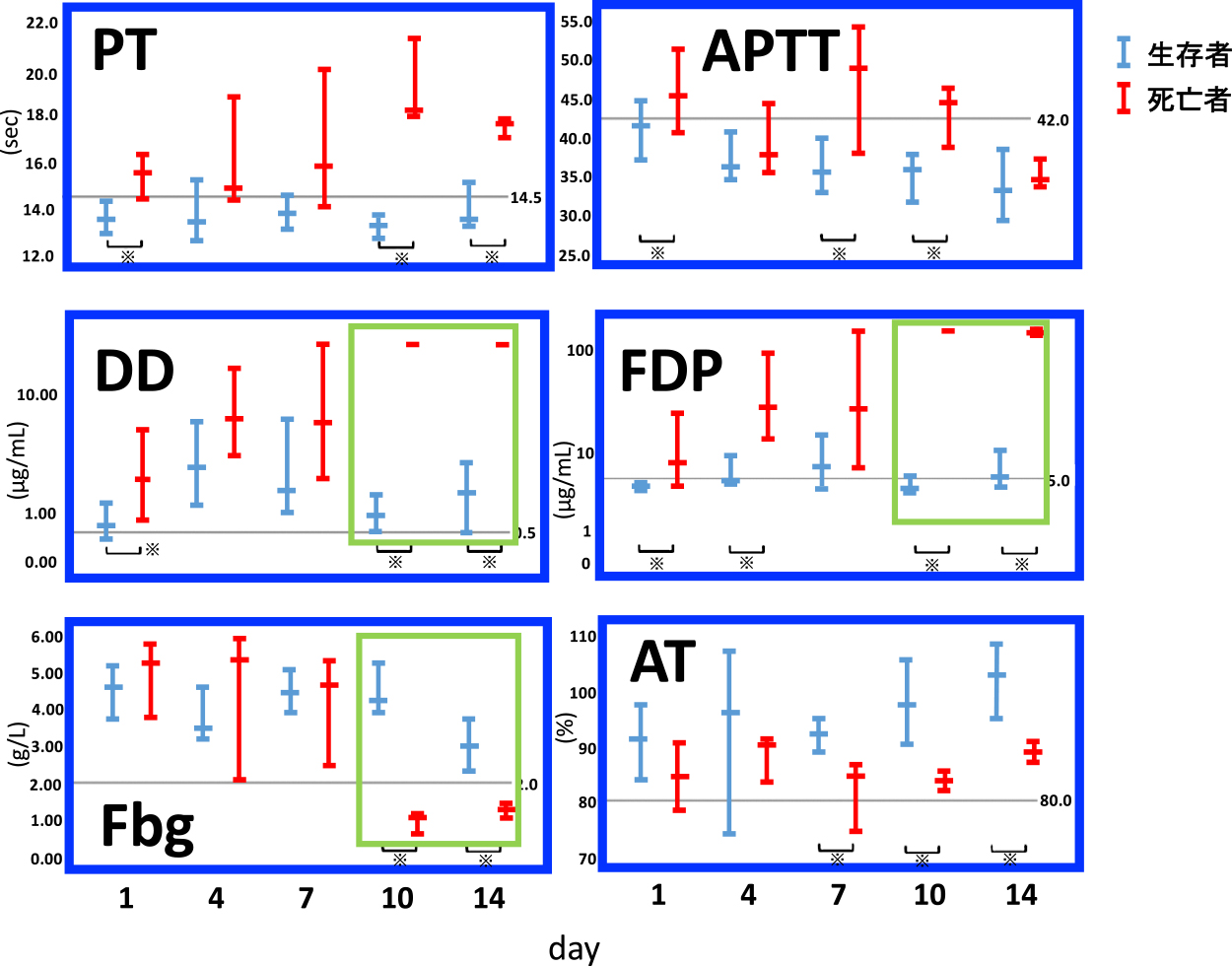
図1は,COVID-19患者において,生存例と死亡例に分類して,凝固線溶病態を追跡している6).多くの凝固線溶マーカーで検討しているのみでなく,経時的に追跡している点で,極めて価値のある報告である.COVID-19の凝固線溶病態を論じたほとんどすべての報告でこの論文が引用されている.この論文では3つのポイントがある.
1)死亡例でのDICの合併
DICの合併率は,生存例では0.6%であるのに対して,死亡例では71.4%と報告されている6).重症例におけるDICの合併率が高いと判断される.換言すれば生存例でのDIC合併はほとんどない.
死亡例におけるDay10,14における高度な凝固線溶異常が注目される.FDP>100 μg/mL,D-ダイマー20 μg/mL程度,フィブリノゲン100 mg/dL程度になっている.FDPが著増するのに対してD-ダイマーの上昇は軽度なために,FDPとD-ダイマーの間に乖離現象が見られている(FDP/D-ダイマー比は5程度になっている).PTは延長しているが,APTTの延長はあまり目立たない.アンチトロンビンの低下も目立たない(80%以上を維持)(図1)6).
死亡例におけるこれらの所見は,敗血症に起因する線溶抑制型DICとは大きく異なっており,むしろ線溶亢進型DICに一致した所見である15).線溶抑制型DICでは,FDPやD-ダイマーの上昇は比較的軽度であり,炎症反応のためフィブリノゲンの低下がみられることはほとんどないが,COVID-19死亡例では大きく様相が異なっている.つまり,COVID-19の死亡例では,線溶亢進型DICの病態を想定することができる.
2)入院時のD-ダイマーでの予後予知
入院時のD-ダイマーの値によって,COVID-19の予後を推測できるという報告は他にも多数存在するが2, 12–14),この論文はその先駆け的な論文である6).ただし,より正確な評価のためには,経時的な血液凝固検査の追跡は不可欠と考えられる.
3)凝固線溶病態のダイナミックな変動
興味あることに,死亡例ではDay7と10では大きなマーカーの変動に差異が見られている(図1)6).つまり,死亡例では,Day7におけるフィブリノゲンは400 mg/dL程度と高値傾向であるが,3日後のDay10には,100 mg/dL程度にまで急降下し,一方FDPやD-ダイマーは急上昇していたことが読み取れる.つまり,特に重症例では凝固線溶マーカーを経時的に追跡していないと,病態の変化を見逃すことになる.入院時のD-ダイマーが安全域であったからといって,日本人はCOVID-19の凝固異常はそれほど重篤化しないなど安易な理解は危険である.変化する病態を細やかに察知し,それにあわせて治療方法を選択する必要がある.線溶亢進型DICの病態の時期には,大出血に注意が必要である.
このように,COVID-19では特に重症例において短期間に凝固線溶病態が急激に変化する可能性があり,1~3日毎の追跡が必要である.
COVID-19では,血栓症(特に静脈血栓塞栓症)の発症率が高いことが注目されており確かに患者の重症度と関連することが多い16).しかし,死亡するような超重症例(剖検例)では,血栓のみならずかなりの出血が観察されている17).つまり,超重症例では線溶抑制型DICから線溶亢進型DICに変貌している可能性がある.この正確な評価のためには,TATやPICを含めた血液凝固検査が不可欠であるが,これまではほとんど報告はない.
4.COVID-19で必要な凝固線溶検査
COVID-19における凝固線溶病態を正しく把握するためには,表1に示した検査を行うことが肝要である.一流誌での報告でも,D-ダイマーやPTの検討があっても,フィブリノゲン,FDP,APTTなどでの検討はあまりなされていない.
表1
COVID-19で行うべき凝固線溶検査
| マーカー |
検査の意義 |
| 血小板数 |
・種々の原因で低下(COVID-19そのもの,DIC,抗リン脂質抗体症候群,ITP,血球貪食症候群,HIT,薬物による骨髄抑制,偽性血小板減少症など) |
| PT |
・ビタミンK欠乏症のスクリーニング検査(PIVKA-IIで確定診断) |
| ・肝不全の評価 |
| APTT |
・未分画ヘパリンのモニタリング |
| ・ループスアンチコアグラントのスクリーニング検査 |
| ・後天性血友病のスクリーニング検査 |
| フィブリノゲン |
・DIC(特に線溶亢進型DIC)の診断.2~3日での短期間での急降下に注意する. |
| ・上昇すれば血栓傾向 |
| ・肝不全の評価 |
| FDP/D-ダイマー |
・DIC(特に線溶亢進型DIC)の診断.2~3日での短期間での急上昇に注意する.線溶亢進型DICでは,FDPは著増するがD-ダイマーは軽度から中等度の上昇にとどまるために,FDPとD-dimerの間に乖離現象がみられる. |
| ・マクロ血栓症&ミクロ血栓症の診断 |
| ・肺障害を反映 |
| アンチトロンビン |
・肝不全の評価 |
| ・DIC合併例で低下していれば,アンチトロンビン濃縮製剤投与を考慮. |
| TAT |
・凝固活性化の評価 |
| PIC |
・線溶活性化の評価 |
| α2 PI |
・PIC著増例でα2 PIが著減していれば,大出血を来たしやすい. |
| VWF抗原&活性 |
・後天性von Willebrand症候群のスクリーニング検査.後天性von Willebrand病では,VWF抗原量に比較して,VWF活性が低下する. |
PT,プロトロンビン時間;APTT,活性化部分トロンボプラスチン時間;FDP,フィブリン/フィブリノゲン分解産物;TAT,トロンビン-アンチトロンビン複合体;PIC,プラスミン-α2プラスミンインヒビター複合体;α2 PI,α2プラスミン インヒビター;VWF,von Willebrand因子;DIC,播種性血管内凝固;ITP,免疫性血小板減少性紫斑病;HIT,ヘパリン起因性血小板減少症;PIVKA-II,protein induced by vitamin K absence or antagonist.
COVID-19ではAPTTの延長が高頻度に見られ,高率にループスアンチコアグラントが見つかっている18, 19).COVID-19におけるAPTT検査は,ヘパリンモニタリング以外の意義もあることを知っておきたい.
また,DICの病型によっては,D-ダイマーよりもFDPの方が感度良好である6, 14, 15).実はこれまでの多くの論文では,D-ダイマーの有用性が強調されてきたが,特に重症例ではD-ダイマーよりもFDPの方がはるかに鋭敏に変動し病態を反映する.例えば,Liao14)らの報告でもいくつかのマーカーの中で,FDPのみがグラフの縦軸が対数になっている(FDPの上昇が際立っている)ことにも注目したい.
FDP,D-ダイマーの乖離現象を評価することもできるために,可能な限りFDP,D-ダイマーの両者の測定を行いたい.フィブリノゲンは,経時的に追跡することで,DICの病型の変化もチェックしうる.
COVID-19の重症例ではECMOが必要になる.Day 60まで追跡できたECMO使用症例を検討したSchmidtらの報告からは,死亡率31%,さらに大出血42%,出血性脳梗塞5%であった20).出血の有害事象がなければもう少し良い成績を期待できると考えられる.ECMO装着時の出血症状は,ECMOの回路を循環させる際に使用するヘパリンによる有害事象と考察されやすい.しかし,Schmidtらの論文に記載されている抗凝固療法の強度は適切であり20),出血の主因とは考えにくい.したがって,ECMO使用下の出血の理由として,以下の機序を考えておかなければならない.
1)線溶亢進型DICの合併:前述.
2)血管内皮炎:COVID-19では特に重症例ほど血管内皮炎21)が高度であり,血管脆弱性が強いと考えられる.
3)後天性von Willebrand症候群:ECMOなどの体外循環時には,高ずり応力によって,von Willebrand因子のlarge multimerが分解されることが知られている22, 23).この場合,von Willebrand因子抗原量に比較してvon Willebrand因子活性が低下する.確定診断のためには,von Willebrand因子マルチマー構造解析が必要である.
COVID-19では,血栓症のみならず出血の合併症も見られやすく,それらの対策のためにも,表1に示した検査を繰り返し行うことが必要である.
5.マクロ血栓症
COVID-19では,強い血栓傾向を背景に動脈血栓症も静脈血栓症も報告されている.具体的には,動脈血栓症としては脳梗塞,心筋梗塞,四肢動脈血栓症など,静脈血栓症としては深部静脈血栓症(deep vein thrombosis: DVT),肺血栓塞栓症(pulmonary thromboembolism: PTE)などが報告されている.一般的に,DVTとPTEは同時に発症することもあり,合わせて静脈血栓塞栓症(venous thromboembolism: VTE)と呼称されてきた.この中で,COVID-19において最も多いのはVTE特にPTEである24).
また,COVID-19のVTEの特徴として,DVTの血栓が飛来して発症するPTEもあるものの,それ以上に多いのは,DVTがなくてもPTEを発症することがある点である.正確には,肺塞栓(DVT有り)(pulmonary embolism: PE)よりも,肺血栓(DVT無し)(pulmonary thrombosis: PT)の方が多い25).
ICUに入室になった重症COVID-19症例184名の検討では,血栓症75例の発症が見られている.血栓症の内訳は,PTE 65例,DVT 3例,脳梗塞 5例,全身性の動脈塞栓症 2例であった.やはり,重症例での血栓症はPTEが圧倒的に多い(DVTはあまり多くない).なお,抗凝固療法の予防投与は,血栓症発症の抑制に繋がっていなかった26).
ICU入院例(重症例)と一般病棟入院例(軽症例)に分類して検討した報告があるが,ICU入院例では約6割にVTEが見られ,一般病棟入院例では約1割にVTEが見られている27).ICU患者では入院3週間まではVTEの累積発症率は漸増,一般病棟では1週間までは漸増しているが,どちらの群においてもその後の新規発症は見られていない.つまり,入院早期の時点でのVTE対策が特に重要と考えられる.なお,この報告でも予防的に抗凝固療法が行われていてもVTEを発症していた.
今後,日本からの血栓症発症率に関する報告が待たれるが,どの水準まで検査が実施されたかに留意して正しい情報を集積しなくてはならない.例えば,人工呼吸器やECMO管理中の患者では脳梗塞発症を見逃しやすく速やかな画像診断がなされない可能性がある.あるいは,胸部造影CTや下肢静脈エコー検査が行われていないと,VTEの確定診断はできない.COVID-19の医療機関内感染のリスクと,どこまで精力的に血栓症診断を行うかに関しては,ジレンマがある.
6.ミクロ血栓症
VTEなどのマクロ血栓症は造影CTなどの画像で診断することが可能であるが,画像では診断できない顕微鏡レベルでの多発性のミクロ血栓症の存在が剖検による検討で明らかになっている.
Foxらの剖検例での検討では,肉眼所見としては,肺の末梢血管の血栓,右心室の拡大が見られているが,同時に鏡見所見として,肺細小動脈や肺細小静脈にも血栓が多発している17).これらの血栓はフィブリンと血小板の両成分が含有された血栓である.血管内皮障害を伴っているために,肺において血栓性微小血管障害(thrombotic microangiopathy: TMA)の病態が加味されている可能性もあるが,この点は今後の検討課題である.
Laxらの剖検による検討においても,11例中10例では,予防的抗凝固療法が行われていたにも関わらず,全例で,肺小・中動脈に血栓が見られ,8例では梗塞をきたしていた28).どの症例も生前には,VTEの診断はなされていなかった点も注目される.
Carsanaらの剖検例での検討(N=38)では,肺細小動脈内にいわゆるミクロ血栓(血小板とフィブリン含有)が33/38例(87%)で観察されている29).検討可能であった26例全例で,D-ダイマーは正常上限の10倍以上に上昇していた.この報告で注目されるのは,血栓症の存在のみならず肺胞出血も同頻度33/38例(87%)見られている点である.線溶亢進型DICを合併していた可能性がある.
COVID-19とインフルエンザに起因するARDSを比較した興味ある報告がある30).COVID-19とインフルエンザのいずれにおいても,びまん性肺胞障害(diffuse alveolar damage: DAD)の所見が得られるも,COVID-19では高度の血管内皮障害(内皮細胞内にウイルスの存在,細胞膜の破壊),微小血管障害を伴う広範囲な血栓が見られ,特に肺胞毛細血管レベルで比較すると微小血栓形成の程度は,インフルエンザでの9倍に及ぶなど,COVID-19の肺における高度な血栓形成が容易に理解された.血管新生に関しては,COVID-19はインフルエンザの2.7倍であったが,新生血管は正常機能を有しておらず,血栓形成に拍車をかけていると思われる.
7.Pulmonary intravascular coagulopathy
サイトカインストームと表現される強い免疫・炎症反応を背景に,全身性に血栓傾向になるものの,肺における血栓症が圧倒的に多いために,DICではなくpulmonary intravascular coagulopathy(PIC)と呼称すべきという意見もある31–33).いわゆるPICでは,肺において「マクロ血栓症」のみならず,さらに厄介なことに肺の広範囲に多発する「ミクロ血栓症」が存在する.つまり,胸部造影CTでは分からない肺のミクロ血栓症も想定しながら,抗凝固療法を行う必要がある.生前にミクロ血栓症を病理学的に証明することは困難と思われるが,特にD-ダイマー高値例では,画像診断で診断されなかった場合でも,血栓症(ミクロ血栓症)の存在を想定すべきであろう.
新型コロナウイルス(SARS-CoV-2)の存在部位について,剖検での検討がある34).腎,肝,心,脳,血中などにも存在するが,呼吸器領域でのSARS-CoV-2検出量が圧倒的に多い.SARS-CoV-2の宿主側レセプターであるangiotensin-converting enzyme 2(ACE2)が,各臓器においてどの程度発現しているかと関連している.小児ではCOVID-19の発症頻度が少ないことが知られているが,小児ではACE2の発現が少ないためと考えられている35).
8.D-ダイマーの起源
これまでは,D-ダイマーの上昇は凝固・線溶両者の活性化を反映していると考えられてきた.これに対して,COVID-19におけるD-ダイマーの起源について論じた報告がある.つまり,D-ダイマーの上昇は,肺障害の結果として肺胞内,肺実質などに形成されたフィブリンの分解産物を反映している(D-ダイマーが肺局所から流血中に移動する)という考え方である36).確かに,D-ダイマーの起源が肺局所のフィブリンであるとすると,D-ダイマーが肺障害の程度や予後と関連するというのは,より理解しやすい.
大量胸水や大量腹水,大量血腫においてしばしばD-ダイマーが上昇するが,この原因は,胸腹水や血腫中のD-ダイマーが流血中に移動することと似た発想である.
D-ダイマーが肺胞から流血中に移動することの証明は困難かもしれないが,興味深い考え方である.
9.FDPとD-ダイマー(両測定の意義)
ルーチンの凝固検査といえば,PT,APTT,フィブリノゲン,そしてFDPまたはD-ダイマーが挙げられる.本来であれば,FDPとD-ダイマー両者の測定を行うことで,線溶亢進型DICの診断などに威力を発揮する.実際,日本血栓止血学会DIC診断基準2017年版(https://www.jsth.org/guideline/dic診断基準2017年度版/)でも,FDPとD-ダイマー両者測定の医学的な意義が述べられている.ただし,保険診療上の制限もあり,今後の医療環境の改善を期待したい.
ルーチンの凝固検査の中で,COVID-19の重症度や予後と関連しているのは,D-ダイマーである点は前述した.凝固マーカーとしてPT,APTT,は有名であるが,これだけの情報では十分な評価ができない.FDPおよびD-ダイマーを含めた評価が不可欠である.ただし,実はCOVID-19の病期により,FDPはD-ダイマーよりもさらに分かりやすいマーカーになっている6, 14).おそらく,COVID-19の致命的な病期においては,線溶亢進型DICの病態になっているために,D-ダイマーよりもFDPが敏感に変動するためではないかと考えているが,今後の検討課題である.
10.血小板数とリンパ球数の低下
COVID-19の予後と血小板数との関連を論じた報告がいくつかある37–39).その中で,単施設1,476例で検討した報告がある37).238人(16.1%)が死亡例である.血小板数の最低値が,0~5,5~10,10~15,15~(万/μL)に対して,死亡率は,92.1,61.2,17.5,4.7(%)と報告されている.経過中血小板数が10万/μLを切ると,特に予後が厳しくなっている.さらには,血小板数5万/μLを切ると,画期的な治療が行われないと絶望的と考えられる.血小板数低下の原因は,DICをあげている.
ただし,COVID-19では多数の薬剤が使用されており,薬剤性の血小板産生低下(骨髄抑制)の場合もあるだろう.その際は,未成熟血小板比率(immature platelet fraction: IPF)をチェックすることで,簡単に鑑別することが可能である.IPFの上昇が見られれば,骨髄抑制を否定できる.現在,IPFの測定が可能な施設が増えているので,積極的に活用したい.MPV(mean platelet volume)やPDW(platelet distribution width)でも,血小板数低下の原因が骨髄抑制かどうか鑑別可能ではある40, 41).実際,IPFはMPVやPDWと正相関する.また,MPV,PDWは全ての医療機関,すべての症例でデータが存在する点は強みである.しかし,血小板数が著減していると,MPVやPDWは算出できなくなるのが難点である.
血小板数の低下は,COVID-19そのものでも見られるようであるが,多くの原因が報告されている(表1).前述のように,DIC合併の報告がある6–10).抗リン脂質抗体(抗カルジオリピン抗体,ループスアンチコアグラント)は高率に出現する18, 19, 42–44).血栓症が見られれば抗リン脂質抗体症候群と診断される.ただし,一般にウイルス感染症で抗リン脂質抗体が一時的に陽性になる場合があることは以前より知られている(この場合は,血栓症と無関係).COVID-19での抗リン脂質抗体が血栓症とどの程度関連しているかに関しては,今後の検討課題である45).免疫性血小板減少性紫斑病の報告も見られる46, 47).サイトカインストームを背景に,血球貪食症候群の合併も報告されている48, 49).COVID-19症例では,簡単に骨髄検査を行いにくいことが想定されるため,血球貪食症候群の未診断例が多い可能性がある.COVID-19ではヘパリンが使用されることが多く,ヘパリン起因性血小板減少症(HIT)の報告も多い50, 51).HIT抗体の測定を積極的に行うことで,診断が遅れないようにしたい.偽性血小板減少症の報告もある52).この報告では,COVID-19の治療によりSARS-Cov-2抗体の消失と共に,偽性血小板減少症の現象も消失している.SARS-Cov-2抗体と偽性血小板減少症との関連が論じられている.
COVID-19の特に重症例では,リンパ球が低下することが知られている.CD4細胞,CD8陽性細胞ともに低下するが,リンパ球数とCD4陽性細胞との間には強い相関が見られる1, 53, 54).また,CD4陽性細胞によるIFN-γの産生も低下する53).これらの変化が疾患の重症度と関連しているため,今後の治療法の開発においても念頭におくべきと考えられる.好中球/リンパ球比がCOVID-19の重症度や予後と関連しているという報告もある55, 56).
11.石倉論文から学ぶべきこと
日本血栓止血学会雑誌に,極めて興味あるCOVID-19の6症例報告がある(図2)57).ここまで詳細に凝固線溶異常を評価した論文は,筆者が知る限りは本稿執筆時点では世界的にもこの論文のみである.連日の血液検査が行われたこと,TATやPICを含む凝固線溶検査が行われたことで,凝固線溶病態が詳らかにされている.
1)TATとPICの測定で分かること
これまでの他者の報告ではD-ダイマーの測定は行われていても,TATやPICの測定まで踏み込んだ報告はほとんどなかった.D-ダイマーは,凝固活性化の結果として血栓が形成されて,線溶活性化の結果としてその血栓が分解される初めて血中に出現する.しかし,D-ダイマーのみでは,凝固や線溶活性化の程度を評価することはできない.前述のように,敗血症に合併した線溶抑制型DICでは,凝固活性化が高度であっても,血栓の分解はあまり見られないために,D-ダイマーの上昇は軽度にとどまる.D-ダイマーの上昇が軽度だからと言って,凝固活性化が軽度なわけでもなく,病態が軽症なわけでもない.
この点,TATやPICは,まさに凝固,線溶の本態をみるマーカーということができる.石倉論文の6症例の中で,2症例でDay7以降にPICが著増している.PICのレベルは,30~40 μg/mLにまで達しており,線溶亢進型DICの代表格とも言える急性前骨髄球性白血病(acute promyelocytic leukemia: APL)を凌駕するような線溶活性化状態である15).そしてさらに注目すべき点は,この2症例で脳出血が見られた点である.
COVID-19の血栓症対策は確かに重要であるが,時に出血が見られること,そして出血の原因の一つとして線溶亢進型DICの合併があることを深く認識しなければ医原性の出血を招きかねない.
2)FDPとD-ダイマーの両測定で分かること
PICが著増した2症例では,Day8ではFDPが200 μg/mL以上と著増している.同日にD-ダイマーも上昇しているが,50~60 μg/mL程度に止まっている(FDP/DD比は,3~4程度になっている).つまり,FDPとD-ダイマーの間に大きな乖離現象が見られている.FDPは,フィブリン分解産物とフィブリノゲン分解産物の総和であるが,著しい線溶活性化によって,フィブリンのみならずフィブリノゲンの分解まで進行したために急激に増加したFDPとフィブリンのみの分解産物を反映しているD-ダイマーの間に生じた乖離現象をとらえることに成功している.もしも,TATやPICが測定してなかったとしても,FDPとD-ダイマーの両測定によって,FDPの著増とともに両者の大きな乖離現象が見られたら,線溶亢進型DICを疑い,TATやPICの追加測定に進むことができるであろう.線溶亢進型DICでは,D-ダイマー以上にFDPは鋭敏に変動する.これによって生じるFDPとD-ダイマーの乖離現象は決して見落としてはならない凝血学的危機である.
3)連日測定で分かること
PICの著増した2症例であるが,Day6まではPICはほとんど上昇していなかったにもかかわらず,翌日のDay7(わずか一日の経過)には一気に跳ね上がっている点が注目される.FDPやD-ダイマーについても同様である.もしも連日の血液検査が行なわれていなかったら,この重要かつダイナミックな凝固線溶病態の変化は完全に見逃されていたであろう.特に重症例では,測定間隔をあけることなく定期的に検査することが極めて重要であると痛感する.
凝固線溶病態の変化は,血栓性病態と出血性病態を大きく変化させる.つまり,特に重症例ではわずか1日の経過で,線溶抑制型DICから線溶亢進型DICに変貌することがある.病態が変われば,治療法も変わるために,この日々の病態の的確な把握は重要である.
上記のように石倉論文57)では,多くのことがメッセージされている.その内容は世界のトップジャーナルのレベルを既に超えているが,症例数が増えることで,さらに優れた報告として世界に発信されることを期待したい.
12.凝固線溶病態からみた治療戦略
COVID-19に対しては一律の治療を行うのではなく,重症度,病期によって治療戦略を変えるべきであろうと考えられる(図3).また,SARS-CoV-2の宿主細胞への侵入を阻止する最初のステップの治療戦略から始まり,最終段階のサイトカインストームのコントロールに至るまで種々のステップにおける治療方法,治療薬が候補に挙がっている58–61).
1)COVID-19の抗ウイルス対策
抗ウイルス効果の観点から治療薬の候補に挙がっている薬物,治療法がいくつか知られている.現時点では否定的な治療と,逆に有望視されている治療がある.抗ウイルス治療は,特に感染症初期において最も意義が大きいと考えられる(図3).
2)サイトカインストーム対策
多くの抗サイトカイン療法が検討されているが,最も報告が多いのは,抗IL-6受容体抗体であるトシリツマブである62–64).他剤との併用療法を含めて,今後の展開が期待されている.COVID-19の病態が進行してしまった場合に,サイトカインストーム対策65)の意義が大きいと考えられる.
3)血栓症対策
COVID-19に対する抗血栓療法として最も高頻度に使用されるのは,ヘパリンである.海外では,低分子ヘパリンの使用が多い.わが国では,低分子ヘパリン(ダルテパリン)の保険適用がDICと血液透析のみであるため,DICを合併していないCOVID-19に対しては原則として使用できない.そのために,わが国では現時点においては,低分子ヘパリンよりも未分画ヘパリンの方が,使用頻度が高いと推測される(2020年10月現在).
COVID-19に対するヘパリン治療は,抗凝固作用のみならず,抗ウイルス作用や抗炎症作用も期待されている66–68).その作用は,低分子ヘパリンよりも未分画ヘパリンの方が強いために,COVID-19に対するヘパリン療法は低分子ヘパリンの方がより良いとは言い切れない.今後の検討課題である.
ただし,ヘパリンが投与されていてもVTEは2~3割に発症するという報告69)が多く,ヘパリンは有効ではあるものの限界もある.ヘパリン単独治療を超える治療も求められる.
4)ヘパリン・ナファモスタット併用療法
ナファモスタットは,セリンプロテアーゼ阻害剤であり,トロンビン,プラスミン,トリプシンなどのタンパク分解酵素を強力に阻害する70).ナファモスタットは,使用目的によって至適用量が異なり,DICに対しては膵炎に対してよりも高用量(約10倍量)で用いることができる.ただし,ナファモスタットはDIC用量で用いても出血の副作用が見られない点がヘパリンとの大きな違いであり,ナファモスタットの強みである.ナファモスタットは,DIC治療薬であるが,抗線溶作用が強力であるために70),線溶亢進型DICに対して相性の良い薬物である15).実際,我々は,大動脈瘤や悪性腫瘍に合併した線溶亢進型DICに対して,原疾患は改善しない症例ですらナファモスタットがDICに対して著効する症例を蓄積している.COVID-19は,進行例では前述のように線溶亢進型DICに変貌することがあり,ナファモスタットは有力候補として考えられる.
ただし,ナファモスタットの弱点は抗線溶作用に比較して抗凝固作用は弱いことである70).ナファモスタットの弱点を補うために,ヘパリンとの併用療法を行えば,さらに効果が増大する可能性がある71).
Hoffmannらは,SARS-CoV-2などのコロナウイルスの肺胞上皮細胞への感染には,宿主細胞に存在するACE2とtransmembrane protease serine 2(TMPRSS2)が必須と報告している72).井上らは,コロナウイルスの一つであるMERS-CoVではナファモスタットがTMPRSS2の活性を阻害することによってMERS-CoVの宿主細胞への感染を阻害すると,2016年に報告している73).ナファモスタットは,SARS-CoV-2においても同様に,ウイルスの侵入を阻止する74–76).ナファモスタット(注射薬)は,同じセリンプロテアーゼインヒビターであるカモスタット(経口薬,膵炎治療薬)と比較して10倍以上のコロナウイルス侵入阻害活性を有している75, 76).しかも,DICに対してナファモスタットを使用する場合,膵炎に対して使用するよりも約10倍用量を使用可能である.
なお,ナファモスタットには高K血症の副作用が知られている.筆者の経験では,COVID-19に対してナファモスタットを使用した場合には,これまで知られていたよりも高K血症が高頻度で出現しやすい印象を持っている.
5)抗プラスミン療法の是非
プラスミンは,SARS-CoV-2のSタンパクを切断することで,ウイルスの病原性と感染力を高めると報告されている77).ナファモスタットは抗プラスミン作用を有しており70),SARS-CoV-2の病原性と感染力を低下させることが期待される.なお,抗プラスミン(抗線溶)作用が強力な薬剤として,トラネキサム酸が知られている.トラネキサム酸は,抗プラスミンという観点からはSARS-CoV-2に対して抑制的に作用する可能性はあるが(実際に海外では臨床試験が行われているようであるが)78),致命的な血栓症を誘発する懸念があり,安易に行うべきではないと考えられる79).その点,ナファモスタットは抗トロンビンを併せ持っている上での抗プラスミン作用のため,安全に使用可能である.
COVID-19に対して,ナファモスタットが有効という国内外からの報告が見られているが80, 81)もっぱら,抗ウイルス作用に着目したアプローチである.ECMO治療中(ヘパリンが必要)にナファモスタットが投与されると,必然的にヘパリン・ナファモスタット併用療法となり,奇しくも我々が凝血学的視点から推奨してきた治療法と重なり合う.COVID-19に対するナファモスタットの潜在的多様性がうかがわれ,ファビピラビルとの併用だけではなく,ヘパリンを併用することの意義についても合わせて検証されることが望まれる.
6)線溶療法の是非
COVID-19における血栓性病態を是正するために,前述のようにしばしばヘパリン,特に低分子ヘパリンが使用されるが,それにも関わらず重症例では肺塞栓症が見られており69),抗凝固療法の用量,強度に関しても議論のあるところである.抗凝固療法のみの治療には限界がある可能性がある.そのために,線溶療法に期待する報告もある82).肺循環を妨げている既存のフィブリンに対して線溶薬による加療を行うことで,血栓性病態の改善が期待される.実際,COVID-19におけるARDSに対して,線溶薬であるtissue-type plasminogen activator(tPA)の全身投与が試みられており,一部の症例では有効のようである83–85).
しかし,ARDSを伴った重症COVID-19に対して全身性にtPAを投与することには,十分な注意が必要である.前述のように,COVID-19の凝固線溶病態は1~3日でも大きく変動することがある6, 57).もし,線溶亢進型DICの病態が存在するタイミングで全身性の線溶療法が行われたら極めて危険であり,脳出血を含む致命的な出血をきたす懸念がある.
一方で,tPAやplasminogenなど線溶関連物質の「吸入」による治療であれば,COVID-19のいずれの病期であっても出血の懸念が比較的少なく行うことができる可能性がある82, 86, 87).線溶関連物質を吸入で投与することで,肺胞腔内のフィブリン含有浸出物を溶解して肺胞換気を改善する可能性,肺胞近辺の微小循環レベルにおけるフィブリン血栓を溶解する可能性,肺実質内に形成されたフィブリンを溶解する可能性が期待される.ただし,吸入治療はエアロゾルを介して医療機関内で感染拡大に広がらないか,吸入で投与されたtPAはどの程度血中に移行するかなど,解決すべき問題も多い.今後の展開を期待したい.
結語
COVID-19の病態は不明な点が多い.凝血学的検査のうちD-ダイマーは優れたマーカーであるがこれのみでの評価には限界もある.凝固や線溶活性化の本態を評価するマーカーであるTAT,PICなどのマーカーも加えた病態解明が期待される.また,特に重症例では,1~3日の短期間で病態が大きく変貌することを認識しておきたい(図4).
COVID-19の治療は,画一的に行うのではなく,病態に応じた治療法を選択し,常に凝固線溶病態を監視し適切な治療戦略を展開することで,生存率の向上につなげていきたい.
謝辞
稿を終えるにあたり,呼吸器内科専門医の立場で校正していただいた,小川晴彦博士(金沢春日クリニック/金沢大学医薬保健学域医学類 臨床教授(学外))に深謝いたします.
著者の利益相反(COI)の開示:
本論文発表内容に関連して開示すべき企業等との利益相反なし
文献
- 1) Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B: Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395: 497–506, 2020.
- 2) Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Guan L, Wei Y, Li H, Wu X, Xu J, Tu S, Zhang Y, Chen H, Cao B: Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: A retrospective cohort study. Lancet 395: 1054–1062, 2020.
- 3) Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS; China Medical Treatment Expert Group for Covid-19: Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 382: 1708–1720, 2020.
- 4) Takahashi T, Ellingson MK, Wong P, Israelow B, Lucas C, Klein J, Silva J, Mao T, Oh JE, Tokuyama M, Lu P, Venkataraman A, Park A, Liu F, Meir A, Sun J, Wang EY, Casanovas-Massana A, Wyllie AL, Vogels CBF, Earnest R, Lapidus S, Ott IM, Moore AJ; Yale IMPACT Research Team, Shaw A, Fournier JB, Odio CD, Farhadian S, Dela Cruz C, Grubaugh ND, Schulz WL, Ring AM, Ko AI, Omer SB, Iwasaki A: Sex differences in immune responses that underlie COVID-19 disease outcomes. Nature 2020, Aug 26. doi: 10.1038/s41586-020-2700-3.
- 5) Zhao J, Yang Y, Huang H, Li D, Gu D, Lu X, Zhang Z, Liu L, Liu T, Liu Y, He Y, Sun B, Wei M, Yang G, Wang X, Zhang L, Zhou X, Xing M, Wang PG: Relationship between the ABO blood group and the COVID-19 susceptibility. Clin Infect Dis, 2020 Aug 4, doi: 10.1093/cid/ciaa1150.
- 6) Tang N, Li D, Wang X, Sun Z: Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 18: 844–847, 2020.
- 7) Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ; HLH Across Speciality Collaboration, UK: COVID-19: Consider cytokine storm syndromes and immunosuppression. Lancet 395: 1033–1034, 2020.
- 8) Jose RJ, Manuel A: COVID-19 cytokine storm: The interplay between inflammation and coagulation. Lancet Respir Med 8: e46–e47, 2020.
- 9) Wright DJM: Prevention of the cytokine storm in COVID-19. Lancet Infect Dis, 2020 May 7: S1473-3099(20)30376-5. doi: 10.1016/S1473-3099(20)30376-5.
- 10) Iba T, Levy JH, Levi M, Connors JM, Thachil J: Coagulopathy of coronavirus disease 2019. Crit Care Med 48: 1358–1364, 2020.
- 11) Rodríguez Mega E: COVID has killed more than one million people. How many more will die? Nature 2020 Sep 30. doi: 10.1038/d41586-020-02762-y.
- 12) Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, Aaron JG, Claassen J, Rabbani LE, Hastie J, Hochman BR, Salazar-Schicchi J, Yip NH, Brodie D, O’Donnell MR: Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: A prospective cohort study. Lancet 395: 1763–1770, 2020.
- 13) Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, Huang H, Zhang L, Zhou X, Du C, Zhang Y, Song J, Wang S, Chao Y, Yang Z, Xu J, Zhou X, Chen D, Xiong W, Xu L, Zhou F, Jiang J, Bai C, Zheng J, Song Y: Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 180: 934–943, 2020.
- 14) Liao D, Zhou F, Luo L, Xu M, Wang H, Xia J, Gao Y, Cai L, Wang Z, Yin P, Wang Y, Tang L, Deng J, Mei H, Hu Y: Haematological characteristics and risk factors in the classification and prognosis evaluation of COVID-19: A retrospective cohort study. Lancet Haematol 7: e671–e678, 2020.
- 15) Asakura H: Classifying types of DIC: Clinical and animal models. J Intensive Care 2: 20, 2014.
- 16) Helms J, Tacquard C, Severac F, Leonard-Lorant I, Ohana M, Delabranche X, Merdji H, Clere-Jehl R, Schenck M, Fagot Gandet F, Fafi-Kremer S, Castelain V, Schneider F, Grunebaum L, Anglés-Cano E, Sattler L, Mertes PM, Meziani F; CRICS TRIGGERSEP Group (Clinical Research in Intensive Care and Sepsis Trial Group for Global Evaluation and Research in Sepsis): High risk of thrombosis in patients with severe SARS-CoV-2 infection: A multicenter prospective cohort study. Intensive Care Med 46: 1089–1098, 2020.
- 17) Fox SE, Akmatbekov A, Harbert JL, Li G, Quincy Brown J, Vander Heide RS: Pulmonary and cardiac pathology in African American patients with COVID-19: An autopsy series from New Orleans. Lancet Respir Med 8: 681–686, 2020.
- 18) Harzallah I, Debliquis A, Drénou B: Lupus anticoagulant is frequent in patients with Covid-19. J Thromb Haemost 18: 2064–2065, 2020.
- 19) Bowles L, Platton S, Yartey N, Dave M, Lee K, Hart DP, MacDonald V, Green L, Sivapalaratnam S, Pasi KJ, MacCallum P: Lupus anticoagulant and abnormal coagulation tests in patients with Covid-19. N Engl J Med 383: 288–290, 2020.
- 20) S Schmidt M, Hajage D, Lebreton G, Monsel A, Voiriot G, Levy D, Baron E, Beurton A, Chommeloux J, Meng P, Nemlaghi S, Bay P, Leprince P, Demoule A, Guidet B, Constantin JM, Fartoukh M, Dres M, Combes A; Groupe de Recherche Clinique en REanimation et Soins intensifs du Patient en Insuffisance Respiratoire aiguE (GRC-RESPIRE) Sorbonne Université; Paris-Sorbonne ECMO-COVID investigators: Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19: A retrospective cohort study. Lancet Respir Med, 2020 Aug 13: S2213-2600(20)30328-3. doi: 10.1016/S2213-2600(20)30328-3.
- 21) Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H: Endothelial cell infection and endotheliitis in COVID-19. Lancet 395: 1417–1418, 2020.
- 22) Horiuchi H, Doman T, Kokame K, Saiki Y, Matsumoto M: Acquired von Willebrand syndrome associated with cardiovascular diseases. J Atheroscler Thromb 26: 303–314, 2019.
- 23) Thomas J, Kostousov V, Teruya J: Bleeding and thrombotic complications in the use of extracorporeal membrane oxygenation. Semin Thromb Hemost 44: 20–29, 2018.
- 24) Fraissé M, Logre E, Pajot O, Mentec H, Plantefève G, Contou D: Thrombotic and hemorrhagic events in critically ill COVID-19 patients: A French monocenter retrospective study. Crit Care 24: 275, 2020.
- 25) Gabrielli M, Lamendola P, Esperide A, Valletta F, Franceschi F: COVID-19 and thrombotic complications: Pulmonary thrombosis rather than embolism? Thromb Res, 2020 Sep; 193: 98. doi: 10.1016/j.thromres.2020.06.014.
- 26) Klok FA, Kruip MJHA, van der Meer NJM, Arbous MS, Gommers D, Kant KM, Kaptein FHJ, van Paassen J, Stals MAM, Huisman MV, Endeman H: Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: An updated analysis. Thromb Res 191: 148–150, 2020.
- 27) Middeldorp S, Coppens M, van Haaps TF, Foppen M, Vlaar AP, Müller MCA, Bouman CCS, Beenen LFM, Kootte RS, Heijmans J, Smits LP, Bonta PI, van Es N: Incidence of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost 18: 1995–2002, 2020.
- 28) Lax SF, Skok K, Zechner P, Kessler HH, Kaufmann N, Koelblinger C, Vander K, Bargfrieder U, Trauner M: Pulmonary arterial thrombosis in COVID-19 with fatal outcome: Results from a prospective, single-center, clinicopathologic case series. Ann Intern Med 173: 350–361, 2020.
- 29) Carsana L, Sonzogni A, Nasr A, Rossi RS, Pellegrinelli A, Zerbi P, Rech R, Colombo R, Antinori S, Corbellino M, Galli M, Catena E, Tosoni A, Gianatti A, Nebuloni M: Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: A two-centre descriptive study. Lancet Infect Dis 2020 Jun 8: S1473-3099(20)30434-5. doi: 10.1016/S1473-3099(20)30434-5.
- 30) Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D: Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 383: 120–128, 2020.
- 31) McGonagle D, Sharif K, O’Regan A, Bridgewood C: The role of cytokines including interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease. Autoimmun Rev 19: 102537, 2020.
- 32) Fogarty H, Townsend L, Ni Cheallaigh C, Bergin C, Martin-Loeches I, Browne P, Bacon CL, Gaule R, Gillett A, Byrne M, Ryan K, O’Connell N, O’Sullivan JM, Conlon N, O’Donnell JS: COVID19 coagulopathy in caucasian patients. Br J Haematol 189: 1044–1049, 2020.
- 33) McGonagle D, Sharif K, O’Regan A, Bridgewood C: Increased cardiovascular mortality in African Americans with COVID-19. Lancet Respir Med 8: 649–651, 2020.
- 34) Puelles VG, Lütgehetmann M, Lindenmeyer MT, Sperhake JP, Wong MN, Allweiss L, Chilla S, Heinemann A, Wanner N, Liu S, Braun F, Lu S, Pfefferle S, Schröder AS, Edler C, Gross O, Glatzel M, Wichmann D, Wiech T, Kluge S, Pueschel K, Aepfelbacher M, Huber TB: Multiorgan and renal tropism of SARS-CoV-2. N Engl J Med 383: 590–592, 2020.
- 35) Bunyavanich S, Do A, Vicencio A: Nasal gene expression of angiotensin-converting enzyme 2 in children and adults. JAMA 323: 2427–2429, 2020.
- 36) Hunt BJ, Levi M: Re The Source of elevated plasma d-dimer levels in COVID-19 infection. Br J Haematol 190: e133–e134, 2020.
- 37) Yang X, Yang Q, Wang Y, Wu Y, Xu J, Yu Y, Shang Y: Thrombocytopenia and its association with mortality in patients with COVID-19. J Thromb Haemost 18: 1469–1472, 2020.
- 38) Liu Y, Sun W, Guo Y, Chen L, Zhang L, Zhao S, Long D, Yu L: Association between platelet parameters and mortality in coronavirus disease 2019: Retrospective cohort study. Platelets 31: 490–496, 2020.
- 39) M Maquet J, Lafaurie M, Sommet A, Moulis G: Thrombocytopenia is independently associated with poor outcome in patients hospitalized for COVID-19. Br J Haematol 190: e276–e279, 2020.
- 40) Lee E, Kim M, Jeon K, Lee J, Lee JS, Kim HS, Kang HJ, Lee YK: Mean platelet volume, platelet distribution width, and platelet count, in connection with immune thrombocytopenic purpura and essential thrombocytopenia. Lab Med 50: 279–285, 2019.
- 41) Kaito K, Otsubo H, Usui N, Yoshida M, Tanno J, Kurihara E, Matsumoto K, Hirata R, Domitsu K, Kobayashi M: Platelet size deviation width, platelet large cell ratio, and mean platelet volume have sufficient sensitivity and specificity in the diagnosis of immune thrombocytopenia. Br J Haemato 128: 698–702, 2005.
- 42) Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, Chen H, Ding X, Zhao H, Zhang H, Wang C, Zhao J, Sun X, Tian R, Wu W, Wu D, Ma J, Chen Y, Zhang D, Xie J, Yan X, Zhou X, Liu Z, Wang J, Du B, Qin Y, Gao P, Qin X, Xu Y, Zhang W, Li T, Zhang F, Zhao Y, Li Y, Zhang S: Coagulopathy and antiphospholipid antibodies in patients with Covid-19. N Engl J Med 382: e38, 2020.
- 43) Gutiérrez López de Ocáriz X, Castro Quismondo N, Vera Guerrero E, Rodríguez Rodríguez M, Ayala Díaz R, Martínez López J: Thrombosis and antiphospholipid antibodies in patients with SARS-COV-2 infection (COVID-19). Int J Lab Hematol, 2020 Aug 26. doi: 10.1111/ijlh.13320.
- 44) Reyes Gil M, Barouqa M, Szymanski J, Gonzalez-Lugo JD, Rahman S, Billett HH: Assessment of lupus anticoagulant positivity in patients with coronavirus disease 2019 (COVID-19). JAMA Netw Open 3: e2017539, 2020.
- 45) Devreese KMJ, Linskens EA, Benoit D, Peperstraete H: Antiphospholipid antibodies in patients with COVID-19: A relevant observation? J Thromb Haemost, 2020 Jul 3: 10.1111/jth.14994. doi: 10.1111/jth.14994.
- 46) Zulfiqar AA, Lorenzo-Villalba N, Hassler P, Andrès E: Immune thrombocytopenic purpura in a patient with Covid-19. N Engl J Med 382: e43, 2020.
- 47) Lévesque V, Millaire É, Corsilli D, Rioux-Massé B, Carrier FM: Severe immune thrombocytopenic purpura in critical COVID-19. Int J Hematol, 2020 Jul 1: 1–5. doi: 10.1007/s12185-020-02931-9.
- 48) Dewaele K, Claeys R: Hemophagocytic lymphohistiocytosis in SARS-CoV-2 infection. Blood 135: 2323, 2020.
- 49) Debliquis A, Harzallah I, Mootien JY, Poidevin A, Labro G, Mejri A, Lamarque M, Kuteifan K, Drénou B: Haemophagocytosis in bone marrow aspirates in patients with COVID-19. Br J Haematol 190: e70–e73, 2020.
- 50) Patell R, Khan AM, Bogue T, Merrill M, Koshy A, Bindal P, Joyce R, Aird WC, Neuberg D, Bauer KA, Zwicker JI: Heparin induced thrombocytopenia antibodies in Covid-19. Am J Hematol, 2020 Jul 13: 10.1002/ajh.25935. doi: 10.1002/ajh.25935.
- 51) Warkentin TE, Kaatz S: COVID-19 versus HIT hypercoagulability. Thromb Res 196: 38–51, 2020.
- 52) Li H, Wang B, Ning L, Luo Y, Xiang S: Transient appearance of EDTA dependent pseudothrombocytopenia in a patient with 2019 novel coronavirus pneumonia. Platelets 31: 825–826, 2020.
- 53) Chen G, Wu D, Guo W, Cao Y, Huang D, Wang H, Wang T, Zhang X, Chen H, Yu H, Zhang X, Zhang M, Wu S, Song J, Chen T, Han M, Li S, Luo X, Zhao J, Ning Q: Clinical and immunological features of severe and moderate coronavirus disease 2019. J Clin Invest 130: 2620–2629, 2020.
- 54) Zhou Y, Zhang Z, Tian J, Xiong S: Risk factors associated with disease progression in a cohort of patients infected with the 2019 novel coronavirus. Ann Palliat Med 9: 428–436, 2020.
- 55) Fu J, Kong J, Wang W, Wu M, Yao L, Wang Z, Jin J, Wu D, Yu X: The clinical implication of dynamic neutrophil to lymphocyte ratio and D-dimer in COVID-19: A retrospective study in Suzhou China. Thromb Res 192: 3–8, 2020.
- 56) Liang W, Liang H, Ou L, Chen B, Chen A, Li C, Li Y, Guan W, Sang L, Lu J, Xu Y, Chen G, Guo H, Guo J, Chen Z, Zhao Y, Li S, Zhang N, Zhong N, He J; China medical treatment expert group for COVID-19: Development and validation of a clinical risk score to predict the occurrence of critical illness in hospitalized patients with COVID-19. JAMA Intern Med 180: 1081–1089, 2020.
- 57) 石倉 宏恭, 丸山 隼一, 入江 悠平, 泉谷 義人, 内藤 麻巳子, 鯉江 めぐみ, 星野 耕大, 仲村 佳彦:重症新型コロナウィルス感染症(COVID-19)の凝固線溶系異常の特徴―Case series―.血栓止血誌 31: 398–408, 2020.
- 58) Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP: The trinity of COVID-19: Immunity, inflammation and intervention. Nat Rev Immunol 20: 363–374, 2020.
- 59) Matheson NJ, Lehner PJ: How does SARS-CoV-2 cause COVID-19? Science 369: 510–511, 2020.
- 60) Pons S, Fodil S, Azoulay E, Zafrani L: The vascular endothelium: The cornerstone of organ dysfunction in severe SARS-CoV-2 infection. Crit Care 24: 353, 2020.
- 61) Romagnoli S, Peris A, De Gaudio AR, Geppetti P: SARS-CoV-2 and COVID-19: From the bench to the bedside. Physiol Rev 100: 1455–1466, 2020.
- 62) Guaraldi G, Meschiari M, Cozzi-Lepri A, Milic J, Tonelli R, Menozzi M, Franceschini E, Cuomo G, Orlando G, Borghi V, Santoro A, Di Gaetano M, Puzzolante C, Carli F, Bedini A, Corradi L, Fantini R, Castaniere I, Tabbì L, Girardis M, Tedeschi S, Giannella M, Bartoletti M, Pascale R, Dolci G, Brugioni L, Pietrangelo A, Cossarizza A, Pea F, Clini E, Salvarani C, Massari M, Viale PL, Mussini C: Tocilizumab in patients with severe COVID-19: A retrospective cohort study. Lancet Rheumatol 2: e474–e484, 2020.
- 63) Biran N, Ip A, Ahn J, Go RC, Wang S, Mathura S, Sinclaire BA, Bednarz U, Marafelias M, Hansen E, Siegel DS, Goy AH, Pecora AL, Sawczuk IS, Koniaris LS, Simwenyi M, Varga DW, Tank LK, Stein AA, Allusson V, Lin GS, Oser WF, Tuma RA, Reichman J, Brusco L Jr, Carpenter KL, Costanzo EJ, Vivona V, Goldberg SL: Tocilizumab among patients with COVID-19 in the intensive care unit: A multicentre observational study. Lancet Rheumatol 2020 Aug 14. doi: 10.1016/S2665-9913(20)30277-0.
- 64) X Xu X, Han M, Li T, Sun W, Wang D, Fu B, Zhou Y, Zheng X, Yang Y, Li X, Zhang X, Pan A, Wei H: Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A 117: 10970–10975, 2020.
- 65) Ogawa H, Kakuchi Y, Asakura H: Adjunctive therapies for early withdrawal from extracorporeal membrane oxygenation. J Card Surg 2020 Sep 29. doi: 10.1111/jocs.15024.
- 66) Liu J, Li J, Arnold K, Pawlinski R, Key NS: Using heparin molecules to manage COVID-2019. Res Pract Thromb Haemost 4: 518–523, 2020.
- 67) Lindahl U, Li JP: Heparin—an old drug with multiple potential targets in Covid-19 therapy. J Thromb Haemost, 2020 May 19: 10.1111/jth.14898. doi: 10.1111/jth.14898.
- 68) Thachil J: Clinical differentiation of anticoagulant and non-anticoagulant properties of heparin. J Thromb Haemost, 2020 May 29: 10.1111/jth.14933. doi: 10.1111/jth.14933.
- 69) Hasan SS, Radford S, Kow CS, Zaidi STR: Venous thromboembolism in critically ill COVID-19 patients receiving prophylactic or therapeutic anticoagulation: A systematic review and meta-analysis. J Thromb Thrombolysis, 2020 Aug 3: 1–8. doi: 10.1007/s11239-020-02235-z.
- 70) Aoyama T, Ino Y, Ozeki M, Oda M, Sato T, Koshiyama Y, Suzuki S, Fujita M: Pharmacological studies of FUT-175, nafamstat mesilate. I. Inhibition of protease activity in in vitro and in vivo experiments. Jpn J Pharmacol 35: 203–227, 1984.
- 71) Asakura H, Ogawa H: Potential of heparin and nafamostat combination therapy for COVID-19. J Thromb Haemost 18: 1521–1522, 2020.
- 72) Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Müller MA, Drosten C, Pöhlmann S: SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 181: 271–280, 2020.
- 73) Yamamoto M, Matsuyama S, Li X, Takeda M, Kawaguchi Y, Inoue JI, Matsuda Z: Identification of nafamostat as a potent inhibitor of middle east respiratory syndrome coronavirus S protein-mediated membrane fusion using the split-protein-based cell-cell fusion assay. Antimicrob Agents Chemother 60: 6532–6539, 2016.
- 74) Inoue J, Yamamoto M: Identification of an existing Japanese pancreatitis drug, Nafamostat, which is expected to prevent the transmission of new coronavirus infection (COVID-19). Available at: https://www.u-tokyo.ac.jp/focus/en/articles/z0508_00083.html
- 75) Yamamoto M, Kiso M, Sakai-Tagawa Y, Iwatsuki-Horimoto K, Imai M, Takeda M, Kinoshita N, Ohmagari N, Gohda J, Semba K, Matsuda Z, Kawaguchi Y, Kawaoka Y, Inoue JI: The anticoagulant nafamostat potently inhibits SARS-CoV-2 S protein-mediated fusion in a cell fusion assay system and viral infection in vitro in a cell-type-dependent manner. Viruses 12: 629, 2020.
- 76) Hoffmann M, Schroeder S, Kleine-Weber H, Müller MA, Drosten C, Pöhlmann S: Nafamostat mesylate blocks activation of SARS-CoV-2: New treatment option for COVID-19. Antimicrob Agents Chemother 64: e00754-20, 2020.
- 77) Ji HL, Zhao R, Matalon S, Matthay MA: Elevated plasmin(ogen) as a common risk factor for COVID-19 susceptibility. Physiol Rev 100: 1065–1075, 2020.
- 78) Barker AB, Wagener BM: An ounce of prevention may prevent hospitalization. Physiol Rev 100: 1347–1348, 2020.
- 79) Ogawa H, Asakura H: Consideration of tranexamic acid administration to COVID-19 patients. Physiol Rev 100: 1595–1596, 2020. (Co-first author)
- 80) Doi K, Ikeda M, Hayase N, Moriya K, Morimura N; COVID-UTH Study Group: Nafamostat mesylate treatment in combination with favipiravir for patients critically ill with Covid-19: A case series. Crit Care 24: 392, 2020.
- 81) Jang S, Rhee JY: Three cases of treatment with nafamostat in elderly patients with COVID-19 pneumonia who need oxygen therapy. Int J Infect Dis 96: 500–502, 2020.
- 82) Whyte CS, Morrow GB, Mitchell JL, Chowdary P, Mutch NJ: Fibrinolytic abnormalities in acute respiratory distress syndrome (ARDS) and versatility of thrombolytic drugs to treat COVID-19. J Thromb Haemost 18: 1548–1555, 2020.
- 83) Christie DB 3rd, Nemec HM, Scott AM, Buchanan JT, Franklin CM, Ahmed A, Khan MS, Callender CW, James EA, Christie AB, Ashley DW: Early outcomes with utilization of tissue plasminogen activator in COVID-19 associated respiratory distress: A series of five cases. J Trauma Acute Care Surg 89: 448–452, 2020.
- 84) Choudhury R, Barrett CD, Moore HB, Moore EE, McIntyre RC, Moore PK, Talmor DS, Nydam TL, Yaffe MB: Salvage use of tissue plasminogen activator (tPA) in the setting of acute respiratory distress syndrome (ARDS) due to COVID-19 in the USA: A Markov decision analysis. World J Emerg Surg 15: 29, 2020.
- 85) Wang J, Hajizadeh N, Moore EE, McIntyre RC, Moore PK, Veress LA, Yaffe MB, Moore HB, Barrett CD: Tissue plasminogen activator (tPA) treatment for COVID-19 associated acute respiratory distress syndrome (ARDS): A case series. J Thromb Haemost 18: 1752–1755, 2020.
- 86) Wu Y, Wang T, Guo C, Zhang D, Ge X, Huang Z, Zhou X, Li Y, Peng Q, Li J: Plasminogen improves lung lesions and hypoxemia in patients with COVID-19. QJM 113: 539–545, 2020.
- 87) Asakura H, Ogawa H: Perspective on fibrinolytic therapy in COVID-19: The potential of inhalation therapy against suppressed-fibrinolytic-type DIC. J Intensive Care 8: 71, 2020.