2022 Volume 33 Issue 6 Pages 693-700
2022 Volume 33 Issue 6 Pages 693-700
悪性腫瘍では様々なタイプの血栓症が合併することが知られている.深部静脈血栓症(DVT),非細菌性血栓性心内膜炎(nonbacterial thrombotic endocarditis: NBTE),播種性血管内凝固症候群(DIC),血栓性微小血管症(TMA),心房血栓,心筋梗塞,脳梗塞などいずれも生命を脅かす危険な病態であるが,特に悪性腫瘍に合併する脳梗塞に関しては発症機序や最適な予防法・治療法の研究は不明な部分が多いのが現状である1).
脳梗塞の臨床病型には,①頸動脈や脳動脈におけるアテローム血栓性脳梗塞(large artery atherothrombosis: LAA),②ラクナ梗塞,③心原性脳塞栓症(cardioembolic stroke: CE),④塞栓源不明の脳梗塞(embolic stroke of undetermined sources: ESUS)に大別され,その他にも5%以下の頻度とまれではあるが動脈解離や血管炎なども原因として含まれる2).このように脳梗塞は多様な病態を含む疾患であることを認識することが重要である.悪性腫瘍においては脳梗塞の頻度は約5倍に上昇することが報告されており,脳梗塞を機に初めて悪性腫瘍と診断されることもある3).このような悪性腫瘍を背景として発症する脳梗塞においては心原性脳塞栓症と塞栓源不明の脳梗塞が原因として重要と思われる4).
本稿では,悪性腫瘍に合併した脳梗塞患者の脳動脈責任病変から採取された脳血栓の病理像から悪性腫瘍に合併する脳血栓塞栓症の特徴を概説する.
一般的に脳梗塞患者から血栓回収療法よって採取される血栓のほとんどは心房細動に伴う心房血栓からの血栓塞栓症であるが,少数例では頸動脈やさらに頻度は少ないが脳動脈のアテローム血栓症,大動脈・心室など他の部位からの血栓塞栓,深部静脈血栓症から卵円孔を介して生じる血栓塞栓,動脈解離,癌に合併するトルーソー症候群,血液凝固異常症を背景とした症例なども含まれる.
これらの血栓を病理学的に観察すると,赤血球が主体の部分やフィブリンが優位な領域あるいは血小板が豊富な領域に分けられる.また細胞成分として好中球や単核の炎症細胞などが種々の程度に混在している.さらに血栓の形成に関与することが示唆されているneutrophil extracellular traps(NETs)がしばしば一部に観察される.これら様々な血栓成分と血栓の採取部位・基礎疾患,発症からの時間,臨床的検査データ・所見,患者の状態,治療歴や予後との関連性についての報告は少数ながら存在するが5, 6),悪性腫瘍に合併した脳梗塞患者から採取された血栓の検討はほとんどされていない4, 7, 8).
脳梗塞患者の脳血管責任病変から回収した血栓は,多くの症例で赤血球が主体の血栓であり,その背景にはフィブリン網が形成されている.血小板が豊富な領域はマイナーな構成成分であり,赤血球が主体の部分を取り囲むように,あるいは赤血球優位血栓中に島状,索状,あるいは層状に血小板凝集領域が存在している像がみられる(図1,2).これら血栓の病理学的パターンの臨床的な意義は不明である.また心原性血栓塞栓症,アテローム性血栓症,ESUS,動脈解離などから回収した血栓において,血栓の各構成成分を免疫染色で比較検討を行っても有意な差はみられない(図3,表1)5).

アテローム性血栓塞栓症の患者から回収された脳動脈の血栓.赤血球が主体の血栓を取り囲むように,血小板凝集層が存在している.このようなパターンを示す血栓は血栓溶解療法に対して抵抗性を示す可能性がある.
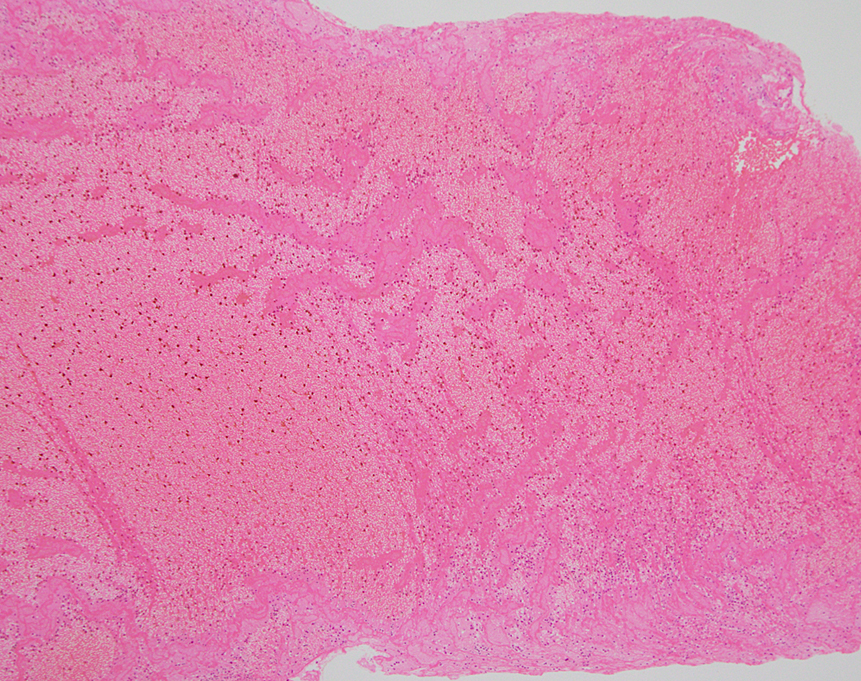
心原性塞栓症の患者から回収された脳動脈の血栓.赤血球優位血栓中に島状,索状,あるいは層状パターンに血小板凝集領域が存在している像がみられる.心房細動に伴う血栓塞栓症ではよくみられる組織パターンである.

心原性塞栓症の患者から回収された脳動脈の血栓における免疫染色.(A)赤血球と血小板凝集から構成されている混合血栓を認める.HE像.(B)抗赤血球抗体であるGlycophorin A抗体による免疫染色.赤血球が主体の部分が約50%の領域を占める.(C)抗血小板GPIIIa抗体であるCD61抗体による免疫染色.血小板が主体の部分が約50%の領域を占める.Bとは対照的な分布パターンを示し,CD61陰性領域は基本的にGlycophorin A陽性であるが,CD61とGlycophorin Aの陽性領域は一部ではオーバーラップしている.(D)抗Fibrin抗体による免疫染色.血小板CD61陽性領域とオーバーラップしているが,赤血球優位な領域とも重複している.
| 臨床病型(症例数) | フィブリン | 血小板 | 赤血球 | vWF |
|---|---|---|---|---|
| 心原性塞栓(58) | 39.2±14.0 | 24.8±15.1 | 34.9±13.6 | 8.0±9.0 |
| アテローム血栓症(6) | 38.1±15.2 | 18.2±9.6 | 32.9±14.7 | 12.5±16.6 |
| ESUS(7) | 35.2±8.6 | 19.6±7.9 | 29.5±15.6 | 8.5±12.0 |
| 動脈解離(3) | 26.6±5.7 | 17.2±7.0 | 19.3±15.7 | 8.2±4.1 |
(数字は血栓の全面積に対する各種成分の占める割合:平均%±SD)
がんを合併した脳梗塞患者9名(表2)から回収した血栓を免疫染色により検討すると,2名において血小板凝集領域が主体の特異な組織像を示す血栓がみられた(図4).この2名は心房細動を合併しておらず,血栓の構成成分として大部分が血小板からなり,一部に赤血球領域と背景に繊細なフィブリン網を認める病理像を示していた(図4).また,その他の7名においても血栓に占める血小板面積が,多くの症例で60%を超えており非がんの脳梗塞患者より明らかに高値を示した(図5).この傾向は心房細動の合併の有無には関係しなかった.現在までに検討が終了している74名の非がんの脳梗塞患者では,約75%の症例において回収血栓における血小板の面積は50%以下であり赤血球が主体の血栓から成っていることとは対照的であり,がん患者に合併した脳梗塞患者の血栓の病理学的特徴を示すものと考えられた(図6).
| 年齢 | 性 | 心房細動 | D-dimer μg/mL | 転帰 | 死亡 | 血小板(%) | 赤血球(%) | フィブリン(%) | VWF(%) | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 87 | 女 | なし | 15.0 | 不良 | なし | 59.3 | 40.6 | 31.4 | 14.0 |
| 2 | 68 | 女 | なし | 1.8 | 不良 | なし | 84.5 | 17.3 | 27.0 | 22.9 |
| 3 | 82 | 男 | あり | 17.7 | 良好 | なし | 63.3 | 7.2 | 30.4 | 7.9 |
| 4 | 80 | 女 | なし | 50.3 | 不良 | あり | 63.8 | 10.6 | 36.7 | 21.9 |
| 5 | 92 | 女 | なし | 1.2 | 不良 | なし | 68.7 | 39.8 | 35.5 | 20.2 |
| 6 | 77 | 男 | あり | 1.2 | 良好 | なし | 47.4 | 38.1 | 21.4 | 17.4 |
| 7 | 73 | 女 | あり | 7.1 | 良好 | なし | 66.6 | 25.8 | 53.1 | 20.5 |
| 8 | 72 | 男 | なし | 0.8 | 良好 | なし | 40.8 | 36.1 | 31.9 | 18.3 |
| 9 | 84 | 女 | あり | 26.1 | 不良 | なし | 60.0 | 48.8 | 48.3 | 22.8 |

がんを合併した脳梗塞患者の脳動脈責任病変から回収された血栓.(A)血小板凝集塊から成る血栓を認める.HE像.(B)赤血球は血栓の一部に存在するのみである.Glycophorin A免疫染色.(C)血栓の大部分は血小板から成る.CD61免疫染色.(D)血栓全体には背景に繊細なフィブリン網を認める.Fibrin免疫染色.
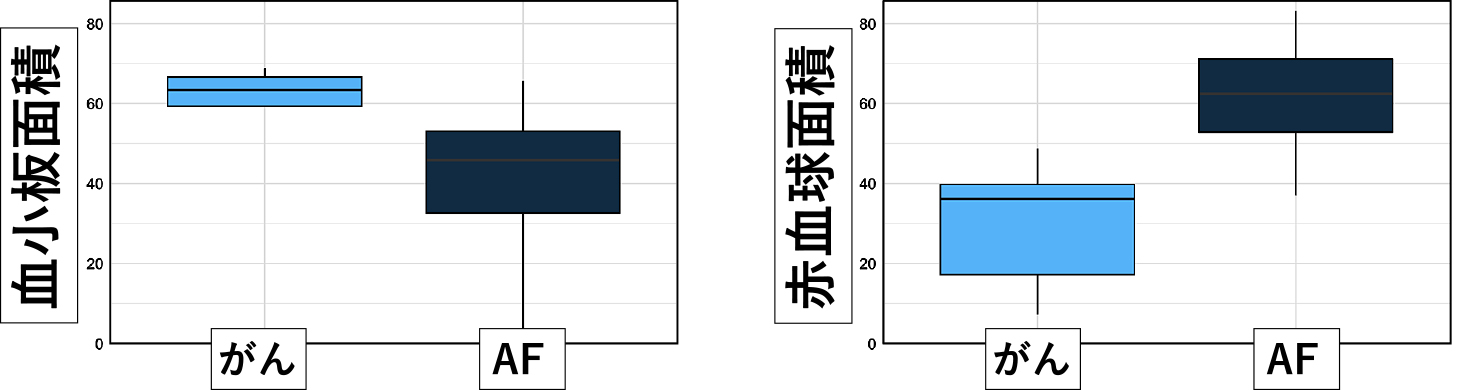
免疫染色による赤血球,血小板,フィブリン,von Willebrand因子の陽性面積の検討では,がんを合併した脳梗塞患者9名から回収した血栓は,非がん患者で心房細動(AF)を合併した脳梗塞10名からの血栓と比較して優位に血小板領域が高値を示した(左).逆に,非がんの脳梗塞患者からの血栓では赤血球の占める面積が優位に高値であった(右).

血栓に占める赤血球と血小板の陽性面積比の検討では,非がんの脳梗塞患者からの回収血栓においては約75%の症例で赤血球が主体の血栓からなっているが,がんに合併した脳梗塞の血栓ではほとんどの症例で血小板が優位である.
Trousseau症候群の代表的疾患であるNBTEでは大動脈弁や僧帽弁において血栓性疣贅を生じる(図7).がんに合併したNBTEの剖検例(5症例)について,血栓の免疫染色で血栓組成を検討すると全例において,血栓全体が血小板凝集塊からなる血栓で赤血球やフィブリンはマイナーな成分であった(図8).一方,心筋梗塞後に生じる左室梗塞部の壁在血栓,感染性心内膜炎に合併した僧帽弁の血栓,左心房血栓,大動脈瘤で生じた壁在血栓,下大静脈血栓については,動脈系の血栓は多数の赤血球とともにフィブリンや血小板領域が主体の混合血栓で,その他の静脈系血栓の多くは赤血球が主体の血栓から成っている9).このように様々な臓器や病態で生じた血栓について組成を調べてみるとNBTE血栓の特異な病理像が明らかとなり,がん患者の脳梗塞2名でみられた血小板凝集塊からなる血栓はNBTEの疣贅を塞栓源とした血栓塞栓(図9)と推察でき,その他の血栓は心房細動などに合併した血栓塞栓が中心と考えられた.更にがん患者に合併した脳梗塞においては心房細動やESUSにおいても血小板優位な血栓が形成されることが示唆された.

大腸がんに合併した非細菌性血栓性心内膜炎(NBTE)の肉眼像.大動脈弁に血栓性疣贅を認める.インセットは疣贅の割面を示す.

非細菌性血栓性心内膜炎(NBTE)の病理像.(A)血小板主体の疣贅を認める.HE染色.(B)表層の一部に赤血球を認める.Glycophorin A免疫染色.(C)疣贅は大部分が血小板凝集塊からなることが分かる.CD61免疫染色.(D)フィブリンは一部に陽性像を示すのみ.フィブリン免疫染色.

非細菌性血栓性心内膜炎(NBTE)の脳血栓塞栓像.脳実質内の塞栓物は血小板凝集塊からなる.
脳血栓にはNETsもみられるが(図10),多くの症例においては血栓の一部に限局しているのみであり血栓形成の開始因子となる可能性はあるものの,主体的な役割を果たしていると考える所見は見出しえなかった.またがん患者と非がん患者から回収した脳血栓におけるNETsの分布や量の違いも認めていない.がん細胞からは組織因子(TF)やムチン,ポドプラニンなど凝固系あるいは血小板を活性化させる因子が産生されている.さらにPAI-1やp-セレクチンを介する機序も報告されている.がん患者の脳梗塞の原因として心房内における血栓形成は最も重要であるが,がん患者特有な血栓形成促進因子,凝固系に加えて特に血小板凝集を亢進させるムチンやサイトカインなどの因子が重要な増幅因子となっている可能性が考えられる(図11)9–11).

がんに合併した脳梗塞患者から回収した血栓にみられたNETs.血栓の一部にNETsを認めるが,非がん患者においても同様に認めた.

がん患者における血栓形成には,背景因子として年齢,高血圧,糖尿病などの危険因子に加えて,血流の変化,内皮細胞障害による血小板の活性化,von-Willebrand因子(vWF)の増加,組織因子の発現増加や,がん細胞から産生されるサイトカイン,がん細胞由来ムチン,組織因子,マイクロパーティクル(MP)などによる血液の過凝固性など多くの因子が複雑に関与していると推察される.AF:心房細動,NBTE:非細菌性血栓性心内膜炎.文献10より改変.
がんに合併した脳梗塞にみられる血栓の質についての特徴を概説した.その予防や治療方法の開発のためには,背景となる多くの因子を考慮する必要があるが,個人による病態の違いを正しく評価しながら個別の対処法を展開してゆくことがまずは大切と考えられる.
本論文発表内容に関連して開示すべき企業等との利益相反なし