2024 Volume 83 Issue 1 Pages 23-32
2024 Volume 83 Issue 1 Pages 23-32
A 37-year-old woman with hereditary Parkinson’s disease (PARK2: exon 3/7 hetero-duplication & exon 3/5 hetero-deletion) visited our neuro-otology unit for evaluation of postural instability; she had no history of dizziness or vertigo. Neurological examination revealed no other significant abnormalities than the cardinal signs of Parkinsonism: mild rigidity, resting tremor and dystonia. Brain MRI revealed mild atrophy of the cerebellar dorsal vermis and hemisphere. The ENG showed square wave jerks (SWJ) during forward gaze in the dark. The visually guided saccades were hypometric in both the horizontal and vertical directions. Both horizontal and vertical smooth pursuits were slightly disturbed and required corrective anticipated saccades to follow the sinusoidal target. Horizontal OKN could be induced, but the slow phase velocity and frequency were relatively reduced. These findings were slightly different from those in sporadic Parkinson’s disease, although there were also some similarities. Considered with the MRI findings, the above ENG findings suggest dysfunction of not only the basal ganglia, but also of the cerebellum, especially the vestibular cerebellum, including the dorsal vermis, fastigial nucleus, flocculus, and ventral paraflocculus. In conclusion, it is necessary to consider dysfunction of the cerebellum, as also that of the basal ganglia, as the cause of the abnormal eye movements in this case.
Parkinson病(PD)は,90%以上が孤発性PDで,残り10%前後が遺伝性(家族性)PDとされる。遺伝性PDの中で,PARK2は我が国で臨床病型の報告と遺伝子単離がなされ,6番染色体長腕先端付近(6q25.2-27)のparkin遺伝子異常により常染色体劣性(潜性)遺伝形式で発症する1)2)。発症年齢は,Lohmann等3)によると,年齢幅7歳~70歳,平均年齢31.4 ± 11.9歳,80%以上が20歳以下,20%弱が46歳~55歳とされる。PDの臨床診断上有力な手掛かりとされる123I-MIBG心筋シンチグラフイー検査では,孤発性PDのような著明な心筋へのMIBG集積低下はみられないことが多い4)。臨床症状は,孤発性PDとほぼ同様であるが,緩徐進行性,日内変動,睡眠効果,発症年齢の若い場合は下肢dystoniaを伴う,などの例が多い。また,少量のL-DOPAで著明な改善がみられる一方,L-DOPA誘発性dyskinesiaやwearing-off現象が早期からみられる場合が多い1)~3)。病理所見は,黒質緻密部,青斑核に限局性に病変がみられる事が多く(黒質緻密部>青斑核),その他の部位への波及は顕著にみられず5)6),また,PDのhallmarkとされるLewy小体も殆ど認められない場合が多い7)。
今回,ENG上square wave jerks(SWJ)など様々な異常眼運動所見やMRI上小脳萎縮が認められたPARK2例を経験した。PARK2の異常眼運動所見に関する報告例は文献的に極めて少なく8)9),また具体的にENGを例示した報告例は,著者の調べた限り,認められなかったことから文献的考察を加え報告する。
症例:37歳,女性
既往歴:特記すべき事なし
家族歴:父:parkin遺伝子exon 3/7 hetero-duplication,母:parkin遺伝子exon 3/5 hetero-deletion,二人の兄:現在まで未発症
現病歴:200X年6月(15歳)頃より,歩行時に右下肢が回旋するようなdystoniaが出現した。症状は,睡眠により改善がみられた。しかし,徐々に歩行時に突っ張りや右上下肢に振戦なども出現した。200X + 2年4月,近医受診し「日内変動を伴う遺伝性進行性dystonia(瀬川病)」が疑われたが,精査の結果GCH1遺伝子は陰性だった。11月同院でL-DOPA 200 mgより投与開始し1000 mgまで増量したが効果は不明瞭であった。200X + 4年7月よりL-DOPA/carbidopa 250 mgに変更したが,右手の使いづらさなどが出現したため遺伝性Parkinson病が疑われ,6月14日当科外来紹介受診した。遺伝子検査で,parkin遺伝子exon 3/7 hetero-duplication & exon 3/5 hetero-deletionが認められた。薬剤もL-DOPA/carbidopaからcabergolineに変更後,歩行に改善がみられた。200X + 14年8月,妊娠,翌年5月,帝王切開にて出産。200X + 22年7月,両下肢のdystoniaは増悪し,薬剤の利いている時間帯は杖歩行も可能だが,それ以外は車椅子生活となったため,薬剤調整のため当科外来を再診した。併せて,PDの主症状の一つである平衡機能障害の精査目的で著者外来を受診し,当院耳鼻咽喉科にENG検査を依頼した。
初診時所見:初診時,意識は清明。失語,失行,失認,など特に認められなかった。また,脳神経症状は,特に異常所見は認められなかった。また,両鼓膜とも特に異常所見は認められなかった。運動系では,四肢に麻痺など筋力低下は認められなかったが,四肢筋に軽度固縮が認められた。また,四肢に安静時振戦が認められた。深部腱反射は,上下肢とも正常域であった。またChaddock・Babinski反射など病的反射は認められなかった。小脳性協調運動に関しては,指鼻試験,膝踵試験及び反復拮抗運動試験などで特に異常は認められなかった。感覚系は,顔面・四肢・体幹に表在覚及び深部覚に特に異常所見は認められなかった。尚,直立検査(Mann検査,Romberg検査など),継ぎ足歩行検査などは,左下肢dystoniaが強く検査は実施困難であった。
純音聴力検査:平均聴力(4分法)は,右耳8.8 dB,左耳8.8 dBで,両耳とも特に有意な閾値上昇は認められず正常域であった。
頭部MRI検査(図1A,B):第IV脳室拡張,小脳半球第一裂・後上裂開大などがみられ小脳半球・虫部などの萎縮が認められた。
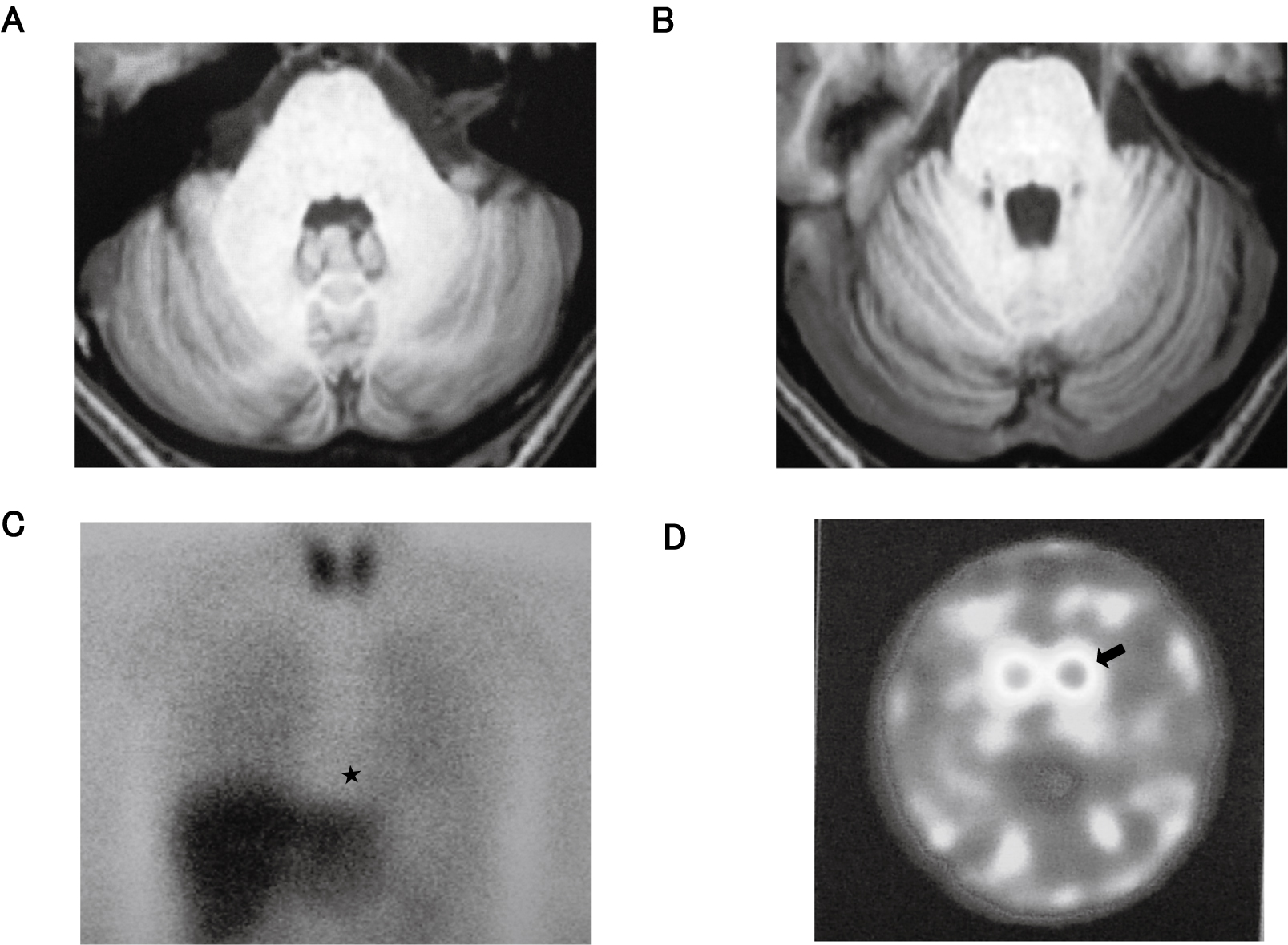
A.B.頭部MRI検査:第IV脳室拡大,小脳半球第一裂・後上裂の開大など小脳半球,小脳虫部などに軽度萎縮が認められた。
C.123I-MIBG心筋シンチグラフイー検査:心臓(H)/縦隔(M)比(H/M比)の当院施設基準値(2.2)に対して,早期相2.21,遅延相1.83と遅延相で若干低下が認められ,心筋へのMIBG集積軽度低下(★印)が示唆された。
D.123I-FP-CITドパミントランスポーターSPECT検査(DAT-scan):両側とも,“egg”型のGrade-2のレベルで,両側被殻/尾状核頭の集積低下(矢印)がみられ,黒質線条体dopamine作動性neuronのsynapse前傷害が示唆された。
123I-MIBG心筋シンチグラフイー検査(図1C):心臓(H)/縦隔(M)比(H/M比)の当院施設基準値(2.2)に対して,早期相2.21,遅延相1.83と遅延相で若干低下が認められ,軽度の心筋へのMIBG集積低下(★印)が示唆された。
123I-FP-CITドパミントランスポーターSPECT検査(DAT-scan)(図1D):両側とも“egg”型のGrade-2レベルで,両側被殻/尾状核頭の集積低下(矢印:SBRBolt:右3.19,左3.24,平均3.21:正常4.0以上)がみられ,黒質線条体dopamine作動性neuronのsynapse前傷害が示唆された。
ENG所見:暗所・水平記録・正面視で著明なSWJ(振幅5°頻度2 c/sec,intersaccadic interval 128 msec:図2矢印)が認められた。また,眼位を正中視から右方視に変換時に右向き眼振が軽度認められた(図2)。二点交互視検査では,水平性はhypometric saccadeで,いわゆる“staircase”saccade(矢印),垂直性も,特に上向きでhypometric saccadeで同様に“staircase”saccade(矢印)及びsaccade後にcorrective saccade(*印)が連続するpostsaccadic drift(glissade)が認められた(図3)。視標追跡検査(ETT/図4)では,水平・垂直とも,軽度のsaccadic pursuitが認められた。saccadeはcatch-up saccade(矢頭)とanticipated saccade(矢印)が混じるPD特有のpatternを示した。また,視標の方向変換点では眼位保持不安定となりcorrective saccade(*印)が連発した。視運動性眼振pattern(OKP)検査では,水平・垂直(未呈示)OKNとも総眼振数(fusion),最大緩徐相速度(adaptation)はやや低下し解発不良であった(図5)。因みに,水平OKN緩徐相の総眼振数,最大緩徐相速度につき用手的に定量解析を行ったが,総眼振数/右160,左151,最大緩徐相速度/右65.6°/sec,左55.2°/secと各々解発不良が確認された。尚,当院では,OKP刺激は,等加速度刺激(4°/sec2),65 sec持続,最高速度130°/secを用いている。
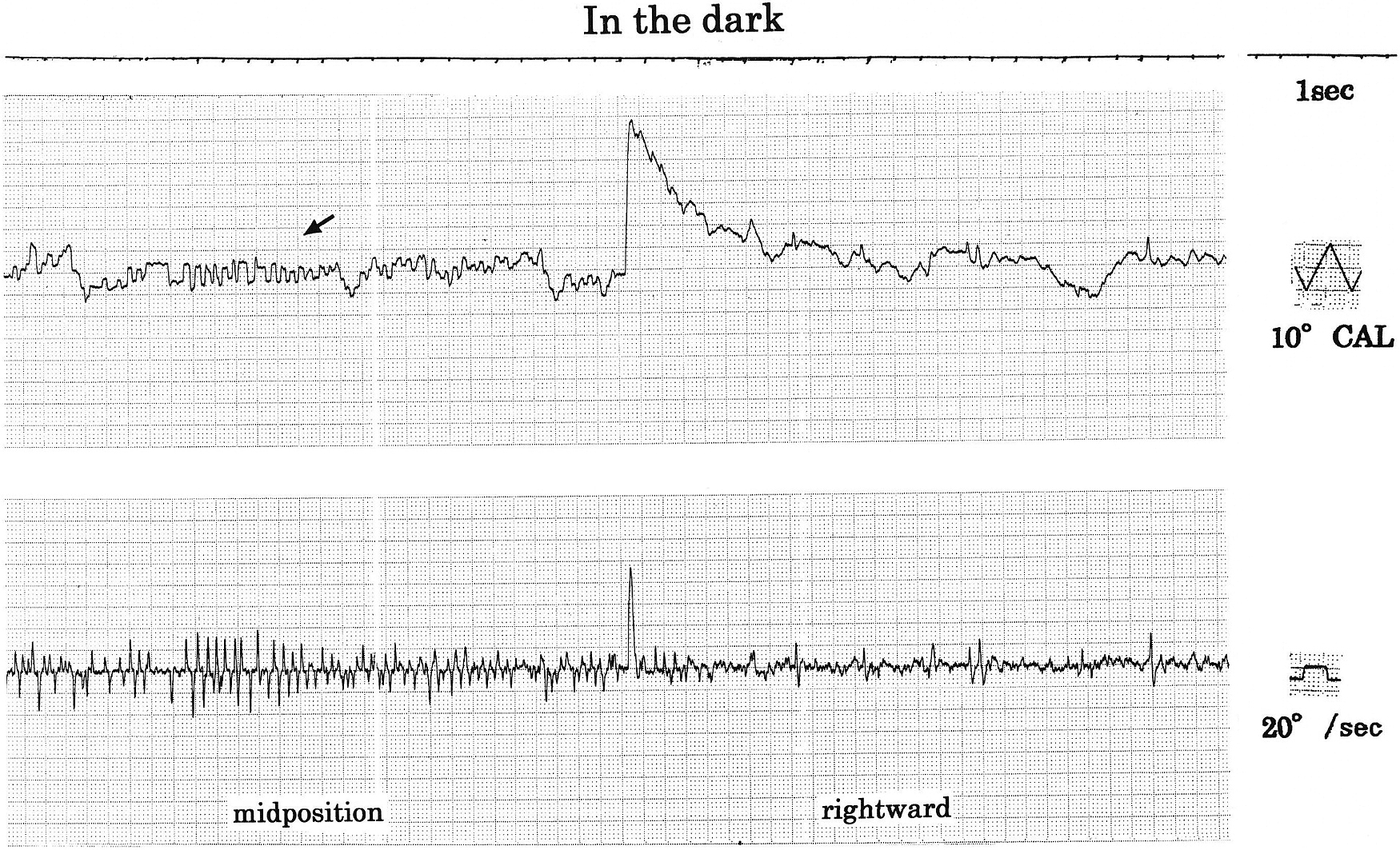
暗所,正中視で著明なsquare wave jerks(SWJ)が認められた(矢印)。また,眼位を正中視から右方視に変換時に右向き眼振が観察された。

水平性はhypometric saccadeで,いわゆる“staircase”saccade(矢印),垂直性も,特に上向きでhypometric saccadeで同様に“staircase”saccade(矢印)が認められた。また,saccade後に眼位保持が難しくcorrective saccade(*印)が連続的に生じ,いわゆるpostsaccadic drift(glissade)が認められた。●はまばたきを示す。
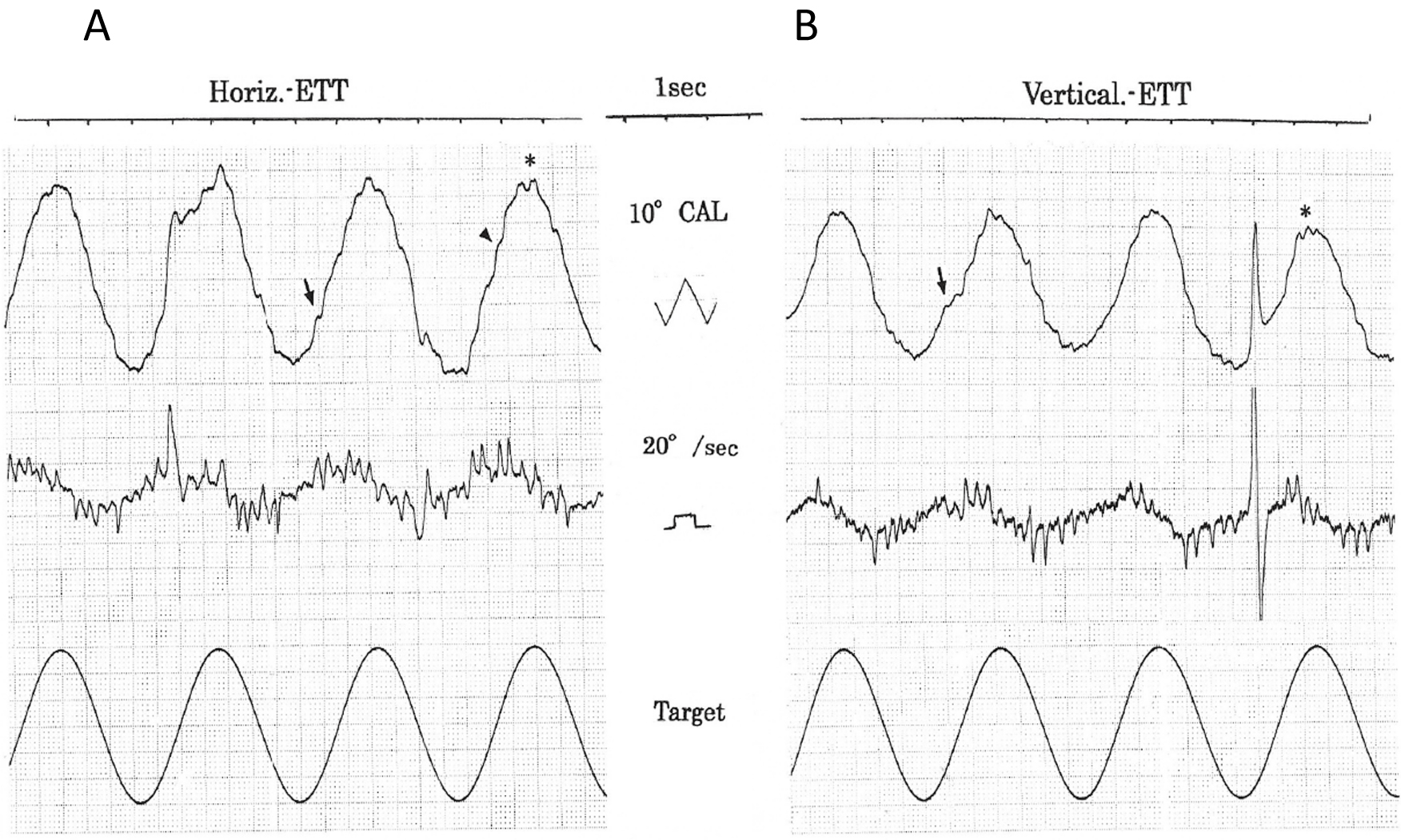
水平・垂直ETTとも,軽度のsaccadic pursuitが認められた。pursuit時のsaccadeは,catch-up saccade(矢頭)及び,anticipated saccade(矢印)が混入するPD特有のpatternを示した。また,視標の方向転換点では眼位保持不安定となりcorrective saccade(*印)が連発した。
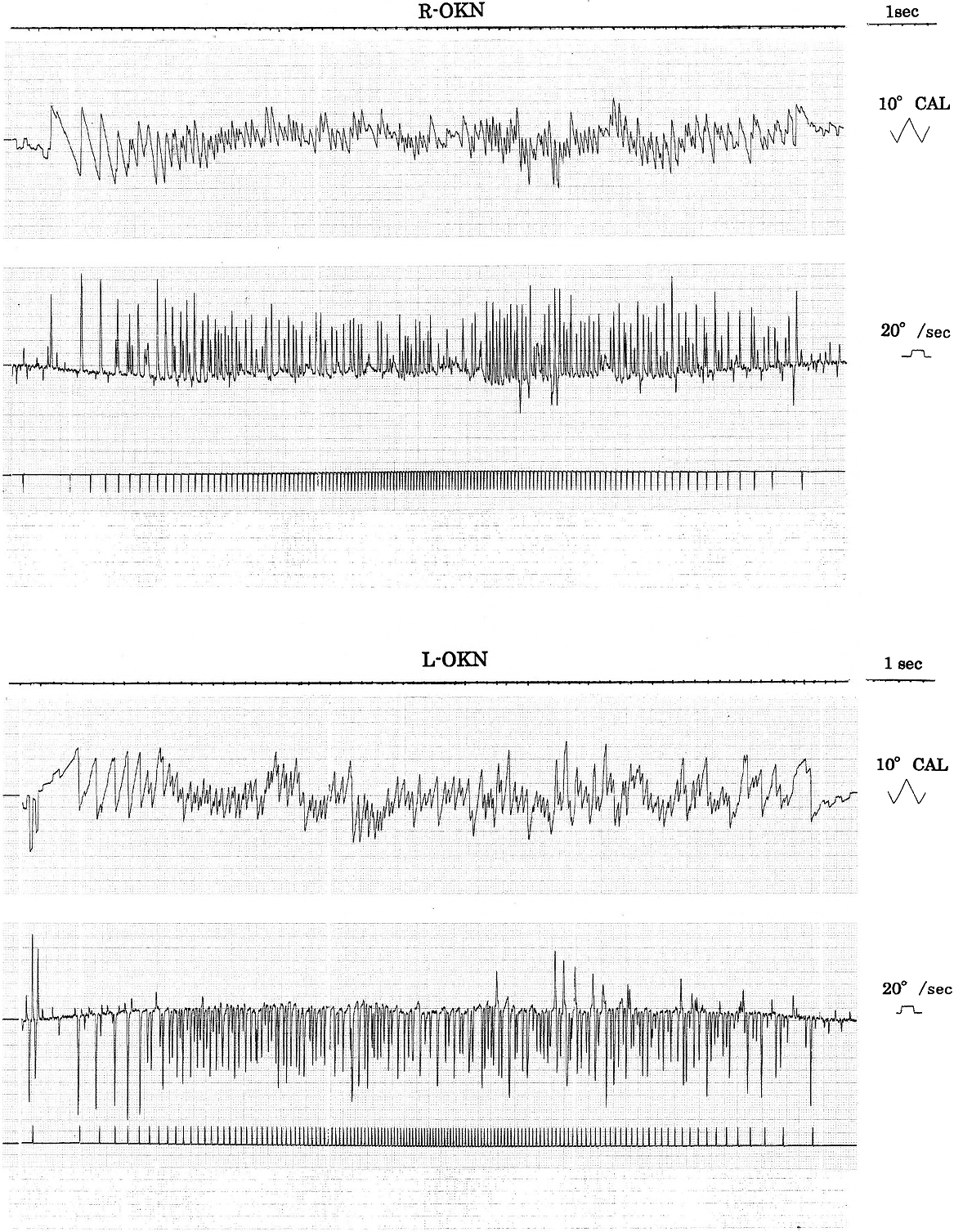
水平OKNは,緩徐相は,眼振頻度(fusion),最大緩徐相速度(adaptation)が各々軽度低下し解発不良であった
PARK2は,孤発性PDとほぼ同様の臨床症状を呈するが,それでも前述の通り,孤発性PDとはやや異なる臨床像を呈する事が多く,異常眼球運動に関しても,孤発性PDとはやや異なる所見が認められる事が多いと考えられる。しかしながら,今迄にPARK2の異常眼球運動に関する報告8)9)は極めて少なく,具体的なENG所見を例示した例も認められないことから,本例で検討したENG所見4点を中心に若干の文献的考察を行った。
i)square wave jerks(SWJ)本例でSWJが認められたが,著者の調べ得た限りでは,今迄にPARK2でSWJの記載された報告例は認められなかった。そもそも,SWJは,主にFriedreich失調症10)やその他の小脳障害11)或いは進行性核上性麻痺(PSP)12)13)などで多く認められる一方,PDでの報告例は比較的少ない。Rascol等14)によると,PSP例は8例中7例(87.5%)にSWJが認められた一方,PD例では85例中僅か13例(15.3%)に限られていた。
SWJの病態機序は未だ不明ながら,一般的には,中脳上丘(SC)レベルでのsaccade-fixation機構の障害と考えられている。周知の通り,SC吻側部fixation neuronとSC尾側部saccade neuronの相反作用によりfixation及びsaccadeが生じるが,この神経機構に障害が生じると,突発的に異常なsaccadeが生じ,これを補正するために逆向きcorrective saccadeが生じることでSWJが生じると推察される15)。同様に,PDにおけるSWJの機序も,周知の通り黒質緻密部(Snc)のdopamineが減少することで,結果的に,視床下核(STN)から淡蒼球内節(Gpi)・黒質網様部(Snr)への興奮性投射は増強し,続くGpi/SnrからSCへの抑制性投射は強化されSCレベルでのsaccade-fixation機構へ周期的な抑制-興奮信号が伝播されることでSWJが生じると考えられる16)。一方,前述の通り,多くの小脳疾患でSWJが観察されることから小脳(特に室頂核)機能障害による可能性も示唆される17)~19)。室頂核(fastigial oculomotor region/FOR)は,小脳背側虫部(VIc/VIIA: oculomotor vermis/OMV)から抑制性投射を受け,SCのsaccade-fixation neuronへも投射20)しsaccade-fixationの調整を行っていることから,OMVが障害されることでSWJが生起する可能性が考えられる。本例の場合,MRI検査で小脳半球・虫部などに軽度萎縮が認められ((図1A,B),また,後述する他の幾つかのENG所見なども考慮すると小脳障害の可能性も考えられる。
ii)二点交互視検査でhypometric saccade(saccadic dysmetria)本例では,水平性及び垂直性(特に上向き)hypometric saccadeが認められたが,Helmchen等9)も,PARK2家系53例で同様に視覚誘導型saccade(visually guided saccade: VGS)を検討した結果,水平性及び垂直性(特に上向き)saccadeでhypometriaが認められたと本例と全く同様の結果を報告している。このことから,PARK2の一つの特徴である可能性も考えられる。これに対して,初期PDにおいては,VGSは保たれる一方,記憶誘導型saccade:(memory guided saccade: MGS)が障害される21)~23)ことはよく知られている。これは,尾状核(Cd)やSnrにはMGSに選択的に反応するneuronが多く存在する24)ことも関係していると考えられる。実験的に,サル一側CdへMPTP(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine)を微量注入しPDを発症させVGS及びMGSを検討すると,VGSは保たれた一方でMGSは障害される25)。PARK2のhypometric saccadeの機序に関しては未だ解明が進んでいないが,PDと共通する基底核病変部位でも障害程度にやや差がある可能性が考えられる。もう一つの可能性としては,SWJの機序と同様に,小脳機能障害が考えられる。OMV/FORは,saccade及びpursuitを正確に制御する上で重要な機能を有し,同部位の障害でsaccadic dysmetriaが生じることは周知の通りである26)~28)。
また,本例の垂直二点交互視(図3)で,特に上向きsaccade後にcorrective saccadeが連続的に生じるpostsaccadic drift(glissade)が観察されたが,眼位保持のため外眼筋運動neuronへ伝達されるstep信号がsaccade時のpulse信号に比べ小さいためにpulse-step mismatchが生じたと考えられる。仮に,pulse信号の問題ならばOMV/FORの障害29),またstep信号の問題ならば小脳片葉(FL)・傍片葉(p-FL)の障害30)が各々考えられる。
iii)水平/垂直smooth pursuitの障害:本例の水平・垂直ETTは,共に軽度ながらsaccadic pursuitが認められた。PDにおいては,smooth pursuitが障害されることは上述のhypometric saccadeと共によく知られているが21)31),PARK2でのsmooth pursuitの障害に関する論文は1篇8)のみ認められる。即ち,Machner等8)は,症状の発現例では未発現例や健常者に比べpursuit gainに低下が認められると報告したが,この点はPDの多くの症例でもpursuit gainが健常者に比べて低下する21)31)ことと一致する。但し,視標刺激が正弦波刺激ではgainの低下は観察され難く32),また,刺激周波数も1.2 Hz以下では低下は認められず,1.2~1.56 Hz帯で漸く著明な低下が認められたという報告33)もある。本症例の場合,あくまでも臨床検査の枠内ということで定量的なgain計測は行っていないが,刺激条件が正弦波刺激,刺激周波数0.3 Hzということで,仮に計測を行った場合もgainの低下は認め難いと推察される。尚,本例では,定性的にsaccadic pursuitが認められ,しかもsaccadeも多系統萎縮症(MSA)でよく認められるcatch up saccadeではなく,catch up saccadeとanticipated saccadeが混じるpatternである点はPDの特徴をよく反映していると思われる34)。
smooth pursuitの障害に関する機序として,先ずは,大脳基底核の障害が考えられる。saccadeに関連するSNr neuronの中には,pursuitの開始及び最中に自発性の活動電位を停止するneuronも認められ35),PDでsaccadeとpursuitの両者が障害される事との関連性が示唆される。しかし,大部分の報告でL-DOPA製剤によりsmooth pursuit障害が改善されない事から,寧ろdopamine系の大脳基底核以外の部位が責任病巣として示唆されている8)。本例の場合,MRI画像や様々なENG所見など考慮すると,特に小脳の障害の可能性も考えられる。smooth pursuitに関わる小脳部位としては,FL/p-FL36),OMV(VI/VII小葉)37),FOR38)39),小脳皮質半球VI/VII小葉40),などが挙げられるが,Vahedi等37)のOMV障害例でsmooth pursuitとOKNが共に障害され,またhypometric saccadeが認められた点など本例と共通の所見が多くみられることから,OMV-FOR障害中心にFL/p-FLも含めた前庭小脳の障害が考えられる。
iv)水平・垂直OKN緩徐相解発不良本例では,水平・垂直OKNともに軽度ながらもfusion,adaptationが低下し解発不良であったが,PARK2でOKN解発不良の報告例は見当たらない。PDでも,文献的にはOKNは障害されない例が多い41)。OKN緩徐相は,周知の通り,Cohen-Raphan model42)43)によると,二つの成分direct pathwayとindirect pathwayから成り立っている。direct pathwayはFL/p-FLを中心とするsmooth pursuitにより44),またindirect pathwayは前庭核(特に内側前庭核MVN45)46))中心のvelocity-storage(VS)機構により駆動すると考えられている。本例の場合,direct pathwayに関しては,垂直/水平pursuitが障害されていたことからdirect pathwayの障害(adaptation低下)に関しては,ある程度理解しうる。一方,indirect pathwayの障害(fusion)に関しては,VS機能の障害が示唆され,MVNなどの障害が示唆される。しかしながら,本例では,温度刺激検査を行ったが良好な温度眼振が得られた(未呈示)ことなどから,脳幹VS器自体には障害(即ちMVNの障害)は及んでいないと推察される。甚だ矛盾するようだが,VS機構の具体的な神経回路網の詳細は不明ながら,VS器は,前庭小脳(特にsmooth pursuitに関わるFL/p-FL)から入力信号を受けfeed-back loopを形成することでvisual-vestibular interaction47)を行っていると考えられ,今回,前庭小脳障害により脳幹MVN/NPH部のVS器を駆動すべき入力信号が不完全なためvisual-vestibular interactionが十分に働かず,結果的に視運動刺激時にVS機能に障害が生じたと推察した。
今回,PARK2例でENG検査中心に検討を行ったが,SWJ,hypometric saccade,smooth pursuitの障害,OKN解発不良など4点の特徴的なENG所見が認められた。文献的に,PDとの比較検討を行ったが,共通した特徴もみられた反面,相違した特徴もみられた。
PARK2は,病理学的にはPDに比べ大脳基底核により限局した病巣が認められるとされるが,今回の検討では,大脳基底核障害に加えて前庭小脳(OMV-FOR,FL/p-FLなど)の機能障害の要素も示唆された。近年,Parkinson症状に加えて小脳失調症状,錐体路徴候が認められ,MRI上も小脳皮質及び虫部に本症例と同様の軽度萎縮,及び内包~大脳脚にかけて変性(T2高信号域)が認められる,いわば非典型的なPARK2例も複数報告されている48)49)。Parkin遺伝子は,大脳基底核の他にも,大脳皮質,小脳,脳幹,脊髄など広く分布している1)ことから,大脳基底核以外の部位の神経細胞に障害が生じ機能低下を来す可能性は十分考えられる。また,PDにおいても主要四症状(安静時振戦,固縮,無動,平衡失調)の中で,安静時振戦,平衡失調などは,無動,固縮などに比べL-DOPA製剤が効きにくいことやDBSにより安静時振戦に改善が得られること,或いは,振戦優位のPD例ではMRI画像上有意に小脳(特に虫部・半球)萎縮が認められる50)51),ことなどから,最近,PD症状の病態機序としては大脳基底核障害のみならず小脳遠心路(小脳-視床-大脳皮質)の障害などが着目されている。従って,本例の異常眼運動の機序としても,基底核の障害のみならず小脳機能障害の要素も十分考慮する必要があると考えられる。
利益相反に該当する事項はない。