2024 Volume 83 Issue 1 Pages 33-44
2024 Volume 83 Issue 1 Pages 33-44
Understanding cortical activity associated with vestibular input is of great importance in the diagnosis and treatment of vertigo. Previous studies on the vestibular cortex in humans have mainly used fMRI and PET, but due to the characteristics of these measuring equipments, it has been difficult to measure the cortical responses to physiological vestibular stimuli, such as rotational acceleration or deceleration to the head. Therefore, we used a portable near-infrared spectroscopy system to measure the cortical blood flow responses to rotational acceleration or deceleration stimuli in 18 right-handed normal subjects while the subjects sat on a rotational chair. The temporoparietal junction (TPJ) of both sides, which is considered as the core region of the so-called “multiple vestibular cortices,” was selected as the region of interest for the measurement. All subjects accelerated and decelerated at 3°/sec in either direction, and then performed the same acceleration and deceleration in the opposite direction a total of four times. The NIRS-SPM software was used to verify whether the concentration of oxyhemoglobin was significantly increased under the four conditions of rightward rotational acceleration, rightward deceleration, leftward acceleration, and leftward deceleration in the subjects. The results showed that there was predominant activation within the TPJ under all four conditions, that the direction of nystagmus coincided with the laterality of the activated TPJ under all the conditions, and that the pattern of TPJ activation differed depending on whether the left or right semicircular canal was stimulated.
前庭器である三半規管と耳石器で発生した回転加速度並びに直線加速度信号は,前庭神経核から視床,小脳,そして大脳にある前庭覚に関連した“前庭皮質”へと伝えられ,姿勢や眼球運動の制御や,自己の身体の空間的位置や運動の知覚・認知,さらには身体の自己所有感などを認識する上で重要な情報を提供する1)2)。前庭障害などに起因しためまい感の認知にも前庭皮質が関与している3)。サルの前庭皮質に関して,複数の大脳領域が前庭入力を受けていることがわかっており,とくにParieto-Insular Vestibular Cortex(PIVC)はこのネットワークの中核領域と考えられている4)5)。一方,機能的核磁気共鳴画像法(fMRI)や陽電子放出断層撮影法(PET)による脳機能画像研究より,ヒトの前庭皮質も,運動前野,体性感覚野,後部頭頂皮質,楔前部,後部島皮質,側頭頭頂接合部(Temporo-parietal junction: TPJ)などの複数の大脳領域で構成されることが明らかとなっており,サルのPIVCに相当する大脳領域としてTPJが考えられている6)。ただ,機器の問題で計測時の被験者の動作が制限されるため,ヒトでは頭部回転や直線運動などの生理的前庭刺激に対する大脳皮質活動が測定困難であり,カロリック刺激,ガルバニック刺激など非生理的前庭刺激が主に用いられてきた6)。
近赤外線分光法(Near-infrared spectroscopy: NIRS)は,近赤外線光を頭皮上から送光し,拡散した光を頭皮上で計測することで大脳皮質表面の血流濃度変化を測定する方法である7)。NIRSは,空間分解能ではfMRIやPETに比べ劣っており(2–3 cm程度),大脳皮質表面の相対的な血流濃度変化しか検出できないことなどの欠点があるが,一方で拘束性が低く,日常生活に近い環境や軽運動下での脳機能計測が可能なこと,fMRIやPETに比べ機器が安価で省スペースであること,身体に無害な近赤外線光を送光するだけなので被爆の可能性がなく安全であること,などの利点がある7)。また,近年小型化が進み,無線で計測データを転送できる携帯型の機器も開発されている。そこで本研究では,携帯型NIRS測定装置を用いて,両側TPJを関心大脳領域とし,生理的前庭刺激である頭部回転刺激を提示した際のヒトのTPJ周辺の大脳皮質応答を計測・解析することにした。
18人の健康成人[男性13名,女性5名,年齢26.2 ± 7.9歳,全員右利き]が本研究に参加した。被験者全員,両側の鼓膜や外耳道所見に異常はなく,めまいや難聴,中耳炎などの耳疾患,頭部外傷などの既往歴はなかった。また,ビデオヘッドインパルス検査(ICS Impulse®︎, Otometrics社製)を行い,両側外側半規管機能に異常がない(VOR gain ≥ 0.8)ことを確認した。研究の趣旨,内容,結果の取り扱いに関して十分に説明し,被験者から書面による同意を得,富山大学倫理委員会の承認(臨26-17)を得て実施された。
実験課題被験者には,課題中,目を閉じるように指示した。課題として,30秒間の静止状態ののち,3°/sec2で20秒間左右いずれかの方向に回転(加速度刺激)したのち,60°/secで100秒間等角速度刺激を行った。その後20秒間,−3°/sec2で減速停止(減速度刺激)した。100秒間の静止ののち,逆方向に3°/sec2で20秒間回転加速したのち,60°/secで100秒間等角速度刺激を施行,その後20秒間,−3°/sec2で減速停止し,100秒間静止した。これら全てを1つの課題とし,右,左の順に加速,等速度,減速の回転刺激を行う課題を課題1,方向を逆にし,左,右の順に回転刺激を行う課題を課題2とした(図1)。被験者は,pseudo-randomに課題1,2を各2回ずつ行った。従って,被験者には,全課題を通じて,3°/sec2で20秒間の右回転加速度刺激(right acceleration: RA),右回転減速度刺激(right deceleration: RD),左回転加速度刺激(left acceleration: LA),左回転減速度刺激(left deceleration: LD)がそれぞれ4回ずつ提示された。
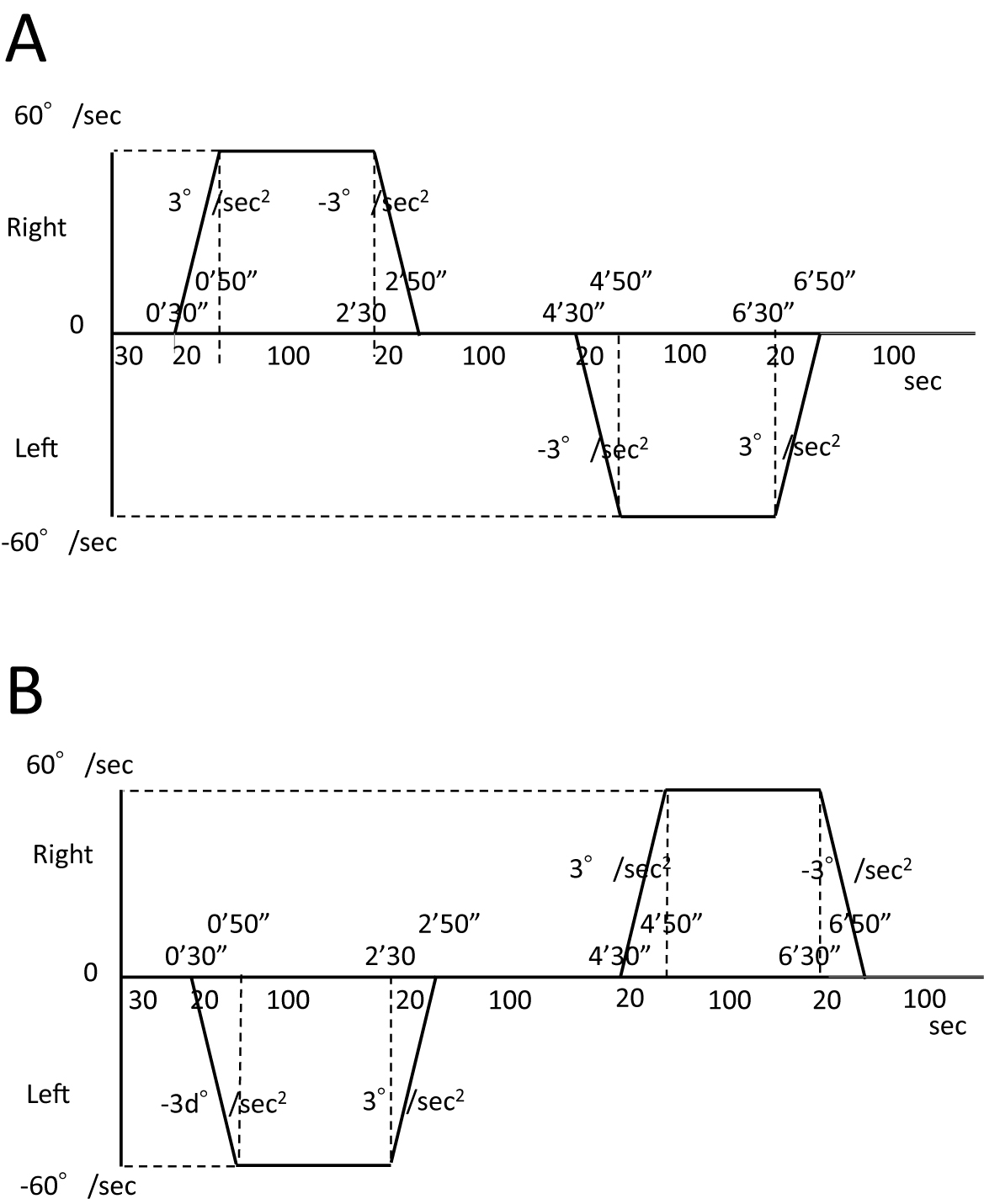
A:課題1の模式図。3°/sec2で20秒間右方向に回転(加速度刺激)したのち,60°/secで100秒間等角速度刺激を行った。その後20秒間,−3°/sec2で減速停止(減速度刺激)した。100秒間の静止ののち,左方向に3°/sec2で20秒間回転加速したのち,60°/secで100秒間等角速度刺激を施行,その後20秒間,−3°/sec2で減速停止し,100秒間静止した。
B:課題2の模式図。課題1と回転方向の順を逆にして,左,右の順に回転刺激を行った。
被験者は,左右方向に回転速度・加速度を電動で制御できる回転いす(OKN/VOR刺激装置,第一医科製)に座り,椅子の回転による転倒を防ぐために,体幹を椅子にしっかりと固定した。椅子の回転軸は,座った際に被験者の中心軸に一致するように設計されていた。その後,NIRS記録用のヘッドキャップ(FLASH-PLUS;島津製作所)を被験者の頭部に装着した(図2A)。ヘッドキャップの頂点位置は10–20脳波システムにおける頂点(Cz)に一致させ,NIRSプローブホルダー(図2B)を有するヘッドキャップ上に8個の送光プローブと7個の受光プローブをそれぞれ交互に配置した。プローブホルダーは,各プローブ間隔を3 cmとする3 × 3の正方形配置とし,TPJをターゲットとして両側側頭頭頂部に設置した。正方形配置の最も上部にあるプローブを結ぶ水平線は,ナジオン,Czおよびイニオンを結ぶ頭部の矢状正中線から9 cm外側に設定され,一方,正方形ホルダーの中心を垂直に通る線は,左右の外耳孔前位置(耳珠)(それぞれARおよびAL)と各半球のCzを結ぶ頭部の冠状正中線に一致するように設定された(図2B)。さらに各半球に1個ずつ,計2個の受光用プローブを送光用プローブから1.5 cm間隔で設置した。3 cm間隔の送光・受光プローブ間の中点を「NIRSチャンネル」とし,1.5 cm間隔の送光・受光プローブの中点は,「皮膚血流チャンネル」とした。これにより,NIRS信号は合計16チャンネル,皮膚血流信号は合計2チャンネル(左右それぞれ8つのNIRSチャンネル,1つの皮膚血流チャンネル)より計測された(図2B)。椅子には眼振計測用の電極ボックスが設置されており,被験者の左右外眼角の外側に関電極を2か所,額に接地電極を1か所設置し,回転刺激中の眼振を記録した。回転いすの背もたれの背面に,ポータブル光脳機能イメージング装置(LIGHTNIRS®︎,島津製作所製)を1台設置・固定した。LIGHTNIRS®︎は8つの光源プローブと8つの受光プローブを1つのシステムに搭載しており,パルス幅5 msecの3つの異なる波長(780, 805, 830 nm)の近赤外線光を送光器から照射し,受光器で検出した。Hb濃度の変化(酸素化ヘモグロビン:Oxy-Hb,還元ヘモグロビン:Deoxy-Hb,総ヘモグロビン:Total-Hb[Oxy-Hb + Deoxy-Hb])を測定するために,受光器から得られた信号を修正ランベルト-ビール則に基づいて処理した8)。実験課題中に本装置で計測したNIRS信号は無線で送信され,WiFiルータで受信することで離れたコンピュータ内にリアルタイムで記録した。実験課題がすべて終了後に,被験者のナジオン,Cz,左右耳珠,各送光・受光プローブの頭皮上の3次元座標を,3次元ディジタイザー(Nirtrack®︎,島津製作所製)で計測した。NIRSチャンネルの解剖学的位置を決定するために,NIRS信号の統計解析のためのSPM5または8およびMATLABベースのソフトウェアパッケージであるNIRS-SPM(statistical parametric mapping)の「Spatial registration of NIRS channel locations」機能を使用した9)。“Stand alone”オプション(MRI画像を使用しない)を使用し,Montreal Neurological Institute(MNI)脳テンプレート10)を用いた標準脳11)の表面上にNIRSチャンネルの三次元座標を推定した。全被験者のNIRSチャンネルの推定位置をまとめて,NIRS-SPMに組み込まれている3次元デジタル脳アトラス12)の標準脳上に示し,計測した領域がTPJをほぼカバーしていることを確認した(図3)。

A:実験システムの写真。被験者は回転椅子に座り,頭部にNIRS計測用キャップをかぶっている。椅子の背もたれの背足部に携帯型NIRS測定装置(LIGHTNIRS®︎)を固定し,被験者の頭部には送光用プローブと受光用プローブを各8個設置した。
B:計測用プローブ設置部位の模式図。送光用プローブ(黒四角)と受光用プローブ(白四角)は左右側頭から頭頂部領域に3 × 3の格子状配列で交互に設置した。格子状配列の上辺が頭部正中線から9 cm外側に,中心が脳波電極設置の10–20法のCz(白丸)と左右耳珠を結ぶ線上に来るように設置した。各8個ずつの送光及び受光プローブのうち,8個の送光プローブと7個の受光プローブをそれぞれ交互に3 cm離して配置し,その中間点をNIRSチャンネル(灰色四角)として合計16チャンネル設定した。さらに左右各1つの受光用プローブ(R4とR8)をそれぞれ1つの送光プローブ(それぞれT7とT8)から1.5 cm離して設置し,その中点は皮膚血流チャンネル(斜線四角)として合計2チャンネル(左右半球に1カ所)設定した。

標準脳上に表示した全被験者のNIRSチャンネルの位置(黒点)を示す。ほぼ両側側頭頭頂接合部(TPJ)領域(黒丸)をカバーしているのがわかる。白点線:シルビウス裂。
上述のように,Pseudo-randomに4回繰り返された課題施行中にNIRS信号を計測した。神経賦活化に対する典型的な血流動態反応は,Oxy-Hbの増加13)とDeoxy-Hbの減少14)からなり,Oxy-Hb信号の振幅はDeoxy-Hb信号の振幅よりも大きい15)ので,Oxy-Hb濃度の増加とDeoxy-Hb濃度の減少を大脳神経活動の増加として解析した。まず,被験者毎に,計測された計4回のNIRS信号データを施行順に連結し,1つのデータファイルを作成した。このファイルには,RA,RD,LA,LDの加速度・減速度刺激に対するNIRS信号を各4施行分ずつ含まれた。また,このNIRS信号データは局所の大脳血流応答に加えて頭皮血流データが含まれている可能性があるため,主成分分析空間フィルタリング16)を用いて,計測領域全体に重畳する頭皮血流成分を除去した。さらに呼吸,心拍変動などの影響を除外するために,0.01–0.1 Hzのバンドパスフィルターにて処理した16)。次に,大脳血流動態の時間的変化を分析するために,Oxy-Hb,Deoxy-Hb,Total-Hb濃度の各NIRSデータをそれぞれ合計し,各4条件における加速・減速刺激開始前の20秒間をベースラインとして加算平均した。また,NIRS-SPM9)を用いて,一般線形モデル(General linear model: GLM)に基づくNIRSデータの個人解析ならびに集団解析を行った。まず,被験者毎に前述のフィルタリング処理(上記参照)を行った後,左右×加速・減速の4条件(すなわち,RA,RD,LA,LD)について,NIRS-SPMを用いて,NIRS信号データを分析した(個人解析)。GLM分析では,回転加速あるいは減速刺激期間の20秒間を課題期間とし,静止(回転椅子が停止している状態)もしくは等角速度運動(60°/secで回転椅子が動いている状態)している期間をベースライン期間と定義した。次に,個人解析にて得られた被験者毎の標準脳上のT値の統計マップをもとに,NIRS-SPMを用いて各条件における集団統計解析を行った。その結果得られた集団解析によるT値の統計マップを,各条件におけるMNI標準脳に重ね合わせた。集団解析における統計的有意水準は,false discovery rate(FDR)17)で補正したp < 0.05とした。
代表的被験者における各刺激条件でのOxy-Hb,Deoxy-Hb,Total-Hbの各加算平均波形を示す(図4A–D)。計測範囲内のNIRSチャンネルにおいて,20秒の加速・減速回転刺激期間内に,Oxy-Hbが大きく増加しDeoxy-Hbが減少,Total-Hbが増加する典型的な大脳活動に伴う血流変化が観察された。NIRS_SPMによる上記代表被検者の個人解析の結果では,賦活化された脳領域や賦活化の強さに関しては4条件間でやや異なるものの,TPJ領域の賦活化が観察された(p < 0.05, uncorrected)(図5)。
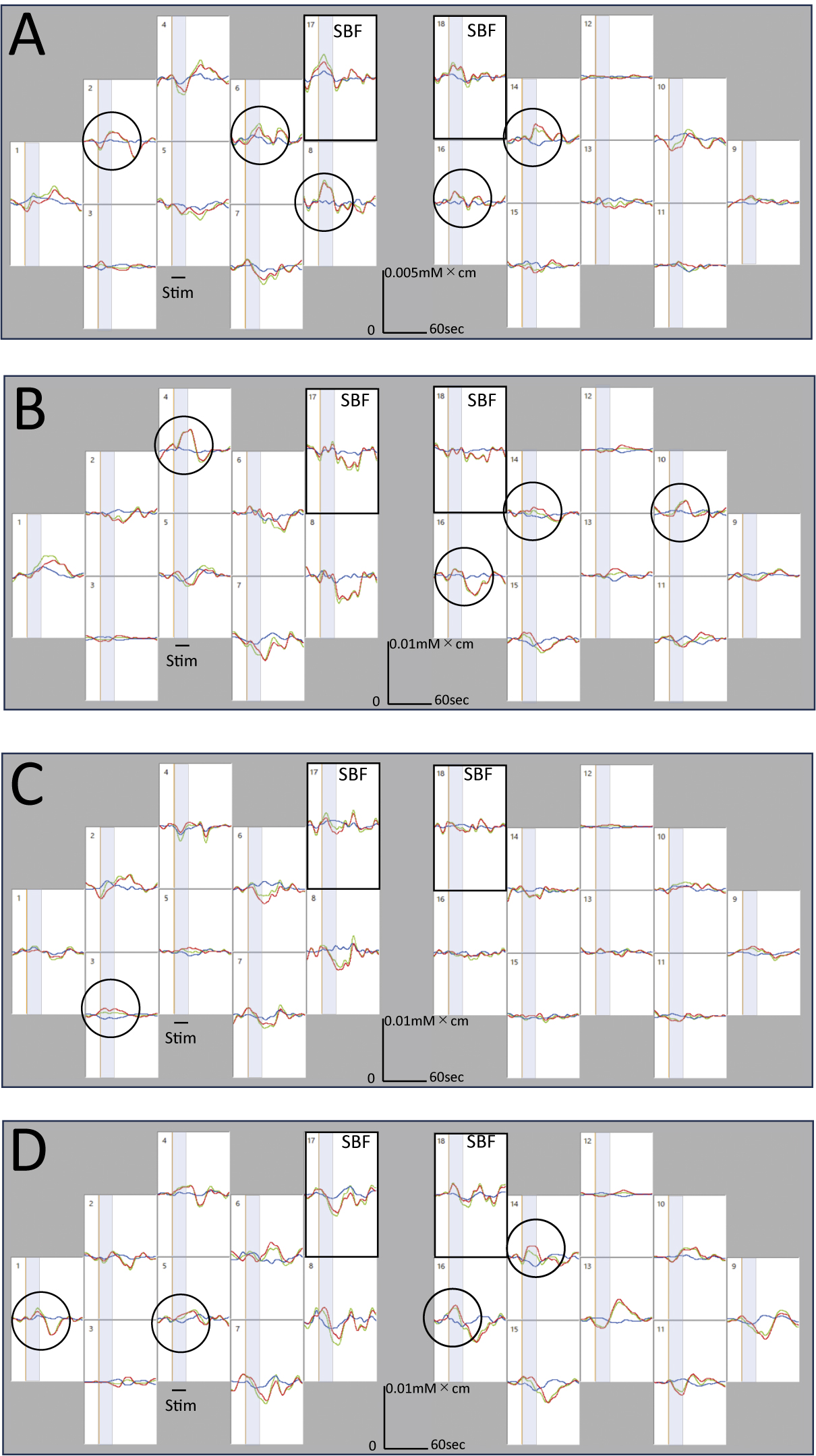
代表的被験者における,回転加速刺激あるいは減速刺激開始時点を基準として,各4回刺激時のデータを加算平均した各計測チャンネルにおける大脳血流の変化。A:右方向加速刺激,B:右方向減速刺激,C:左方向加速刺激,D:左方向減速刺激の大脳血流濃度変化を示している。赤線:酸素化ヘモグロビン,青線:還元ヘモグロビン,緑線:総ヘモグロビンの濃度変化を表している。各条件毎に,加速・減速刺激期間20秒間(灰色帯,stim)において,酸素化ヘモグロビン濃度の大きな増加と還元ヘモグロビン濃度の減少,そして総ヘモグロビン濃度(酸素化ヘモグロビンと還元ヘモグロビン濃度の和)の増加を示す,大脳皮質活動の亢進パターンが観察された(黒丸)。
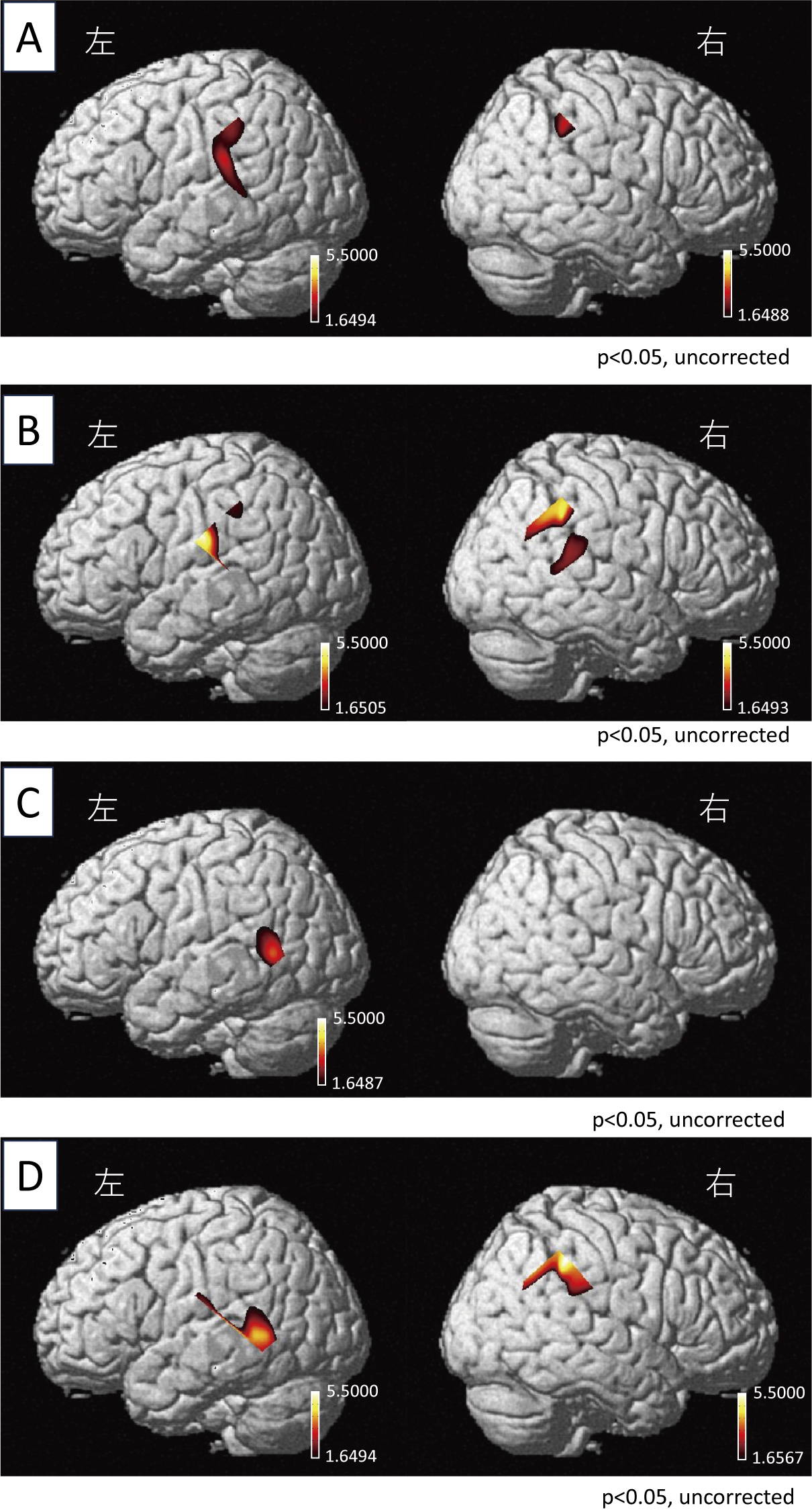
NIRS-SPM(個人解析)を用いた,代表的被験者における大脳皮質賦活部位を示す。
A:右方向加速刺激条件,B:右方向減速刺激条件,C:左方向加速刺激条件,D:左方向減速刺激条件での結果を表す。一側あるいは両側の側頭頭頂接合部の有意な賦活化が見られた(p < 0.05, uncorrected)。
正常被験者18人の個人解析による大脳皮質の賦活化の程度やパターンには,個人差によるばらつきが認められたため,NIRS-SPMを用いた集団解析を行い,被験者内で共通して賦活化した大脳領域を統計的に推定した。その結果,RA刺激では両側,RD刺激では左,LA刺激では左,LD刺激では両側のTPJ内でそれぞれ有意な賦活化が観察された(図6)。賦活化領域と回転刺激で生じる眼振の方向との関係をみると,眼振方向と賦活化されたTPJの半球側との関係が一致しており,右向き眼振が出現するRA刺激とLD刺激時には右側のTPJ領域内で,左向き眼振が出現するRD刺激とLA刺激では左のTPJ領域内で有意な賦活化が観察された。さらにRA及びLD刺激時には左側のTPJ領域内の有意な賦活化も観察された。
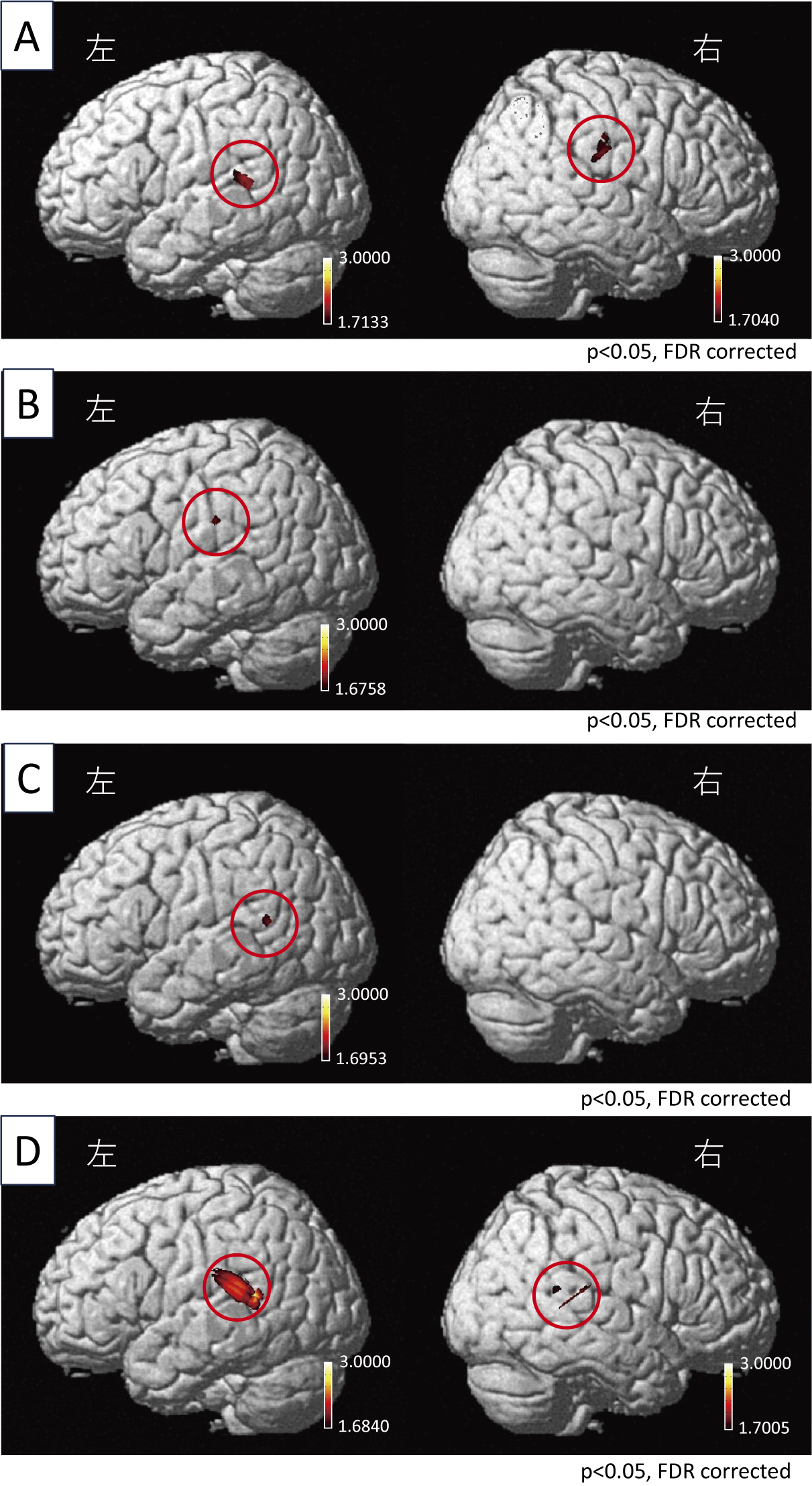
NIRS-SPM(集団解析)を用いた,正常被験者18名での有意な大脳皮質賦活部位を示す。A:右方向加速刺激条件,B:右方向減速刺激条件,C:左方向加速刺激条件,D:左方向減速刺激条件での結果を表す。AとDの刺激条件では両側の,BとCの刺激条件では左の側頭頭頂接合部領域内で有意な賦活化が見られた(p < 0.05, FDR corrected)。
今回の研究結果から,回転椅子を用いた頭部回転加速・減速刺激によって,ヒトのTPJ領域が有意に賦活化することが明らかとなった。
生理的な頭部の回転加速度刺激に対するヒトの大脳皮質応答を記録解析した研究は,少ないがいくつか報告されており,我々の結果と同様にTPJ付近の大脳皮質の賦活化が示されている。ヒトの脳波(EEG)を計測した研究では,種々の前庭刺激によって,刺激開始後70~850 msecで,5–7つの陰陽性波形で構成される誘発電位Vestibular evoked potentials(VestEP)が観察される18)。過去の研究では,回転を急停止する刺激後220 msecにピークを持つ陽性電位が確認され,このVestEPは,健常者では観察されるが,両側迷路破壊術後患者や中大脳動脈領域の脳梗塞患者で潜時延長,反応低下や消失が見られたことから,側頭頭頂皮質が関与していると報告している19)。また比較的新しい研究では,健康なヒト被験者と両側前庭機能喪失患者群において,一過性および等速度の受動的回転刺激中の高密度EEG(192ch)を記録解析したところ,一過性前庭刺激と等速性前庭刺激の両方がアルファ帯(8–13 Hz)域のパワーの顕著な抑制と関連しており,アルファ帯域の抑制は両側の側頭頭頂領域に局在していたと報告している20)。ただし,EEGによる研究の問題点として,頭皮上の電位マップが必ずしも直接大脳皮質の活動部位を反映しているとは言えないこと,前庭刺激により生じる眼振や筋電位などの電気的アーチファクトの影響を受けることが挙げられる。18F-FDG PETを用いた最近の研究では,受動的な全身回転運動と並進運動の後にオフラインでPETスキャンを行う方法が用いられた21)。この研究では,回転刺激課題として右方向のみに51°/sec2で加速,60°/secで当角速度,40°/sec2で減速して360°回転した後,8秒停止する運動を35分間繰り返し行ってからPETスキャンを行い,その結果,両側の後部島皮質と一次聴覚野とされるHeschl回でFDGの取り込みの増加が認められている。ただ,本研究では,右方向への加速と減速刺激の両方を含んだ課題であるため,左右の外側半規管の刺激に対する大脳皮質応答を分離できていない。また時間分解能が低いため,前庭情報処理における経時的な大脳皮質血流の変化も評価できない点で課題があると考える。fMRIを用いた研究では,被験者が視覚的に提示された標的に対して能動的に頭部回旋運動を行った際の大脳活動を測定した研究がある22)。左右14°の範囲での指標の動きに合わせて,頭部を被験者自らが動かした条件において,PIVCに相当する側頭平面後方とTPJの賦活化を認めたという22)。ただ,サルの研究から,能動的頭部運動と受動的運動では,小脳,脳幹,大脳皮質レベルでの活動性が異なることが知られており23)~26),両者の研究データを直接比較することは限界がある。NIRSを用いた我々の研究は,サルなどの動物実験で用いられた回転椅子による受動的回転刺激をヒトに適用していること,回転刺激により生じる眼振などの電気的なアーチファクトの影響を受けないこと,大脳皮質の血流濃度変化を計測しており,従来のfMRIによるヒトの前庭皮質に関する研究データと比較しやすい点,回転刺激中の大脳活動をオンラインで計測している点,計時的な脳活動の変化も観察可能である点で特徴があり,NIRSは生理的前庭刺激(回転加速度刺激と直線加速度刺激)に対するヒトの前庭皮質活動を解明する上で有用な計測手法であると考える。
本研究の結果,右利き正常被験者群において,RA及びLD刺激では両側のTPJ領域で,LA及びRD刺激では左のTPJ領域内の有意な大脳皮質血流の増加が観察された。RA及びLD刺激は右外側半規管の興奮性刺激と左外側半規管の抑制性刺激であり,右向きの眼振が出現する一方,LA及びRD刺激では左外側半規管が興奮性刺激,左外側半規管は抑制性刺激となり,左向きの眼振が出現する。このことから,回転による眼振方向の違いによって,TPJにおける賦活化のパターンが異なる可能性があると考えられた。
末梢前庭から大脳皮質への投射に関しては,サルなどの動物実験では対側優位の両側性投射であることが報告されている6)が,ヒトでは動物と異なり,前庭投射の両側性パターンに加えて,刺激耳側と被験者の利き手側の両方に依存する大脳半球優位性が示されている6)。生理的な回転刺激ではないが,カロリック刺激を用いたPETによる脳機能画像研究において,Naitoら27)は,TPJ及びその周辺領域の賦活化が眼振方向に依存し,右向き眼振時に右半球が,左向き眼振では左半球が強く賦活化したことを報告した。また,Dieterichら28)は,44°Cのカロリック温刺激において,大脳皮質活動における利き手と刺激耳側との関係について検討し,PIVCを含むTPJ周辺領域の活動が両側性に賦活化するが,非優位半球側(すなわち右利き被験者では右半球,左利き被験者では左半球),カロリック温刺激側で優位に大きいことを報告した。このことは,Naitoら27)の報告と同様に,眼振の方向側優位にTPJ周辺の賦活化がみられることを示すとともに,ヒト前庭皮質の賦活化が利き手と関係していることも示している。我々の研究結果でも,右向き眼振出現時(RA,LD刺激)には右TPJで,左向き眼振出現時(LA,RD刺激)には左TPJでの賦活化が確認されており,これらの報告と一致している。さらに,Dieterichら28)は,利き手と同側を刺激した場合の方が,反対側を刺激した場合に比べて前庭覚関連大脳皮質の活動が強いことも示している。以上より,今回我々の研究で見られた,眼振方向におけるTPJにおける賦活化のパターンの違いは,右利き患者群に対する外側半規管刺激側の違いに基づいた大脳皮質の活動性の違いを反映しているのではないかと考えた。
これまでの非生理的前庭刺激(カロリック刺激やガルバニック刺激)を用いたfMRIやPETでの脳機能画像研究では,両側TPJの賦活化が認められたが6),今回の生理的回転刺激を用いた我々の研究では,RA,LD刺激条件では両側TPJの賦活化が見られたものの,RD,LA刺激条件では左側TPJのみの賦活化であり,右側TPJの賦活化は示さなかった。サルのPIVCやヒトTPJは,前庭入力のみならず,体性感覚と視覚入力も受け,複数の感覚情報を統合し,空間認知や身体知覚などに関与していることが知られている6)。我々の先行研究では,イクイテスト®︎を用いて立位時における視覚・体性感覚入力の減弱による不一致(ミスマッチ)を生じた際の大脳血流応答を計測した結果,前庭入力に対する体性感覚や視覚入力のミスマッチが大きいほど,TPJ領域の賦活化がより強い傾向を示していた29)。最近のレビューでは,ヒトのTPJは,記憶,注意,言語,自己所有感,心の理論など幅広い認知機能に関与し,予期される感覚,運動,認知事象と実際の事象との一致(マッチ)と不一致(ミスマッチ)の両方をコード化する働きがあり,ミスマッチのコード化には両側TPJが,マッチのコード化には左側TPJが関与する,との仮説が提唱されている30)。カロリック刺激やガルバニック刺激などの非生理的前庭刺激はミスマッチ刺激,今回の生理的回転刺激はマッチ刺激と言えることから,今回の生理的回転刺激時のTPJの活動性は,従来の非生理的刺激によるヒトの研究結果に比べて,特に右半球で相対的に弱くなる可能性が考えられる。このことに加えて,左向き眼振方向(RD, LA)刺激では,利き手と反対側の刺激となることも影響し,NIRSでは右側TPJの賦活化が検出できず,左側TPJのみの賦活化が観察されたのではないかと考えた。
本研究の限界として,本研究では右利き被験者しか検討していない。そのため,上述の仮説を実証するには,今後左利き被験者を対象として同様の実験を行うなど,さらなる研究が必要と考える。
生理的な前庭刺激である頭部回転刺激に対するヒトの大脳皮質活動を明らかにするために,正常被験者に対して回転椅子による回転加速度・減速度刺激を与えた際の両側TPJ周辺領域の大脳皮質活動を,携帯型NIRS計測装置を用いて計測・解析した。右外側半規管刺激時には両側のTPJ領域で,左外側半規管刺激時には左のTPJ領域で有意な賦活化が確認され,大脳皮質レベルでの回転感覚の認知過程を反映していると考えられた。また,各刺激におけるTPJ領域の活動性のパターンの違いから,水平回転刺激に対するTPJの活動性は,外側半規管の刺激側および利き手による前庭関連大脳皮質の活動性の違いに依存している可能性が考えられた。
本研究に関連して,著者全員に開示すべき利益相反はない。