2021 Volume 16 Issue 3 Pages 231-239
2021 Volume 16 Issue 3 Pages 231-239
メサドンは血中濃度の定常状態に日数を要し7日間増量できず,血中濃度や薬効の個人差も大きく早期効果判定が難しい.日本人がん患者の血中濃度等に関する報告はほとんどないため,血中濃度と疼痛スコア(NRS)の変動,血中濃度の変動因子等を検討した.血中濃度と相関があったのは体重換算投与量のみであった.有効例ではNRSは投与開始後7日目まで経時的に低下し,1日目から有意差が認められたが,無効例では3日目まで低下傾向にあったがそれ以降変化がなかった.血中濃度は有効例では7日目に110 ng/mlまで上昇し,無効例ではすでに3日目にその濃度に達し,血中濃度と薬効に相関はなかった.各個人の血中濃度は3日目以降緩やかな上昇あるいは低下傾向にあったが,1例のみ上昇し続けた.以上より,早期に効果判定できる可能性が示されたが,血中濃度が7日目まで上昇し続けた例もあったことから,早期の増量は慎重に行うべきと考えられた.
オピオイド鎮痛薬であるメサドンは,1937年ドイツで合成されたジフェニルヘプタン誘導体であり,世界保健機関(WHO)のがん疼痛治療ガイドラインで強オピオイド鎮痛薬に位置し,有用性の高い製剤として古くから世界各国で使用されている薬剤である1).本邦においては,2013年3月に発売され,他の強オピオイド鎮痛薬で治療困難ながん性疼痛に使用されている.その薬理作用としてはμ受容体に対する高い親和性とNMDA受容体拮抗作用を併せ持つことから,神経障害性疼痛にも有用であるとの報告2〜5)があり,本邦におけるがん疼痛治療薬として期待されている.しかし,当該薬には,(1)血中濃度が定常状態に達するまでに時間を要し効果発現に時間がかかること,(2)薬物動態や薬物間相互作用による個人差が大きく用量調整が難しいこと,(3)呼吸抑制やQT延長などの重篤な副作用が発現するといった問題点があり6〜12),本邦の添付文書では,開始後7日間同用量で継続することとなっている.
しかしながら,メサドンを要する難治性がん性疼痛患者の多くは予後が限られているため,臨床現場では少しでも早期での効果判定が求められているが13),本邦においてメサドンの早期効果判定についての明確な基準は定められていない.また一方で,メサドンの効果判定を行っていくうえで,メサドンの血中濃度の推移を把握することは有用である可能性が考えられるが,メサドンの血中濃度測定を実施した文献14,15)は,海外の麻薬中毒者に関する報告がほとんどであり,日本人のがん性疼痛患者に対する報告は少ない16).
そこで,今回,日本人のがん性疼痛患者に対して,メサドンを使用した患者において,投与開始後7日間とその後の効果判定時の血中濃度測定および疼痛スコアのモニタリングを実施し,血中濃度と効果および副作用の関係性,血中濃度の変動因子,さらには血中濃度の推移とNRSの変動からメサドンの早期効果判定の可能性について検討を行った.
本研究は2016年12月1日から2018年9月30日までに兵庫医科大学病院ペインクリニック部より,メサドン(メサペイン®錠)が処方開始となったがん性疼痛を有する入院患者のうち研究に対する同意が得られた患者を対象とし,電子カルテより患者の性別,年齢,体重,原発巣,痛みの種類,痛みの病態,メサドンの投与量(開始量,効果判定時投与量),併用薬,numerical rating scale(NRS),レスキュー回数,臨床検査値(アスパラギン酸アミノトランスフェラーゼ(AST),アラニンアミノトランスフェラーゼ(ALT),総ビリルビン(T-Bil),血清クレアチニン(Scr),血中ナトリウム,カリウム,マグネシウム,カルシウム),QTc間隔,副作用症状を後方視的に調査した.メサドンの開始量は,先行オピオイドをレスキューも含め経口モルヒネ量に換算し,メサペイン®錠の添付文書に記載されている換算表に基づいて決定したが,症例に応じて処方医の判断で適宜増減が行われた.メサドンの有効性評価はメサドン国内第II相試験(TK-642-0201)時の至適用量到達の判定基準の評価項目を参考17)として,メサドンを同一用量で6日間以上投与した翌日に,(1)判定日前日のレスキュー使用回数が1日2回以下であって,かつNRSが切り替え前の値以下である,(2)忍容できない副作用および過量投与の兆候がない,(3)安全性・有効性の観点から,投与量に問題ありと考えられる要因がない,のすべてを満たす場合を至適用量到達かつ有効と判定した.また,体重換算投与量は,各患者のメサドン投与量を体重で除すことで算出した.
メサドンの血中濃度測定を実施するための血液サンプルは,投与前,投与開始後1, 3, 5, 7日目および以降の効果判定日に採血を行った.採取した血液は,ただちに遠心し,血漿を分離後,測定時まで−80℃で保管した.メサドンの血中濃度測定は,methadone ELISA kit(品番:131619; NEOGEN Corporation, Lansing, MI, USA)を用いて3回の測定を実施し,その平均値を測定値とした.なお,測定の標準値には帝国製薬より譲受したメサドン塩酸塩(Lot: 1108001190)を用いた.
連続変数は平均値±標準偏差で表した.すべての解析は,EZR on R commander Version 1.51を用いて実施し18),p<0.05の場合を有意差ありと判定した.臨床検査値の変動,NRSの推移にはWilcoxon符号付順位和検定を,二群間の比較にはStudent’s t-検定を,メサドン血中濃度と投与量との関連性にはPearsonの積率相関係数を用い,相関係数(r)を算出した.また,血中メサドン濃度と各因子との関連性については単回帰分析を行い,さらにその因子についてステップワイズ変数減少法を用いて重回帰分析を行い,血中メサドン濃度との関連因子を特定し,回帰係数(β)を算出した.
本研究は兵庫医科大学倫理審査委員会の承認を得て,研究開始時に患者より文書による同意を取得し,個人情報の保護に十分配慮して行った(承認番号:倫ヒ0346).
同意取得患者は17例であったが,メサドン開始後1週間以内に内服困難となり中止または同量継続が困難であった2例を除外した15例を解析対象とした.対象患者の患者背景を表1に示す.性別は男性9例,女性6例,平均年齢は60±12歳で,原発巣は肺がん6例,膵がん3例,子宮がん3例,悪性胸膜中皮腫2例,大腸がん1例で,痛みの種類は体性痛および神経障害性痛の混合痛が13例,体性痛,内臓痛および神経障害性痛の混合痛が1例,内臓痛のみが1例で,平均体重は55.9±15.2 kgであった.メサドンの開始投与量は15 mg/日が10例,20 mg/日が2例,30 mg/日が3例であった.NRSスコアやレスキュー回数,副作用発現状況より,メサドン有効例は11例,効果不十分例は4例と判定し,有効率は73.3%であった.なお,症例9は,NRSスコア,レスキュー回数とも効果判定基準を満たしているが,患者の満足度が低く,メサドンの増量を行ったが,増量後に傾眠の副作用が発現し中止となったため,効果不十分と判断した.また,データには示していないが,全患者のNRSスコアの平均変化量[95%信頼区間]は,−4.0[−2.543, −5.457]であり,効果判定日の中央値は投与開始後7日(範囲:7~28日)であった.
投与期間中の副作用症状は,傾眠6例(40.0%),便秘3例(20.0%),悪心1例(6.7%),呼吸抑制1例(6.7%)であった.呼吸抑制を生じた症例(症例7)は投与開始後7日目に呼吸抑制を生じ,傾眠傾向も強く,投与開始後14日目には内服も難しくなったため,オキシコドンの持続静注へ変更となった.一方,500 msec以上のQT延長や重篤な不整脈をきたした症例はなかった.また,傾眠が発現した症例としなかった症例で効果判定時のメサドン血中濃度を比較したところ,両群間に有意な差は認められなかった(p=0.767).また,対象患者のメサドン開始前および開始1週間後において,AST, ALT, T-Bil, Scr,血中ナトリウム,カリウム,マグネシウム,カルシウムおよびQTc間隔に有意な変動は認められなかった.
メサドン投与後の血中濃度推移を図1に示す.血中濃度は15 mg/日群では経時的に血中濃度の上昇を認めたが,20 mg/日群では投与開始後3日目にほぼ定常状態に達した後7日目には3日目より低下し,30 mg/日群では投与開始後5日目にピークを迎え,7日目には低下した.投与開始後7日目の血中濃度は,15 mg/日群で110.0±58.5 ng/ml,20 mg/日群で87.2 ng/ml,30 mg/日群で203.9 ng/mlであった.また,各投与量の症例毎の血中濃度推移についても付録図1〜3に示す.各症例において,投与開始後3日目以降の上昇は緩やかな傾向にあり,むしろ低下する例もあったが,無効例の1例のみ7日目まで上昇し続けた(症例9).
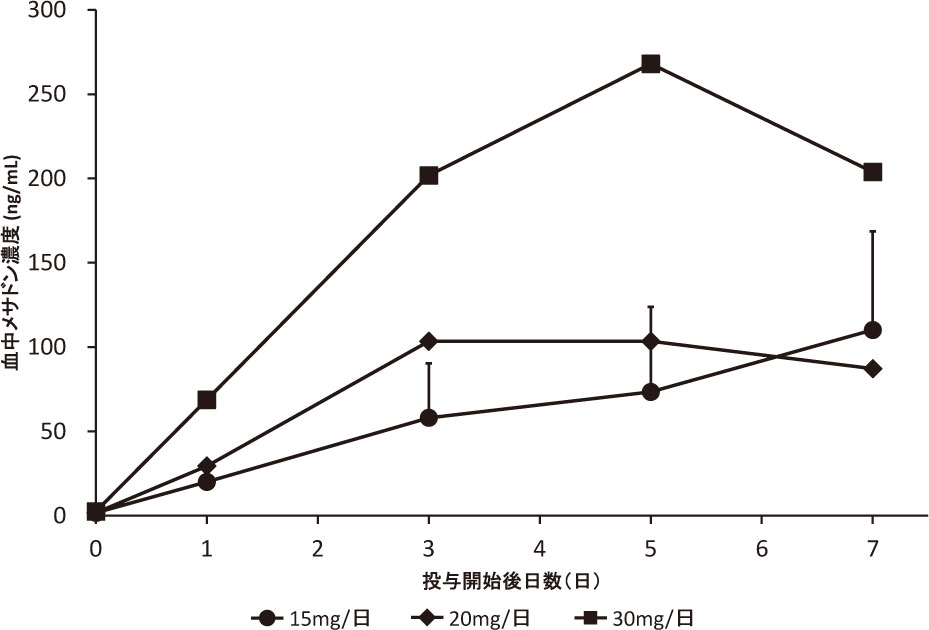
15 mg/日 : n=10 (平均±標準偏差),20 mg/日: n=2,30 mg/日: n=3,(平均)
次にメサドン有効例および効果不十分例の2群に分けた場合の血中濃度およびNRSの推移について図2に示す.メサドン有効例では血中濃度は投与開始後7日目までに経時的に119.2±85.8 ng/mlにまで増加するとともにNRSは経時的に投与開始後1日目から有意な減少が認められたのに対し,メサドン効果不十分例では,血中濃度が116.5±30.5 ng/mlに上昇する投与開始後3日目まではNRSは減少する傾向にあったが,投与開始後3日目以降はさらに血中濃度が上昇するにもかかわらずNRS変化量の低下を認めなかった.投与開始後7日目でのNRS変化量は有効例で−4.7,効果不十分例で−1.5であった.また,効果判定時の血中濃度は,有効例では154.6±171.5 ng/ml,効果不十分例では256.2±178.0 ng/mlであった.

有効例: n=11,効果不十分例: n=4.平均±標準偏差,*p<0.05 **p<0.01 vs 0日目.
$p<0.05 vs 効果不十分例
次に,効果判定時のメサドンの血中濃度と投与量,体重換算投与量について相関係数を求めたところ,投与量はr=0.672, p=0.006,体重換算投与量はr=0.773, p<0.001であり,投与量よりも体重換算投与量との間により強い正の相関性が認められた.体重換算投与量 (x, mg/kg)と血中濃度( y, ng/ml)の関連性については図3に示すように回帰直線( y=433.8x−16.8)が得られたが,男性に比べ,女性では血中濃度のばらつきが大きく,血中濃度が高くても効果が不十分な例が多かった.図2より有効例および効果不十分例とも血中濃度約110 ng/ml付近では,効果判定が可能であったことから,その濃度を得るための体重換算投与量を図3の回帰直線より算出すると,0.29 mg/kg (16.2 mg/平均体重55.9 kg)であった.また,効果判定時の体重換算投与量は有効例で0.45 mg/kg (25.1 mg/平均体重55.9 kg),効果不十分例で0.48 mg/kg (26.8 mg/平均体重55.9 kg)であった.

最後にメサドンの血中濃度が上昇する背景因子を調べるため,メサドン血中濃度と各因子との関係性について検討を行った.併用薬の影響については,国分らの報告19)に基づいてメサドンと相互作用の可能性があり併用頻度の高かったCYP2D6を中等度阻害するデュロキセチンと胃内pH上昇によりメサドンの吸収上昇の可能性があるプロトンポンプ阻害薬の影響について検討した.なお,その他のCYP3A4あるいは2D6の阻害薬や誘導薬あるいはP糖タンパク阻害薬の併用はなかった.単回帰分析を行ったところ,男性(β: −201.23, p=0.021),効果判定時投与量(β: 12.59, p=0.006),体重換算投与量(β: 433.60, p<0.001)がメサドン血中濃度と関連する因子であり,年齢,体重,併用薬および効果とは有意な関連が認められなかった(表2).次に重回帰分析の結果,体重換算投与量(β: 433.60, p<0.001)のみが独立してメサドン血中濃度に関連する因子であった.
メサドンの血中濃度測定に関して,日本人がん患者を対象とした報告はほとんどない.そこで今回われわれはメサドン投与後の血中濃度の経時的な測定および疼痛スコアのモニタリングを実施し,血中濃度と効果および副作用の関係性,血中濃度の変動因子,さらにはメサドンの早期効果判定の可能性について検討を実施した.
本検討でのメサドンの有効率は73.3%であり,この有効率はWeschulesらの46〜89%20),本邦の第II相臨床試験での85.0%17),木村らの報告21)の84.1%に比べると同等もしくはやや低かった.その理由として,持続痛のコントロールは良好であったが,突出痛があった患者2例についてレスキュー使用回数が多く,至適用量到達の判定基準を満たさなかったことが挙げられた.また,至適用量到達中央値は,先述の報告17,21)で,それぞれ8日(範囲:7~20日),12日(範囲:7~55日)であり,本研究の効果判定中央値もほぼ同様であった.
次に,安全性については投与開始後7日目に呼吸抑制が1例認められた.呼吸抑制は国内においてTakemuraらにも報告22)されている.今回の原因としては,当該患者は高齢の肺がん患者であり,Modesto-Loweら9)が挙げるメサドンの呼吸抑制のリスク因子である高齢,肺疾患を有していたこと,呼吸抑制が生じた前日にベンゾジアゼピン系薬剤を使用していたことが考えられた.オーストラリアでメサドン関連死の74%でベンゾジアゼピン系薬剤が併用されていたとの報告23)があり,とくにベンゾジアゼピン系薬剤の併用の際には,呼吸抑制などの重篤な副作用に注意が必要であると思われる.
メサドン投与後の投与量ごとの血中濃度の推移は,15 mg/日群では,経時的に血中濃度の上昇を認め,投与開始後7日目の平均血中濃度は,110.1±58.5 ng/mlであった.日本人健康成人5例を対象とした臨床試験において,15 mg/日の7日間の反復投与でのCmaxは,94.6 ng/mlと報告24)があり,本研究の結果もほぼ大差のない数値であった.一方,20 mg/日群では投与開始後3日目にはほぼ定常状態に達し,103.4 ng/mlとなり,7日目には低下した.30 mg/日群では投与開始後5日目にピークを迎え,268.0 ng/mlとなり,こちらも7日目には低下した.すべての投与群各個人の血中濃度の推移より,投与開始後3日目にほぼ定常状態近くに達する傾向にあったが,無効例の1例のみ7日目まで上昇し続けた(付録図1〜3参照).メサドンはCYP3A4およびCYP2B6の自己誘導能を有しており25),メサドン投与開始後5日程度まで血中メサドン濃度は上昇するが,その後,自身の酵素誘導能により徐々に低下し定常状態に達するという報告26)があり,20 mg/日群および30 mg/日群では,メサドン自身の酵素誘導能による影響を受けた可能性が考えられたが,症例数がそれぞれ2例,3例と少ないことから,今後のさらなる検討が必要と思われる.
さらにメサドン有効例と無効例における血中濃度およびNRSスコアの推移について,メサドン有効例では投与開始後1日目には血中濃度が平均28.7 ng/mlにもかかわらず,NRSスコア変化量は平均−2.1と有意に低下し,さらに7日目には血中濃度は119.2 ng/mlとなり,−4.7まで低下した(図2).一方,効果不十分例では投与開始後3日目には血中濃度が平均116.5 ng/mlとすでに110 ng/ml以上にまで上昇し,NRSスコアの変化量は平均−2.0と少ないながら低下したが,3日目以降は血中濃度がさらに上昇したにもかかわらず,NRSスコアはそれ以上低下しなかった(図2).有効例,効果不十分例の血中濃度とNRSスコア変化量より,個人差が大きい中での平均値での議論ではあるが,血中濃度約110 ng/mlが効果判定の一つの参考となる平均目標濃度ではないかと算出された.しかしながら,個別に血中濃度を測定して投与設計することは患者負担のため現実的には困難であろうと考えられる.
次に血中濃度と効果および副作用の関係についてであるが,メサドン有効例と効果不十分例に分けた血中濃度の推移より,メサドン効果不十分例の血中濃度が有効例よりむしろ高い傾向を示しており(図2),表2の単回帰分析の結果からも血中濃度と効果に相関性は認められなかった.また,副作用に関しても傾眠が発現した症例としなかった症例でのメサドン血中濃度を比較したところ,両群間に有意な差は認められず,副作用と血中濃度に相関性は認められなかった.Inturrisiらは,疼痛および副作用である鎮静の最大効果の50%推定値は,患者間で10~20倍の変動があったと報告しており27),本研究結果からも同様のことが示唆された.
メサドンの血中濃度に関連する因子については投与量そのものよりも体重換算投与量により強い血中濃度との正の相関(r=0.897, p<0.001)が認められ,単回帰分析を行ったところ,性別,効果判定時投与量および体重換算投与量(p<0.001)が挙げられ,投与量そのものには有意差が認められなかった(p=0.104).性別に関しては,男性よりも女性で個人差が大きく(図3),平均値は男性101.2±42.6 ng/ml,女性302.4±227.7 ng/mlと女性の方が高値となると予想されたが,症例数が少なく,今後さらなる検討が必要である.さらに重回帰分析では,体重換算投与量のみがメサドンの血中濃度に影響する独立した因子であった.投与量と血中濃度の関連性については,メサドン国内第II相試験(TK-642-0201)の結果より,ばらつきが大きいことが報告されていた17).一方,体重あたりの投与量と血中濃度の関連性については,海外でWolffらの報告において正の相関性が示されている28).Wolffらの報告28)では, 1 mg/kgあたり263 ng/mlの上昇であったが,日本人における本試験結果では1 mg/kgあたり433 ng/mlと上昇が高く,理由として,人種差のみならず男女比が異なっていた可能性も考えられた.上述のように,効果判定のための平均目標濃度は約110 ng/mlと推察されたが,得られた回帰直線(y=433.8x−16.8)(図3)より,その血中濃度を得るための体重換算投与量は0.29 mg/kg(16.2 mg/55.9 kg)と算出された.この用量は使用していた他のオピオイド鎮痛薬からメサドンに移行する場合の最低用量で,今回例数が最も多かった15 mg/日とほぼ一致しており,メサドンの初期投与量設定は平均的には妥当であったと確認された.さらに参考までに,有効例の効果判定時の体重換算投与量は0.45±0.34 mg/kg(25.1 mg/55.9 kg)であった.メサペイン®錠の添付文書には,メサドンの開始用量はメサドン切り替え前のオピオイド鎮痛薬の投与量に応じて,目安量が記載されているが,体重を考慮した用量設定にはなっていない.そのため,体重も考慮した用量設定を行うことで,血中濃度の個人差をより軽減できる可能性が考えられた.
最後にメサドンの早期効果判定の可能性について,メサドン血中濃度の推移とNRSスコアの変動から考察した.Takemuraら22)は,メサドン投与経験がある医師による注意深い観察下で,日本人がん患者20名を対象にメサドン投与開始後7日目までの疼痛スコアを経時的に測定したところ,投与開始後3日目には疼痛スコアが有意に低下し,17名(85%)に鎮痛効果が得られ,その後の疼痛スコアに有意な変化はみられず,また7日目までに重篤な副作用である呼吸抑制の発現も1例であったことから,メサドンの7日以内の早期効果判定の可能性について言及している.本研究においても,メサドン有効例では経時的に疼痛スコアが低下し,投与開始後1日目から有意差が認められたのに対し,効果不十分例では投与開始後3日目以降スコアの低下を認めなかったことから,7日以内に効果判定を行える可能性が考えられた.本研究ではさらに,メサドンの血中濃度の経時的な測定を実施し,血中濃度の変動からの早期効果判定の可能性について検討したところ,各個人データおよび平均値より投与開始後3日目以降の上昇は緩やかな傾向にあり,むしろ低下するケースもあったことから(図1,2,付録図1〜3),7日以内に血中濃度が安定して効果判定できる場合がある可能性が示された.しかし,15例のうち1例で上昇し続けた無効例があったことから,やはり早期の増量は少量ずつ慎重に行うべきと考えられた.
本研究の限界としては,少数例での検討であり,本研究結果をさらに検証していくためには,今後症例数を蓄積しさらなる検討を実施していく必要性があると考えられる.
本研究において,これまであまり報告されていなかった日本人がん患者における血中濃度と効果および副作用の関係性,血中濃度の変動因子さらにはメサドンの早期効果判定の可能性に関する臨床研究データを得た.メサドンの早期効果判定について,メサドン有効例では経時的に疼痛スコアが低下したのに対し,効果不十分例では投与開始後3日目以降疼痛スコアの低下を認めず,血中濃度の推移は3日目以降の上昇は緩やかな傾向にあり,むしろ低下する例もあったことから,投与開始後7日目より早期に効果判定できる可能性が示されたが,無効例の1例のみ上昇し続けたため,早期の増量は少量ずつ慎重に行うべきと考えられた.
すべての著者の申告すべき利益相反なし
中村は研究の構想,デザイン,研究データの収集,分析,研究データの解釈,原稿の起草および原稿の重要な知的内容に関わる批判的な推敲に貢献;棚田は研究の構想,デザイン,研究データの収集,分析および原稿の起草に貢献;岡村,乾,土井,宮脇は研究データの収集,分析,原稿の起草に貢献;廣瀬,木村,清水,田中,馬渕は,研究の構想,デザイン,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献した.すべての著者は投稿論文ならびに出版原稿の最終承認,および研究の説明責任に同意した.