2024 Volume 19 Issue 1 Pages 53-57
2024 Volume 19 Issue 1 Pages 53-57
【緒言】がん終末期において,低血糖による意識障害を来した症例を報告する.【症例】73歳男性.2016年,開頭腫瘍摘出術を施行され,孤立性線維性腫瘍と診断.2022年,脳腫瘍再発し当院ホスピスに入院.転院120日目,突然意識障害が出現.低血糖を認め,ブドウ糖静注により意識障害は改善した.諸検査の結果,膵外腫瘍による低血糖症(non-islet cell tumor hypoglycemia: NICTH)が強く疑われた.【考察】NICTHはインスリン様物質(大分子量insulin-like growth factor (IGF-)II)が腫瘍から過剰分泌されることが原因と考えられている.低血糖は徐々に進行することから,前駆症状なく意識障害が出現することがある.意識混濁,せん妄などがあり,巨大腫瘍を有する症例では,NICTHによる意識障害も鑑別診断に入れる必要がある.
Introduction: We report a case of sudden loss of consciousness due to hypoglycemia in the terminal stage of cancer. Case: A 73-year-old man underwent craniotomy in 2016 and was diagnosed with solitary fibrous tumor. In 2022, his brain tumor recurred and he was admitted to our hospice. On the morning of the 120th day after transfer, the patient suddenly developed impaired consciousness. Blood tests showed hypoglycemia (33 mg/dL), and intravenous glucose injection improved his loss of consciousness, leading to a diagnosis of impaired consciousness due to hypoglycemia. After various examinations, hypoglycemia due to extrapancreatic tumor (non-islet cell tumor hypoglycemia: NICTH) was strongly suspected. Discussion: NICTH is considered to be caused by excessive secretion of an insulin-like substance (high molecular weight insulin-like growth factor (IGF-)II) from the tumor. In patients who are exposed to hypoglycemia for a long period of time, central nervous system symptoms such as impaired consciousness may suddenly develop without sympathetic symptoms. NICTH should be considered as a differential diagnosis in patients with delirium, impaired consciousness, or convulsive seizures and a large tumor, although it is not easy to prove the excessive secretion of high-molecular-weight IGF-II, especially in the terminal stage of cancer.
がん終末期において,せん妄,意識混濁などの意識障害にしばしば遭遇する.突然発症した意識障害の原因精査が必要となることも少なくなく,低侵襲な治療により意識障害が回復することもある.今回われわれは,突然の意識障害で発症した低血糖症を経験したので報告する.
【症例】73歳,男性
【現病歴】2016年,頭痛,失語症の原因精査目的の画像検査で左前頭葉に6 cm大の髄外腫瘍を認め,開頭腫瘍摘出術施行.病理組織検査の結果,孤立性線維性腫瘍と診断.またけいれん発作に対して抗てんかん薬内服開始.2019年,肝転移に対して肝動脈化学塞栓療法施行.2020年,骨転移(左寛骨)に対して緩和的放射線照射施行.2021年,脳腫瘍で再発したが侵襲的治療は行わない方針となった.2022年9月,再発脳腫瘍による両側麻痺出現,失語症増悪し,自宅療養の継続は難しいと判断され,10月,当院ホスピスに入院.
【既往歴】【家族歴】特記すべきことなし.
【入院時現症】身長163 cm,体重60 kg,血圧144/76 mmHg,脈拍82/分整,体温36.7度,SpO295%.簡単な質問に対して頷きは可能だが,発語は不可能.右上下肢完全麻痺.左上肢不全麻痺.心雑音なし.呼吸音清.腹部平坦軟,圧痛なし.
【画像検査(第1病日)】頭部CT:左前頭葉に脳浮腫を伴う4 cm大の腫瘤を認める.胸腹部CT:両側肺に肺転移と思われる7 cm大までの腫瘤,結節を多数認める.肝に肝転移と思われる15 cm大までの低吸収の腫瘤を認める.
【血液検査(第63病日)】WBC 6500/µL,RBC 339×104/µL,Hb 10.5 g/dL,Plt 11.2×104/µL,TP 5.9 g/dL,Alb 3.1 g/L,T-bil 0.8 mg/dL,AST 17 U/L,ALT 11 U/L,ALP 96 U/L,LDH 210 U/L,血糖123 mg/dL,HbA1c 4.5%.
【内服薬】ラコサミド300 mg分2朝夕食後,ベタメタゾン1 mg分1朝食後,クエチアピン25 mg分1寝る前,ビソプロロール貼付剤4 mg1日1枚.
【入院後経過】失語症のため発語はなかったが,日中覚醒時には頷きなどにより簡単な意思疎通は可能であった.食事は介助で全量食べられ,テレビでスポーツ観戦をするなど穏やかに過ごしていた.第119病日も夕食を全量摂取し就寝したが,第120病日の朝,呼びかけするも覚醒しなかった.同日施行した頭部CT(図1)では明らかな腫瘍の拡大や新規病変は認めなかったが,血液検査で低血糖を認めた.
WBC 10100/µL,RBC 387×104/µL,Hb 12.6 g/dL,Plt 9.0×104/µL,TP 6.1 g/dL,Alb 2.9 g/L,T-bil 0.8 mg/dL,AST 42 U/L,ALT 66 U/L,ALP 543 U/L,LDH 255 U/L,ChE 225 U/L,Cr 0.65 mg/dL,BUN 9 mg/dL,Na 145 mmol/L,K 3.5 mmol/L,Ca 8.9 mg/dL,P 2.9 mg/dL,CRP 0.77 mg/dL,血糖33 mg/dL.
ブドウ糖静注により意識障害は改善したことから低血糖による意識障害と診断した.その後も主に早朝に低血糖を繰り返したことから(図2),インスリンなどの血糖調節ホルモンを測定した(以下,括弧内は基準値を示す).

インスリン0.5 µU/mL未満(1.7–10.4),Cペプタイド1.7 ng/mL(0.6–1.8),インスリン抗体濃度125 nU/mL未満(125未満),結合率0.4%未満(0.4未満),コルチゾール6.0 µg/dL(3.7–19.4),ACTH 17.1 pg/mL(7.2–63.3),free T4 0.90 ng/dL(0.70–1.48),TSH 0.847 µIU/mL(0.350–3.67),GH 0.12 ng/mL(2.47以下),IGF-I 21 ng/mL(56–194).
インスリン,GH,IGF-Iとも低値,および腫瘍の病理組織,腫瘍の大きさから,IGF-II産生膵外腫瘍による低血糖症(non-islet cell tumor hypoglycemia: NICTH)が強く疑われた.このためステロイド,および末梢静脈からの10%ブドウ糖含有電解質持続輸液を開始したところ,明らかな低血糖症状は認めなくなった.その後約1カ月は低血糖症状の再発はなく食欲は保たれていたが,徐々に食欲は低下し衰弱が進み第170病日(低血糖症状出現後50日目)に永眠された.
NICTHは重篤な腫瘍随伴症候群の一つであり,内因性低血糖症の原因の一つとして知られ,大部分のNICTHは腫瘍から過剰分泌された大分子量IGF-IIによる低血糖症と認識されている.Bodnarらは大分子量IGF-II産生NICTHに関する文献検索を行い,症例報告,症例シリーズから288症例の報告をまとめている1).これによるとNICTHに関する報告は,間葉系腫瘍あるいは肝細胞がんに合併したものが多く,最も多く報告された組織型は孤立性線維性腫瘍(22%)であった.最も多いとされる胸膜起源の孤立性線維性腫瘍のうち,臨床症状を伴った低血糖症を引き起こしたとされるのは4%にすぎないとされている2,3).また腫瘍はかなり大きいこともNICTHの特徴であり,FukudaらはNICTHの78症例のうち70%で腫瘍の直径が10 cmを超えていると報告している4).
NICTHの確定診断のためには,腫瘍から産生される大分子量IGF-IIの過剰分泌を示す必要があるが,検査を行える医療機関はほとんどない.一般に測定可能な血液検査項目の中では,インスリン,IGF-Iの低値を示すことがNICTHの特徴とされてきた5).またGHの分泌低下もNICTHの特徴とされている6).本症例ではIGF-IIの測定はしていないが,インスリン,GH, IGF-Iとも低値であり,腫瘍の病理組織,腫瘍の大きさを考慮するとIGF-II産生NICTHが強く疑われた.本症例はがん終末期で肝転移,低栄養を有するため,遷延する低血糖の原因として肝機能障害の関与もあるものと考えられる.しかし本症例においては,意識障害発症時の血液検査,および浮腫や腹水もないことから肝機能は比較的保たれている.また肝機能障害が主たる原因の低血糖の場合,インスリン拮抗ホルモンであるGH,グルカゴンなどが高値となると考えられることから,本症例では低血糖の遷延に肝機能障害の寄与は少ないものと考えられる.NICTHは内因性低血糖症の原因疾患のうち3.8%とされているが7),NICTHの診断が容易でないことを考慮するとNICTHの頻度は過小評価されている可能性もある.
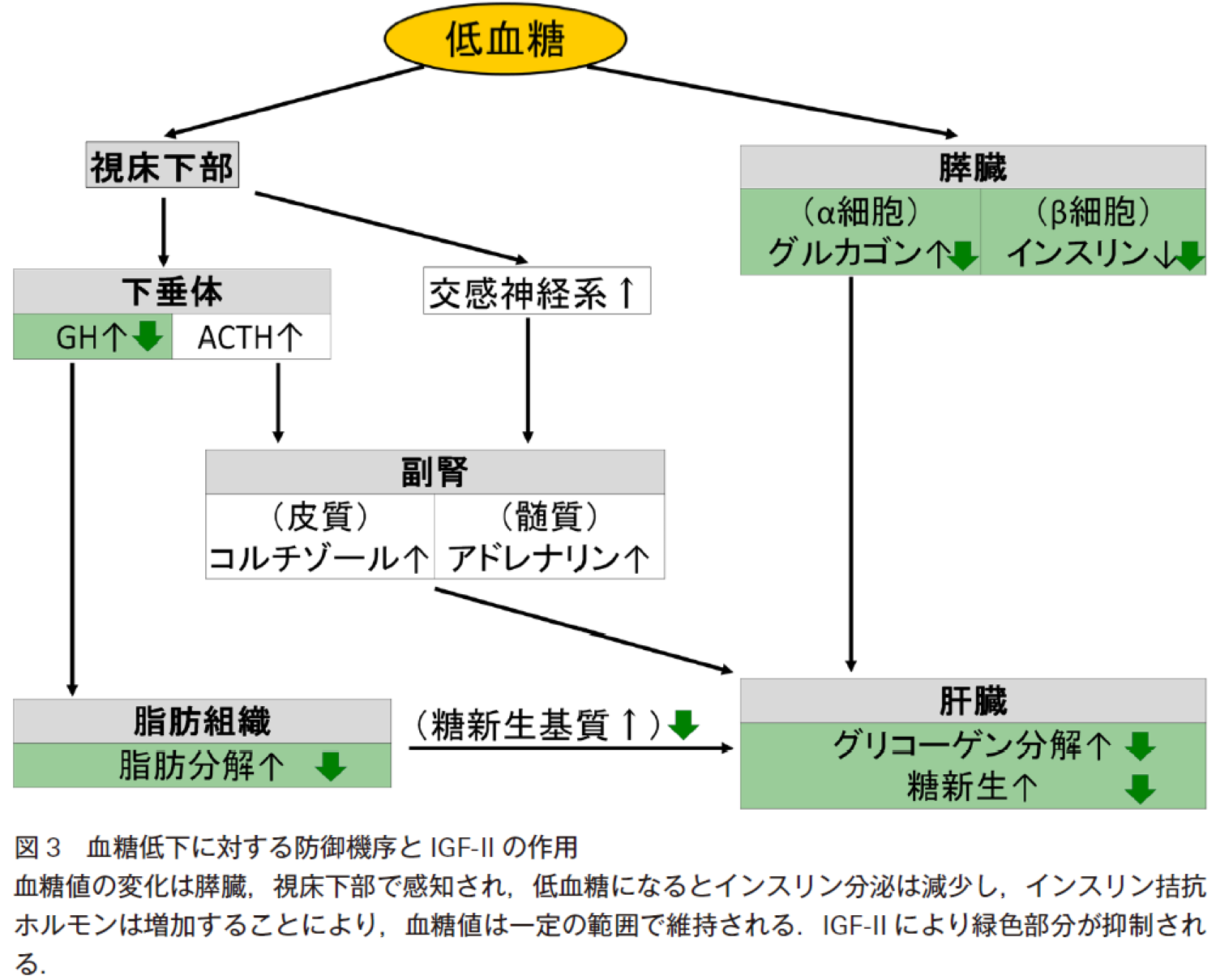
過剰分泌された大分子量IGF-IIは肝臓でのグリコーゲン分解,糖新生を抑制し(図3),さらに骨格筋でのグルコースの取り込みも増加させる5).このように低血糖に対する防御反応が低下するため,睡眠により長時間の絶食になる早朝に低血糖を来しやすい.このため早期からブドウ糖持続輸液を開始し,早朝の低血糖を予防することが重要と考えられる.NICTHに対する根本的治療は,IGF-IIを分泌する腫瘍の完全切除,あるいは部分切除や化学療法による腫瘍の縮小である1).腫瘍の完全切除,縮小が不可能な場合,これまでの報告で最も多い治療法は糖質コルチコイド療法である1).本症例では脳浮腫に対してデキサメタゾン1 mgを低血糖症状発症前より内服していたが,低血糖を繰り返すため4 mgに増量した.
血糖値が約70 mg/dL以下になると,アドレナリンなどのインスリン拮抗ホルモンの分泌増加による交感神経症状が出現し,約50 mg/dL以下になると脳へのブドウ糖供給不足により中枢神経症状が出現するとされる.つまり低血糖になると,交感神経症状が先行すると考えられている8).交感神経症状としては発汗,振戦,動悸,不安などがあり,中枢神経症状としては頭痛,錯乱,眠気,空腹感などがあり,低血糖が持続するとけいれん発作,昏睡に至る.しかし低血糖を繰り返す患者や血糖が穏やかに低下する患者においては,自律神経が障害された結果交感神経症状が出現せず,いわゆる無自覚低血糖の状態から突然重篤な中枢神経症状を発症することが少なくない9).本症例においても潜在的に低血糖に罹患していたことにより交感神経症状が表出せず,突然の意識障害で発症した可能性がある.また脳腫瘍によるけいれん発作予防目的に抗てんかん薬を内服し,高血圧症に対してβ遮断薬を使用していたため,振戦,動悸などの症状が軽減され,突然意識障害を来したことも考えられる.また失語症があったこともあり,われわれ医療従事者が交感神経症状を発見できず,低血糖を早期に検知できていなかった可能性もある.
がん終末期において,意識障害の原因としてNICTHが強く疑われた再発脳腫瘍症例を経験した.長期間低血糖にさらされる病態では,交感神経症状がなくいきなり意識障害などの中枢神経症状で発症することがある.がん終末期においてせん妄症状,意識障害,けいれん発作を来し,巨大な腫瘍がある場合には,NICTHによる意識障害も鑑別診断として挙げる必要がある.
すべての著者の開示すべき利益相反なし
長谷川は研究の構想およびデザイン,研究データの収集および分析と解釈,原稿の起草および原稿の重要な知的内容に関わる批判的な推敲に貢献した.伊藤,田橋,坂本,新地,徳永,田村は研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献した.すべての著者は投稿論文ならびに出版原稿の最終承認,および研究の説明責任に同意した.