2024 Volume 40 Issue 1 Pages 17-27
2024 Volume 40 Issue 1 Pages 17-27
核医学治療とは,標的組織に発現する分子に特異的結合する物質を放射標識し,組織集積させることにより細胞死を惹起させるものである.古くには,放射性ヨウ素131Iによる甲状腺疾患しか存在しなかったが,昨今種々の標的に対する新規製剤が開発され,実臨床にあがる時代となった.診断用核種で標識された診断薬で,あらかじめ患者選択,線量評価などが可能である.従って,通常の化学療法や免疫治療とは異なり,画像診断(diagnostics)と治療(therapeutics)が一体化(theranostics)しているものである.小児領域においては,甲状腺疾患に加え,神経芽腫に対する131I-MIBGが保険応用に向けて議論されているところである.
Targeted radionuclide therapy involves inducing cell death by radiolabeled substances that specifically bind to molecules expressed in target tissues, which allows the substances to accumulate in these tissues. In the past, this treatment has only been used with 131I for thyroid diseases. However, new preparations with various targets have recently been developed and are now used in clinical practice. These agents are labeled with a diagnostic nuclide, which allows for patient selection and dose assessment in advance. Therefore, unlike conventional chemotherapy or immunotherapy, this therapy uses a combination of therapeutics and diagnostics, and thus, is referred to as theranostics. In the pediatric field, in addition to use in thyroid diseases, 131I-MIBG for neuroblastoma is being considered for insurance coverage.
放射性医薬品(放射性アイソトープ標識化合物)を体内に投与し,その特異的病巣集積による放射線照射に基づく治療を内用療法(内照射療法,アイソトープ治療,核医学治療)という.内用療法に応用可能な放射線には,β線,α線,オージェー電子などがある.現在臨床でルーチン応用されているのはβ線とα線核種である.腫瘍組織内の全ての癌細胞に放射性医薬品が結合あるいは取り込まれなくても,ターゲティングされた細胞の周囲に存在する細胞も照射されるという利点を有している.診断用製剤の核種をこれらの治療用核種に置き換えることにより,診断(diagnostics)と治療(therapeutics)をシームレスに実施可能である(Fig. 1).病巣への製剤集積の確認により患者選択,定量化することにより線量計算,治療効果予測・効果評価,異常分布による有害事象予測などが可能である利点を有する(Fig. 2).このような観点から,前記の2語を融合したtheranosticsという用語が使われるようになった.

同一の分子構造で,標識核種により診断から治療に推移できる.金沢大学核医学診療科/国立がん研究所先端医療開発センター 稲木杏吏先生作成.

病巣集積の確証をシンチグラムやPETによる画像で診断し,治療時には病巣線量定量化(線量計算)により,治療効果予測を行う.治療後は,画像で治療効果評価を行う.治療前画像で有害事象予測も可能である.
もっとも歴史がある治療は,放射性ヨウ素131I(radioactive iodine; RAI)による甲状腺疾患である.初めて臨床応用されてから,すでに80年を経過している1).甲状腺癌の治療は,国際的に,アブレーション,補助療法(アジュバント),残存・転移治療の3種類に整理されている(Fig. 3).アブレーションとは,根治手術により残存腫瘍がないと考えられる患者における正常濾胞細胞除去に相当する(Fig. 4).国内においては,この定義による加療患者はほぼいないと考えられる.補助療法とは,画像診断では認識できない顕微鏡的な残存腫瘍(たとえば手術断端陽性例)が存在する患者における癌細胞破壊を意味する(Fig. 5).


根治術後に甲状腺床除去の目的で実施する.これにより表示のような利点が発生しうるが,我が国ではほぼ行われない.中リスク(大きい原発,腺外浸潤,リンパ節転移多い,等)以上の再発リスクの高い症例で実施される内用療法は,Fig. 5の補助療法に相当する.

40歳代女性.乳頭癌 T3N0M0 stage III.非治癒切除で,剥離面に腫瘍細胞が露出しており,再発リスクが高い症例.甲状腺床下方に,治療前に認識されていなかった微少リンパ節転移集積(矢印)が確認された.
さて,甲状腺分化癌肺転移はRAI治療のよい適応とされ,中年期以前の微少転移では寛解も望める一方で(Fig. 6),高齢者では無集積であったり,集積があっても効果がでなかったりする(Fig. 7).本稿の論点である小児甲状腺癌においては,国内にはまだガイドラインが存在していない.米国甲状腺学会ガイドラインの小児例に関する記載には,小児甲状腺癌のRCTは存在しない,小児(特に10歳未満)では成人で観察される典型的な乳頭癌の特徴がない(小児例では被包なし,広範浸潤)とある2).また,RAI治療で小児肺転移例では大多数で寛解は得られないが(Fig. 8,9),病状安定が得られ疾患特異死が減少する.望ましい治療回数は不明であり,治療最大効果が15–18か月後となることもあるので,再治療は12か月以上の間隔をあけることとされている.小児例で問題になり得るRAI治療による二次発がんリスクに対する安全な投与量は明らかではないため,全例にRAI治療をルーチン使用すべきではない.これらの背景から,成人例で推奨される積極的加療は,小児においては長期的リスクから判断すると,必ずしも適切ではないということを銘記すべきである(Fig. 10).

20歳代女性.濾胞癌の肺転移に対する内用療法.初回治療時に観察される転移巣への集積は,2回目治療時の画像では消失し,サイログロブリン(Tg)が陰性化している.2回目画像で胸部正中に見られる集積は,正常胸腺への生理的集積.
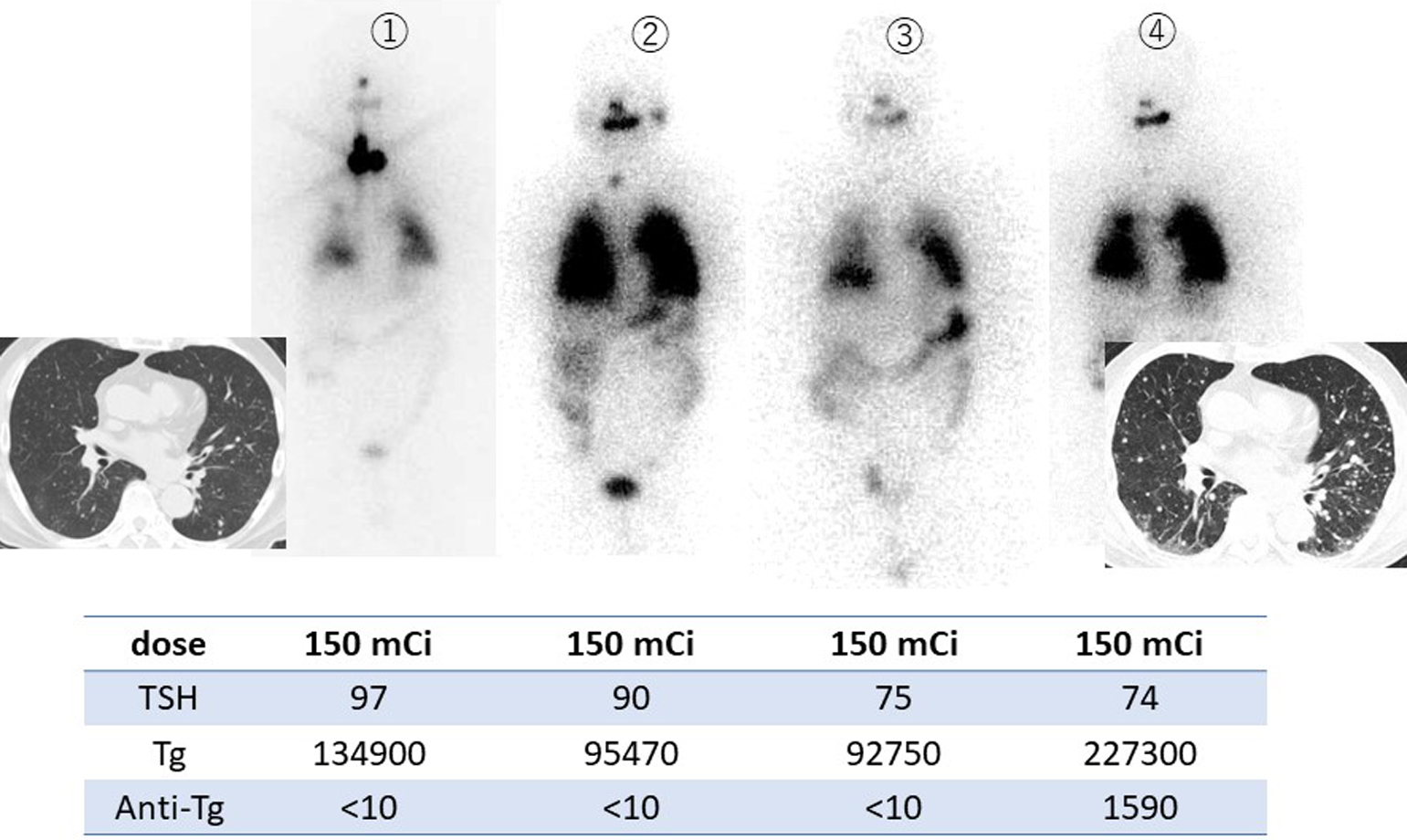

10歳代前半の女性,乳頭癌.①初発術前の頸部CT.②5年後に多発性肺転移が認められた.③内用療法を実施時の全身前後像.肺転移には集積を認めなかった.

10歳代後半の男性,乳頭癌.肺転移に集積がない.

10歳代前半の女性,乳頭癌.計4回の内用療法を受けている.初回,2回目のシンチグラムでは肺へのびまん性集積,腰椎転移への集積を認める.3回目までサイログロブリンは低下傾向にあるが,4回目には下げ止まっている.転移巣集積は3,4回目では非常に淡くなっている.二次発がんリスクも考慮して,これ以上の治療は継続しないこととした.
2021年に悪性褐色細胞腫・パラガングリオーマに対する131I標識meta-iodobenzylguanidine(MIBG)(Fig. 11)と神経内分泌腫瘍に対する177Lu-DOTATATE(Fig. 12)の2剤が新たに核医学治療薬として承認された.これらの疾患は,小児領域ではあまり関連はないかと思うが,131I-MIBGは神経芽腫に対する適用が議論されている.

治療前後のシンチグラム,腫瘍マーカーの変化より,治療効果が確認できる.

50歳代女性.治療前に見られた異常集積が,治療後に軽減している.
神経芽腫に関する国内の診療ガイドラインでは,高リスク患者において化学療法,細胞移植,外科療法,放射線治療を経た後治療として131I-MIBG治療の記載がある3).我が国においては,筆者の施設で自費治療,先進医療B,医師主導治験と種々の方策で長年実施してきたところである.治療開始初期には3.7 GBq(100 mCi)程度の低投与量で実施していたものの,十分な効果を得ていたとは言いがたい面があった.ある時点から,初期治療で寛解導入されたようなタイミングでアジュバントとして使用するのが望ましいであろうとの考えから,現在は,体重当たり15–18 mCiの骨髄破壊的投与量による加療,大量化学療法,骨髄(幹細胞)移植を行うという手法にシフトしている(Fig. 13).その結果,67%の症例でシンチグラフィでの寛解が得られた(Fig. 14)4,5).現在,当局と今後に関わる議論をしているところである.

導入療法で腫瘍の縮小を図った後に,骨髄破壊的投与量 18 mCi/kg(666 MBq/kg)による131I-MIBG治療と高投与量化学療法を実施し,骨髄移植を実施する.

Fig. 13の方針で治療を受けた症例.(A)完全寛解例.initial diagnosis画像で見られる骨格描画は,腫瘍細胞の骨髄浸潤によるもの.治療後に集積は消失している.(B)病状安定例.骨髄浸潤に加え,腹部に大きめの病巣がある患児.MIBG治療により骨髄集積は認識できなくなったが,腹部病巣は残存している.
131Iは,組織透過性の強い高エネルギーγ線を大量放出するので,治療実行中の医療従事者の体外被ばくに関して,厳重な配慮が必要である.医療従事者の放射線被ばくの観点から,患者が身の回りのことを独力で行うことができるADLが確保されていることが原則である.種々のトラブルは,体内に大量の放射能が残存している時期に発生することが大多数であるため,対応する医療従事者の被ばくが高度になる弊害が発生する.したがって,治療適応決定に際して,現疾患以外の患者背景の十分な把握が重要である.神経芽腫患児の治療でもこの通りであり,これまでの経験では,5歳から上の年齢であれば,治療前のコールドランなどによるトレーニングを経てほぼ治療実行可能である(Fig. 15).家族の介助が必要なこれより年少児では,家族に放射線・放射能教育を行い,行動原理を学んでいただくことが必須である6).

177Lu-DOTATATEは,ソマトスタチン受容体陽性の神経内分泌腫瘍に対する治療薬である.2022年3月に発出された厚生労働省保険局医療課長通知による本剤に関わるDPC診療群分類番号には,褐色細胞腫・パラガングリオーマ,前立腺の悪性腫瘍,その他の悪性腫瘍の明記がある7).したがって,前立腺癌で神経内分泌腫瘍化した状態や,他の癌腫でもSSTR陽性が画像上示されていれば適用の可能性がある.SSTR発現確認目的には,我が国では111In-オクトレオスキャンを用いる.
現在,世界的に広がりつつある治療として177Lu-PSMA(prostate specific membrane antigen)による前立腺癌治療がある.世界的大規模第3相試験では,標準療法の対照群と比べ,PFS,OSが有意に延長される結果が示されている8).また,カバジタキセルと比較した第2相試験では,本剤の有効性が有意に勝る結果であった9).欧米などで承認済みであり,我が国でも承認が待たれているところである.本剤とtheranosticsの観点でペアとなるのは,68Gaあるいは18FのPSMA標識体によるPET検査である.初期治療前後で本検査の有用性が広く報告されている.特に,初期治療で寛解導入された後の経過観察において,CT/MRI等の既存の検査よりも検出感度・特異度共に優れていることが示されている10).つまり,非常に低い値でのPSA再発が疑われる患者において,既存画像では病巣検出ができず,PSMA PETでのみ検出できる事例が多々報告されており,欧米のガイドラインではPSA再発例における画像診断としてPSMA PETが推奨されている.この背景において,転移巣が数カ所であるoligometastasesとして検出される事例が多い.このような患者においては,化学療法よりも,局所治療である放射線治療が選択されるようになっており,治療スキームに大きな修正がはかられている.
さて,昨今国際的にα線核種による核医学治療が広まりつつある.225Ac-PSMA11),225Ac-DOTATATE12)が,β線核種による治療が無効であった患者でこれらにスイッチし寛解が得られた例など,複数の施設から著効例が報告されている.225Acは国際的な十分量の供給のための整備が不十分で,ルーチン使用に至るまではかなりの年数がかかると考えられるが,将来に期待が持てる.
国内においても,211At(大阪大学)による甲状腺癌治療13),211At-MABGによる褐色細胞腫治療(福島県立医科大学)14)が医師主導治験として進行中である.甲状腺癌も褐色細胞腫も,シンチグラムで病巣集積が見られるにもかかわらず,治療効果のでない不応性患者が相当数経験される.これに対して,α線核種を応用しようという試みである.このα線核種は,国内に存在するやや大きな加速器で製造可能であるが,広く普及するためには,現存装置では全く不十分であるため,大型加速器建設などの国の施策が必要である.
α線治療の高い効果は,β線とくらべてエネルギーが高いため,DNAにヒットすると二重鎖切断が生じること,腫瘍組織内の低酸素状態とは無関係にDNA障害が生じることなどにより説明されていた.しかし,腫瘍内の放射能集積は著しく不均一であることに加え,α線の組織内飛程はたかだか数十ミクロンであることを考慮すると,腫瘍内に存在する癌細胞のかなりの割合が照射を受けていないであろうという事実に気づかされる.にもかかわらず,β線治療が無効である症例がα線治療で寛解に入る事例が報告されるのは何故であろうか.この現象は,アブスコパル効果によるものであると理解されている15).抗腫瘍効果の大きいα線により,比較的短時間に大量の細胞死が生じるため,宿主免疫が強く誘導されるのであろう.外照射の世界では古くから(1950年代から),ある部位の照射により,照射野外の腫瘍も縮小する事例が存在することが報告されていたが,これもアブスコパル効果であるとされている.
これをお読みになった皆さんにお願いがある.我が国では,核医学治療に用いられている治療用核種は100%輸入に頼っている.(211Atは国内の加速器で製造されているが,全国をカバーできる状況にはない.)過去に製剤輸入が,諸々の理由で停止となり,患者の皆さんにご迷惑をかけてきた.長年,国内生産が必要であることを患者会などと共にアピールし,国会議員の方々にもご尽力いただいてきた.昨年その努力が実り,原子力委員会から“医療用等ラジオアイソトープ製造・利用推進アクションプラン”が発出された(Fig. 16).この中に,211At,225Ac,227Th,68Gaが言及されている.これらの国内開発は数年で決着がつくのではなく,プランの中では10年の間に実現すべき目標とされている.したがって,これを真に実現するためには,関係者が声を挙げ続ける必要がある.関係者とは,医師,患者のみならず,診療放射線技師,研究者,企業人等,すべての方々をふくむものであることを理解していただくことを祈念し,稿を終えたい.

2022年5月31日に出された医療用ラジオアイソトープ製造などに関わる国のアクションプラン.国内での製造を実現することを謳っている.