2024 Volume 40 Issue 1 Pages 43-48
2024 Volume 40 Issue 1 Pages 43-48
リンパ疾患は外傷性,先天性,腫瘍性,炎症性,特発性等,多種多様な原因により発症する.その主な病態は,リンパ管の損傷とリンパ液のうっ滞や過剰産生による破綻である.リンパシステムの全体像把握は難しく,特に肝臓や腸からのリンパ流の全体的評価は困難だが,近年の技術進歩により肝リンパ流の評価が可能となってきている.それにもかかわらず,リンパ系の画像評価は未だ発展途上であり,病態解析と治療計画の根拠とするには限界がある.小児患者に対する治療として,我々はリンパ管造影,胸管塞栓術,胸管破砕術,肝内リンパ管塞栓術等を用いて乳び胸水,乳び腹水,鋳型気管支炎,乳び心嚢症,蛋白漏出性胃腸症等を治療している.本稿では,我々が直面している実際の症例に基づいてリンパ疾患の病態を解説し,その治療により解決した領域と,これから取り組むべき課題を紹介する.
Lymphatic diseases can be caused by various factors, with primary pathologies involving damage to the lymphatic vessels and disruption due to congestion or excessive lymph production. While imaging of the lymphatic system remains under development, recent advances allow for some evaluation of hepatic lymph flow. We treat pediatric patients using techniques such as lymphangiography, thoracic duct embolization, thoracic duct disruption, and intrahepatic lymphatic embolization to address conditions such as chylothorax, chylous ascites, plastic bronchitis, chylopericardium, and protein-losing enteropathy. This paper discusses the pathologies of lymphatic diseases based on actual cases, indicating areas of consensus and future challenges.
リンパ系の認識は古代ギリシャ時代にまで遡る.アリストテレスとヒポクラテスは紀元前500年に乳白色の液体で満たされた「glandular corpuscles」を特定し,これが後に「lymph node:リンパ節」と記載された.さらに進んで1500年代初頭,バルトロメオ・ユースタキウスは中央の太いリンパ管を特定し,これが胸管と名付けられた.その後200年間で死体研究によりリンパ系の理解は大きく進み,リンパ管内の弁構造と蠕動機能が確認され,18世紀後半にはMascagniによるリンパ網の全身地図が完成した.リンパ液の詳細な研究は20世紀まで続き,1970年代にMarlys Witteが外科的リンパドレナージと心不全における体液貯留を治療するための改良に大きく寄与した.
しかし,リンパ管の問題を画像化し,アクセスし,治療する能力は,1990年代にコンスタンチン・コープが経皮的に胸管にアクセスし,画像化し,経皮的胸管塞栓術を発表するまで,解剖学的理解を超えることはなかった.コープの技術導入以降,リンパ管の画像診断と介入の進歩は多くの患者,特に先天性心疾患(CHD)を持つ患者の罹患率と死亡率に変化をもたらした.この進歩は小児リンパ疾患の診断と治療に多大な影響を与えている.
リンパ系は血液循環系の一部であり,体内の組織液を吸収し,その液体を血液循環に戻す役割を果たす.リンパ系は主にリンパ管とリンパ節から構成されている.
リンパ管は微細なリンパ毛細血管から始まり,これらは広範囲の組織で間質液を吸収する.これらの毛細血管は,組織の間にある大きなリンパ管に合流する.右側上半身は,直接右静脈角へ,左上半身及び両側下半身は胸管を介して左静脈角を介して静脈循環に排出する.
静脈角には血液の逆流を防ぐための弁があり,吸気時に弁が開放され,胸管内のリンパ液が静脈へと排出される.
一方,リンパ節はリンパ液の流れをフィルタリングする役割を果たし,免疫系の一部として機能する.小児では,特に頸部,腋窩,腹部,鼠径部にリンパ節が豊富に存在する.さらに,小児ではリンパ節が大人よりも比較的大きく,また免疫反応に対してより活発である傾向がある.これは子供の免疫系がまだ成熟していないため,感染症などに対する反応が強くなる傾向があるためである.
全身を巡る脈管には動脈,静脈,リンパ管がある.動脈には駆動力として心臓があるが,静脈やリンパ管は,体内の様々な工夫により低速で進んでいる.
リンパ系は,体内の全細胞に必要な酸素や栄養素を運ぶ血液と同様に,体液循環系の重要な部分である.リンパ液の1日あたりの流量は,体重に比例しており,全血漿量の60%以上が胸管を介して流れる.成人では1日あたり約1リットルのリンパ液が還流する.
リンパ液は血液毛細血管から間質に漏出した血漿成分から形成される.この血漿成分はリンパ毛細血管に入り,最終的にリンパ液となる.リンパ液の生成に最も寄与するのは肝臓と小腸であり,これらの器官が生成するリンパ液は全体の80%を占めている.
腸リンパシステムは脂肪の吸収と輸送を担っており,脂肪が豊富なためリンパ液は白く見える.食事により腸リンパの産生量は2倍に増加し,中性脂肪やコレステロールの増加に加えて,カイロミクロンの存在が確認できる.尚カイロミクロンの産生は小腸リンパ管のみが担っており,腸リンパ漏の診断に有用である.
肝リンパ液は,小腸から流れてくる門脈血液から肝臓で類洞を介して肝静脈に排出される過程で産生される.肝リンパ液にはアルブミンが豊富である.
以上のことから,リンパ系は体の循環系の一部として,栄養素の輸送,免疫系の一部としての役割,および余分な液体や廃棄物の排除といった多岐にわたる機能を持っていることが理解できる.また,肝臓や腸といった特定の器官がリンパ液の生成に大きく寄与していることも見て取れる.これらの知識は,リンパ系の異常やリンパ液の異常を理解するために重要である.
一般的に胸管内の圧力は20~27 cmH2O前後と言われており,鎖骨下静脈(≒右房圧)の2~8 cmH2Oに向かって排出されている.この約15 cmH2O前後の圧格差が,リンパ液の生理的な流れを生み,圧格差が縮小した場合,リンパシステムはうっ滞する.この圧格差を縮小する原因として,①静脈側の問題(鎖骨下静脈閉塞,右心不全),②リンパ機能不全(リンパ管の弁機能不全,リンパ管拡張症,胸管閉塞)等が挙げられる.
また,先に述べたように肝臓とリンパシステムは密接に関係がある.正常の門脈圧は7~14 cmH2Oであり,肝硬変などの門脈圧亢進症では,20~47 cmH2Oとなる.この圧上昇の結果,脾腫が増悪し,門脈血液量が増加する.この門脈血は,遠肝性血流となったもの以外(食道胃静脈瘤,直腸静脈瘤等)は類洞を通過することになり,産生される肝リンパ液も増加する.このように,肝硬変では正常の肝リンパ液に比べ増量し,最大20倍のアルブミンが豊富な肝リンパ液が産生される.
リンパ浮腫のメカニズムは,リンパ管がリンパ液を適切に排出できない結果,リンパ液が組織間に溜まり,腫脹を引き起こすというものである.リンパ液は血液中の水分やタンパク質,老廃物を含む.これらが組織間に滞留すると,そこで腫脹が生じる.
小児期で問題となるものは,①リンパシステムの機能不全,②リンパ液の排出不全による鬱滞である.機能不全の原因として,リンパ管の弁形成の低形成,胸管の未発達,感染等がある.排出不全には遠位胸管の閉塞,静脈角の形成不全,鎖骨下静脈閉塞,右心不全がある.
小児期のリンパ疾患では,特に,新生児乳び胸腹水,術後性乳び胸水,Fontan術後リンパ漏,リンパ管腫関連リンパ漏,リンパ機能不全関連リンパ漏が問題であり,以下に病態治療法について自験例を元に紹介する.
様々なリンパ漏を有する患者で適応があり,医原性(外傷性)リンパ漏が最も良い適応ではあるが,特発性リンパ漏やFontan循環に関連するような鬱滞性リンパ漏に対しても有効ない症例は多い.
リンパ管造影にはLipiodolを用いるが,Lipiodolによる血管傷害性に期待した治療的リンパ管造影を2005年にYamagamiらにより報告されており1),小児領域においても同様の有用性の報告がある2).尚,Lipiodol使用限界量について,エビデンスレベルの高い論文は無いが,小児患者においては0.2 ml/kgを目安として用いている.特に,右左シャントがある症例では,可能であれば一時的にバルーン閉塞することで重篤な合併症の予防が可能となる.
【症例】総肺静脈還流異常症に対する修復術を日齢1で実施後,術後からリンパ性胸水が発症.
フィブロガミン,サンドスタチン,ステロイド,絶食による保存的治療を行うも,170 ml/kg/dayの胸水排液が続き,Alb,IgGの低下が持続した.
漏出原因の評価としてリンパ管シンチグラフィを行った(Fig. 1A, B).シンチでは,胸腔内に核種の緩徐な漏出が確認された.CLFDによる,乳び胸水と考えられた.

A:15分後
右胸壁に沿って2箇所に核種の集積があり,肋間リンパ管へのリンパ液の逆流と考える.
B:60分後
肋間リンパ管への集積が増加している.胸水の原因と考える.
【治療】鼠径からのリンパ管造影を行うことで,漏出点にリピオドールがたどり着くと考えた.Therapeutic lymphangiographyを期待して,リピオドール0.6 mlを用いてIntranodal lymphangiographyを実施した(Fig. 2A, B).リンパ管造影では胸管の走行は確認され,漏出点の同定は出来なかった.静脈角は明瞭に確認され,鎖骨下静脈への流入も確認された.

A:右鼠径部からのリンパ管造影.腰リンパ管が明瞭に描出されている.
B:胸管(矢印)および,静脈角(矢頭)は確認されるが,血管外への漏出像は見られない.
リンパ管造影後,胸水は緩徐に減量したが,下腹部皮下は浮腫性に肥厚し腹水が増加した.その後2週間ほどで術前と同程度の胸水量に戻った.精査のためリンパ管シンチを行ったところ,胸管は閉塞し,下腹部皮下へのリンパ液の逆流を確認した(Fig. 3).
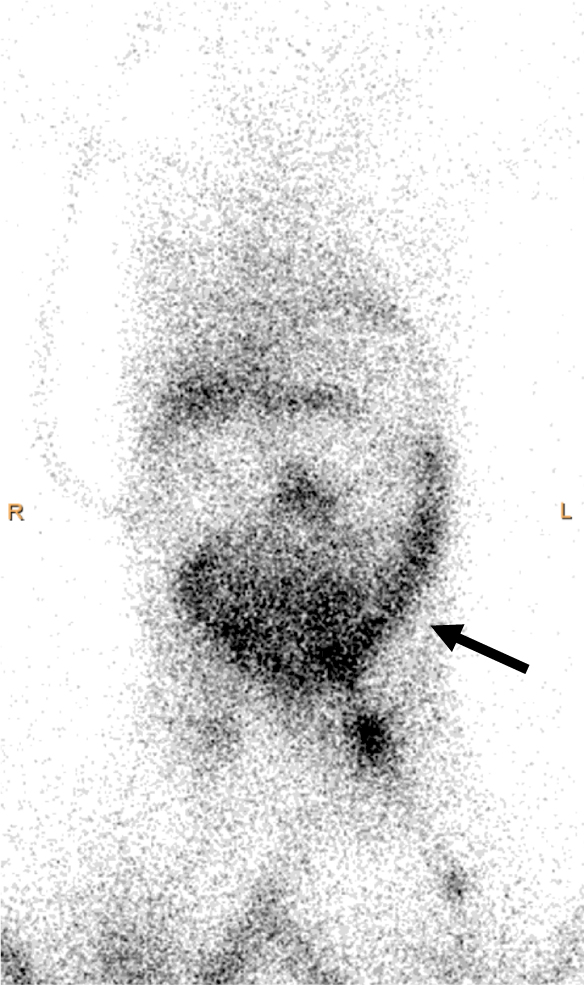
上行するリンパ路は消失し,胸腔への漏出は減量しているが,腹壁や腸管膜への核種の逆流が確認される(矢印).
その後,3度のIntranodal lymphangiographyを行うことで,胸腔ドレーンの抜去に成功した.
【症例の解説】CLFDにより,リンパ流の停滞が生じ,肋間リンパ管へリンパ液の逆流となり結果的に乳び胸水が生じた.小児患者での心大血管の術後のリンパ瘻は少なく(8%),多くはPLPS(56%)やCLFD(36%)が原因とされる3).このため,成人の術後性乳び胸水と異なり,多くの症例でリピオドールによるリンパ管造影で漏出点が同定できることは少ない.
Central Lymphatic Flow Disorder (CLFD)/Congenital Lymphatic Dysplasia (CLD)/Pulmonary Lymphatic Perfusion Syndrome (PLPS)
・CLFDは中心リンパ系の流れの異常に関する疾患である.これにより,リンパ液の過剰な蓄積や漏れが発生することがある.
・CLDは生まれながらのリンパ系の形成不全を指すものである.これはリンパ管の形状やサイズの異常に起因することが多い.そのため,リンパ液の移動が妨げられることがあり,患者はリンパ浮腫などのリンパ関連の症状を示すことがある.
・PLPSは肺のリンパ系の異常に関連する疾患である.この疾患のため,肺にリンパ液が過剰に滞留することがある.これは肺のリンパ系の流れや排出の異常によるものである.PLPSの患者は,呼吸困難や酸素飽和度の低下などの症状を示すことがある.
これらは,このように定義されるが,基本的に中心リンパ管の機能不全による,リンパ液の過剰な蓄積や,鬱滞にともない生じる疾患であり,貯留する場所によって様々な病態を呈する.
2. Fontan術後リンパ漏【症例】13歳男児.左心低形成症候群の診断で,日齢7で両側肺動脈絞扼術を施行.生後3か月でNorwood手術および両方向性グレン手術を施行.肺動脈狭窄に対して3回バルーン拡張を施行し,3歳3か月で左肺動脈形成を施行.その後4歳でFenestrated TCPC(Total Cavopulmonary Connection)および三尖弁形成術を施行された.再TCPCを施行した5歳の頃からProtein Loosing Enteropathy(PLE)が発症した.その後保存的治療(肺血管拡張薬,利尿剤)を施行しPLEは小康状態を保っていたが,12歳の頃から再度アルブミンの補充(連日10 gの補充)が必要になり,重度のPLEの診断で紹介受診となった.
【心カテ所見】上大静脈17 mmHg,右肺動脈15 mmHg,左肺動脈15 mmHg,肺動脈楔入圧12 mmHg
【現在の内服薬】ヘパリン療法,Alb週2回補充
【治療】全身麻酔で23G Chiba針を用いエコーガイド下に肝内リンパ管を穿刺し,インドシアニングリーンを投与して内視鏡で漏出部位が十二指腸であることを確認した(Fig. 4).その後20% NBCA-Lipiodol混和液を用いて,肝内リンパ管を塞栓した(Fig. 5).術直後は腹痛が増悪したが,2日後にはほぼ消失した.また,術前にみられた顔面浮腫,下腿浮腫,陰嚢浮腫は速やかに改善した.Albの漏出速度は術直後では一定の効果はあったが数週間で術前の状態に戻った.

超音波ガイド下に23Gで肝内リンパ管を穿刺し,インドシアニングリーン(ICG)を穿刺針から注入後1分.腸管壁からICGの漏出が確認された.
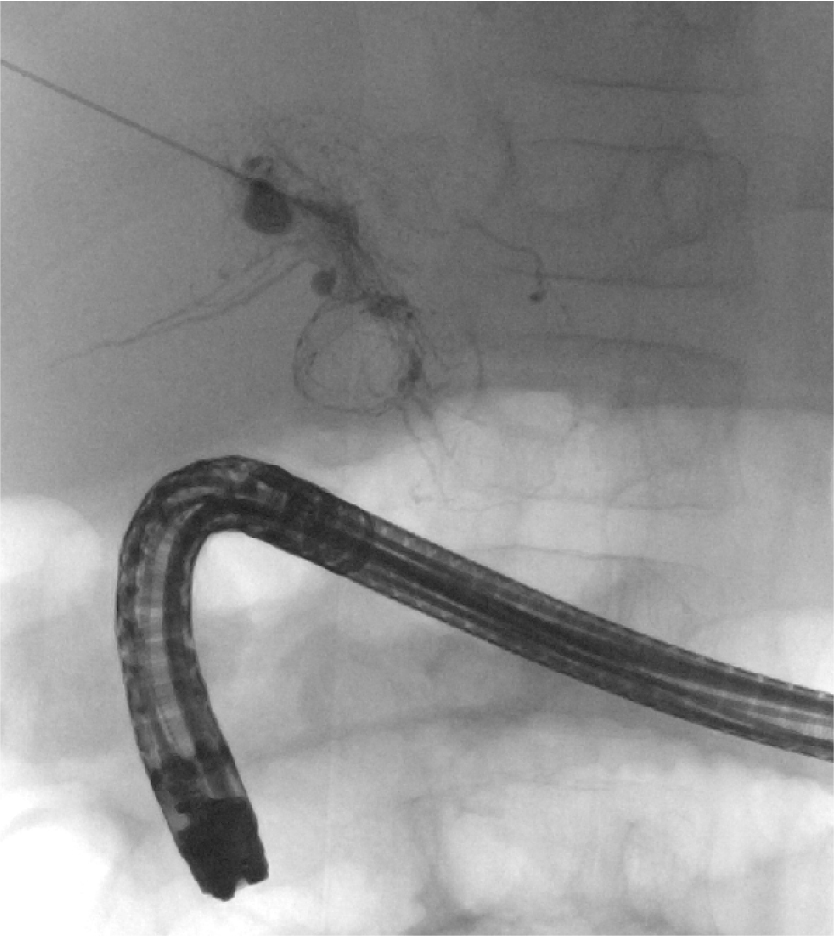
穿刺針から20% n-butyl-2-cyanoacrylate (NBCA)-Lipiodol混濁液を2 ml注入した.
2か月後に2度目の治療を追加することで,Alb補充の頻度は改善した.2回目の塞栓後でも,数日間腹痛および消化管出血があり,輸血で対応した.
【症例の解説】PLEに対する塞栓術は,適応がまだ定まっているとは言い難く,重症化後に実施するのが良いか,発症時に行うのが良いかは最適な実施時期は未だ議論されている.本症例は,1度目の塞栓前後で,肉眼診察可能な症状はほぼ消失して,患者満足度は高かったがAlbの改善は乏しかった.2度目の塞栓後で,1度目よりは補充の頻度は改善し,5年たった現在も外来通院している.塞栓後の腹痛は全例で生じ,下血は約半数で生じる.この治療は,門脈に沿い腸管を経由して胸管に流入する肝内リンパ管を塞栓し,肝リンパ液を肝静脈にそったリンパ路に誘導する事でアルブミンの漏出減を狙うものだと,私は理解している.このため,漏出部と塞栓物質の投与位置は離れており,塞栓物質が目的の部位にたどり着くかは,術者のコントロール外である.このため,既報では複数回の実施で改善した報告が多いが,観察期間を明確に記載したものは乏しく4,5),今後の大規模研究が待たれる.
小児領域におけるリンパ系IVRを紹介した.成人では,主に外傷性(術後性)リンパ瘻に対して行われており,非常に良好な成績を得ている.多くの小児では,術後に生じることが多いが,リンパ管の損傷というよりは,リンパシステムの未成熟を背景とした複雑な病態であることが多い.
病態把握には,リンパ管シンチが最も簡便であるが,精査にはDynamic Contrast Magnetic Resonance Lymphangiography(DCMRL)や,リピオドールによるリンパ管造影が有用である.今後,我々放射線科医が,担う分野の多い領域であり,症例の蓄積に励んでいきたい.