2025 Volume 41 Issue 1 Pages 41-50
2025 Volume 41 Issue 1 Pages 41-50
心血管MRIの胎児心血管への応用は魅力的であり,欧米では約20年以上前から臨床的に撮像が開始されている.ただし,従来の心血管MRIと同様の方法で胎児心血管のデータを取得した場合,胎児心が小さく心拍数が高いこと,胎児心拍をモニタリングできないため通常の心電同期撮像が難しいこと,母体の呼吸と予測できない胎児の動きなど多くの制限が生じてしまう.近年胎児心血管MRIは技術的進歩を重ね,シングルショットイメージングから高解像度動的イメージングが可能となり,胎児心血管の解剖学的構造の視覚化,血流の定量化,血中酸素飽和度およびヘマトクリット値の定量化などができるようになっている.本稿では,胎児心血管の動的MRI撮像を可能にした胎児心電図取得技術の開発,加速イメージング技術,および動き補正アルゴリズムの改良などの技術革新について解説し,胎児先天性心疾患が胎児の循環生理学に及ぼす影響についても概説する.
The application of cardiovascular MRI to fetal cardiovascular imaging is compelling, and clinical imaging has been implemented in Western countries for over 20 years. However, when attempting to acquire fetal cardiovascular data using conventional cardiovascular MRI methods, numerous limitations arise: the fetal heart is small with a high heart rate, conventional cardiac gating is difficult due to inability to monitor fetal electrocardiogram, and there are challenges with maternal breathing and unpredictable fetal movement. In recent years, fetal cardiovascular MRI has made significant technical advances, progressing from single-shot imaging to high-resolution dynamic imaging, enabling visualization of fetal cardiovascular anatomical structures, quantification of blood flow, and measurement of blood oxygen saturation and hematocrit values. This paper discusses the technological innovations that have made dynamic MRI imaging of the fetal cardiovascular system possible, including the development of fetal ECG acquisition techniques, accelerated imaging technology, and improvements in motion correction algorithms. It also provides an overview of how fetal congenital heart disease affects fetal hemodynamics.
胎児心エコーの歴史は1970年代に遡り1),1980年代には技術の進歩によりBモード平面画像,パルスウェーブドプラ,カラードプラが導入された.これらにより,胎児の心臓形態と血流波形の観察が可能となり,胎児心エコーは先天性心疾患(congenital heart disease; CHD)の出生前診断スクリーニングとして広く普及した2–5).出生前診断には,出生後に血行動態の不安定を引き起こす可能性のある疾患を早期に発見し,適切な治療を行えるという利点がある.また,重症なCHDが診断された場合には,予後改善を目的とした胎児への治療介入が提案されることもある6–8).
胎児心エコーは,心臓の形態を可視化し,ドプラ法で血流波形を評価できるため,心構造異常の検出に非常に適している.しかし,妊娠後期には母体肥満,羊水過少症,胎位異常,多胎妊娠,骨性胸郭によるacoustic shadowなど,様々な要因により検査が困難になる場合がある9–13).このような背景から,胎児に対する心血管MRI(cardiovascular magnetic resonance; CMR)の開発が注目されるようになった.特に,妊娠後期では羊水量の減少や胎児の体動低下により,MRIの画質が向上する点が特筆される(Fig. 1, Movie 1)14–16).そのため,胎児CMRは,胎児心エコーの診断的有用性が制限される場合に補完的な役割を果たす可能性がある.

妊娠後期に羊水過少症がエコーウィンドウを制限している場合もCMRは優れた解剖学的情報を提供でき,この四腔断面像(左)にて右室憩室が描出された.(Mike Seed教授から提供)
MRIの胎児への安全性については,ガドリニウム造影剤を使用しない場合の安全性が報告されている17–19).ガドリニウム造影剤は,子宮内での炎症性疾患のリスクを高める可能性があるため,妊娠中の使用は禁忌とされている20,21).
胎児の小さな心臓をMRIで撮像するには様々な技術的課題があったが,近年の技術革新によりこれらの問題が克服されつつある22).胎児の心電図取得技術の開発,加速イメージング技術,動き補正アルゴリズムの改良などにより,MRIを用いて胎児心臓の構造と機能を評価し,血管内の血流や酸素含有量を測定することが可能となった.
本稿では,筆者が過去に所属していたカナダのThe Hospital for Sick Childrenでの経験をもとに,胎児CMRに関する最新技術について概説する.
胎児心臓を画像化する際,一般的に用いられる撮像法には,“bright blood imaging”であるbalanced steady-state free precession(bSSFP)(Siemens: TrueFISP, GE: FIESTA, Philips: balanced-FFE, Canon: True SSFP)がある.一方,“black blood imaging”であるハーフフーリエシングルショット高速スピンエコー(Siemens: HASTE, GE: SSFSE, Philips: SS-TSE, Canon: FASE)は,縦隔の血管構造,気道,肺の描出に適している.これらの撮像法は,短時間で比較的高い空間分解能を得られるため胎児CMRに適しているが,心臓の動きによるアーチファクトが生じやすく,心機能の評価には困難を伴う.
出生後に行われる従来のCMRでは,心電同期を用いて心周期の各時相で画像を取得し,拍動する心臓の高解像度動画を得ることが可能である.しかし,MRI環境下では胎児の心電図を検出するのが難しいため,胎児の心臓を同期的に撮像する非侵襲的な方法として,メトリック最適化ゲーティング(metric optimized gating; MOG)やドプラ超音波ゲーティング(doppler ultrasound gating; DUS)などが開発されてきた23–29).ただし,bSSFPシネ画像の撮像には数秒の時間を要するため,胎児の体動や母体の呼吸運動によるアーチファクトが生じやすい課題がある.このようなアーチファクトを軽減するために,ラジアルサンプリングによるk空間充填と圧縮センシングを組み合わせたgolden-angle radial sparse parallel MRI(GRASP)などの技術が活用されている(Fig. 2, Movie 2, 3)16,22,30,31).

心電同期撮像を可能とするmetric optimized gatingとアーチファクト軽減のためにラジアルサンプリングによるk空間充填と圧縮センシングを組み合わせたgolden-angle radial sparse parallel MRIにて撮像した.(Mike Seed教授から提供)
過去20年以上にわたり,複数の研究がCHDの診断における胎児CMRの有用性を検討してきた.bSSFPイメージングは,胎児の心臓および大血管の大まかな形態構造を可視化するのに用いられている.これにより,心房位,心室位,心房心室関係,心室大血管関係,体静脈および肺静脈の接続,大血管の構築,大動脈弓の側性,さらには心室および血管のサイズを特定することが可能となっている15,32–36).いくつかの研究報告によると,胎児CMRと心エコー検査の間には高い一致性が示されている33,37–39).Votinoらの研究では,胎児CMRは,CHDの検出において88%の感度と96%の特異度を示したが,MRIが心エコーに対して追加の診断価値を提供しなかったと指摘している39).一方,Dongらは,胎児CMRがCHDの診断補助として有用であると報告している.この研究では,心エコーで誤診された症例の15%がCMRで正確に診断され,逆にCMRで誤診された症例の18%が心エコーで正確に診断された.両方の検査で誤診された症例は,わずか3%であった40).他の大規模な単一施設後方視的研究では,胎児CMRと出生後診断を比較し,MRIは正常心を99.2%,CHDを60.6%,その他の心臓疾患を87.9%の精度で診断したと報告している41).
近年では,心電同期シネCMRが胎児にも適用可能となり,胎児心臓の解剖学的構造をより確実に捉えるだけでなく,心機能の評価も可能になったと報告されている25,27,30,31,42).ただし,心エコーと比較すると,MRIの連続的な動画像は優れた品質を示しているが,心室流出路,細い肺動脈,弁の形態の解像度が不足している点が指摘されている.これらの可視化が困難な主な理由は,胎児の動きによるものであった43).その後,胎児の動き補正技術がblack blood imagingに適用され,非常に高解像度の三次元データセットの作成に成功している.このデータセットは,大血管,体静脈と肺静脈も含む先天性心疾患のボリュームレンダリング再構成に利用されている.Lloydらは,動き補正アプローチを用いた再構成が胎児CMRにおける縦隔血管の可視化率を53%から97%に改善し,90%の症例で診断可能な画像が得られたと報告している16).
小児および成人の血管血流情報を非侵襲的に測定するゴールドスタンダードなアプローチは,位相コントラスト(phase contrast; PC)CMRである44,45).前述したシネ画像化のための心臓ゲーティングアプローチを活用することで,PC CMRを胎児血管の血流定量化に適用し,右心室および左心室の拍出量,肺血流量,さらには臍帯血流量の測定が可能になった23,46–48).多くの血管において血流を定量化することで,卵円孔を介したシャント量をはじめとする心内血流動態を推定できるようになっている.また,上大静脈の血流定量化は,脳血流量の近似値を提供する手段としても有用である49).このように,胎児MRIは胎児循環の分布を定量的に評価し,CHDが胎児の臓器灌流に与える影響を解析するために使用することができる50).
MRI信号の特性の一つとして,酸素飽和度やヘモグロビン濃度の変化に対する感受性が挙げられる.T1およびT2マッピングなどの定量的な緩和測定技術を利用することで,胎児血管内の血液酸素含有量を定量化することが可能となり,胎児の血行動態を評価するための全く新しいアプローチが実現した.心筋の縦緩和時間(T1)および横緩和時間(T2)を測定するために開発されたシーケンスを改良し,脱酸素化ヘモグロビンの常磁性効果がMRI信号の変化に寄与する現象(blood oxygenation level dependent; BOLD)を利用することで,血液のT2が酸素飽和度に比例することが示された(Fig. 3).一方で,T1は主にヘマトクリット値に依存することが明らかにされている51–54).また,T1とT2が互いに影響し合うことも解明されており,個々の血管から得られるT1およびT2の測定値を組み合わせることで,ヘマトクリット値と酸素飽和度を正確に算出することが可能になった.さらに,血漿中に溶解した酸素の影響は無視できるため,酸素含有量は酸素飽和度とヘマトクリット値の積として定量化することができる55–57).

Blood oxygenation level dependentを利用することにより血液T2が酸素飽和度に比例する.色の明るいUVの方がDAoより酸素飽和度が高いことが示された.DAo, descending aorta; UV, umbilical vein. (Mike Seed教授から提供)
胎児血管の血流データとオキシメトリーのデータを組み合わせることで,胎盤および胎児の血行動態,胎児の酸素輸送,さらに胎児の代謝に関する追加情報を得ることができる.血管内の酸素流量は,酸素含有量と血流量の積として表されるため,胎児への酸素供給量は,臍静脈の血流量と酸素含有量の積として定量化することが可能である.さらに,胎児への酸素供給量と臍動脈または下行大動脈の酸素含有量を組み合わせることで,胎児代謝の指標となる酸素消費量や,供給された酸素量に対する実際に消費された酸素量の割合である酸素抽出率を算出できる.酸素抽出率は,組織への酸素供給量が低下した場合に増加することが知られている58,59).同様のアプローチにより,胎児血管における血流量と酸素飽和度の測定を組み合わせることで,個々の臓器への酸素供給量や酸素消費量を推定することが可能である.例えば,羊胎児の研究では,頸動脈の血流量測定と上大静脈および上行大動脈での酸素飽和度測定を組み合わせることで,脳への酸素供給量を測定している60).この原理は,胎児CHDにおける脳の酸素化への影響の研究にも利用されている61).
また,臍静脈の酸素飽和度を測定することで,胎児CHDに関連する胎盤機能不全が明らかにされている62).Rudolphらは,羊胎児の複数の静脈部位にカテーテルを用いて放射性マイクロスフィアを注入し,循環分布を測定する手法を開発した63).この方法は,従来の血液ガスサンプルや圧力値と組み合わせることで,胎児循環の血流動態を明らかにすることに役立った.
その後,人胎児の循環分布に関する心エコー研究が行われたが,胎児CMRの導入により,妊娠後期の人胎児の血流動態がより詳細に解明された.その結果,羊胎児との多くの類似点が確認された46,64).人胎児循環では,羊胎児と同様に右心室と左心室が並列に機能している.胎児期には肺循環の必要性が低いため,胎児循環には卵円孔,静脈管,動脈管の3つの短絡が存在する.このため,右心室からの血流の大部分は動脈管を通って肺動脈から下行大動脈へ流れ,肺を循環する血液量はごくわずかである.胎児循環において,酸素飽和度が最も高いのは臍帯静脈(85%)で,臍帯静脈からの血液が動脈管と卵円孔を通じて左心系に流れるため,左心室と大動脈の酸素飽和度(68%)は,右心室と主肺動脈(49%)よりも高くなる.下行大動脈の酸素飽和度は,これらの中間(57%)となり,臍帯動静脈間の酸素飽和度の差は28%になる(Fig. 4).
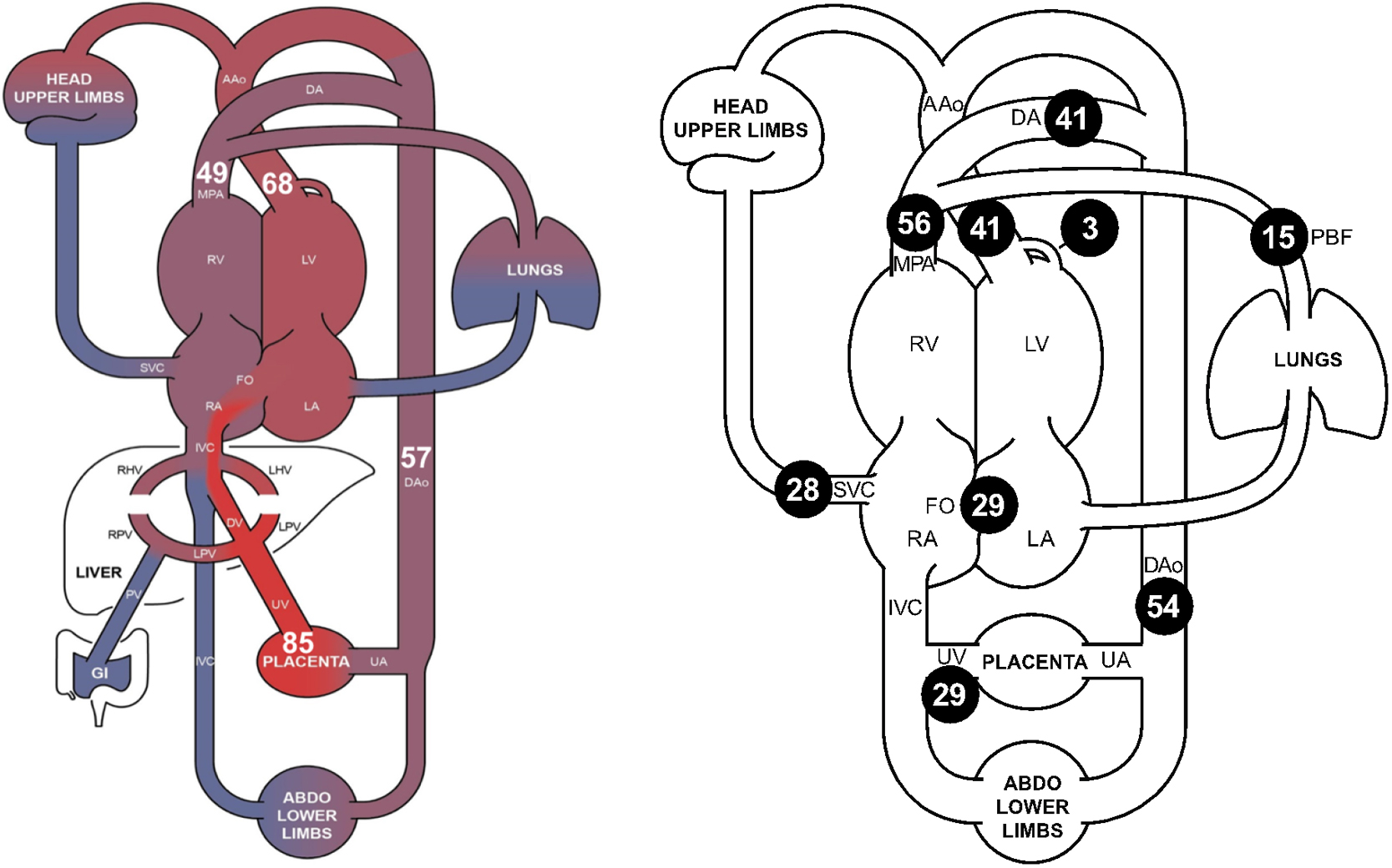
左図の数値は酸素飽和度,右図の数値は両心室の合計心拍出量に対する割合(単位はいずれも%)を表している.
AAo, ascending aorta; DA, ductus arteriosus; DAo, descending aorta; DV, ductus venosus; FO, foramen ovale; GI, gastrointestinal; IVC, inferior vena cava; LA, left atrium; LHV, left hepatic vein; LPV, left portal vein; LV, left ventricle; MPA, main pulmonary artery; PBF, pulmonary blood flow; PV, portal vein; RA, right atrium; RHV, right hepatic vein; RPV, right portal vein; RV, right ventricle; SVC, superior vena cava; UA, umbilical artery; UV, umbilical vein. (Mike Seed教授から提供)
妊娠後期の人胎児における両心室の合計心拍出量(combined ventricular output; CVO)は465 ml/min/kgで,右心室から56%,左心室から44%が駆出されている.人胎児の肺血流は羊胎児よりも多く,CVOの15%を占めている.臍帯血流と卵円孔シャントは,それぞれCVOの29%を占めている.人胎児循環では,臍帯血流(135 ml/min/kg)は羊胎児より少ないものの,ヘマトクリット値(15.5 g/dl)が高いため,酸素供給量(25 ml/min/kg)と酸素消費量(6.8 ml/min/kg)は羊胎児と同程度で,酸素供給が豊富であることが特徴である60).胎児循環は,酸素が豊富な血液が左心室に到達し,代謝の活発な心臓や脳に供給される一方,脱酸素化された血液が右心室から動脈管を通じて体循環から胎盤に戻るという独特のメカニズムを持っている(Fig. 4, Movie 4)65).
胎児CHDにおいて,酸素運搬量の減少と低酸素性脳症が実証されたことから,神経保護戦略として母体高酸素化の可能性が注目されている61).母体の吸入酸素分圧(FiO2)を上げることで,胎児の動脈血酸素分圧(PaO2)および動脈血酸素飽和度(SaO2),特に臍帯静脈のSaO2が上昇することが知られている.
1990年代の複数の無作為化比較試験では,慢性的な母体高酸素化が胎児発育不全の予後改善と関連していることが示唆されている66).
Circular shuntを伴うエプスタイン病では,胎児CMRを用いた研究で,非ステロイド性抗炎症薬の経胎盤投与によって動脈管血流が抑制された後,全身および脳血流の増加が確認された.この症例では,著しく低下した心拍出量および脳血流がMRIで確認され,分娩のタイミングを決定する上で有用であることが示されている(Fig. 5, Table 1, Movie 5)67).

重度の三尖弁逆流により,動脈管→肺動脈→右心室→右心房→卵円孔→左心房→左心室と廻るcircular shuntを形成している(左シェーマ).経胎盤的非ステロイド性抗炎症薬(インドメタシン)投与により動脈管の狭窄を誘発しcircular shuntの軽減が図られた(右シェーマ).(Mike Seed教授から提供)
| Indomethacin | PRE | POST |
|---|---|---|
| Gestational Age (weeks) | 34 | 35 |
| AAo (ml/kg/min) | 299 | 299 |
| SVC (ml/kg/min) | 80 | 128 |
| DAo (ml/kg/min) | 90 | 139 |
| UV (ml/kg/min) | 79 | 93 |
| CVO (ml/kg/min) | 308 | 308 |
| CS (ml/kg/min) | 130 | 32 |
| Cerebral DO2 (ml/kg/min) | 9.5 | 13.1 |
| Cerebral VO2 (ml/kg/min) | 1.8 | 2.6 |
インドメタシン投与後,上大静脈と下行大動脈の順行性血流が増加したことがMRIにて示された.
Circular shunt = {AAo flow – (DAo flow + SVC flow)}/AAo flowにて算出.AAo, ascending aorta; CS, circular shunt; CVO, combined ventricular output; DAo, descending aorta; DO2, 酸素運搬量;SVC, superior vena cava; UV, umbilical vein; VO2, 酸素消費量.(Mike Seed教授から提供改変)
また,大血管転位症(transposition of the great arteries; TGA)の胎児にとって,心房中隔の開存が重要な予後因子であることが明らかになっている68).心房中隔欠損が狭小化したTGAでは,出生後に重度の低酸素血症を引き起こす可能性があるため,妊娠後期にバルーン拡大による心房中隔裂開術を行い,胎児循環から新生児循環へのより安定した移行を目指す方法が報告されている(Fig. 6)69).

黄色矢印は狭小化した心房中隔内に挿入されたバルーンを示している(左上シェーマCの状態).右のシェーマは,子宮内心房中隔裂開術前後での酸素飽和度と血流分布である.酸素飽和度はスケールのように色分けされ,数値は両心室の合計心拍出量に対する割合(単位は%)を表している.AAo, ascending aorta; DA, ductus arteriosus; DAo, descending aorta; DV, ductus venosus; GI, gastrointestinal; IVC, inferior vena cava; LA, left atrium; LV, left ventricle; MPA, main pulmonary artery; PBF, pulmonary blood flow; RA, right atrium; RV, right ventricle; SVC, superior vena cava; UA, umbilical artery; UV, umbilical vein. (Mike Seed教授から提供)
胎児CMRは,将来性のある技術として大きな期待が寄せられているが,その実用化には重大な課題が存在する.最も顕著な問題は,現在のところ妊娠後期でのみ有用である点である.このことは,胎児CHDにおける重要な治療方針決定は,多くの場合妊娠中期になされるため,臨床現場のニーズと合致していない.
また,現在の胎児CMR技術は,胎児の体動によるアーチファクトという深刻な技術的課題に直面している.画質の向上のために様々な技術的進歩が遂げられてきたが,依然として複雑な後処理が必要である.この後処理にはコンピュータサイエンスの専門知識が必要であり,手動での分析作業も伴うため,多大な時間と費用が必要となっている.これらの課題を克服するためには,後処理を自動化し,効率的に実行できるシステムの開発が不可欠であり,そのためには,MRIメーカーとの緊密な連携が重要である.さらに,日本において胎児CMRを普及させていくためには,撮影技術の標準化,専門家の育成,検査費用の削減,そして臨床研究の推進が必要である.
これらの問題点が解決されれば,胎児CMRは日本の胎児医療の質を飛躍的に向上させるだけでなく,胎児発育研究の更なる発展にも大きく貢献することが期待される.
胎児CMRは,胎児の心臓の形態や機能を詳細に評価できる革新的な画像診断法である.当初,様々な技術的な課題に直面していたが,撮像の高速化と胎児の動き補正の二つの重要な技術の導入によって大きく進歩した.
これらの技術的進歩により,従来の心エコー検査では十分な情報が得られなかった症例でも,心臓の解剖学的構造を詳細に観察できるようになった.また,先天異常が胎児の成長や発達に与える影響についても,新たな知見が得られている.
特に,高度な周産期管理が必要な症例において,胎児CMRは重要な診断ツールとして期待されている.
日本小児放射線学会の定める利益相反に関する開示事項はありません.
本稿執筆にあたり,貴重な画像をご提供いただいたThe Hospital for Sick ChildrenのMike Seed教授には心より感謝申し上げます.また,内容についてご校閲をいただいた榊原記念病院の吉敷香菜子先生と水野直和先生には深く感謝いたします.