2020 Volume 29 Issue 1 Pages 87-91
2020 Volume 29 Issue 1 Pages 87-91
COPD患者は労作時の息切れを避けるために身体活動性が低下しており,活動制限は全身併存症の増加や死亡リスクと関連する.症状の改善や増悪抑制のために中心となるのは気管支拡張薬である.本邦のガイドラインでは,症状や増悪の程度を考慮しながら,LAMAやLABAを単剤もしくは併用で用いることが推奨されている.心不全はCOPDと高率に合併するが,興味深いことに気管支拡張薬による肺過膨張の減少が肺血流動態を改善し,左室の一回拍出量を増加させることが報告されている.COPDに喘息病態を合併する場合には吸入ステロイド薬の併用が増悪の抑制に有用である.さらに,慢性気管支炎に対するマクロライド薬や,心不全が合併する場合のβ遮断薬は増悪のリスクを抑制する.今後は,気管支拡張薬や運動療法に加え,できるだけ早期に治療可能な臨床特性を個別に評価し,COPDと合併病態を並列に治療介入する戦略が重要と考える.
慢性閉塞性肺疾患(COPD)はタバコ煙を主とする有害物質を長期に吸入曝露することなどにより生ずる肺疾患であり,呼吸機能検査で閉塞性換気障害を示す1).末梢気道病変と気腫性病変が関与する気流閉塞により呼気の気流制限があるCOPDでは安静時でも静的な肺過膨張により横隔膜の可動域が制限されている.活動時は酸素消費量の増加に対応するため呼吸回数が増加するが,呼出に時間を要するCOPDでは十分な呼出を終える前に次の吸気が始まるため,肺内にとらえ込む(エア・トラッピング)空気の量(残気量)が増加していく.やがて,酸素を吸いたくても,吐ききれないため息が吸えない状態となり活動を休止してしまう.この動的肺過膨張はCOPDに特徴的な労作時息切れの重要な原因である.
COPDには「息切れの悪循環」が存在する2).気流閉塞や肺過膨張による労作時の息切れを自覚しているCOPD患者は,息切れを避けるために日常活動を制限する.この身体活動性の低下により骨格筋廃用が進み,息切れ症状はさらに悪化していく.また心血管疾患,糖尿病,ガン,不安・うつ病など全身性の合併疾患が増加し,生命予後は悪化する(図1).実際,1万人の一般住民を対象とした17年間の前向き観察研究では,COPDに特徴的な病態である気流閉塞の進行が心不全,脳卒中の発症および全死亡のリスクを有意に上昇させることが報告された3).興味深い点は,既知の危険因子である年齢,性別,BMI,喫煙歴,LDLコレステロール,高血圧,糖尿病などで補正しても,急速な気流閉塞の進行が心不全発症や全死亡における独立したリスク因子であることが明らかにされた点である3).また,最近ではCOPDと心不全を合併する患者において,気管支拡張薬による肺過膨張の改善が左室1回拍出量の増加と関連することが報告され注目されている4,5).ガドリニウム増強MRIにより気管支拡張薬の投与前後における肺微少血管血流と肺局所換気量を計測することで,左室拍出量が増加する機序が検討された.気管支拡張薬による肺換気量の改善は肺微小血管の血流量増加と関連することが示され,COPDではエア・トラッピングによる微小血管の圧排狭窄や低酸素性の血管攣縮によって肺循環が障害されており,気管支拡張薬で気流閉塞を改善することで肺静脈から還流する血流量が回復する可能性があることが示された5).

COPD患者における息切れの悪循環
COPDでは呼吸機能が低下するだけではなく,廃用や活動制限が進展するため全身性の合併疾患が増加し,生命予後が悪化する
近年,COPD患者の息切れ症状は多因子にて構成されていることが明らかにされつつある6).気流閉塞,肺過膨張,増悪歴などCOPDに関連する因子に加え,不安,抑うつ,栄養障害などがその説明変数になり得ることが報告されている6).COPD患者の息切れによる活動制限と不安症は有意に関連することが知られており7),実際,身体活動性が高いCOPD患者ではうつ・不安の併存リスクが低いことが報告されている8).これらの知見からCOPD患者の息切れや活動制限には,疾患に特徴的な気流閉塞に加えて,不安・うつによる換気効率の低下(頻呼吸,浅呼吸など)や廃用進行による換気需要の亢進(胸郭コンプライアンス低下など)による肺過膨張や呼吸仕事量の増加が大きく影響していると考えられる(図2).

COPDにおける息切れと活動制限の病態生理
国民の健康寿命を伸ばしていくための取り組みとして2012年より開始された健康日本21(第二次)では,ガン,心血管疾患,糖尿病と並ぶ主要取組疾患としてCOPDが選定された.これらの疾患は共通する生活習慣や加齢を背景に合併率が高いだけでなく,先述したように相互の病態生理における関連性も重要であることが明らかにされてきた.2022年におけるCOPDの達成目標は国民認知度を80%まで向上させることであるが,最近の調査でも30%に到達していない.「COPDは早期診断し適切な教育と治療を行えば,健康寿命が延伸し,生命予後も改善する疾患」であることを社会に啓発していくことは極めて重要である.
2018年に日本呼吸器学会のCOPDガイドラインは第5版に改訂され,従来の流れを引き継ぎながら管理目標や薬物療法の戦略についても新たな知見が反映された1).COPDの管理目標は,現状の改善として①症状およびQOLの改善,②運動耐容能と身体活動性の向上および維持,さらに将来リスクの低減として③増悪の予防,④全身併存症および肺合併症の予防・診断・治療,が掲げられた(表1).これらの管理目標が達成されれば,COPDの疾患進行(呼吸機能低下)の抑制や生命予後の改善につながることが期待される.
| 1. 現状の改善 ① 症状およびQOLの改善 ② 運動耐容能と身体活動性の向上および維持 2. 将来のリスクの低減 ③ 増悪の予防 ④ 全身併存症および肺合併症の予防・診断・治療 |
図3に安定期COPD管理指針を示す.COPDの最大の危険因子は喫煙であり,多くのCOPDは禁煙によって予防が可能である1).禁煙はCOPDの疾患進行を抑制する最も効果的で経済的な方法であり,増悪リスクや死亡率を減少させる.受動喫煙もCOPDの危険因子であり,その回避を指導するべきである.
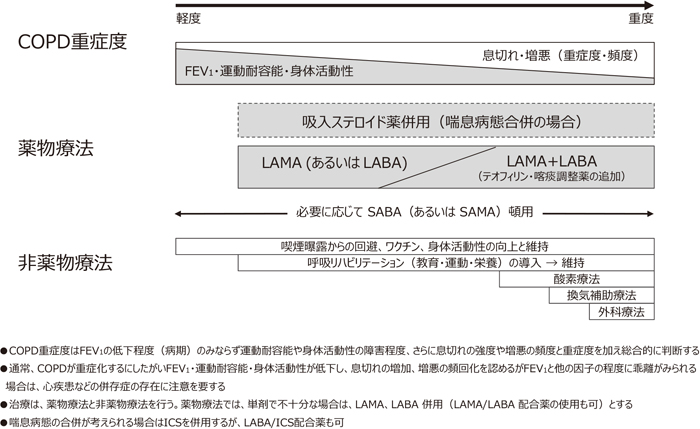
安定期COPDの管理指針(日本呼吸器学会COPDガイドライン第5版)
気管支拡張薬はCOPD薬物治療の中心であり,先述した管理目標の全てに有効性を示すエビデンスがある.気管支平滑筋弛緩作用により気道抵抗の低下や肺過膨張の改善が得られ,運動耐容能が向上する.気管支拡張薬には抗コリン薬,β2刺激薬,メチルキサンチンの3系統がある.患者の呼吸機能に加え,症状や増悪頻度を考慮しながら単剤もしくは多剤の併用を行う1).ごく軽度のCOPDでは症状の軽減を目的として,運動などの必要時に短時間作用性気管支拡張薬の使用が推奨される.SABA(short-acting beta2-agonist)の吸入が選択されることが多い.一方,軽度以上のCOPDでは,症状の改善に加えQOL,運動耐容能や身体活動性の向上および維持が重要な目標となり長時間作用性気管支拡張薬の定期使用が推奨される1).本邦では,LAMA(long-acting muscarinic antagonist)およびLABA(long-acting beta2 agonist)が単剤もしくは併用で使用されることが多い.
COPDに喘息が合併する症例(asthma and COPD overlap: ACO)が15~20%程度見込まれることから注意が必要である.喫煙歴や,呼吸機能検査,画像検査などからCOPDと診断されていても,喘息の合併を疑い問診や検査を行うべきである1).COPD患者の症状や重症度だけで喘息の合併を判別することは必ずしも容易でなく,日本呼吸器学会からACOの診断基準が発表され,COPDの特徴と喘息の特徴を診断する際のチェック項目が示されている(表2)9).この基準は現在の診療実態を考慮し,症状や病歴など一般診療で簡単に評価可能な指標と本邦で臨床応用が進んでいる炎症バイオマーカーを組み合わせて作成されている.喘息病態合併の診断には,喘息やアレルギー性鼻炎の既往に加え,呼気NO濃度測定,血中IgEおよび好酸球値,気道可逆性検査などが有用である9,10).図3に示すように,本邦では喘息病態を合併するCOPD患者において気管支拡張薬に加え吸入ステロイド薬(inhaled corticosteroids: ICS)を使用することが推奨されている1,9).COPDではICSの使用が肺炎の発症リスクと関連し,特に,アジア人患者に特徴的な高齢,男性,BMI低値の患者ではリスクが高くなることが報告されている11).喘息病態合併の根拠があるCOPD患者を対象にICSを使用することは有効性と安全性の両面からステロイド薬の適正使用に繋がると考えられる.
| 基本的事項 | |
| 40歳以上、咳・痰・息切れなどの呼吸器症状、胸部X線による他疾患除外 慢性気流閉塞(気管支拡張薬吸入後の1秒率<70%) | |
| COPDの特徴 1,2,3の1項目 | 喘息の特徴 1,2,3の2項目あるいは 1,2,3の1項目と4の2項目以上 |
| 1. 10pack-years以上の喫煙歴あるいは同程度の大気汚染暴露 2. CTで気腫性変化を示す低吸収域 3. 肺拡散能障害(%DLco/VA<80%) | 1. 変動性(日内、日々、季節)あるいは発作性の呼吸器症状(咳、痰、呼吸困難) 2. 40歳以前の喘息の既往 3. 呼気NO濃度>35ppb 4-1)通年性アレルギー性鼻炎の合併 -2)有意な気道可逆性 -3)末梢血好酸球>5%あるいは>300/μL -4)IgE高値あるいは特異的IgE陽性 |
*COPDの特徴のみあてはまる場合はCOPD、喘息の特徴のみあてはまる場合は喘息(リモデリングのある)と診断する
*ACOを診断する際に、喘息の特徴を確定できない場合、喘息の特徴の有無について経過を追って観察することが重要である
国際的なCOPD管理指針のGOLD(Global Initiative for Chronic Obstructive Lung Disease)レポートでは,症状と増悪の程度によりCOPD患者を層別化し治療薬を選択することが推奨されている12).しかし,症状や増悪の状況は背景にある患者の病態を反映するわけではない.安定期管理においては,COPD患者に通常認められる病態である息切れ,増悪,活動制限,呼吸不全などの程度に応じ,気管支拡張薬,運動療法,ワクチン,酸素療法などを組み合わせた治療を行う.一方,喘息,慢性気管支炎,気管支拡張症などの肺合併症や心血管疾患,不安症,うつ病などの全身併存症は個別の患者に特異的な病態である.先述したように,ICSは発作性の呼吸器症状や呼気NO濃度,血中好酸球の上昇などの喘息病態を合併する患者に効果的である1,9).また慢性に咳・痰が持続するCOPD患者ではマクロライド薬の有用性が報告されている13).心不全を合併するCOPD患者ではβ1選択性β遮断薬の併用により急性心不全やCOPD増悪が抑制される14).今後は,気管支拡張薬や運動療法に加えて,できるだけ早期に患者個別の治療可能な臨床特性(treatable traits)を評価し,COPDと合併病態を並列に治療介入する戦略が重要と考えられる(図4)15).実臨床で評価が可能な臨床特性に基づいて個々の患者の病態をより包括的に管理することにより,COPD治療は層別化から個別化に向けてのパラダイムシフトを迎えることが期待される.

COPDと合併疾患を並列に介入する新たな治療アルゴリズム
松永和人;講演料(アストラゼネカ,グラクソ・スミスクライン,サノフィ,ノバルティス ファーマ,ベーリンガーインゲルハイム,Meiji Seika ファルマ,杏林製薬).