2022 Volume 31 Issue 1 Pages 58-63
2022 Volume 31 Issue 1 Pages 58-63
慢性閉塞性肺疾患(COPD)患者では,高齢者ほどサルコペニア併存頻度が高く,COPDに合併したサルコペニアに対する栄養治療は重要である.
COPDに合併したサルコペニアに対する栄養治療は確立されていないが、①蛋白合成促進を促す,ア)必須アミノ酸の投与 イ)β-ヒドロキシ-β-メチル酪酸(3-Hydroxy 3-Methylbutyrate: HMB)の投与 ② 蛋白分解抑制を促す,ア)ホエイ蛋白の投与 イ)ω-3脂肪酸の投与 ③蛋白合成促進と蛋白分解抑制を促す,ア)グレリン投与のトライアルなどが既存の報告から,期待される治療と考える.
COPDに合併したサルコペニアでは,筋肉量の減少に加えて骨量低下の合併や,嚥下障害の併発による栄養摂取困難にも留意する必要がある.
COPDに合併したサルコペニアに対する栄養治療のエビデンスは少なく,予後・QOLの改善のため今後の更なる研究が望まれる.
慢性閉塞性肺疾患(COPD)患者では,高齢者ほどサルコペニア併存頻度が高い.筋量と筋力の低下は,身体活動性低下を介してCOPD患者の予後を左右する可能性があり,高齢COPD患者において,サルコペニアに対する栄養治療を確立することは重要であると考える.
高齢COPD患者にサルコペニアが多い原因としては,加齢による一次性サルコペニアとCOPD特有の全身性炎症などに伴う疾患関連性の二次性サルコペニアが合併していることによると考えられるが,残念ながら栄養治療に関してのエビデンスは少なく,確固たる治療法がないのが実情である.
そこで今回は,COPDに合併したサルコペニアに対して,蛋白分解抑制・蛋白合成促進の観点と抗炎症効果の観点から治療選択を考え,それぞれのトライアルを示しながら栄養治療戦略を提示していきたい.
サルコペニアとは,筋量と筋力の進行性かつ全身性の低下に特徴づけられる症候群で,身体機能障害,QOL低下,死のリスクを伴うものとEWGSOP(The European Working Group on Sarcopenia in Older People)が提唱した疾患群である1).一次性サルコペニアと二次性サルコペニアに分類され,一次性サルコペニアは加齢によるもの,二次性は①活動関連性(寝たきり・無重力等)②疾患関連性(重症臓器不全・炎症性疾患・悪性腫瘍など)③栄養関連性(吸収不良・消化器疾患等による摂取エネルギーや蛋白質の減少など)に分類されている.
サルコペニアの診断は,我が国においてはAWGS(Asian Working Group for Sarcopenia)の診断基準の使用が推奨されている2)(図1).2019年に診断基準が改訂されており,筋肉量を正確に測定できない診療所などでも,拾い上げがしやすいようになっている(図2).

サルコペニア診断手順(AWGS)
握力の低下 かつ 骨格筋量の低下 あるいは,身体機能の低下 かつ 骨格筋量の低下をみとめたら,サルコペニアと診断する.
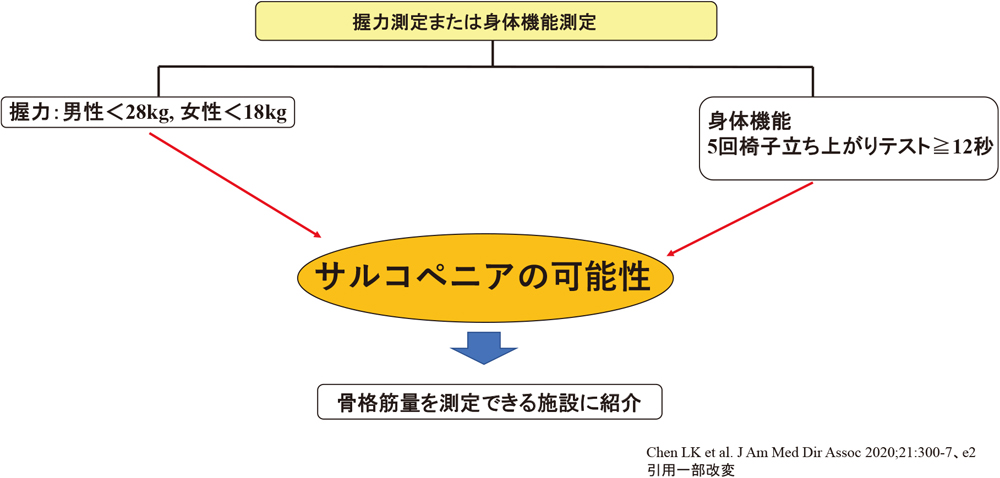
サルコペニア簡易診断手順(AWGS)
握力:男性<28 kg,女性<18 kg または,身体機能:5回椅子立ち上がりテスト≧12秒であれば,サルコペニア可能性がありと診断して,骨格筋量を測定できる施設に紹介を考慮する.
COPDは,タバコ煙を主とする有害物質を長期に吸入曝露することなどにより生じる肺疾患で,呼吸機能検査において気流閉塞を認め,1秒率70%未満のものと定義されている.COPDでは肺のみならず,併存症が多く存在しており,COPD診断と治療のためのガイドライン2018でも,栄養障害,骨格筋障害(サルコペニア),心・血管疾患(高血圧・心筋梗塞・狭心症・脳血管障害),骨粗鬆症,精神疾患(不安・抑うつ),代謝性疾患(糖尿病),消化器疾患(胃潰瘍・GERD),睡眠時無呼吸症候群が記載されている3).その理由の一つして,COPD患者では安定期においても,血液中に炎症性メディエーターであるTumor Necrosis Factor-α(TNF-α)やInterleukin-6(IL-6)の増加や,C-反応性蛋白(CRP)が増加していることが示されており,COPDに存在する全身性炎症が示唆されている.Byunらの報告では4),TNF-αが増加すると握力の低下と筋量の低下が示されており,二次性の疾患関連性サルコペニアとCOPDの全身性炎症との関連が示唆されている.
また,Jonesら5)の報告によると,外来COPD患者622人において14.5%にサルコペニアの合併を認め,高齢・高度の気流障害認めるほど頻度が高くなることが示されている.高齢COPDでは,一次性サルコペニアが存在しており,COPDの全身性炎症による二次性サルコペニアを併発することで,合併頻度が増加するものと推察される.
COPDに合併したサルコペニアでは身体活動性が低下することも報告されており,身体活動性低下はCOPD全死亡の最大の危険因子であることから,高齢COPDにおいては,サルコペニアを早期に診断し,サルコペニアに対する治療介入を開始していくことが必要であると考える.
COPDに合併したサルコペニアに対するエビデンスは少ない.2017年度サルコペニア診療ガイドライン6)でも,「アミノ酸補充療法が身体機能の改善に有効である.」(エビデンスレベル;非常に低,推奨レベル;弱)となっており,まだまだ未知の部分が多い.
そこで,COPDに合併したサルコペニアに対して,アミノ酸補充療法含め,可能性のある治療戦略を考えていきたい.図3に治療戦略の模式図を示す.

COPDに合併したサルコペニアに対する栄養学的介入
ロイシン・HMBを含む必須アミノ酸,ホエイ蛋白,ω-3脂肪酸,グレリンによる蛋白合成促進と抗炎症効果による蛋白分解抑制により,COPD患者の筋肥大を促し,サルコペニアを改善させる可能性がある.
2010年にサルコペニアの定義がEWGSOPから発表された同年に発表された論文で,COPDに合併したサルコペニア患者で予測1秒率50%以下の重度の気流障害をともなった32名を対象に,必須アミノ酸 4 gを1日2回投与することで,プラセボ群と比較して,12週で除脂肪量と体重が,それぞれ 3.6 kgと 6.0 kgと有意に増加したことが示されている7).小規模の試験ながら,数少ないCOPDに合併したサルコペニアで検討された論文であり,貴重なデータと考える.またこの論文では,1日の歩数が12週後に,アミノ酸投与群がプラセボ群と比較して有意に増加しており,アミノ酸投与により活動性も高まる可能性が示唆されており,予後にも良い影響を与えるかもしれない.
イ) HMB(3-Hydroxy 3-Methylbutyrate; β-ヒドロキシ-β-メチル酪酸)の投与HMBは,必須アミノ酸であるロイシンの代謝中間体のひとつである.HMBは,mammalian target of rapamycin(m-TOR)経路を活性化させることを通じて筋タンパク質の合成促進を誘導する一方で,ユビキチン-プロテアソーム経路とカスパーゼ活性を抑制することで,筋タンパク質の分解抑制を誘導していると考えられる.ロイシンの5~10%のみがHMBに代謝されるためmTORの刺激には多くのロイシンが必要となる.そのため,効率的にmTORを刺激するにはHMB自体の投与が有用と考えられる.
COPD患者が約35%程度含まれた入院患者の検討で,HMB投与群と非投与群を比較したところ,退院後の生存率と90日後の再入院率を合わせたプライマリーエンドポイントでは有意差がでなかったものの,退院後の生存率ではHMB投与群が有意に改善していた.HMB投与群では体重が統計学的な有意差はないものの増加傾向を示しており,栄養状態の改善が生存率の改善に寄与した可能性がある8)(図4,5).

HMB 含有高蛋白栄養剤の効果
A;90日後死亡率が,プラセボ群9.7%HMB投与群4.8%で有意に死亡率が低下している.
B;カプランマイヤー生存曲線でもHMB投与群が有意に死亡率を抑制しているのを示している.

HMB 含有高蛋白栄養剤の効果
90日後有意差はないものの,プラセボ群と比較してHMB投与群では体重増加傾向を認めている.
COPDでは全身性炎症を併存しており,抗炎症治療により筋量・筋力の回復が期待される.
ア) ホエイ蛋白の投与ホエイ蛋白はカゼインと比較し,消化吸収に優れ,分岐鎖アミノ酸含有率が高く,抗酸化作用と抗炎症効果を有するといわれている.平均年齢74歳の31名の脳梗塞患者での検討で,ホエイ蛋白を投与するとIL-6が有意に低下し,抗酸化物質であるグルタチオンの有意な増加が示されており,ホエイ蛋白の抗炎症効果と抗酸化作用が示されている9).
Sugawaraらの研究によると10),平均年齢77.2歳の高齢COPD患者を対象に,ホエイ蛋白を含んだ栄養補助療法と運動療法を併用した結果,3か月後に有意な体重増加,IL-6やTNF-αなどの炎症性サイトカインの減少,6分間歩行距離の改善を認めており,栄養状態の改善と運動能耐容能の改善が示されている.
イ) ω-3脂肪酸の投与ω-3脂肪酸は転写因子であるNuclear factor kappa B(NF-κB)を制御することで,炎症性サイトカインの産生を抑制する.プロスタグランジンE2やトロンボキサンA2などのエイコサノイドの産生抑制作用もみられる.
Sugawaraらの研究によると11),平均年齢77.3歳の高齢COPD患者群にω-3脂肪酸を含んだ栄養補助療法と運動療法を併用し,3か月後に有意な高感度CRPやIL-6などの炎症性マーカーの低下を認め,吸気筋力の増加や6分間歩行距離の改善が示されている.
③ 蛋白合成促進と抗炎症治療による蛋白分解抑制を促す戦略 ア) グレリンの投与グレリンは,成長ホルモン分泌促進因子受容体の内因性リガンドとして胃組織より発見された成長ホルモン分泌因子で,成長ホルモン分泌による作用として,蛋白同化作用があり,蛋白合成が促進される.またグレリン単独の作用として,抗炎症効果があり,それに加えて摂食促進作用も期待されている(図6).

Ghrelin(グレリン)の生理活性
グレリンは,成長ホルモン分泌促進因子受容体(GHS-R)の内因性リガンドとして胃組織より発見された成長ホルモン分泌因子.成長ホルモン分泌促進を介する作用として,蛋白同化作用があり,蛋白合成が促進される.グレリンによる直接作用として,抗炎症効果や摂食促進作用がある.
COPDを含めた慢性呼吸器疾患患者で検討された結果では,朝9~12時の間にオクタン酸を含む栄養補助療法を行うと,夕食前のアシルグレリン濃度が上昇することが示されている12).このことから,62~78歳の19名の慢性呼吸器疾患患者に2週間オクタン酸を含む栄養補助療法を行ったところ,visual analog scale を用いたAppetite scoreとbody mass index(BMI)の改善をみとめ,グレリンによる作用が影響した可能性が示唆されている.
COPDにおいて,栄養療法のみでは効果は限定的であり,運動療法との併用が,栄養状態や身体機能を改善する可能性があると,European Society for Clinical Nutrition and Metabolism(ESPEN)のステートメントが推奨している13).
ただ,サルコぺニアにおいては,運動強度が強ければ,全身性炎症を増強し異化作用に働くことが懸念される.運動時に骨格筋からミオカインとよばれる様々なサイトカインが産生されるが,その一つであるIL-6も上昇が認められ,全身性炎症を助長する可能性がある.特に,COPDに合併したサルコペニア患者では,運動により炎症性サイトカインであるIL-6の上昇が高度であることが示されている14).逆に,運動後には抗炎症性サイトカインであるIL-1 receptor antagonistやIL-10の上昇みとめており,継続的なリハビリにより,運動に伴うIL-6の上昇が抑制されると考えられている15).COPD患者においても歩行を主体とした身体活動性の向上が全身性炎症の抑制に有効であることが報告されているが16),具体的にどの程度の強度の運動療法が栄養療法との併用に最適かは結論がでていない.
COPDに合併したサルコペニアにおける骨粗鬆症併存の割合は22.0%,その前段階である骨量減少群は68.3%に認められるとの報告があり17),その併存には注意が必要である.しかし,COPDに関連した骨粗鬆症に対するエビデンスレベルの高い治療戦略は確立されておらず,原発性骨粗鬆症治療に準じた治療を行っているのが実状である.COPDの骨粗鬆症の発症関連因子を検討した報告18)では,3年後に骨粗鬆症になるリスクファクターとしてビタミンD低値が示されており,ビタミンDの補充がCOPDサルコペニアにおいても骨密度低下予防に有効かもしれない.
COPDにおける誤嚥のメカニズムは,呼吸状態の問題も当然あるが,サルコペニアが原因となる摂食嚥下障害が,日本摂食嚥下リハビリテーション学会,日本サルコペニア・フレイル学会,日本リハビリテーション栄養学会,日本嚥下医学会の4学会が共同で作成されたポジションペーパーで2019年に報告されており19),COPDに合併したサルコペニアでは,頻度が増加する可能性を考えないといけない.また,嚥下障害とCOPD増悪の関連が示唆されており20),嚥下機能評価と食事形態などの工夫が必要と考える.
高齢COPD患者においては,サルコペニアの合併を見逃してはいけない.サルコペニア合併を認めた場合は,積極的に栄養療法と運動療法を考慮する.有効性が期待できる様々な栄養療法があるが,エビデンスレベルが高いものはなく,今後の検討課題である.
室 繁郎;講演料(アストラゼネカ,日本ベーリンガーインゲルハイム,ノバルティスファーマ),研究費・助成金(ロート製薬,近鉄ケーブルネットワーク)