2016 Volume 58 Issue 4 Pages 236-253
2016 Volume 58 Issue 4 Pages 236-253
Brånemarkらによって確立された口腔インプラント治療は,歯周補綴あるいは包括的歯周治療において予知性の高い選択肢として定着している。歯周炎によって歯を失った患者に対して欠損補綴を行う場合,自立型の補綴装置であるインプラント義歯は残存歯の咬合負担を軽減出来るため,隣接する歯周炎罹患歯の延命にも寄与できる。米国歯周病学会会員の7割以上が学会名(The American Academy of Periodontology)に「Dental Implantology」を追加することに賛同していることからも,歯周炎患者におけるインプラント治療は不可欠の治療オプションといえる。
一方,口腔インプラント治療の普及に伴い,インプラント治療の短期的および長期的な失敗が報告されるようになった。インプラント周囲疾患の発症頻度が4割を超え,インプラント治療の合併症と認識されるにつれ,インプラント周囲疾患に関する基礎的および臨床研究が増加している。歯周炎の既往はインプラント周囲炎のリスクファクターであるという疫学研究が報告されているが,歯周炎患者におけるインプラント周囲炎の病態と治療法のコンセンサスを得るには至っていない。
本小論では,インプラント周囲炎を歯周炎と同様に複雑系として捉え,インプラント周囲炎の進行モデル,インプラント周囲炎の定義と分類,検査方法,疫学,各種リスク因子および治療と予防に関する現時点の知識を整理する。
Brånemarkらによって無歯顎患者に対する口腔インプラント治療の有効性が報告1)されてから40年以上が経過した。光学顕微鏡下で骨とインプラント間に軟組織が介在しない状態をBrånemarkが「osseointegration」という造語で説明して以来1,2),この名称は現在に至るまで世界中で使用されている。一方,osseointegrationのメカニズム解明はまだ不十分である。
1980年代にはインプラント治療の失敗の原因は術者のミスかオーバーロードと考えられる程度であり,インプラント周囲炎の存在が取り上げられることはなかった。しかし,インプラント周囲炎に関する臨床研究が増えるにつれ,インプラント治療の失敗や問題点を科学する機運が高まった。とりわけ,1990年頃からのevidence-based medicine(EBM;科学的根拠に基づく医療)の広がり(図1)に伴って,インプラント治療に関する臨床研究とsystematic review(SR)が数多く報告されている。インプラント治療を実施すれば95%程度の「生存率」が得られているが,「成功率」に関しては報告間のばらつきが大きい。現時点では,成功率の定義や基準が統一されておらず,被験者の歯周疾患罹患状況に関する情報も少なく,歯周炎患者のインプラント治療に関するエビデンスは十分ではない。
科学は「実験」と「観察」から成り立つ。倫理的問題から人間を使った臨床研究には制限があるため,人間(患者)を治療した経過を観察して集めたデータを解析することが多い(図2)。ランダム化対照試験が望ましいが,横断研究,患者対照研究および後ろ向きコホート研究が多い。臨床研究は患者ごとの観察結果に基づいてデータを集め,仮説の検証あるいは反証を繰り返しながら発展している(図3)。インプラント周囲炎の病態および治療に関する研究は,現在進行形で進んでいる感が強い。
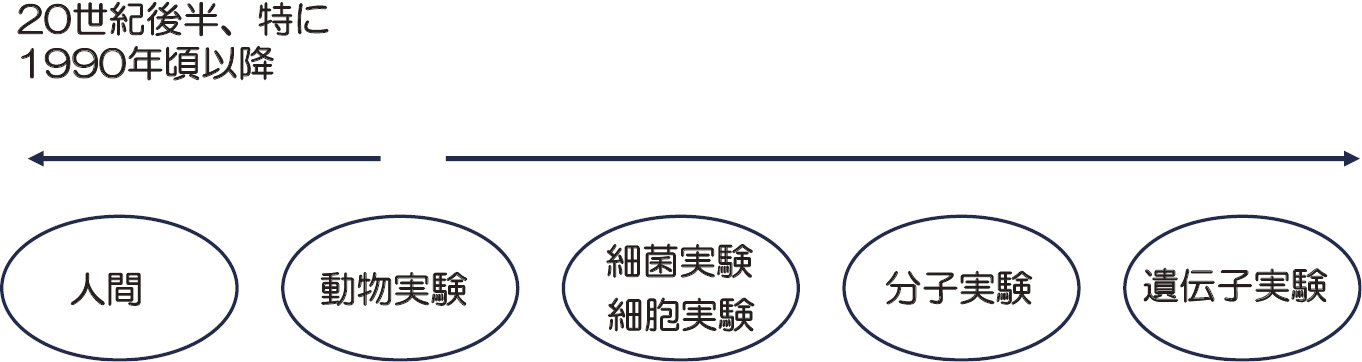
研究対象の広がりと発展
19世紀の生理学者ベルナールや細菌学者コッホら以降,実験医学は右の方向,すなわち要素還元主義に沿ってミクロへと向かった。現在は,細胞,分子および遺伝子レベルの研究が行われている。一方,20世紀の疫学は左の方向,すなわち人間の方向へと研究対象が広がっていった。とくに,1990年以降EBMの広がりに伴い臨床研究が増えた。歯周病学やインプラント治療学においても,細菌学,病理学,細胞および分子生物学的手法を取り入れた研究および動物実験が行われている。一方,人間を対象とした臨床研究も数多く発表されている。(文献3)より引用)
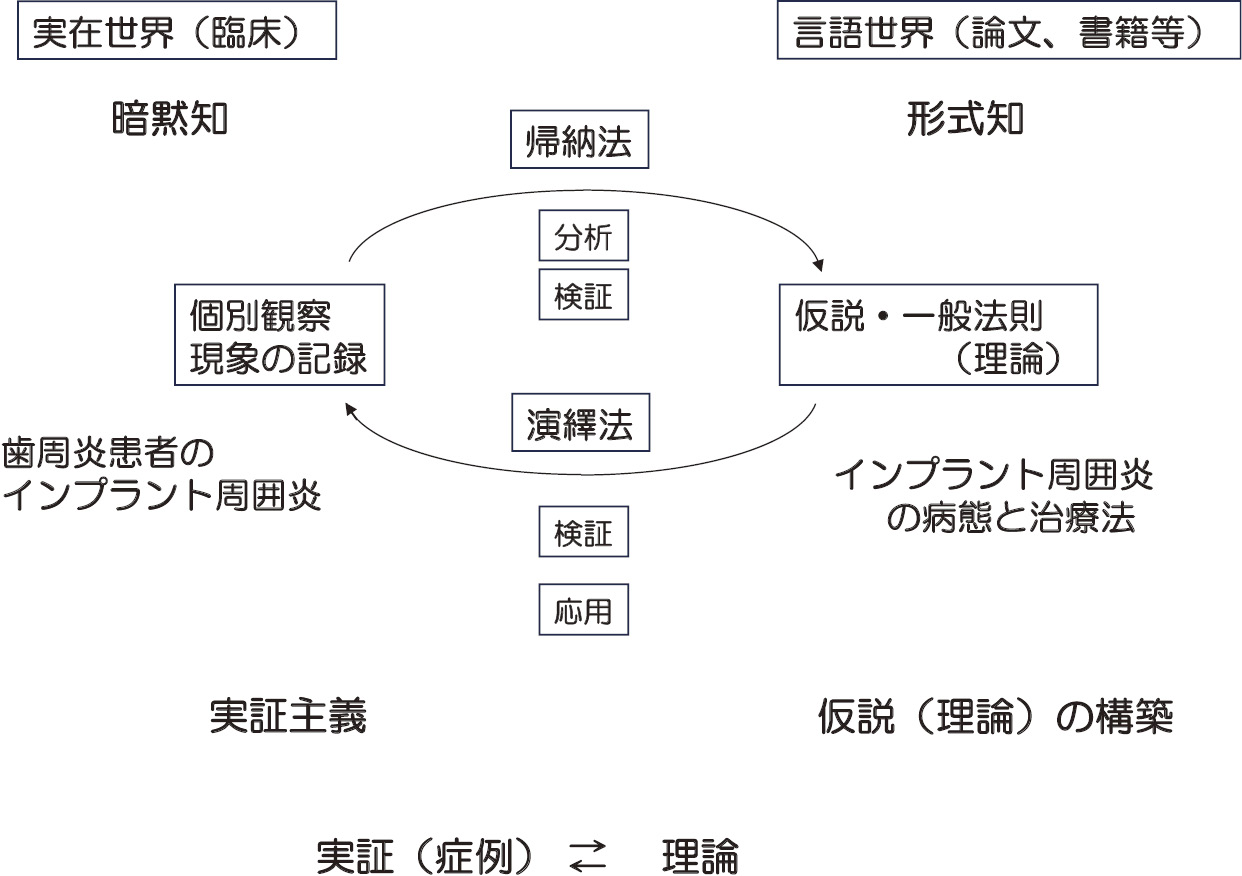
科学の営みの概念図
歯科医師は個々の患者を治療している時には図の左側(実在世界)にいるが,科学的であるためには常に図の右側(言語世界)を意識する必要がある。歯科臨床における個別観察の方法は,口腔内写真,エックス線写真,CT,歯周検査および模型検査であろう。臨床の暗黙知を形式知へ転換することがインプラント周囲炎を科学することに繋がる。
帰納法(臨床経験,たとえば個々の症例から得られる知見)によって集積したデータに基づいて仮説が作られ,演繹法により一般法則(理論)が形成され,個々の症例に照らし合わせながら,矛盾のない理論の構築へと改善が繰り返される。インプラント周囲炎の科学についても同様の過程を進行中である。
臨床家は臨床における実証を重んじ,大学人は仮説(理論)の構築に熱心な傾向はあるものの,実証(個々の症例)主義と仮説(理論)構築は双方向的に進むものである。(文献3)を一部改変)
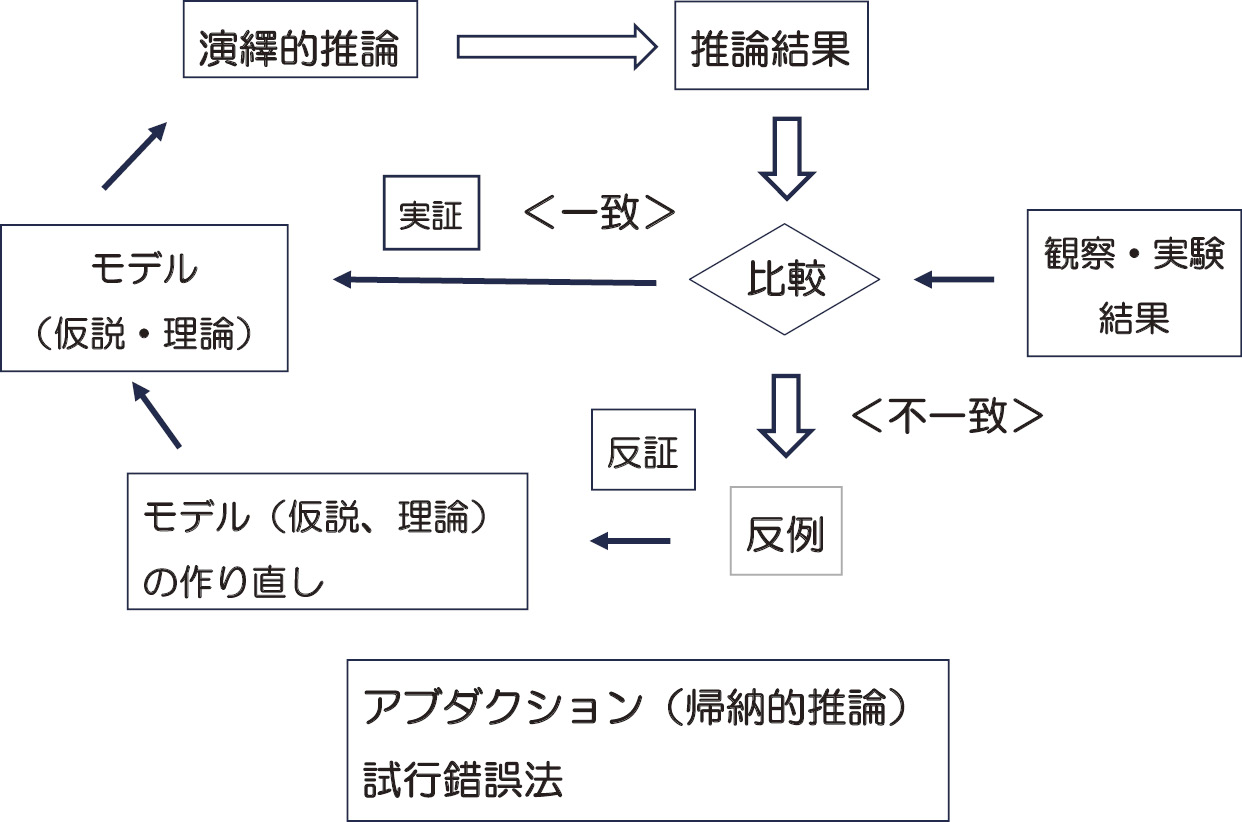
モデル検証法
疾患の検査や治療法の開発に際し,我々はある一定のモデルを作り,検証を繰り返す。したがって,モデル検証法はそれへの反例が見つかるまで偽りでないことを示しているにすぎず,作られたモデルが正しいことを保証しない。一度構築された定義は反証によって変わり得る。カール・ポパーはモデル検証法の本質は「反証可能性」にあるとした。すなわち,反証可能性が科学であることの証明といえる。(文献4)を一部改変)
アブダクション(帰納的推論)は基本的には試行錯誤法であり,演繹的推論のような一直線の論理的な方法は存在しないため,臨床経験や臨床データに基づいて試行錯誤を繰り返しながらより良いモデルが構築される。治療や経過観察が長期におよぶインプラント周囲炎の治療ではモデル検証に時間がかかる。
歯周炎のような多因子性の慢性疾患の病態を物理学や数学におけるシンプルな数式で表現できる訳もなく,「複雑系の理論」から説明することが現実的であろう。著者は共同研究者らと,歯周炎の進行を歯根に30~40万本存在する歯根膜線維が断裂する様態と捉えてcellular automata解析し,歯周炎進行の様態をnon-linear chaotic modelで説明できること5,6),歯根周囲の歯根膜strange attractor fractal dimensionが1.85であることを報告した7)。また,免疫学的データから侵襲性歯周炎患者の病態を再帰分割分析およびニューラルネットワークの観点から解析した8,9)。
インプラント周囲炎に関連した骨吸収度は被験者間で大きく異なり,ほとんどのケースで非直線的に進行し,時間とともに骨喪失の割合が加速する10)。インプラント周囲炎には「易罹患性」と「抵抗性」の2タイプが存在し,インプラント周囲の骨吸収は6つの変数(残存歯数,プラークスコア,インプラントの表面性状,年齢,歯周炎の重症度,糖尿病の有無)で予知できると報告11)されている。無作為に9年間経過観察したインプラント596本から中等度あるいは重度インプラント周囲炎に罹患したインプラント体105本(患者62名)の解析では,インプラント周囲炎の進行はnon-linearに進行し,多くは咬合機能後3年以内に発症している12)。インプラント周囲炎も歯周炎と同様にnon-linear chaotic modelで説明できるであろうが,重度歯周炎13)に比較してインプラント周囲炎の進行速度が速い14)ことから,インプラント体周囲に歯根膜が無いことによる低い血流量や咬合緩衝能がないことのリスクおよびインプラント―骨境界面の破壊機序について研究を進める必要がある。
歯周炎は「セメント質―歯根膜―固有歯槽骨」3ユニットの,インプラント周囲炎は「インプラント―骨境界面」の破壊といえる。Disintegrationはインプラント体全周のosseointegrationが失われることによって生じる。インプラント周囲炎が歯周炎に比較して進行が速いという観察結果から歯周炎とは異なる組織破壊機序が推察される。たとえば,セメント質剥離は肥厚したセメント質が層状に剥離するか象牙質―セメント質境界面の剥離によって生じ,急速な歯周組織の破壊を引き起こす。一方,インプラント周囲の急速な骨吸収機序は不明であるが,天然歯における「セメント質剥離」に起因する急速な歯周組織破壊と類似した現象が生じてインプラント―骨境界面のosseointegrationが短期的に広範に失われれば,感染,炎症反応および上皮のダウングロースによって急速な骨吸収を生じても何ら不思議ではない。
複雑系とされる天気の変動や地震の予知は現在でも難しい。人間は複雑系の最たる対象といえる。医学や歯学は「人間を扱う科学」であり,科学が苦手とする複雑系で説明される領域と考えられることから「未成熟科学」と定義されている15)。
医療は事後処理型の行為であり,疾患という「結果」から「原因」を推測する(アブダクション)(図3)。観察結果(口腔内検査)とその他の検査から蓋然性が高い原因を推測するが,原因が複数存在する場合には常に不確実性が存在する。歯周疾患のように多因子性の慢性疾患ではなおさらである。これまでに報告されたSRにおける結果のばらつきや結論の多様性から,インプラント周囲炎も歯周炎と同様に複雑系として説明できるであろう。
インプラント周囲疾患が単一の細菌による感染症ではないことは明らかである。また,インプラント治療を受けた患者は,「すでに歯を失っている患者亜群」に属し,日本では自費診療の治療費を払える患者亜群でもある。Derksらが報告16)したスウェーデンでは以前は保険診療でインプラント治療を受けられたため,歯周治療およびインプラント治療のトレーニングが不足している歯科医師が治療したかもしれない。国の政策によっても治療結果は変わり得る。
インプラント周囲炎に罹患した患者あるいはインプラントに対して長期的な経過観察中に以下に示す様々なイベントが生じ,それらの影響が積算されてゆくと考えられる。1)患者レベル:加齢,遺伝的素因,喫煙,ストレス,全身疾患(糖尿病,肥満),外傷,ブラキシズム,Tooth Contacting Habit(TCH),性格,治療に対するコンプライアンス,健康に対する価値観あるいは意識,換言すれば健康文化レベル,社会経済学的環境,歯科医院へのアクセス,心のゆらぎ(精神的な問題)。2)材料レベル:インプラント体の表面性状,ロット差,表面処理の不均一性,たとえば,サンドブラスト処理やハイドロキシアパタイト・コーティング処理,フィクスチャー・アバットメント間のマイクロギャップ,プラットホームスイッチ,インプラント体の材質,人工骨および成長因子の種類。3)口腔内レベル:歯列不正,前歯のガイド,咬合性外傷,咬合圧,咀嚼パターン,過去に受けた歯科治療(医原病,誤診),骨幅,骨質,角化粘膜の状態,軟組織の厚み。4)術者レベル:診断および治療技術(暗黙知),拡大鏡や実体顕微鏡の使用,CBCT,ガイドシステム使用の有無,インプラント埋入のポジション,患者教育力,技工物の精度あるいは技術の高い歯科技工士との連携。まだ取り上げられていない因子を探る必要があるため,ビッグデータの集積と解析が必要になるであろう。
平成23年度厚労省歯科疾患実態調査によれば,8020運動の達成者は37%に上昇しているものの,高齢になるにつれ4 mm以上の歯周ポケットを有する人の割合が増加しており,55~64歳では歯周病の有病者率が82.5%であると報告されている。また,日本人が永久歯を喪失する原因の第一位は歯周病(42%)とする報告17)を考慮すれば,日本でインプラント治療を受けた成人の約半数は歯周炎が原因で歯を失っていると考えてよい。
歯周組織は「セメント質―歯根膜―固有歯槽骨」の3ユニットに歯肉を加えた組織と定義できる。一方,インプラント周囲組織は歯と歯槽骨および歯肉を喪失した後,顎骨および軟組織(角化粘膜あるいは粘膜)から成る。インプラント体は人工物でスクリュー形状をしており,ねじ込み式で顎骨に埋入される。横断面は円形で表面性状は純チタン,チタン合金あるいはハイドロキシアパタイト被膜であり,顎骨あるいは人工骨とインプラント体境界面の接合様式は明らかに天然歯のそれとは異なる。2008年に開催された第6回欧州歯周病学会ワークショップにおいて,インプラント周囲疾患が定義され,インプラント周囲炎は歯周炎とは基本的に異なっており,発症後の進行が速いと報告されている18)。インプラント周囲炎は複数の因子の相乗効果の結果に依存した一般的用語といえる19)。
倫理的問題からインプラント周囲炎罹患部の治療時には炎症性軟組織しか採取できないため,骨組織を調べるのは難しい。一方,遺体を使用した観察研究から長期間使用したインプラント周囲骨の変化が報告されている20)。遺体の観察研究からインプラント周囲炎における硬組織の知見が得られれば,インプラント周囲炎の病理学的研究に有用な指針を提供できるであろう。
インプラント周囲炎および歯周炎組織を病理学的に調べると,両者ともに形質細胞およびリンパ球浸潤が優勢であり,インプラント周囲炎組織には好中球およびマクロファージがより多く浸潤していた21)。典型的な慢性炎症の病理所見を示すことと,好中球およびマクロファージが多く浸潤していることからは,インプラント体周囲の感染防御において自然免疫の果たす役割が大きいと推察される。ヒトからのサンプルにおけるT細胞,B細胞,形質細胞,マクロファージおよび好中球を免疫染色して同定した研究では,インプラント周囲炎局所では歯周炎に比較して細胞浸潤が2倍以上観察されている22)。さらに,インプラント周囲炎局所では,歯周炎組織に比較してmRNAプロファイルがかなり異なること,自然免疫応答および生体防御反応に関連する遺伝子発現が顕著であることが報告された23)。インプラント周囲炎罹患部から採取した骨を培養したところ,線維芽細胞―骨芽細胞様細胞のフェノタイプが異なる可能性が示唆されている24)。細胞および分子レベルの研究からインプラント周囲炎と歯周炎の違いが指摘されている。
ヒトのインプラント周囲炎の生検組織中に多数の形質細胞の浸潤と異物が認められ,セメント周辺に炎症性細胞が浸潤していたことが報告されており25),残存セメントがインプラント周囲疾患を引き起こすリスク因子であることを示唆している。
疾患の定義や分類はある時代におけるパラダイムの影響を受けながら,専門学会のコンセンサスによって決められている。インプラント周囲疾患の定義は主に欧米の歯周治療およびインプラント治療専門医によって行われた臨床(暗黙知)あるいは臨床研究から得られた知見が論文(形式知)として言語化されて普及している(図2)。臨床医学では実在世界と言語世界との間でコンセンサスが得られるまで疾患の定義(言語世界)が変わることをしばしば経験する。
Mombelliらが1987年にインプラント周囲炎の概念を「periimplantitis」という造語で報告し,成人性歯周炎と共通する特徴を有する部位特異的なグラム陰性嫌気性桿菌による複合感染症であると報告した26)。当時は「リスク因子」「多因子性疾患」というパラダイムがないため,歯周炎と同様に細菌学的要因のみを重要視したのであろう。
1994年の第一回欧州歯周病学ワークショップにおいて,インプラント周囲疾患は「インプラント周囲粘膜炎」および「インプラント周囲炎」の2つの病態に分けて定義された27)。この分類は歯周疾患における「歯肉炎」と「歯周炎」のそれに対応しており,インプラント周囲粘膜炎はプラークに起因したインプラント周囲軟組織に生じた炎症反応28)であり,インプラント周囲炎は初期のosseointegrationの成功と咬合機能を果たした後にインプラント体周囲の骨吸収および軟組織に炎症を伴う病的状態と定義されている。
インプラントの「生存率」はインプラントが口腔内に残存するか否かで明確に区別されるが,「成功率」は判定基準によって変わり得る。臨床的な定義は研究者間で異なっているためコンセンサスは得られておらず,現在は便宜的な仮の定義と言える。インプラント周囲炎はPD>4 mmおよびBOPあるいは排膿を伴うインプラント周囲骨における骨吸収程度から分類されているが,まだ標準化された指標とはいえない。5年以上咬合機能しているインプラントにおいて,インプラント周囲粘膜炎は約8割の患者においてインプラントの50%に発症しており,インプラント周囲炎は28%と報告された29)。インプラント周囲炎については,進行度合いに応じた3段階の細分類が提案されている30)。
歯肉炎と歯周炎の鑑別ポイントは「歯周組織破壊」の有無であり,臨床的には,プロービングによる「付着の喪失」またはレントゲン写真上の「歯槽骨吸収の有無」によって判断されている(図4)。
インプラント周囲炎は歯周炎と同様に,プラーク,炎症,組織破壊の順に進行する(図5)ため,インプラント周囲粘膜炎とインプラント周囲炎との鑑別も基本的には同じといえる31)。インプラント周囲粘膜炎かインプラント周囲炎かの鑑別診断について評価者間の合意が極めて良好に得られたのは疾患の定義が不明確であるがゆえとする報告もある32)。
歯周病の臨床検査項目は歯肉縁上プラーク量,歯周ポケット深さ,アタッチメントレベル,BOP,排膿,レントゲン写真上の骨欠損であり,換言すれば「歯肉縁上プラーク量」「炎症の度合い」および「組織破壊の程度」の3段階および咬合状態から病状を評価している(図6)。
8名の歯科医師にgentle probingさせてプローブ圧を調べたところ,術者間の差が大きいことが報告されている33)。ポケットプロービングは簡便な検査方法ではあるが,標準化しなければ術者間のプローブ圧が異なる。インプラント周囲疾患の診断時には必ずプロービングを行うが,測定誤差が生じるため,検査前には必ず検査者間の誤差を最小にするためにキャリブレーションが必要になる。インプラント周囲には天然歯に見られるような生物学的幅径は存在しないため,強圧でプロービングすればプローブ先端が容易にインプラント周囲骨に達するため,インプラント周囲溝をプロービングする際は0.15 Nが疑陽性BOPの発生を避けるための閾値的なプロービング圧力であり,天然歯に比較してインプラント周囲溝のプロービング感度が高く,簡便で信頼のおける検査方法であると報告されている34)。
BOP陽性は内縁上皮の潰瘍化を,排膿は好中球の浸潤が増加していることを示し,プラーク誘導性のインプラント周囲疾患を予知する簡便な臨床指標である。骨吸収は歯周炎と同様にレントゲン写真上の変化を見て判断する。上述した検査の感度と特異性に関する検討が急務であろう。
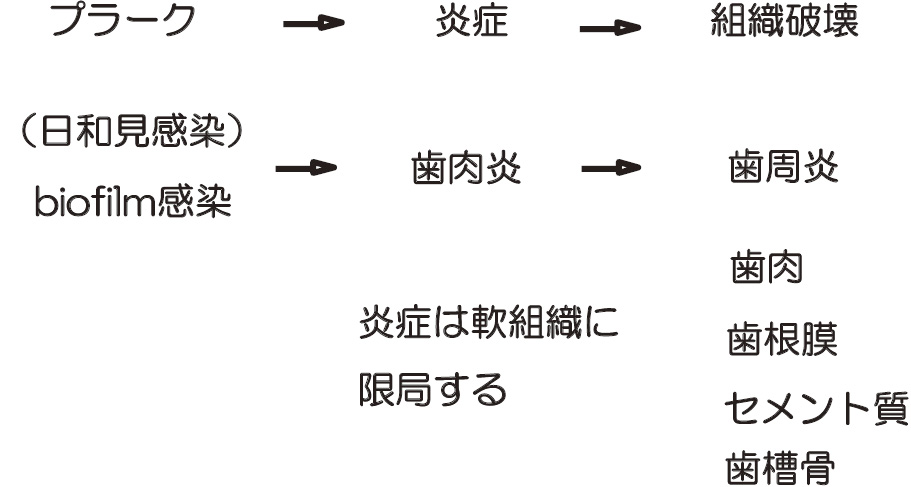
歯周疾患の進行過程
歯周疾患は口腔内細菌によって発症し,歯肉に限局した炎症(歯肉炎)から歯周組織の破壊を伴う病態(歯周炎)へ進行する。歯肉炎から歯周炎に移行する際には,プラークに加えて患者ごとのリスク因子が関わると考えられている。
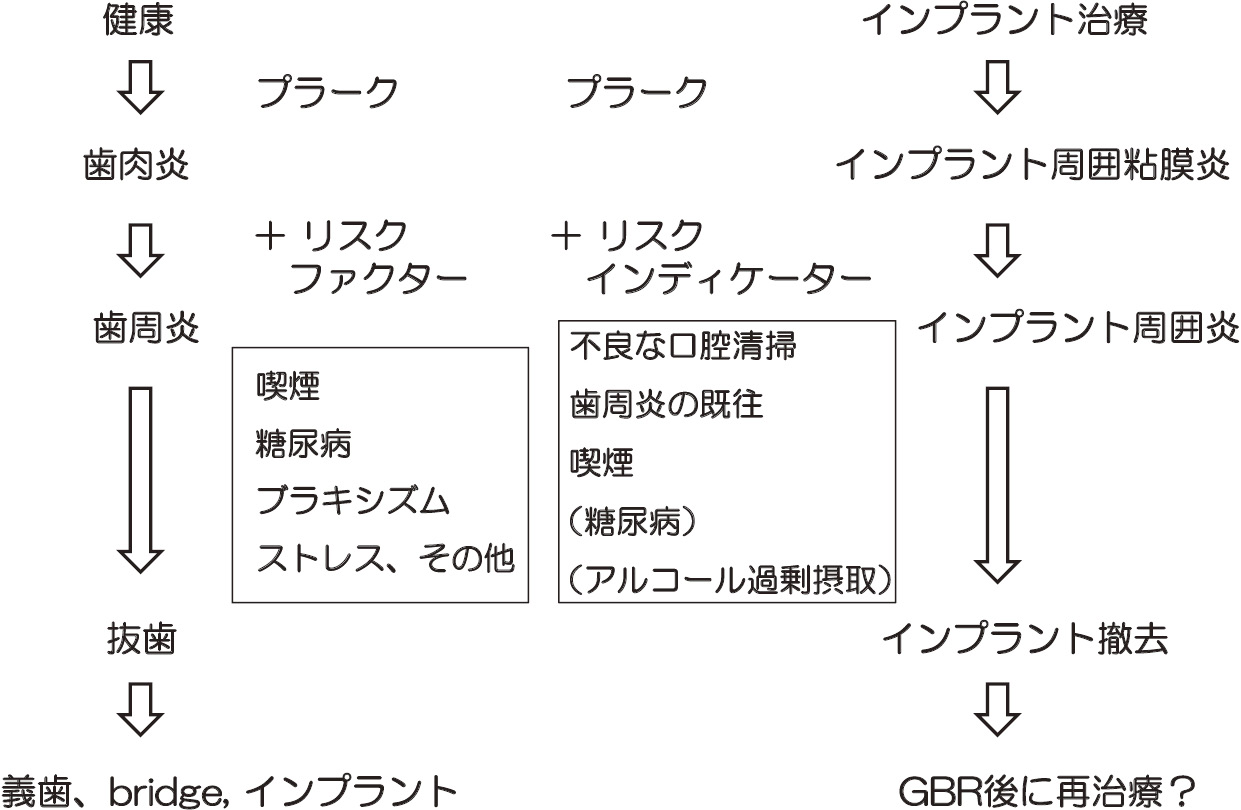
歯周疾患およびインプラント周囲疾患
歯周炎のリスクファクター(細菌,糖尿病,喫煙,ブラキシズム,ストレス,その他)は同様にインプラント周囲炎にとってもリスクとして作用すると考えられる。一方,インプラント周囲炎のリスクインディケーターとして「不良な口腔清掃」「喫煙」および「歯周炎の既往」が報告されており,糖尿病とアルコール過剰摂取はまだ候補因子である。歯周炎とインプラント周囲炎のリスクは共通点が多く,不良な生活習慣が長期間にわたって積算され悪影響を及ぼすと考えられる。

歯周炎とインプラント周囲疾患の検査項目
歯周炎とインプラント周囲疾患の検査の基本概念は同じである。検査内容は「火事の焼け跡の現場検証」に似ている。すなわち,火元(歯肉縁上のプラーク量),火事の燃え具合(歯周組織の炎症の程度)および焼け残った部分(歯周組織の破壊程度)と形態(咬合様式)を調べ,消火と再建を行っている。
疫学は複雑あるいは原因が不明瞭な現象に対して統計調査を通じて可能性の高い原因に絞り込み,対策を提言する試みといえる(図1)。インプラント周囲炎や歯周炎のように多因子が関与している場合にも疫学は有効な研究手段になる。
単一の細菌が疾患の「原因」として発見された古典的な感染症(ペスト,赤痢,ライ病,結核,梅毒など)の時代には,血清や抗生物質で病気が全快することがあった。一方,歯周炎やインプラント周囲炎のように口腔内細菌によって再発するリスクを有し,感染症であるとともに慢性疾患で生活習慣病の側面を有する多因子性疾患の病態の提示は容易ではない。慢性疾患の診断には「オッカムのカミソリ」を適応できない。むしろ「ロスマンの因果パイモデル」が適している35)。
インプラント治療の予後について多くの報告がある。インプラントに咬合負担させて5年間経過観察した結果,生存率は95.3%であり,咬合力の影響が懸念されている36)。Moyらの報告ではインプラント治療の失敗の定義が生存率で評価されており,14.9%の患者でインプラントを少なくとも1本撤去されている37)。インプラント周囲疾患は慢性疾患であるため,治療の成功基準にlongevityが挙げられるが,時間軸が長くなれば関与する因子はより複雑になり,因子間の相互作用も起こり得る。
Franssonらの被験者662名の横断研究では,上部構造装着後5年で急速にインプラント周囲骨が吸収した患者の頻度を調べ,フィクスチャーのねじ山3個以上の骨吸収を「進行性の骨吸収」と定義したところ,28%の被験者に進行性の骨吸収が観察された。この被験者亜群では埋入されたインプラント本数が多く,30%以上で3本以上のインプラントに骨吸収を認め,33%程度が広範囲の骨吸収を起こしていた。一方,3,413本のインプラントのうち,423本(12.4%)のインプラントに急速な骨吸収が認められており,被験者ベースの方がインプラントベースよりも急速な骨吸収を起こす頻度が高い38)。
インプラント治療を受けた294名の患者について行われた3つの後ろ向きコホート研究では,①インプラントの喪失,②インプラント周囲疾患の存在および③インプラント周囲疾患に関わる要因について検討され,以下の結論が得られている39-41)。1)インプラントの生存率は95.7%,2)インプラントの喪失は歯周炎による骨吸収と相関し,3)喫煙習慣との有意な相関は見られず,4)歯周炎の既往がインプラントの喪失に関わっていた。5)インプラント周囲粘膜炎は48%に,6)インプラント周囲炎は16%の患者および6.6%のインプラントに認められ,7)治療後10年間SPTを行っていない場合,インプラント周囲疾患をよくみかける。8)インプラントレベルで,角化粘膜の存在とプラークの有無が有意にインプラント周囲粘膜炎に関連し,9)インプラントの骨レベルでは,角化粘膜の存在と排膿の有無が相関した。10)患者レベルでは,喫煙がインプラント周囲粘膜炎および周囲炎に相関し,インプラント周囲炎は歯周炎の既往と関連した。
インプラントに急速な骨吸収を起こした既往のある184名中86名の患者について臨床評価(炎症症状,BOPと排膿の有無,粘膜辺縁の退縮度)したところ,ポケット6 mm以上,プロービング時の出血,排膿および喫煙の有無から69%の感度で急速な骨吸収を特定でき,歯周炎のリスク評価と酷似していることが報告されている42)。プラークコントロールが良好であれば,インプラント周囲炎は稀にしか生じないため,プラークコントロールを容易にする上部構造を装着することの重要性が述べられている。また,インプラント周囲炎は非喫煙者や歯周炎に罹患していない患者にも発症していることから,多因子性疾患であると推測されている43)。
105名の歯周病患者に338本のインプラント治療を行った経過報告44)では,5年生存率98.7%,成功率はインプラント周囲骨吸収が1.5 mm以下で63.6%,3.0 mm以下では90%であり,適切な歯周治療を行えば,歯周炎患者のインプラント治療でも好成績が得られている。303名の部分欠損患者に治療した511本のインプラントに対して10年間で残存率98.8%,成功率97%およびインプラント周囲炎1.8%と良好な成績が報告されている45)。一方,全く問題のないインプラントは患者ベースで66.4%しかなかった46)とする報告もある。歯周炎に罹患した既往のある全身疾患を有する患者はインプラント周囲炎に罹患しやすいこと47),他にも同様の報告があることから,インプラント周囲疾患に及ぼす因子は数多く存在し,患者ごとの影響度を予測できない状況にある。
322論文から29論文を抽出してメタ解析したところ,ほとんどの論文は横断研究か後ろ向き研究であり,インプラント埋入後5~10年の経過観察では,インプラント周囲炎の頻度は10%程度であったが,個々の論文間でインプラント周囲炎の定義が標準化されておらず,メタ解析には向かないことが指摘されている48)。インプラント周囲疾患に対する臨床研究の質はまだ高くないため,洗練された疫学研究が必要であると結論付ける論文49)もある。さらに,68編の論文を調べたSRの結果が不均一で多様であり,指標自体の明確さが不確実であると指摘されている50)。一方,インプラント治療の失敗の予知因子として喫煙だけが特定されたとする研究もある51)。
588人から無作為に選ばれた2,277本のインプラントについて行われた平均9年間の後ろ向き研究では,インプラント周囲炎の頻度が45%と高く,中等度から重度インプラント周囲炎は14.5%であった。オッズ比の高い因子は4本以上のインプラント埋入(15.1),一般開業医による補綴治療(4.3),歯周炎の既往(4.08)および骨頂から軟組織マージンまでの距離(2.3)であった16)。
日本歯周病学会インプラント委員会から,267名の患者について調べた多施設研究におけるインプラント周囲疾患の発症頻度およびリスク因子が報告された52)。インプラント周囲粘膜炎33.3%およびインプラント周囲炎9.7%であり,欧米の報告に比較して同等の結果といえる。不良な口腔清掃および歯周炎の既往の有無がインプラント周囲疾患の強力なリスク因子であるが,角化粘膜と喫煙の有無については統計的な有意差はなかった。上述したようにインプラント治療の経過報告は増えたものの,データ集積がまだ不十分で患者ごとのリスクを詳細に観察できていないのかもしれない(図2)。
1990年代から歯周炎の病態はリスク因子の概念から説明されるようになり,現時点でもこのパラダイムが支配的である53)。通常,研究された因子はエビデンスの蓄積に伴い,marker→indicator→factorの順に格が上がる。疫学研究ではインプラント周囲炎のリスクが報告されているが,まだindicatorレベルの報告が多い(図5)。
インプラント周囲の経年的な骨吸収は過去に経験した歯周炎による骨吸収度に関連しており,歯周炎罹患性の高い患者はインプラント治療の失敗率も高いと報告されている54)。不良な口腔清掃,歯周炎の既往および喫煙がリスクindicatorであり,真のリスクファクターであることを確信するためにはさらなる研究が必要である55)。残存する歯周ポケットはインプラント治療のリスクindicatorであり,歯周炎の既往のある患者にはインプラント治療を行う前に確実な歯周治療を行うことが不可欠である56)。インプラント周囲炎の病因にはプラーク性(細菌感染)と非プラーク性(オーバーロード,喫煙,角化粘膜の不足,術者の技術,材料的問題)があると考えられている。以下にインプラント周囲炎の各種リスク因子について解説する。
1) 細菌学的因子Mombelliらの報告26)以来,インプラント周囲炎に関する細菌学的研究は多い。口腔内のバイオフィルムによってインプラント周囲疾患が発症するのは明らかである。天然歯とインプラント周囲の細菌叢を培養法で調べた研究57)では,ある種の嫌気性細菌が天然歯に比較してインプラント周囲疾患部位から高頻度に検出されている。犬を使った実験的インプラント周囲炎および歯周炎モデルにおいて,結紮線を除去した後の細菌学的プロフィールを解析したところ,細菌学的プロフィールの大きな多様性により疾患の進行およびプロフィール間の関連性を解釈し難いと報告されている58)。インプラント周囲組織から採取したプラーク中の細菌遺伝子の網羅的な検索から,インプラント周囲炎部の細菌叢は多様で,歯周炎部位のそれに比較して歯周病原性細菌の検出頻度は低く,より複雑な細菌叢による複合感染である可能性が報告されている59,60)。
歯周炎と同様に,インプラント周囲炎特異的な細菌を特定することは困難であろう。そもそも患部から採取した細菌叢の同定からは,疾患の原因か結果かの判断ができない。環境に適した細菌群が結果的に生息しているのかもしれない。すなわち,口腔内,歯周ポケット,インプラント周囲溝およびフィクスチャーとアバットメント間のマイクロギャップ61)が嫌気性菌の生息に適した環境である可能性を否定できない。
分子生物学的手法および次世代シークエンサーを活用することで口腔内細菌叢の解析は飛躍的に進んだ。ただし,特異細菌説あるいは非特異的細菌説の仮説に対して明確な解答を得られていないこれまでの歯周疾患における細菌学的研究と同様に,遺伝子解析が進んでもインプラント周囲炎関連細菌の研究から明確な結論が得られる蓋然性は極めて低い。これまでの要素還元主義的な研究指向(図1)では歯周炎やインプラント周囲炎の病態解明や治療法の開発は困難であろう。
2) オーバーロード(過重な咬合負担)過剰な咬合負担によりdisintegrationした症例を経験したことがある(図7)。インプラント周囲炎と異なり,ソーサー状の骨吸収が生じる前にインプラント体全周のosseointegrationが短期間で破壊されている。disintegrationの発生頻度に関する報告は見当たらないが,コンプライアンスの不良なブラキサーにインプラント治療を行っていれば経験するであろう(図2)。オーバーロードによる極端な病態と言えるかもしれない。
オーバーロードの関わりを人間で実験することは倫理的問題から困難であるため,かわりに動物実験が行われてきた。犬を使った動物実験で,インプラントの長軸方向と非長軸方向に咬合力を加えた際の骨反応を調べたところ,非長軸方向からの咬合力により海綿骨の骨代謝が活発に生じている62)。犬を使った動物実験で,過度の早期接触(過重咬合)を与える群と対照群,結紮線を巻いて炎症を惹起させた群と週三回のブラッシングでプラーク除去を継続した4群間で骨吸収程度を調べた。非炎症下ではわずかに骨吸収を生じ,炎症下の過重咬合はプラーク誘導性骨吸収を増悪した。基本的には歯周炎における過重咬合モデルと同様の結果といえる63)。プラーク誘導性の炎症反応が起きていなければオーバーロードはosseointegrationにマイナスには働かず,むしろ同化作用を示すが,炎症の存在下ではオーバーロードによってプラーク誘導性の骨吸収を生じると結論付けている64)。一方,過重負担はインプラント周囲骨の吸収を促進しなかったとする報告もある65)。
上述した動物実験における「excessive occlusal load model(過重咬合モデル)」では,「過重咬合」を上部構造に早期接触によって作り出した「過高咬合」に置換して実験しているため,ヒトにおけるパラファンクションをどこまで反映しているのか解釈が難しい。動物実験の結果は,ある条件下では犬やサルにもインプラント周囲炎が起き得ることを示してはいるが,疫学研究の結果を勘案すれば,インプラント周囲炎に罹患した人間のリスク因子を犬が保有するとは考えにくく,人間のインプラント周囲炎における一般法則を導き出すには至っていない(図1~233)。
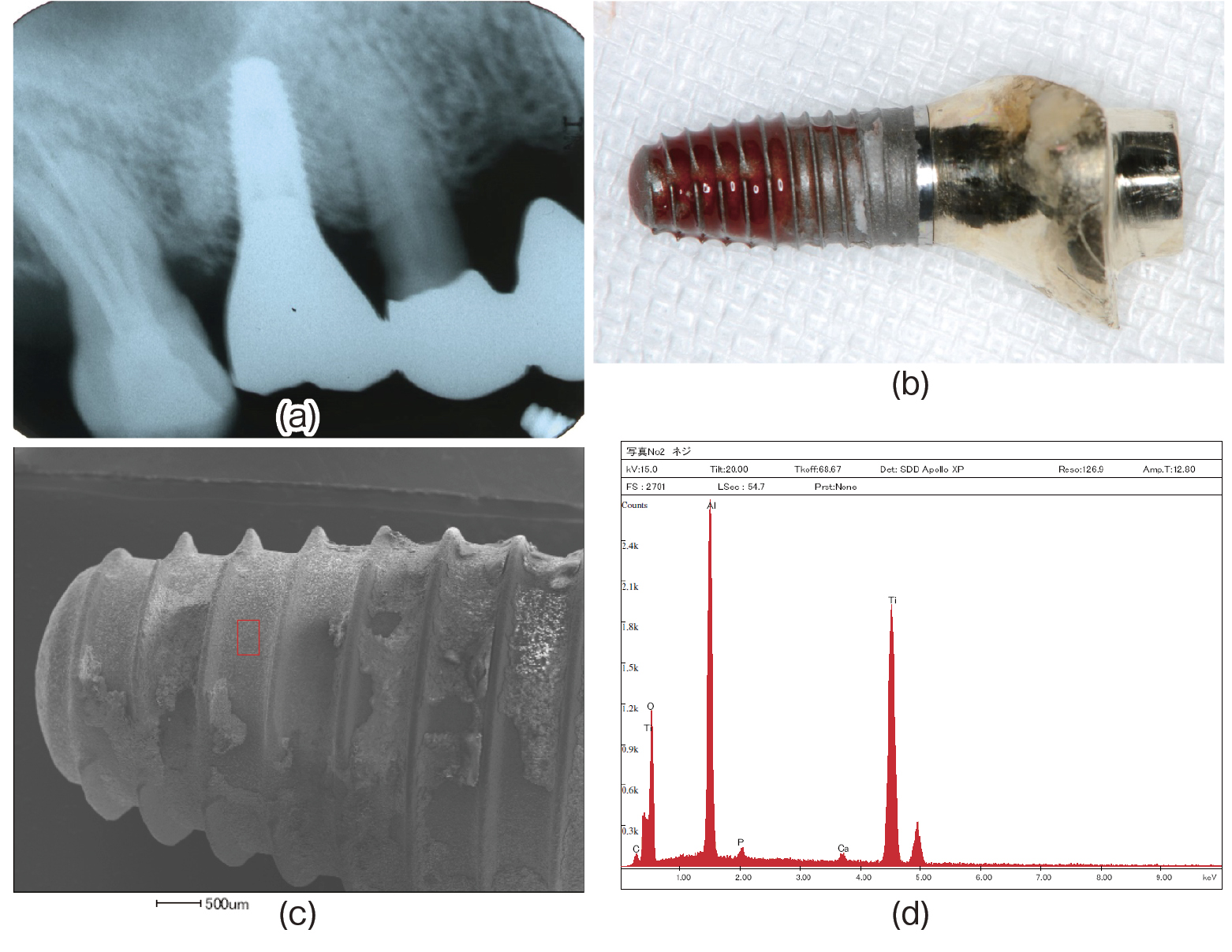
disintegrationしたインプラント体の解析
患者は65歳男性。クレンチングにより上顎右側第一大臼歯(有髄歯)を歯根破折した。上部構造を装着後約半年して上部構造の動揺を主訴に来院した(a)。痛みを訴えなかったため,動揺するインプラント体を無麻酔下で撤去した(b)。エックス線写真からはインプラント周囲炎に見られるソーサー状骨吸収像は見られなかった。この患者は作製したナイトガードを半年程度で使用しなくなっていた。患者側の性格,コンプライアンスの程度もリスクを高める因子と言える。
脱落したインプラントの表面性状をSEMおよび元素解析した。枠で囲んだ部位ではHA被膜が剥離しており,CaおよびPは検出されず,A1, Ti, O, Cが検出された。O, Cは生体組織由来の元素であろう(c,d)。オーバーロードによりdisintegrationを生じた際にHA被膜が剥離したと考えられる。
インプラント体周囲角化粘膜の必要性について統一見解は得られていない。39名の患者に埋入した171本のインプラントを対象にした研究では,角化粘膜の欠損がインプラント周囲軟組織の健康維持を難しくするという仮説を支持しなかった66)。しかし,この論文にはインプラントの種類やフィクスチャーとアバットメントのギャップに関する記載がなく,以前行われていた高床式インプラント治療を受けた患者が被験者である可能性があり,審美性を考慮したフィクスチャー・アバットメントのギャップが粘膜下にある2回法のインプラントではないと考えられ解釈が難しい。
一方,その後の臨床研究では,角化粘膜のメリットを強調する報告が多い。5年間の観察研究からは,角化粘膜幅が2 mm以下の場合,頰側軟組織の退縮と同様に舌側のプラーク堆積とプロービング時の出血が起こりやすい67)。角化粘膜幅が2 mm以上ないとブラッシング時の不快感が増し,プラークが堆積してインプラント周囲軟組織の炎症を引き起こしやすくなる68)。一方,角化粘膜が必要なのは患者あるいはインプラント特異的であって,すべての患者ではないであろうが,どの患者にとって角化粘膜が必要であるかを信頼性高く予知するための十分なデータはまだない69)。
SRからは以下の結論が得られている70)。インプラント周囲に軟組織があるほうが骨の物理的バリアーとして,さらに血流の確保に有利である。一方,フィクスチャーとアバットメント接合部の位置,すなわちプローブ深さが増すことは嫌気性細菌の生息に有利な環境を提供するリスクを伴うこと,臨床レベルで接合部の精密度を比較・検討することは困難であり不確定要素が残り,インプラント周囲軟組織の厚みがあるほうが短期間におけるインプラント周囲の骨吸収が生じにくい。
角化粘膜について考える際,角化粘膜幅と厚みの両方を考慮する必要があるかもしれない。しかも,物理的バリアーとしては非可動性であることが望ましい。著者は歯周炎患者のインプラント治療を行う際,二次手術時に残存する角化粘膜幅が2 mm以下であれば遊離歯肉移植を,5 mm以上あれば角化粘膜を含む部分層弁を作成して頰側根尖側にスライドさせて縫合し,インプラント体頰側の角化粘膜幅の増大を図っている71)。歯周病専門医としての治療技術を応用すれば容易に実践できる。
4) 歯科医師のトレーニング不足適応する基準を厳しくするか治療とメインテナンスを適切に行えればインプラント周囲炎は稀な疾患になるであろう。一方,トレーニング不足の歯科医師が完成度の低いインプラントシステムを使用すれば成功率は下がるであろう72)。
インプラント治療では,埋入方法,埋入部位,軟組織のマネージメント,咬合様式の付与およびリスクの軽減といった患者ごとに最適と思われる治療を施しても,インプラント周囲疾患を発症することがある。ましてや,上述した治療が適切に実施されなければ,インプラント周囲炎を高頻度に発症しても何ら不思議ではない。
インプラント治療の暗黙知を習得するための科学的トレーニング方法の開発が望まれるが,有料のハンズオンセミナーや○□塾に参加して治療の術式を聞いているだけでは,トラブルや失敗のリカバリー能力は身につかない。何よりも,自分の頭で考えるという習慣が身につかないため,ある程度の徒弟制度的なトレーニングは必要であろう。歯周治療およびインプラント治療の両方を指導できる人材育成が求められる。
5) 材料学的因子インプラント体の生体親和性が良いとはいえ,規格化された工業製品であり,インプラント周囲炎の病態を考える際には,材料学的な検討が不可欠である。インプラント体は人工物であることから,何らかの理由でインプラント体表面の酸化チタン被膜(不動態)やHA被膜が損傷すれば,金属イオンの溶出,摩耗紛(微粒子)の放出や拡散が生じ,炎症反応を引き起こす蓋然性は高い。
ビーグル犬を使った実験で,結紮線を巻いてプラーク形成を促進させ約半分の骨吸収が進行した段階で結紮線を除去し,さらなる自発的進行を観察したインプラント周囲炎の実験的モデルにおいて,TiUnit群で骨吸収が有意に大きかった73)。この結果は,インプラント周囲炎を発症すると表面性状の違いがインプラント周囲炎の進行に関わることを示唆する。また,実験的インプラント周囲炎罹患部において,肉眼レベルでは排膿が,組織学的には好中球の浸潤,バイオフィルム層,炎症性細胞浸潤および破骨細胞の浸潤および組織破壊が観察されており,表面性状の違いと炎症および組織破壊の関連を研究する必要性が示唆されている74)。
チタン表面性状が骨反応に影響することはマイクロメーターレベルで,何らかの兆候はナノメーターレベルで報告されている。しかし,測定方法や評価方法が標準化されておらず,2次元的測定に加えて3次元的(空間的)な測定法を用いることが推奨されている75)。インプラント表面性状の粗造さ,表面構成の変化,ペプチドおよび成長因子の有効性を示唆するエビデンスはまだない。一方,BMP-2がosseointegrationを阻害すること76),プラットフォームスイッチ機構が骨吸収を抑制すること77),酸エッチング処理と水溶性の液体に浸漬した際にナノ構造上良好な酸化チタン被膜が形成されること78),境界面の違いによってバイオフィルムの生育が変わること79),が報告されている。
osseointegrationの強度解析を目的としたラットを使用した実験モデルにおいて,Scanning Electron Microscope(SEM;走査電子顕微鏡),原子間力顕微鏡およびenergy-dispersive spectroscopy(EDS;エネルギー分散型分光計)を用いた表面性状の解析が行われている80)。このような機器を用いて脱落したインプラント体の研究を行うことを通してosseointegrationの破壊機序や仮説が構築されるであろう(図3, 7)。
骨造成を併用すると経年的なインプラント周囲骨吸収の生じる傾向が高まると報告されている81)。著者も臨床経験から,人工骨移植材はインプラント周囲炎のリスク因子になり得ると考えている(図8)。人工骨移植材は母床骨とは異なりインプラント体とのosseointegrationも劣るであろう。非吸収性移植材を使用した場合では,顎骨,移植材およびインプラント体3つの境界面のosseointegrationの様態を評価する必要があるが,現実的には画像診断のみであり,有効な検査方法はまだない。
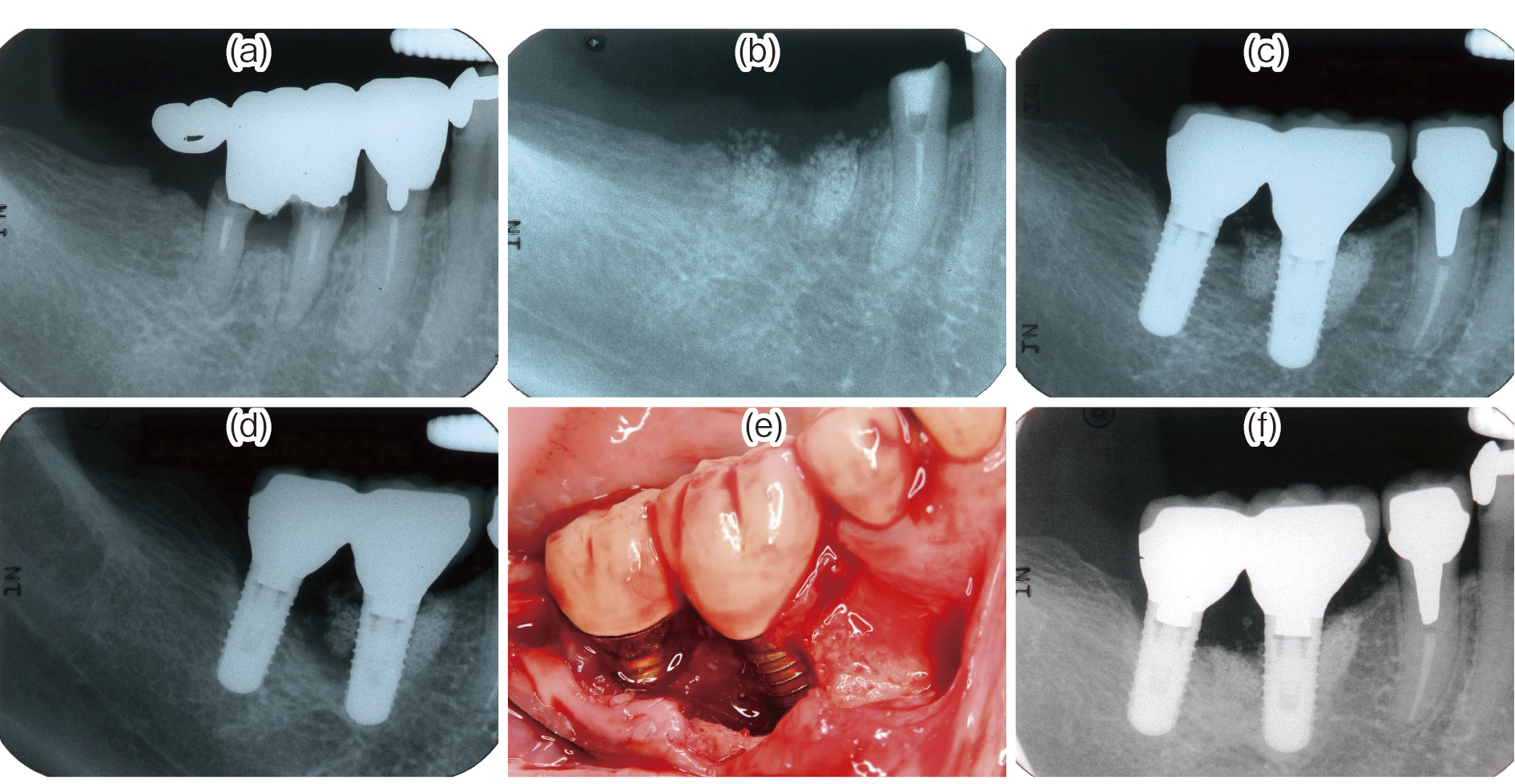
インプラント周囲炎の外科治療
患者は55歳女性。46を齲蝕(a)で抜歯した際に非吸収性人工骨を用いたソケットプリザベーション(b)を行った。インプラント周囲角化粘膜がないため遊離歯肉移植術を勧めたが拒否した。
インプラント治療後2年ほどしてインプラント周囲軟組織に炎症症状を認めた(c)。デンタルエックス線写真から人工骨が剥離していることが伺われたため(d),外科治療(インプラント体の除染,吸収性遮蔽膜を併用した骨移植)を行った(e)。治療後2年,BOP(-)で感染による炎症症状は見られず,人工骨は定着しているように見える(f)。
歯根膜を有さないインプラント体では,咬合時の知覚が8倍程度も鈍くなるため,過剰な力で咬合してしまい,結果的にオーバーロードによってosseointegrationを破壊すると推論される(図7)。一方,抜歯後に歯根膜を喪失しても歯根膜由来の機械的刺激に対するセンサーが一部残存し,顎関節,筋肉,粘膜および骨膜由来の受容体が関与してある程度は咬合圧を感知できる可能性が指摘されている82,83)。インプラント義歯の正常な機能を発揮する上でも知覚―運動制御は臨床上重要である84)。一方,SRからはインプラント支持型の補綴治療を受けた患者は総義歯治療を受けるよりは触覚と顎運動機能が改善されたという程度の結論である85)。これまでの報告からはosseoperceptionのエビデンスと臨床上の重要性をまだ評価ができていない状況であり,今後の研究の進展に期待したい。
インプラント周囲炎の非外科および外科治療の効果に関する報告は1,000編を超えているが,症例数が少なく,研究デザインが不統一で,被験者の選択基準の違いなど歯科医師による臨床研究の標準化がなされておらず,インプラント周囲炎の治療法についてはモデル検証(図3)の初期段階という感が強い。たとえ患者の選択基準を標準化できたとしても,治療の予後評価は数か月から数年後であるため,術者の技術力に加えてメインテナンスを支えるスタッフの仕事力など,まだ認識されていない因子が存在していると思われる。累積的防御療法(cumulative interceptive supportive therapy;CIST)はよく知られているが,コンセプトが先行してエビデンスになる臨床データは乏しい86)。十分に検証された理論あるいは治療概念というよりも仮説に近い(図3)。6種類の抗菌物質間のインプラント体表面の除菌能力を調べた結果,次亜塩素酸,過酸化水素,クロルヘキシジンおよびリステリンの強い抗菌効果が示されている87)。SRからはインプラント周囲炎の治療法で最も効果的な治療介入に関する信頼できるエビデンスはまだ無い88)。インプラント周囲炎の治療目的は「インプラント体の除染」「インプラント体周囲組織の再生」および「咬合機能の回復」である。インプラント周囲炎に対する非外科および外科治療が報告されている。
1) 非外科治療12名のインプラント周囲炎患者に対して,Er:YAGレーザーを用いた非外科治療の効果を臨床的および生検を病理組織学的に調べたところ,臨床症状は改善したがインプラント周囲軟組織中の炎症反応像は改善しなかった89)。インプラント周囲粘膜下への抗生物質の局所配送療法,グリシンパウダーを用いたエアーポリッシングおよびEr:YAGレーザー処理はキュレットを使用したデブライドメントとクロルヘキシジンを用いた補助的洗浄に比較して,インプラント周囲粘膜の炎症に起因する臨床症状をかなり減少できる90)。air-abrasive deviceは機械的デブライドメントよりも短期的には効果がある91)。上述した臨床研究は観察期間が2年以内と短期であるため,長期的な効果に関するデータ集積と解析が必要である。
2) 外科治療インプラント周囲軟組織を切開してフラップを開け,骨吸収により露出したインプラント体部分を除染後に骨移植あるいはエナメルマトリックスタンパク質を適応した治療効果が検討されている。インプラント体の除染には超音波スケーラー,Er:YAGレーザー,air-abrasive device,チタン製ブラシおよびインプラントプラスティーが適応されているが,各術式や方法の適応症は確立されていない。一方,犬を使ったインプラント体の除染に関する実験では,綿球でこするだけで84%骨再生したと報告されている92)。重度インプラント周囲炎に罹患した17名の患者について4年間治療経過を評価したところ,Er:YAGレーザー照射かプラスティックキュレットで除染後に,生食を含ませた綿球で表面を拭く2つの除染方法に差はなかった93)。吸収性遮蔽膜の有無にかかわらず骨移植材を用いたGBR法による治療が可能94)である。インプラント体全周(4壁性骨欠損状態に類似)に骨欠損がみられる場合に,頬側骨の裂開状骨形態部およびインプラント体全周の両方が骨欠損している群よりも良い結果が得られている95)。残存骨からの細胞浸潤や血管新生が生じるからであろう。
インプラント周囲炎に対する再建的治療について430編の論文をSRした結果,ランダム化対照試験は1つだけで倫理的な制約の大きいことが伺える。メタ解析結果は,1)レントゲン写真上の骨欠損の修復度:2.17 mm(95%信頼区間(confidence interval;CI):1.46-2.87 mm),2)プロービング深さの改善:2.97 mm(95% CI:2.38-3.56 mm),3)臨床的なアタッチメントゲイン:1.65 mm(95% CI:1.17-2.13 mm),4)BOP減少率:45.8%(95% CI:38.5-53.3%)であり,論文間の治療結果が大きくばらついていることがわかる。この結果には患者側,欠損形態,再建に使用した材料,さらに残存する天然歯の治療および管理といった術者の治療技術が関わるであろう。インプラント周囲炎に対する再建的な治療法を支持するエビデンスはまだ乏しい96)。
1990年から2013年までの間にインプラント周囲炎の外科治療に関してヒトを使用した臨床研究のうち英語で書かれた論文1,306編から,ポケット深さの減少,臨床的なアタッチメントゲイン,BOP減少率,レントゲン的な骨充填率あるいは量,およびインプラント周囲粘膜幅の退縮量について,平均値および95%CIをランダム効果モデルで評価したところ,適用された外科治療は1)アクセスフラップとデブライドメント,2)外科的切除術,3)骨移植材の填入および4)GBR法であった。このSRからは移植材料と遮蔽膜の適応によりポケット深さやレントゲン的な骨充填率は改善したが,これらの主張を支持する質の高い比較研究が必要である,といった焦点の定まらない結論で終わっている97)。SRを重ねても,個々の論文の質的問題やコンセンサスが十分に得られていないからであろう。インプラント体の除染後にEMDあるいはPDGF処理してGBR法を適応したところ,インプラント体の98.8%が生存し,BOPは91%消失し,ポケットは5.1 mm減少し,インプラント周囲骨は1.77 mmゲインしたとする良好な治療成績が報告されている98)。テクニックセンシティブな治療といえるかもしれない。
米国を中心に「戦略的抜歯」という「歯周病罹患歯の早期抜歯パラダイム」が発表され,歯周疾患の難症例を「hopeless teeth」と診断してインプラントに置換する医療が推進された。しかし,インプラント周囲炎を含めたインプラント治療の問題が指摘されるにつれて天然歯保存の意義が見直され,「天然歯の可及的な保存」という歯科医療の原点回帰がみられる。
インプラント治療は決して万能ではない。とくに歯周炎患者に対するインプラント治療においては,患者ごとのリスク評価,診断および術者の適切な治療技術,定期的なSPTと咬合管理が行われて初めて良好な成績を残せるであろう。「歯周病罹患歯の早期抜歯パラダイム」を選択することは,歯周病専門医としての専門性を失うことに繋がると懸念されている99)。もっとも,咬合の安定化を図れなかったり,歯周組織や他の残存歯に影響を及ぼす患歯を長期に保存するデメリットも勘案し症例ごとに治療方針が決定されるため,最終的には個々の歯科医師の診断および治療レベルに依存している。
インプラント周囲疾患の予防には,インプラント治療後のメインテナンスおよび残存歯のSPTが重要になる。インプラント治療は上部構造を装着したら終了ではなく,長い経過観察の始まりといえる。インプラント周囲炎が頻発するような治療とメインテナンスをしていれば,医院の収入増どころか不良債権が蓄積することになる。
歯肉炎に罹患していなければ歯周炎に罹患しないのと同様にインプラント周囲粘膜炎の予防がインプラント周囲炎の予防に繋がる。もっとも,インプラント治療は一生使えることを保証できないことも事実であろう。Tarnowは整形外科医の患者へのコンサル例を参考にインプラント治療に対する歯科医師の非現実的な考え方を改める必要性を指摘している。整形外科医が股関節置換術を行った自分の患者にインプラント(人工関節)は15年程度は大丈夫だが,その後は再来院して再治療する可能性を話すことを紹介している。我々歯科医師も口腔インプラントが口腔内で一生機能し続けると患者に暗示する習慣から脱却すべきと述べている100)。実際,多くの患者がインプラント周囲炎に罹患して再治療を受けている。
SPT期に歯周炎が再発する患者は歯周組織の安定した患者に比較してインプラント周囲炎およびインプラントを喪失するリスクが高い101)。歯周炎に易罹患性を示す患者では,5 mm以上のポケットがインプラント周囲炎および喪失するリスクを高める。SPT期における残存歯の歯周炎の再発はインプラント周囲炎発症およびインプラントを喪失する大きなリスクになる。
インプラント周囲疾患に関する4つの疫学研究をSRして議論し,(1)インプラント周囲粘膜炎とインプラント周囲炎の発症頻度はそれぞれ43%(CI:32-54%)と22%(CI:14-30%),(2)BOPはインプラント周囲の健康と疾患を区別するカギとなる臨床指標であり,(3)インプラント周囲粘膜炎に罹患している患者が定期的なSPTを欠くとインプラント周囲炎を発症するリスクが増大する,(4)プラーク堆積が病因因子として確立すると,インプラント周囲粘膜炎の進行に対して喫煙は変更可能な患者関連の,余剰セメントは局所的なリスクindicatorとして作用する,(5)患者による機械的なプラークコントロールは効果的な予防法であり,(6)専門家による口腔清掃指導や機械的なデブライドメントから成る治療介入は炎症の臨床兆候を減じ,(7)補助的な方法(抗菌剤,局所および全身的な抗生物質の投与,エアーフロー)は炎症の抑制に効果的とはいえない,ことを挙げている102)。
メインテナンスの重要性に関するSRでは,患者,臨床的およびインプラント関連因子について考えられるあらゆる因子を探索すべきと考察している103)。また,インプラント埋入および上部構造は患者自身が適切に口腔清掃できるように配慮されるべきで,プロービングによる診査と専門的なプラーク除去が特に強調されている。臨床における患者ごとの詳細な観察(図2)が病態解明および治療法と長期メインテナンスの成功に不可欠である。
インプラント周囲炎の予防は基本的には歯周疾患のそれと変わらない。人工物のインプラントで咬合支持を回復しているが,インプラント体が骨と結合して,粘膜を貫通している構造上,インプラント体周囲が感染のリスクに曝されていることは明らかであり,歯周炎患者に適切な歯周治療を行えない歯科医師がインプラント治療を行えば,個人差はあるもののインプラント周囲疾患を発症する確率は高い。
前回のミニレビュー53)で,歯周病学および歯周治療学はまだ「不確実性の科学」であり,「未成熟科学」あるいは「複雑系」としてとらえることの必要性を述べた。インプラント治療に関する疫学データのCI幅が大きいことは,関連因子が数多く存在し,複雑系として考える必要性を示唆している。
一方,インプラント周囲炎に関する科学はまだモデル検証の初期段階であろう。これまでの歯周病研究が参考になるので研究の進展は早いかもしれない。インプラント周囲炎の定義と分類,病態と治療法については科学的に証明されていないことが多い。患者ごと,インプラントごとに詳細な観察結果を集積し,適切な対処法を検討しているが,患者側の問題を解決するには,臨床データの蓄積と観察,仮説の立案,検証,反証および仮説の再構築といった科学のループ(図3)を回すことが当面の課題であろう。
このミニレビューを書いている時にNHKのニュース番組で「インプラント周囲炎」が取り上げられた。日本ではすでに約300万人の患者がインプラント治療を受け,日本歯周病学会の研究報告から,9.7%の患者がインプラント周囲炎に罹患していると紹介された。臨床の現場では適切な歯周治療やリスクの軽減が行われていないケースが多い。患者が歯周炎に罹患していれば,まずは適切な歯周治療が不可欠であり,歯周病専門医の活躍できる領域と言えよう。インプラント周囲炎にしないのが最善策であるが,現実の問題に対処することは避けられない。日本歯周病学会は歯周病治療の専門集団であるので,歯周炎患者のインプラント治療における科学的根拠を構築し,適切な治療指針を社会に情報発信することが求められている。
今回の論文に関連して,開示すべき利益相反状態はありません。