2017 Volume 59 Issue 1 Pages 39-47
2017 Volume 59 Issue 1 Pages 39-47
エナメルマトリックスデリバティブ(エムドゲインⓇ,EMD)は歯周組織再生療法に適用されている薬剤の一つである1)。歯周組織再生を必要とする原疾患は歯周病であり,歯周病がプラークによって惹起されることの根拠を初めて科学的に示したのはLöeら2)で,1965年のことである。それ以降約50年が経過しているが,歯周病に悩まされている人は多く,高齢者になればなるほど歯周病患者は増えている。65歳以上の人が総人口に占める割合が21%を超えると,超高齢社会と呼ばれ,現在,日本では27%に到達している。したがって,超高齢社会が進み,高齢者が増えているなかで高齢者の歯周病も解決すべき課題の一つであると考えられる。歯周病により破壊された歯周組織を元通り回復することが現在の歯科医療における重要課題の一つであり,歯周組織の再生が必要になる。
歯周組織再生療法を可能にしたのは,Melcher3)およびNymanら4)の研究である。歯と歯周組織との線維性の新付着が生じるのは,歯根膜由来細胞が歯根のセメント質表面に接して初めて起こるという考えをMelcher3)は提唱した。それを実践してNymanら4)は接合上皮が増殖しないようにバリアー膜を用いて歯根膜由来細胞が歯根表面に移動する手法を開発して新付着が生じることを報告し,歯周組織再生治療が広まってきた。その再生治療として本邦では,エナメルマトリックスデリバティブの応用以外に骨移植術およびGTR法が行われている1)。
EMDは,歯の発生に関わるタンパク質であり,その主体はアメロジェニンである。これを利用することによって効果的な歯周組織再生がもたらされている5)。EMDが1995年に世に出てから約20年が経過している6,7)。EMDは幼若ブタ(生後約6か月齢)の歯胚から抽出されたタンパク質であるが,アメロジェニンはヒト,サル,ブタなど種を越えてよく保存されている8)。ヒトでは,アメロジェニン遺伝子は2個あり,一つはX染色体上のp22領域にあり,他はY染色体上のセントロメア付近に存在する。アメロジェニンのmRNAは,選択的スプライシングの差により,分子量およびアミノ酸組成が若干異なるものがある9)。
EMDが歯周組織の再生に関与することは多くの研究で認められているが,アプローチの仕方が様々であり,in vitroやin vivoにおける結果が必ずしも全く同じではなく,異なるところもみられる。我々はEMDの組織反応性を検討するなかでEMDそのもののSDS-PAGEによる解析ではみられないバンドを検出し,そのアミノ酸シークエンスを同定することができた10)。そのアミノ酸シークエンスに基づきペプチドを合成し,それについてin vitroやin vivoでの解析を行ってきた11-19)ので,それらの概要について説明する。
EMDは,当初,粉末と液の2つの容器で供給されていたので,その粉末をプロピレン・グリコールに溶解して6週齢の雄性Sprague-Dawley(SD)系ラットの背部皮下の体幹皮筋直下に接種した(図1)。現在のエムドゲインⓇゲルは混合されているので,種々な濃度にEMDを調整することは容易ではないが,当初は,容易に濃度を調整できた。接種後,一定の間隔でラットを安楽死させ,ホルマリンで灌流固定し,接種部位の組織を採取してホルマリンにて浸漬固定後,パラフィン切片を作製して各種染色を行った。その結果,接種したEMD周辺にエオジン好性の円形小体がみられた(図2)。それはEMDの濃度が7.5 mg/ml以上のときであり,実験を行った濃度のなかで30 mg/mlの濃度のときが最高の数になった。丁度,この濃度は臨床で使用されている濃度と同じであった。また,その数は30 mg/mlの濃度で接種7日後に最も多くなり,14日後には減少し,28日後には全く存在しなくなった10)。
ヘマトキシリン・エオジン染色,PAS染色,ジアスターゼ消化PAS染色,トルイジン・ブルー染色,コンゴー・レッド染色,ベルリン・ブルー染色,マッソン・トリクローム染色,リンタングステン酸・ヘマトキシリン染色,ギムザ染色およびエラスティカ・ワンギーソン染色,免疫組織化学的染色(S-100,Factor VIII-related antigen)の結果,円形小体は線維素,酸性ムコ多糖,糖類,グリコーゲン,ヘモジデリン,アミロイドでもなく,酸性の粘液性物質であった。また,円形小体の周囲の細胞は血管内皮細胞でもなく,マクロファージ系の細胞でもないことが明らかになった。この物質を特定するためにパラフィン切片上でマイクロダイセクションを行い,マイクロダイセクトした円形小体をLaemmliの溶液に溶解させ,12.5%マルチゲルを支持体としたトリス-グリシン系SDS-PAGEを行った結果,約40 kDaのバンドを得た。このバンドはEMDのSDS-PAGEでは検出できなかったバンドである(図3)。このバンドを切り出し,トリプシン消化し,抽出されたペプチドを10 mg/ml 2,5-dihydroxybenzoic acidで結晶化し,マトリックス支援レーザー脱離イオン化法(matrix-assisted laser-desorption/ionization)および飛行時間型質量分析法(time-of-flight mass spectrometry)(MALDI-TOFMS)で分析した。その結果,断片化された多数のペプチドが得られ,最長は192アミノ酸残基からなるペプチドであった。断片化されたペプチド群は1,010 Daの分子量領域に非常に強い単一のイオン強度を示した(図4)ので,分子量1,010 Daのペプチドを共通に持っていることが判明した。一個のアミノ酸ごとの分子量,N末端側からの複数個の分子量,およびC末端側からの複数個の分子量を解析し,1,010 Daのペプチドに共通したアミノ酸は7個であることが明らかになった。得られたアミノ酸配列をタンパク質同定システムのMASCOT serverによりデータベース解析した結果,N末端側からWYQNMIR(トリプトファン,チロシン,グルタミン,アスパラギン,メチオニン,イソロイシン,アルギニン)のアミノ酸配列を示した。実際のWYQNMIRの分子量を計算すると1,117 Daとなり,MALDIで分析された1,010 Daにほぼ等しくなる。その他の所見として軟骨様組織の形成を認めたが,これについてBosshardt20)は組織化学的および免疫組織化学的に証明すべきと記載しているが,トルイジン・ブルーでメタクロマジーを呈し,大型の細胞が対向傾向を示し存在していることから軟骨様組織であると考えている10)。以上のようにEMDを皮下に接種して形成された円形小体は7個のアミノ酸シークエンスで構成されたブタのアメロジェニンのエクソン5の部分配列のWYQNML(I)Rを含んでいた。これらのシークエンスはデータベース検索で,ウシのアメロジェニンII前駆物質(WYQNMLR),アメロジェニンロイシン優位アメロジェニンポリペプチド(LRAP),およびブタのアメロジェニン前駆物質(WYQNMIR)であった。EMDが幼若ブタの歯胚から抽出されているので,ブタのアメロジェニンに含まれるWYQNMIRからなるペプチドを合成し検討を行った。
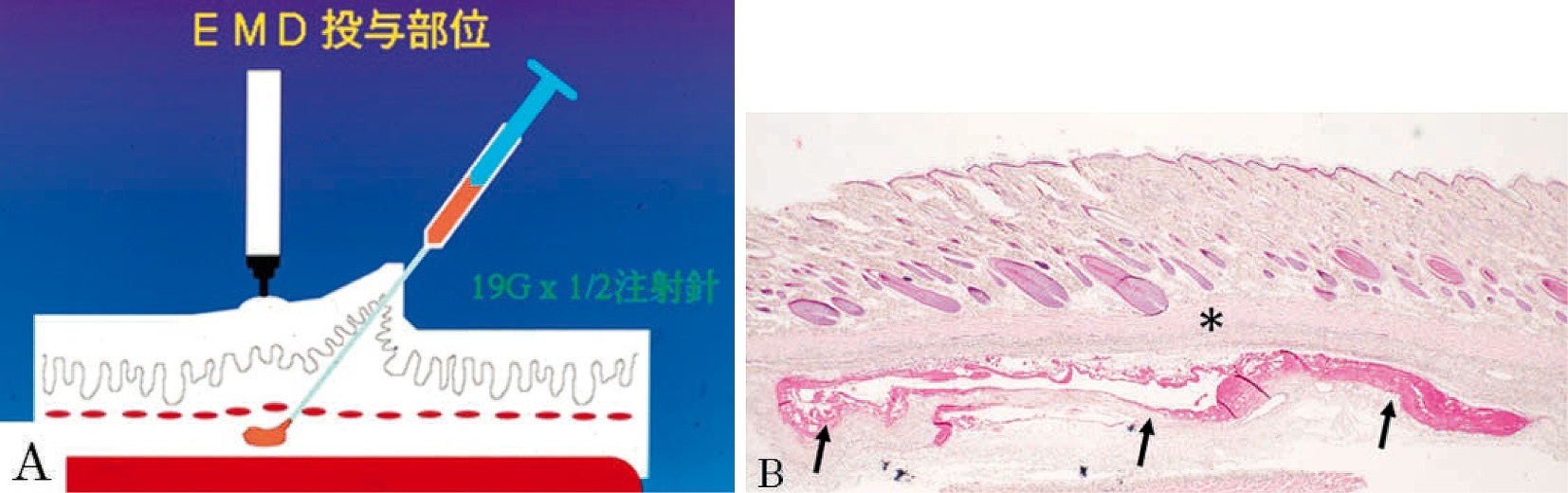
ラット背部皮下へのEMD®の接種。体幹皮筋直下への接種は模式図(A)のように行った。体幹皮筋(*印)直下に接種されたエオジン好性のEMD(矢印)がみられる(B,H-E染色)。(文献10)から引用)
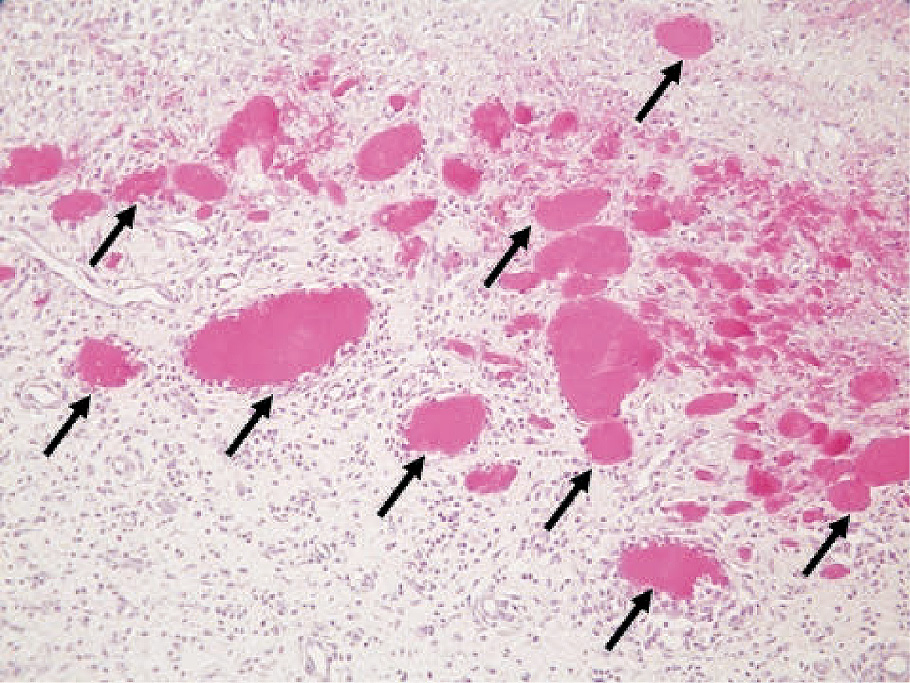
エムドゲイン接種に伴い形成された円形小体(矢印)が多数みられる(H-E染色)。

ペプチドおよびEMDのSDS-PAGE。ペプチドのSDS-PAGEでは約40 kDaにバンド(矢印)が形成されているが,EMDでは形成されていない。(文献10)から引用)M:マーカー,P:ペプチド,E:エムドゲイン®

MALDI-TOFMSの結果。分子量1,010 Da付近に高いピーク(矢印)を認める。(文献10)から引用)
市販の培養ヒト歯根膜線維芽細胞(Lonza Japan社製)に対しては100 ng/mlのペプチドを含有した間質細胞用培地で培養すると,7日目にDNA量は最大を示し,アルカリフォスファターゼ(ALP)活性は経日的に減少した。また,total RNAを抽出し,マイクロアレイ解析を行った結果では,ペプチドを添加した場合に,オステオネクチン遺伝子が1.55倍,BMPレセプター1Aが34.18倍に遺伝子量が増加し,Fibroblast growth factor receptor-like proteinは1/25倍に減少した11)。
ヒトから歯根膜幹細胞を分離,培養し,骨芽細胞用培地でペプチドとともに培養すると,細胞増殖およびALP活性が増強した。また,培養の初期にオステオネクチンの産生が増え,後期にオステオカルシンの産生が増加し,非常に多くの石灰化小塊もみられた16)。また,網羅的遺伝子解析を行い,leucine-rich repeat(LRR)の遺伝子発現が増強していたことを認めた(第23回日本歯科医学会総会発表データ)。
さらにペプチドはヒト間葉系幹細胞の増殖と骨芽細胞への分化を促進し,それは細胞外シグナル関連キナーゼを介して生じていることを明らかにした17)。
ヒト歯根膜細胞を分離培養して,ペプチドの影響についてRT-PCRによって検討した結果,2,3週でplatelet-derived growth beta polypeptideの発現が増強した。オステオカルシンについては培養2週のペプチド群およびEMD群は,対照群と有意差はなかったが,培養3週になるとEMD群のほうが有意に高い産生量であった。培養3週では,EMD群の方が,オステオカルシン産生量が多いとはいえ,合成ペプチド群でもオステオカルシン産生を示しているので,硬組織分化誘導能を持っていると考えられる19)。オステオカルシン産生量について培養3週ではEMD群とペプチド群との間では有意差がみられるが,培養期間を延長した場合については今後の課題である。
SD系ラット骨髄細胞を分離培養し,ペプチドを作用させた結果,ALP活性は有意に高かったことを示し,カルシウム沈着は対照群よりも多くみられたことから,ペプチドはラット骨髄細胞と同様に未分化歯根膜間葉細胞にも硬組織形成を誘導することが考えられる14)。
ペプチドをヒト歯根膜細胞に作用させると増殖,接着,遊走および分化が亢進し,特に細胞遊走についてBoyden Chamberを用いて明らかにした15)。
ペプチドを0.3,3.0,7.5,15.0および30.0 mg/mlの各濃度に調整し,徐放効果をもつとされている歯科用アルジネート印象材を基材として,SD系ラット背部皮下に注射した。注射部位の組織を経日的に採取し,切片を作製し,ヘマトキシリン・エオジン染色,特殊染色,および免疫組織化学的染色を行った。その結果,ペプチド30.0 mg/mlの量の注射後3日では,歯科用アルジネート印象材の小塊がみられ,その近くには,好酸性の円形小体が観察された(図5)。EMDの場合と比較して数は少なかったが,EMDの場合と同様にトルイジン・ブルー染色は陰性であった。7.5 mg/mlのペプチドを接種して14日後に肉眼的には白色の小塊が観察された。病理組織学的には粘液様組織の領域と細胞密度の高い領域の2領域が認められ,粘液様組織の領域にはフォン・コッサ染色陽性の多数の小石灰化物が観察された。15 mg/mlでは,骨および軟骨の形成と軟骨内骨化が認められた(図6)。免疫組織化学的染色では,III型コラーゲンは骨組織および軟骨組織に反応が認められた。一方,von Willebrand因子は,骨組織内に存在する血管内皮に発現しているので,その発現が認められないことは血管が存在しないことを表している。したがって,軟骨には血管が存在しないので,形成された組織の一部は軟骨であることを示している12)。
7週齢の雄性SD系ラットの上顎第一臼歯口蓋側に全層弁を形成した後,歯頸部にラウンドバーを用いて人工的骨欠損を形成した。その部にプロピレン・グリコール・アルジネート(15 mg/mlになるように溶解)水溶液にペプチド(15 mg/ml)を溶解し,その0.3 mlを貼布し,全層弁を元の位置に復位し,吸収性縫合糸にて1糸縫合した。対照として同濃度のプロピレン・グリコール・アルジネートのみを貼布した。術後7日および14日にホルマリン溶液で灌流固定し,組織を採取し,通法に従って切片を作製し,H-E染色を行い検鏡した。対照群の欠損部は術後7日に細胞の豊富な幼若肉芽組織で満たされたが,術後14日には細胞は減少し,線維化が認められた。実験群では,術後7日に線維性結合組織が欠損部を占め,その部の露出象牙質面には破歯細胞による象牙質吸収が観察された。欠損部歯槽頂には不定型の小さな骨様硬組織が存在し,その周囲は立方形の細胞が縁どっていた。術後14日では,欠損部の象牙質表面にセメント質様硬組織の形成は11例中1例に,11例中2例には欠損部の象牙質表面から欠損部に向かって連続性にセメント質様硬組織形成がそれぞれ認められた。11例中8例は対照群と同様の所見であったことから,ペプチドは歯周組織欠損部にセメント質様硬組織形成を誘導することができることを示した(図7)13)。
ペプチドの機能をさらに明らかにするためにラット歯周組織に人工的骨欠損を起こし,ペプチドを貼布して免疫組織化学的に観察すると,上皮細胞の増殖は術後3日間は進行したが,それ以降は止まったことを示した。線維芽細胞は増殖し,タイプIIIコラーゲンは早期に減少し,血管の比率は有意に増加し,血管新生が促進した。ペプチドは創傷治癒を促進し,早期に歯根膜組織の再生を誘導することを示した18)。
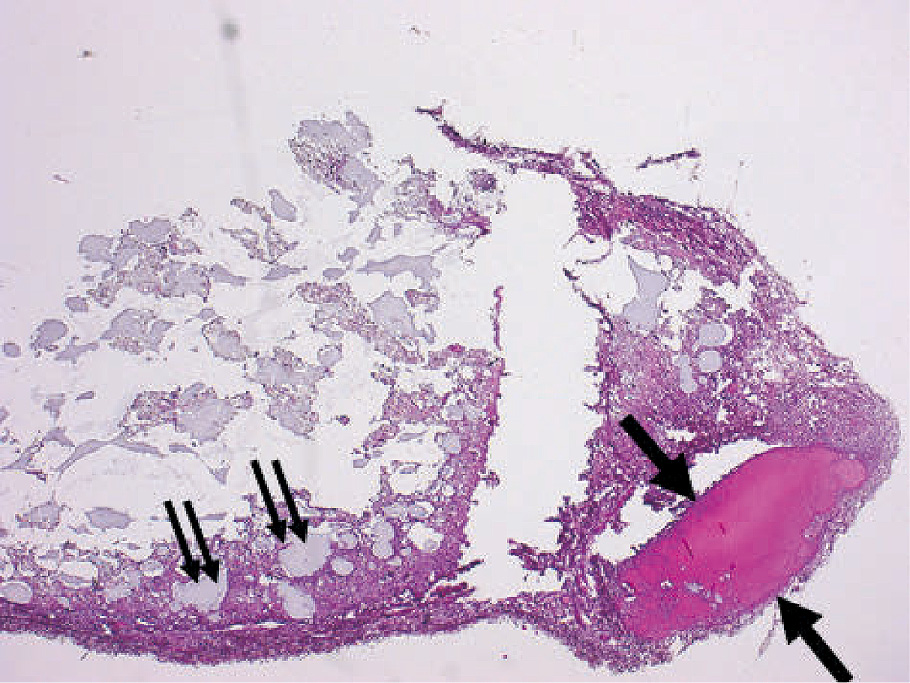
ペプチドに対する組織反応。30 mg/mlペプチド接種後3日にエオジン好性の円形小体(大矢印)およびアルギン酸印象材(二重矢印)が認められる(H-E染色)。(文献12)から引用)

15 mg/mlペプチド接種14日後に肉眼的に認められた白色顆粒状物質の病理組織像(A)を示す。矢印で示す枠内の拡大(B)は軟骨と軟骨内骨化がみられる。二重矢印で示す枠内の拡大(C)は骨と軟骨が認められる(H-E染色)(文献12)から引用)
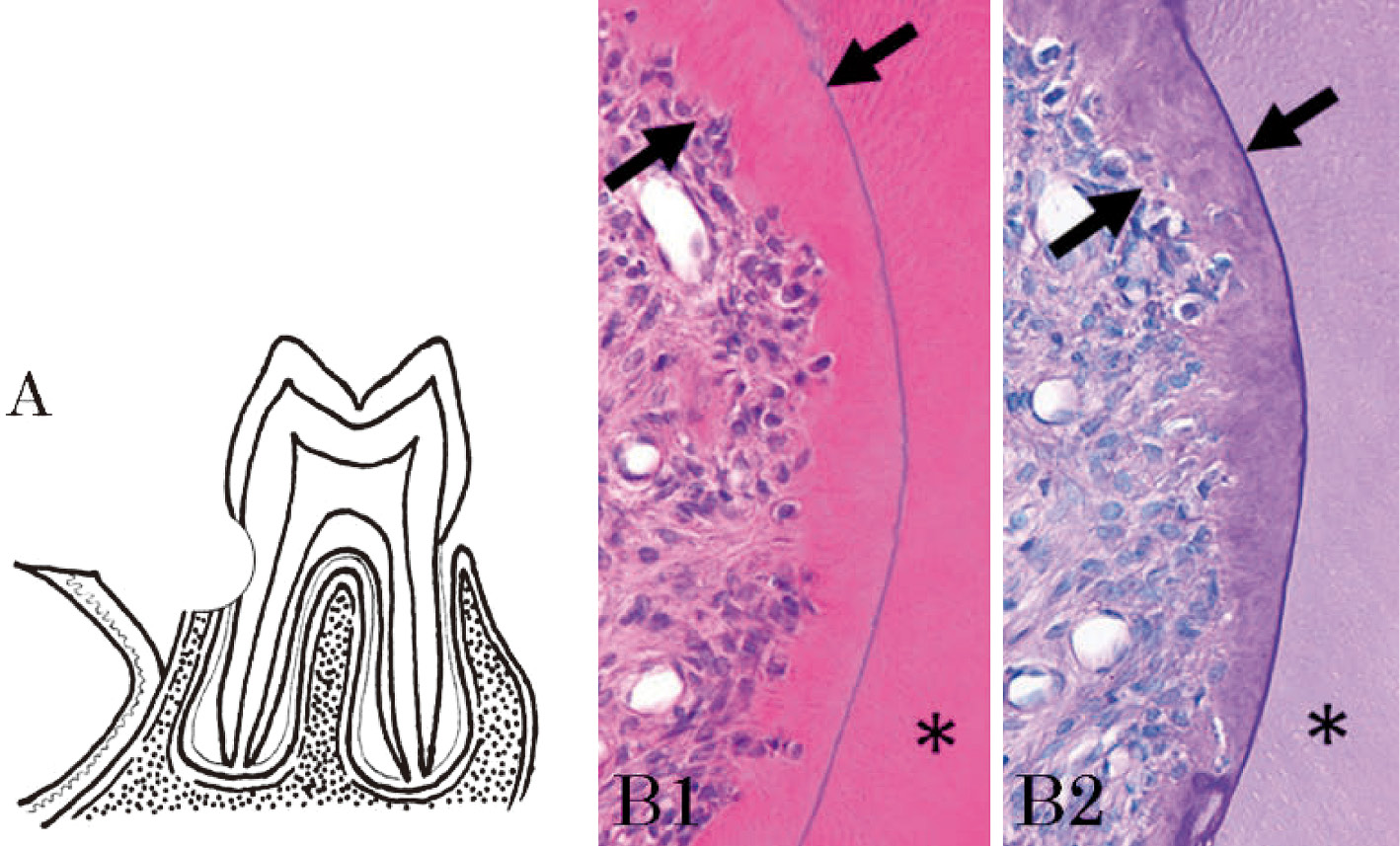
ラット歯周組織の人工的骨欠損の模式図と病理組織像。歯頸部に人工的骨欠損(A)を形成した。欠損部の象牙質(*印)表面にセメント質様硬組織(矢印)がみられ,象牙質(*印)には細管構造が認められるが,セメント質様硬組織(矢印)には細管構造はみられない(B1,H-E染色)。象牙質(*印)表面に形成されたセメント質様硬組織(矢印)は,PAS染色では象牙質よりも濃染している(B2,PAS染色)(文献13)から引用)
Rinconら21)は,歯肉線維芽細胞,歯根膜線維芽細胞,皮膚線維芽細胞の培養細胞に対してEMDを作用させ,20 μg/mlの量で10%FCSを用いたときに最も細胞増殖能および遊走能が高くなったことを報告している。したがって,EMDは創傷治癒の改善にも効果を発揮することを示している。我々もEMDと同様にペプチドによっても培養細胞の増殖を認めた11,14-17)。しかし,細胞の種類によって反応性が異なることがBerryら22)によって示されている。すなわち,彼らは,セメント芽細胞,歯根膜細胞,歯小囊細胞を分離培養してparathyroid hormone/parathyroid hormone-related protein(PTHrP),BMP-2およびEMDに対する反応を検討した結果,各セルラインはPTHrPおよびBMPレセプターを発現しているが,PTHrPおよびBMP-2とEMDに対する反応は全く異なっていることを報告し,再生療法を行う時にはターゲットとする細胞タイプに応じて注意が必要であると述べている22)。
Zhangら23)は,ヒト歯根膜培養細胞にEMDを添加して3日後に細胞増殖およびDNA合成は有意に増加したことを報告している。また,EMDを作用させると骨シアロタンパクとオステオポンチンの骨形成分化マーカーが高度に発現し,歯根膜細胞の骨形成能が増強していることからEMDは細胞増殖を亢進し,歯根膜細胞の分化を促進して歯周組織再生に寄与すると報告している。
ヒト歯根膜細胞,歯肉線維芽細胞,骨肉腫細胞の培養プレートに切開を入れ,EMDを培養液中に添加して創傷部位の細胞の増殖の充塡速度を観察すると歯根膜細胞の創傷充塡速度は,歯肉線維芽細胞および骨肉腫細胞よりも有意に速い結果が報告され,歯根膜細胞の増殖や遊走によって歯周組織の創傷の回復を強めることが示されている24)ことからもEMDは歯根膜線維芽細胞を増殖させる25)ことは明白になっている。ペプチドもEMDと同様に培養細胞を増殖させている11,14-17)。
2) EMDと血管形成Schlueterら26)は,EMDは直接的に血管内皮細胞を刺激することによって血管形成を促し,間接的には歯根膜細胞による血管形成因子の産生を刺激することによって血管形成を行っていると報告していることから,EMDによる血管形成によって創傷治癒が促進するものと考えられる。
3) 骨増生Ohyamaらは27),多能性間葉系細胞であるC2C12はEMDを添加して培養すると,myoblastへの分化が強く阻害されるが,逆にALP活性が亢進することから,多能性間葉系細胞はEMDによって骨芽細胞あるいは軟骨芽細胞へ分化することを報告している。合成ペプチドにより骨形成が促進されるとする我々の研究成果とも一致すると考えられる。このように分化培地を用いることによって,細胞の分化方向が明確になることが示される。歯周組織欠損に対してスキャホールド,EMDおよびiPS細胞を用いた実験でも,オステオカルシン,OsterixおよびRunx遺伝子の発現は亢進していることから,iPS細胞とEMDを共に用いることによってセメント質,歯槽骨および歯根膜の形成を促進したことが報告されている28)。さらに,EMDで処理した歯根膜細胞を非選択的培地で培養すると,骨形成,脂質生成,軟骨形成,新生血管形成,神経形成,グリアなどを示す分化はみられないが,選択的分化培地で培養すると,骨形成,軟骨形成,新生血管形成に関する遺伝子の発現が増強したことをAminら29)は報告している。とくに骨形成や軟骨形成に関与する遺伝子の増強は,実際の骨や軟骨の形成につながるものであり,Hidaら12)の報告と大いに関連するものと考えられる。このことからもEMDは歯根膜細胞の多分化能を調節することができる。
Mrozikら30)は,間葉系間質細胞(骨髄間質細胞および歯根膜線維芽細胞)をEMDで刺激するとコラーゲンタイプI mRNAの発現が72時間培養後に亢進し,BMP-2および骨形成転写因子のCbfa-1の発現は初期の24時間後に増強することを示し,逆にBMP-4の発現は低下することを報告した。Watanabeら31)は,実験的に根尖切除術を行ったイヌの根尖部にEMDを作用させると,セメント質と歯槽骨が形成され,歯根膜も形成されていることを示している。したがって,間葉系間質細胞が存在すれば,EMDの作用で歯根膜が形成され,同時にセメント質および歯槽骨も形成されることになる。これは合成ペプチドを投与した場合にも辺縁部の歯周組織でも同様の現象がみられた13)ことにも通じる。また,菊池32)もラットの人工的な歯槽骨欠損に対してもEMDは線維埋入のセメント質の再生をもたらし,良好な歯周組織の再生をもたらしていることを報告している。
Mironら33)は生体材料として天然骨粒子を用い,それにEMDを塗布し,人工的な大腿骨欠損に埋入すると,非塗布に比較して骨の形成が早まるとしている。さらにPrataら34)によると自家骨にEMDを塗布して抜歯窩に再植すると,非塗布群に比較して10~15%の骨増生がみられ,骨形成が促進している。
我々の研究ではEMDおよびペプチドを皮下組織に接種して骨組織や軟骨様組織の形成をみている10,12)が,Chanら35)は,CD1雄性マウスの大腿筋肉内に①ハイドロキシアパタイトβリン酸三カルシウム(HA-βTCP)のみ,②EMDコーティングβTCPあるいは③血小板由リコンビナント成長因子でコーティングしたβ-TCPを填入したゼラチンカプセルをそれぞれ埋入して組織反応を観察しているが,筋肉内には骨誘導能は増強しないとしている。この違いは使用したEMDの濃度や接種方法が異なり,我々は直接,皮下組織に適用している差によると考えている。
4) EMDと細胞接着エナメルマトリックスタンパクは濃度依存的にファイブロネクチンに結合し,ラミニンとタイプIVコラーゲンとは結合しなかった。そのような相互作用は線維芽細胞と上皮細胞との接着を良くし,結合組織再生を促進すると報告している36)。また,骨芽細胞および歯根膜細胞は,EMDコーティングの移植材には接着しやすいが,血液コーティング移植材には接着しにくい。また,EMDは骨芽細胞とPDL細胞の接着,増殖,分化を高め,血液で汚染された移植材へのEMDの吸着が阻害されることが示されている37)。
EMDは,歯根膜細胞の培養2~5日後にconnexin43とNカドヘリンの発現を有意に促進して骨芽細胞の細胞間分子コミュニケーションと接着分子の発現を助長し,骨芽細胞の分化および石灰化を起こすことから,臨床での新生骨の形成が生じる根拠となることを報告している38)。
5) EMDと遺伝子発現Tokiyasuら39)はオステオカルシンのプロモーターSV40トランスジェニックマウスから採取したセメント芽細胞をEMDで処理して培養し,細胞増殖,遺伝子発現,フォン・コッサ染色性をin vitroで明らかにし,免疫不全マウスに移植してin vivoで検討されている。それによると,EMDはセメント芽細胞のオステオカルシン転写を減弱させ,オステオポンチンの発現は培養8日後に若干,向上させたことからEMDはセメント芽細胞の活性に影響を与え,歯周組織再生の場においては細胞活性を制御するとしている。また,Parkarら40)は,EMDで処理した培養歯根膜細胞の遺伝子発現について268遺伝子のcDNAアレイ解析を行い,46%(125/268)の遺伝子が歯根膜細胞に発現していることを見出し,125遺伝子のうち,38遺伝子にEMDの存在下で発現量が変化したことを認めている。38遺伝子のうち,12遺伝子は発現が低下し,そのほとんどは炎症性の遺伝子であり,一方26遺伝子は発現が上昇し成長因子や成長因子レセプターをコードする遺伝子であったと報告している。同様に合成したペプチドを市販の培養歯根膜細胞に作用させると,骨芽細胞の分化や骨形成に関与するオステオネクチンやBMPレセプター1A遺伝子の発現が増加し11),また,ヒトから分離培養した歯根膜幹細胞にペプチドを作用させると,LRR遺伝子の発現を見出している(第23回日本歯科医学会総会発表データ)。したがって,合成したペプチドにも歯根膜細胞から骨芽細胞への分化や骨形成に関与する遺伝子の発現を誘導していることから,EMDと同様の作用を持っていることが示唆される。
EMDをラット背部皮下に接種してエオジン好性の円形小体が形成され,それをSDS-PAGEにかけると,EMDそのもののSDS-PAGEでは,みられなかった約40 kDaのバンドが確認できた。それをMALDI-TOFMS分析することによってブタのアメロジェニンのエクソン5の部分配列と同じアミノ酸シークエンス(WYQNMIR)を見出した。これをもとにペプチドを合成し,in vitroおよびin vivoで解析した結果,歯根膜細胞などの細胞の増殖や骨形成マーカーの発現などを誘導することを認め,EMDと同じ作用がみられたので,今後,これをさらに発展させていきたいと考えている。
今回の論文に関連して,開示すべき利益相反状態はありません。