はじめに
歯肉増殖症は,歯肉形態の不良による審美性の悪化をもたらすばかりでなく,プラークコントロールを困難にし,歯を移動させて咀嚼機能や,発音などにも影響を及ぼすことがある。歯肉増殖症のうち薬剤によるものは,1939年にKimballより発表されたフェニトイン(PHT)によるもの1),1984年にRamon,Ledermanらによって発表されたカルシウム拮抗剤(主としてニフェジピン:NF)によるもの2,3),1983年にRateitschak-Plüssによって発表された免疫抑制剤シクロスポリンA(CsA)によるもの4),の3種類に大きく分類される。これら3つは類似点も多いが,様々な違いもある。原因薬剤のうち,カルシウム拮抗剤は日本では降圧剤の第一選択薬である。また,超高齢社会に突入して久しい日本では高血圧の患者が多く,本剤を投薬されている患者も多い。従って,カルシウム拮抗剤性歯肉増殖症は研究報告も多く,服用患者における発症率は他の薬剤と比較して高くないが,日常臨床で遭遇する機会は多い。そこで今回は,PHTやCsAの例を参照しながらカルシウム拮抗剤性歯肉増殖症について考えてみたい。
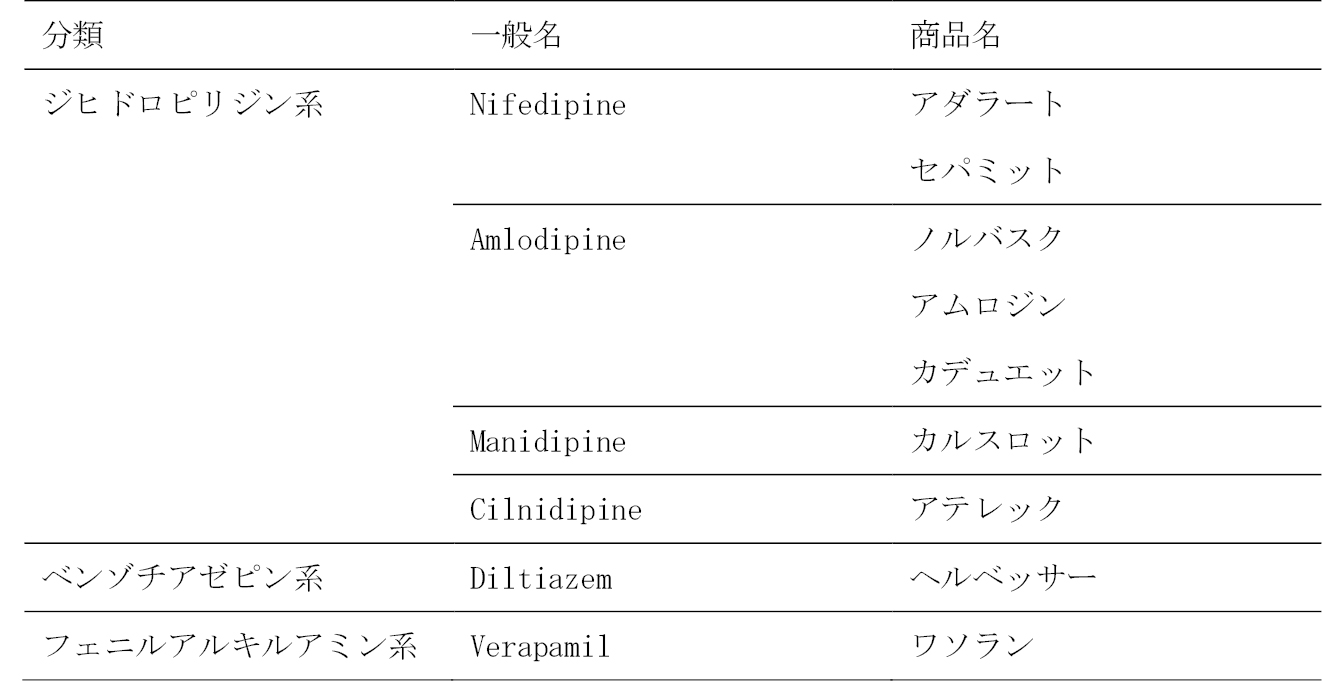
1. カルシウム拮抗剤の種類と発症率
歯肉増殖症を誘発すると言われているカルシウム拮抗剤を表1に示す。
多くの場合,これらの薬剤投与開始から3か月で歯肉増殖症が発症するが,1年以上経てから発症する例もある5)。好発部位は,PHT性歯肉増殖症では前歯部歯間部と言われているが,カルシウム拮抗剤性歯肉増殖症では,前歯部に限らず炎症の強い部位に好発する。図1にアムロジピン服用患者の臼歯部に発症した歯肉増殖の所見を示す。
カルシウム拮抗剤性歯肉増殖症の発症率に関しては,PHT性歯肉増殖症の約50%,CsA性歯肉増殖症の約30%より低く,約20%と言われているが,現在の日本ではカルシウム拮抗剤を服用している患者数はPHTやCsA服用患者より圧倒的に多く,歯肉増殖症全体に占める割合も多いのが実感である。NF性歯肉増殖症の発症率は報告によってばらつきが大きく,6.3,20,55%など様々である6-8)。発症率が様々なのは,増殖症に明確な診断基準が欠けていることが大きな原因であると思われる。Inglésなどが評価法を考案しているが決定的なものはない9)。表2にInglésの評価基準を示す。
NFと同様にジヒドロピリジン系で近年使用頻度の高いアムロジピンの服用患者は,歯肉増殖症発症率が低く,1.7~5%程度である6,10,11)。ジヒドロピリジン系以外のカルシウム拮抗薬であるdiltiazem,verapamilによる発症率もNFと比べると低く,前者は6.3%,後者は4%と言われている6,12)。臓器移植後の患者はしばしばCsAとカルシウム拮抗剤を同時に投与されており,その場合の発症率および重症度は単独投与よりも増加する13-17)。動物実験においては,これらの薬剤の相互作用が認められたものと18)認められなかったもの19)に分かれている。興味深いことに,CsAとアムロジピン,NFを併用した場合の発症率は,それぞれ72%と53%であり,アムロジピンとの併用の方が高い15)。
2. リスクファクター
動物実験では,歯肉増殖の程度は服用したNFの服用量と血清レベル20-22)に関連することが示されたが,ヒトにおける研究ではこの関連性は認められなかった7,8)。ただし,Seymourらは,ヒトにおける研究で,PHT,CsA性歯肉増殖症では血漿濃度との関連がみられなかったものの,NF性歯肉増殖症では血漿濃度と関連がみられたと報告している16)。また,NFの投与期間は増殖の程度と関連がないと言われているが,あるという報告もある5,23)。歯肉溝滲出液(GCF)中の薬剤濃度については,重症度と関連があると報告されている11,16)。一方,プラークやプラーク指数と増殖の程度は関連していることが示されている7,8,11,16,24,25)。さらに,遺伝的要因も歯肉増殖症の発現において重要である26)。HLA発現をレスポンダーとノンレスポンダー(原因薬剤を服用しても歯肉増殖症を来さない患者)で比較した研究では,HLA-DR2,HLA-B37を発現している患者は,歯肉増殖のリスクが増加した14,16)。また,トランスフォーミング成長因子(TGF)-β遺伝子や線維芽細胞の食作用を左右するα2β1インテグリンの遺伝子多型が関与しているとの報告もある17,27,28)。
3. カルシウム拮抗剤性歯肉増殖症の病態像
臨床的にはカルシウム拮抗剤性歯肉増殖症とPHTおよびCsA性歯肉増殖症は類似しており,病理組織像でもPHT,CsA性歯肉増殖症と同様に,結合組織に細胞外マトリックスの蓄積がみられ,上皮が結合組織内へ入り込んだ上皮突起rete pegがみられる(図2)。伸長,肥厚した上皮には,細胞周期関連蛋白で腫瘍関連マーカーであるKi-67,癌抑制蛋白として知られるp53の発現頻度が高い29)。また,上皮細胞の接着・遊走を促進するペリオスチンも多く発現する30)。さらに上皮のインテグリティの欠如,すなわちE-カドヘリンの減少や不連続なコラーゲンタイプIVの発現パターン,ラミニン5の減少も認められている31,32)。SumeおよびAlshargabiは,IV型コラーゲンを分解するマトリックスメタロプロテアーゼ-2,9の増加を報告した31,33)。我々は,上皮内にランゲルハンス細胞が多く出現することを報告し,口腔上皮の防御能が亢進していると推察した34)。
Sumeらは,結合組織内で線維芽細胞のマーカーである線維芽細胞特異蛋白-1(FSP-1)が多くみられたとしている31)。DNA合成期に発現する増殖細胞核抗原(PCNA)を用いた免疫組織学的研究では,NFを服用していないヒトの歯肉に比べ,顕著に線維芽細胞のPCNA陽性率が高かった35,36)。トリチウムチミジン取り込み試験でも有意に線維芽細胞のDNA合成増加が認められた37)。コラーゲン線維の他に非コラーゲン性線維の蓄積も報告されている33,38)。また,Romanosらは,フィブロネクチンのミクロフィブリルの繊細なネットワークが「雲」パターンの分布の外観を示していると報告している39)。さらに,浮腫が所々にみられ,血管内皮細胞も多く,粘膜固有層には様々な線維性および肥大性疾患とも関連するTGF-βの発現がみられる24,40,41)。
線維化や炎症の程度についても他の薬剤を投与された場合と比較されている42,43)。線維化はPHT性歯肉増殖症で強く,次にNF性,CsA性と報告されている。逆に炎症はCsAによるものが強い40)。我々は,CsAがヒト歯肉線維芽細胞においてToll様受容体(TLR)2およびTLR4を介するシグナル伝達を増強し,インターロイキン(IL)-6やIL-8などのサイトカインの産生や接着分子CD54の発現を促進することを報告した44)。この現象についてTrackmanらは,おそらくCsAによって獲得免疫が抑制された代替として自然免疫系が活性化し,IL-6やIL-8およびCD54の発現が促進されたのであろうと考察している43)。カルシウム拮抗剤性歯肉増殖症に浸潤している炎症細胞は,好中球,マクロファージ,CD8陽性細胞,ヘルパーT(Th)17細胞,形質細胞,肥満細胞など多様である8,23,45-50)。
4. カルシウム拮抗剤性歯肉増殖症の病因
炎症時に発現するサイトカインには線維化をきたすものが多く含まれる51)。また,歯肉に発現するTLRはプラーク中の菌体成分を認識して炎症を誘導するが,線維化のシグナルも誘導する51)。この線維化シグナルを増強するのが歯肉増殖症誘導性薬剤であると言われている。実際,歯肉増殖と歯肉の炎症性細胞浸潤とが関連していることを示す文献は多い6,14,16,45,48,50)。一方,動物では,炎症を起こさないでも歯肉の増大がみられる場合があることには注意しなければならない20-22)。炎症が増殖症を惹起するのか,それとも重症度のみに関与しているのか結論はでていない。
また,カルシウム拮抗剤の副作用に浮腫がある。上述したようにNF性増殖症で浮腫はよくみられるが,NFの投与によって動脈系の拡張が起こり,それに対して静脈系の拡大が起こらないために,浮腫が生じ,血液が鬱滞することによって炎症が増強され,二次的に線維化をきたすことも原因の1つとされている38)。コットンペレットをラットの背部に挿入しNFを経口投与したところ,コットンペレット内に早期に浮腫が発生し,その後ハイドロキシプロリンやコラーゲン線維の密度が高くなった52,53)。すなわち,浮腫が起こることによって増殖の「場」が提供されるのかもしれない。
歯肉増殖症では上皮突起が伸長しているとの特徴から,上皮のDNAの傷害や,アポトーシスの阻害が起きているのではないかと推測されている29,54)。また,肥満細胞が伸展した口腔上皮直下に多く認められ,上皮の増殖に何らかの関係があると考えられている49)。さらに,上皮のインテグリティの欠如がみられることから,発育時や癌化および線維症発症時にみられるように,上皮細胞がTGF-β等の作用によって線維形成性線維芽細胞様細胞に細胞の型を超えてトランス分化する現象(上皮間葉転換)が関与していることが報告されている31,33)。
米田は,ヒト歯肉線維芽細胞にカルシウムチャネルがあることを電気生理学的に確認しているが24),カルシウムイオン流入阻害によって増殖症が引き起こされるのかどうかははっきりしていない。武田らはNFのみでなく,臨床的に類似する増殖症を引き起こすPHTやCsAにもカルシウムイオン流入阻害作用があると述べている38)。Barclayらは,薬剤によるカルシウムイオンの細胞内輸送の阻害が歯肉増殖の原因ではないかと述べているが,詳しい機序は明らかではない7)。
FSP-1およびPCNA陽性細胞の増加などから,線維芽細胞の増殖亢進によって増殖症が引き起こされていることもメカニズムの1つと考えられる26,42)。NFは線維芽細胞にエンドセリンを誘導し,そのエンドセリンが線維芽細胞の増殖を招くとする報告がある55)。さらにSumeらは,アムロジピンが歯肉上皮組織の直下でIL-17Aの増加を引き起こすことを示し,それがTGF-βの発現を介して上皮間葉転換による線維芽細胞の増加と歯肉増殖症組織に線維性変化を誘発する可能性があると述べている48)。NFによる歯肉線維芽細胞の増加は,歯肉線維芽細胞のアポトーシスの低下のためであるとする研究成果もある36,43,56)。
線維芽細胞のコラーゲン蛋白産生が,レスポンダーの歯肉線維芽細胞においては有意に亢進していたとされる一方,健常な歯肉線維芽細胞にNFを単独で作用させるとコラーゲンの合成が減少することもある37,57)。また,NFとIL-1βを同時に歯肉線維芽細胞に作用させるとコラーゲン産生において相乗作用がみられる58)。さらに,Luらは,結合組織成長因子(CTGF/CCN2)発現およびプロコラーゲンα1(I)mRNA発現が増強すると述べている59)。TGF-β1は細胞外マトリックス蛋白質の産生および沈着促進に働く重要な因子であり,NFはTGF-βのシグナルを増強すると報告されており30),多くの研究者がカルシウム拮抗剤性歯肉増殖症とTGF-βの関連性を指摘している30,31,33,40,60)。さらに,TGF-βによって発現が促進されるCTGF/CCN2に関する研究も多い40,59)。
コラーゲン代謝の不活性化が細胞外マトリックスの蓄積を引き起こすという報告も多くある25,28,29,61-63)。線維芽細胞には貪食型とそうでないタイプがあり,線維性の組織には貪食型が少ない。NFはその貪食型の比率を顕著に減少させる61)。Nishimuraらは,NFは,培養歯肉線維芽細胞においてカテプシン-L活性とmRNA発現を特異的に抑制し,カテプシンL欠損はリソソームの蓄積を引き起こし,それが細胞内の消化作用を著しく阻害したと報告している63)。事実,カテプシン-L遺伝子を欠損したマウスは,歯肉の肥大を示した。
5. カルシウム拮抗剤性歯肉増殖症の治療
カルシウム拮抗剤性歯肉増殖症は,審美性不良,プラークの蓄積促進,歯の移動,咀嚼不良,発音障害を引き起こし,患者の生活の質の低下,全身の健康への間接的な悪影響をもたらす可能性があるため,その治療に対する期待は大きい。本疾患は薬剤の副作用と炎症との複合疾患であることがより鮮明になってきたこと,また,日本が超高齢社会に突入したことから,より非侵襲的な治療が求められるようになった。すなわち,保存療法/消炎療法が治療の中心となり,歯周外科治療の頻度は少なくなってきている。特に,カルシウム拮抗剤性歯肉増殖症では,薬剤を中止することなく基本治療のみで治癒するという報告が増えてきている13,51,64,65)。図3に,ブラッシング指導と不良補綴物の除去およびSRPなどの歯周基本治療のみで治癒したカルシウム拮抗剤性歯肉増殖症の症例を示す。Seymourらが,NFの血漿濃度と歯肉増殖の程度は関連があると述べ16),動物実験においても薬剤変更の治療効果が明らかにされていることから21),歯肉増殖症誘導薬剤の使用中止または変更は病態改善の有効な手段と考えられる3,11,57)。薬剤投与中止または変更後1~8週間で症状が消退すると言われている11)。図4に,降圧剤をACE阻害剤に変更し,歯肉の増殖が著明に減少し,歯もほぼ正常な位置に復位したアムロジピン性歯肉増殖症の症例を示す。降圧剤には他に多くの種類の薬剤があるため,変更は容易と思われがちである。しかし,カルシウム拮抗剤は糖尿病や高脂血症,腎機能障害のある人にも用いることができるため,合併症を持つことの多い高齢者に対して処方上の利点があり,さらに降圧効果が迅速かつ確実なので,薬剤変更に慎重な内科医も多い。また,薬剤変更の場合の細かい用量調整の効果はまだ十分に明らかにされていない66)。また,狭心症やバージャー病など降圧以外(血流量不足回避など)の目的で使用している時は薬剤の変更が不可能な場合もある。カルシウム拮抗剤の場合には,薬剤の変更なしで歯肉増殖が消退した例も少なからずあるので,まずは消炎治療を行い,基本治療の再評価時に改善が見られない場合に医師との話し合いの上,変更可能であれば変更してもらう方がよいと思われる。上述したように,服用量と増殖度の関連性は薄いので,薬剤の減量はあまり効果がないものと思われる。カルシウム拮抗剤とCsAを併用している場合には,免疫抑制作用を有するタクロリムスは増殖症を引き起こさないので,CsAからタクロリムスに変更することも推奨されている67)。
歯周外科治療は,若年者の症例が多いPHT性歯肉増殖症に対しては外斜切開による歯肉切除術が主に行われているが,カルシウム拮抗剤性歯肉増殖症のように骨縁下ポケットが存在する症例では,炎症巣を完全には除去できないため再発する例が多い。また,付着の喪失があるような症例に歯肉切除術を行うと角化歯肉の大幅な喪失につながる。そのため,付着の喪失を伴う場合は,切開線をやや辺縁から離した内斜切開によるフラップ手術を行う。Pilloniは,NFによる歯肉増殖症においては歯肉切除術よりもフラップ手術の方が歯周ポケットの除去が確実であり,治療効果も優れていると報告した68)。その理由として,術後の細胞分裂活性は,開放創である歯肉切除術の場合が閉鎖創であるフラップ手術よりも高く,そこに服用薬剤が作用すると歯肉切除術症例の方が歯肉増殖の再発が起こりやすいことを挙げている。また,付着の喪失がない場合や増殖が軽度な場合は,電気メスや無痛的で出血量も少なく治癒が早く,再発も少ないレーザーによる歯肉切除術も行われるようになってきた69)。
また,歯肉増殖症は線維性のため,歯の移動を引き起こすことが多いので,矯正治療が必要なこともある23)。SPT・メインテナンスももちろん重要である。特に歯周外科治療後にメインテナンスを怠ると,術後12~18か月に再発が起きることが報告されている60)。カルシウム拮抗剤性歯肉増殖症の治療の流れを図5にまとめた。
6. まとめ
近年,高齢者の増加とともに増加傾向にあるカルシウム拮抗剤性歯肉増殖症の治療は薬剤の変更よりも炎症を消退させるための治療を優先すべきと考えられる。またPHT性歯肉増殖症の治療と大きく異なるのは,年齢層の違いから増殖症と歯周炎が合併しており,軽症の場合は別として,歯周外科治療の場合にはフラップ手術を応用する場合が多いということである。これは広く一般に認識されていないかもしれないが,これからの歯科治療を担う若い歯科医師に是非知っておいて欲しいことである。将来的には,これらの既存の治療法に加えてTGF-βの制御や遺伝子検査の応用などの新しい治療法が開発されることが期待される。
今回の論文に関連して,開示すべき利益相反状態はありません。
References
- 1) Kimball OP: The treatment of epilepsy with sodium diphenylhydantoinate. J Am Med Assoc, 112: 1244-1245, 1939.
- 2) Ramon Y, Behar S, Kishon Y, Engelberg IS: Gingival hyperplasia caused by nifedipine - a preliminary report. Int J Cardiol, 5: 195-206, 1984.
- 3) Lederman D, Lumerman H, Reuben S, Freedman PD: Gingival hyperplasia associated with nifedipine therapy. Report of a case. Oral Surg. Oral Med. Oral Pathol, 57: 620-622, 1984.
- 4) Rateitschak-Plüss EM, Hefti A, Lörtscher R, Thie G: Initial observation that cyclosporin-A induced gingival enlargement in man. J Clin Periodontol, 10: 237-246, 1983.
- 5) Bondon-Guitton E, Bagheri H, Montastruc JL: Drug-induced gingival overgrowth: a study in the French Pharmacovigilance Database. J Clin Periodontol, 39: 513-518, 2012.
- 6) Ellis JS, Seymour RA, Steele JG, Robertson P, Butler TJ, Thomason JM: Prevalence of gingival overgrowth induced by calcium channel blockers: a community-based study. J Periodontol, 70: 63-67, 1999.
- 7) Barclay S, Thomason JM, Idle JR, Seymour RA: The incidence and severity of nifedipine-induced gingival overgrowth. J Clin Periodontol, 19: 311-314, 1992.
- 8) Nery EB, Edson RG, Lee KK, Pruthi VK, Watson J: Prevalence of nifedipine-induced gingival hyperplasia. J Periodontol, 66: 572-578, 1995.
- 9) Inglés E, Rossmann JA, Caffesse RG: New clinical index for drug-induced gingival overgrowth. Quintessence Int, 30: 467-478, 1999.
- 10) Dongari-Bagtzoglou A: Drug-associated gingival enlargement. J Periodontol, 75: 1424-1431, 2004.
- 11) Nakib N, Ashrafi SS: Drug-induced gingival overgrowth. Dis Mon, 57: 225-230, 2011.
- 12) Miller CS, Damm DD: Incidence of verapamil-induced gingival hyperplasia in a dental population. J Periodontol, 63: 453-456, 1992.
- 13) 色川 大輔, 藤田 貴久, 山本 茂樹, 増田 浩之, 齋藤 淳: シクロスポリンAおよびシルニジピンによる歯肉増殖を伴う慢性歯周炎の一症例. 日歯周誌, 56: 72-81, 2014.
- 14) Thomason JM, Seymour RA, Ellis JS, Kelly PJ, Parry G, Dark J, Wilkinson R, Ilde JR: Determinants of gingival overgrowth severity in organ transplant patients. An examination of the role of HLA phenotype. J Clin Periodontol, 23: 628-634, 1996.
- 15) James JA, Marley JJ, Jamal S, Campbell BA, Short CD, Johnson RW, Hull PS, Spratt H, Irwin CR, Boomer S, Maxwell AP, Linden GJ: The calcium channel blocker used with cyclosporin has an effect on gingival overgrowth. J Clin Periodontol, 27: 109-115, 2000.
- 16) Seymour RA, Ellis JS, Thomason JM: Risk factors for drug-induced gingival overgrowth. J Clin Periodontol, 27: 217-223, 2000.
- 17) Linden GJ, Haworth SE, Maxwell AP, Poulton KV, Dyer PA, Middleton D, Irwin CR, Marley JJ, McNamee P, Short CD, Hull PS, James JA: The influence of transforming growth factor-β1 gene polymorphisms on the severity of gingival overgrowth associated with concomitant use of cyclosporin A and a calcium channel blocker. J Periodontol, 72: 808-814, 2001.
- 18) Morisaki I, Fukui N, Fujimori Y, Murakami J, Daikoku H, Amano A: Effects of combined oral treatments with cyclosporine A and nifedipine or diltiazem on drug-induced gingival overgrowth in rats. J Periodontol, 71: 438-443, 2000.
- 19) Chiu HC, Fu E, Chiang CY, Liu D: Does nifedipine aggravate cyclosporin-induced gingival overgrowth? An experiment in rats. J Periodontol, 72: 532-537, 2001.
- 20) Ishida H, Kondoh T, Kataoka M, Nishikawa S, Nakagawa T, Morisaki I, Kido J, Oka T, Nagata T: Factors influencing nifedipine-induced gingival overgrowth in rats. J Periodontol, 66: 345-350, 1995.
- 21) Nishikawa S, Nagata T, Morisaki I, Oka T, Ishida H: Pathogenesis of drug-induced gingival overgrowth. A review of studies in the rat model. J Periodontol, 67: 463-471, 1996.
- 22) Fu E, Nieh S, Hsiao CT, Hsieh YD, Wikesjö UM, Shen EC: Nifedipine-induced gingival overgrowth in rats: breif review and experimental study. J Periodontol, 69: 765-771, 1998.
- 23) 二宮 雅美: 歯列不正を伴う重度薬物性歯肉増殖症患者に対して包括的歯周治療を行った一症例. 日歯周誌, 61: 37-46, 2019.
- 24) 米田 栄吉: 薬剤性歯肉増殖症の発症機序を探る. 日歯周誌, 44: 315-321, 2002.
- 25) Moffitt ML, Bencivenni D, Cohen RE: Drug-induced gingival enlargement: an overview. Compend Contin Educ Dent, 34: 330-336, 2013.
- 26) Doufexi A, Mina M, Ioannidou E: Gingival overgrowth in children: epidemiology, pathogenesis, and complications. A literature review. J Periodontol, 76: 3-10, 2005.
- 27) Kataoka M, Kido J, Shinohara Y, Nagata T: Drug-induced gingival overgrowth-a review. Biol Pharm Bull, 28: 1817-1821, 2005.
- 28) Ogino M, Kido J, Bando M, Hayashi N, Wada C, Nagata T, Nishimura F, Soga Y, Takashiba S, Kubota T, Itagaki M, Shimada Y, Tai H, Yoshie H, Yamazaki N, Shinohara Y, Kataoka M: α2 integrin+807 polymorphism in drug-induced gingival overgrowth. J Dent Res, 84: 1183-1186, 2005.
- 29) Saito K, Mori S, Tanda N, Sakamoto S: Expression of p53 protein and Ki-67 antigen in gingival hyperplasia induced by nifedipine and phenytoin. J Periodontol, 70: 581-586, 1999.
- 30) Kim SS, Jackson-Boeters L, Darling MR, Rieder MJ, Hamilton DW: Nifedipine induces periostin expression in gingival fibroblasts through TGF-beta. J Dent Res, 92: 1022-1028, 2013.
- 31) Sume SS, Kantarci A, Lee A, Hasturk H, Trackman PC: Epithelial to mesenchymal transition in gingival overgrowth. Am J Pathol, 177: 208-218, 2010.
- 32) Kantarci A, Nseir Z, Kim Y-S, Sume SS, Trackman PC: Loss of basement membrane integrity in human gingival overgrowth. J Dent Res, 90: 887-93, 2011.
- 33) Alshargabi R, Sano T, Yamashita A, Takano A, Sanada T, Iwashita M, Shinjo T, Fukuda T, Sanui T, Kishida S, Nishimura F: SPOCK1 is a novel inducer of epithelial to mesenchymal transition in drug-induced gingival overgrowth. Sci Rep, 10: 9785, 2020.
- 34) 尾崎 幸生, 國松 和司, 田尻 公一, 原 宜興, 加藤 伊八: ニフェジピン歯肉増殖症におけるランゲルハンス細胞の上皮内分布および密度に関する免疫組織化学的研究. 日歯周誌, 40: 215-225, 1998.
- 35) 尾崎 幸生, 國松 和司, 田尻 公一, 原 宜興, 加藤 伊八: ヒトニフェジピン歯肉増殖症における抗PCNA抗体を用いた線維芽細胞の増殖に関する研究. 日歯周誌, 39: 217-225, 1997.
- 36) Kantarci A, Augustin P, Firatli E, Sheff MC, Hasturk H, Graves DT, Trackman PC: Apoptosis in gingival overgrowth tissues. J Dent Res, 86: 888-892, 2007.
- 37) Fujii A, Matsumoto H, Nakao S, Teshigawara H, Akimoto Y: Effect of calcium-channel blockers on cell proliferation, DNA synthesis and collagen synthesis of cultured gingival fibroblasts derived from human nifedipine responders and non-responders. Arch Oral Biol, 39: 99-104, 1994.
- 38) 武田 泰典, 鈴木 鐘美, 福田 容子, 戸塚 盛雄: Nifedipine服用者にみられた歯肉の炎症性線維性過形成. 日口診誌, 2: 153-157, 1989.
- 39) Romanos GE, Strub JR, Bernimoulin JP: Immunohistochemical distribution of extracellular matrix proteins as a diagnostic parameter in healthy and diseased gingiva. J Periodontol, 64: 110-119, 1993.
- 40) Uzel MI, Kantarci A, Hong HH, Uygur C, Sheff MC, Firatli E, Trackman PC: Connective tissue growth factor in drug-induced gingival overgrowth. J Periodontol, 72: 921-931, 2001.
- 41) Saito K, Mori S, Iwakura M, Sakamoto S: Immunohistochemical localization of transforming growth factor β, basic fibroblast growth factor and heparan sulphate glycosaminoglycan in gingival hyperplasia induced by nifedipine and phenytoin. J Periodontal Res, 31: 545-555, 1996.
- 42) Trackman PC, Kantarci A: Connective tissue metabolism and gingival overgrowth. Crit Rev Oral Biol Med, 15: 165-175, 2004.
- 43) Trackman PC, Kantarci A: Molecular and clinical aspects of drug-induced gingival overgrowth. J Dent Res, 94: 540-546, 2015.
- 44) Suzuki AM, Yoshimura A, Ozaki Y, Kaneko T, Hara Y: Cyclosporin A and phenytoin modulate inflammatory responses. J Dent Res, 88: 1131-1136, 2009.
- 45) Ozaki Y, Kunimatsu K, Tajiri K, Hara Y, Kato Y, Aoki Y, Kato I: Role of medullasin in nifedipine-induced gingival overgrowth in rats. Arch Oral Biol, 43: 801-810, 1998.
- 46) Pernu HE, Knuuttila ML: Macrophages and lymphocyte subpopulations in nifedipine- and cyclosporin A-associated human gingival overgrowth. J Periodontol, 72: 160-166, 2001.
- 47) Nurmenniemi PK, Pernu HE, Laukkanen P, Knuuttila ML: Macrophage subpopulations in gingival overgrowth induced by nifedipine and immunosuppressive medication. J Periodontol, 73: 1323-1330, 2002.
- 48) Sume SS, Berker E, Ilarslan Y, Yucel OO, Tan C, Goyushov S, Gultekin SE, Tezcan I: Elevated Interleukin-17A expression in amlodipine-induced gingival overgrowth. J Periodontal Res, 55: 613-621, 2020.
- 49) 國松 和司, 尾崎 幸生, 加藤 伊八, 原 宜興: ヒトニフェジピン誘発性増殖歯肉におけるトリプターゼ陽性マスト細胞の組織内分布に関する免疫組織学的研究. 日歯保誌, 44: 561-569, 2001.
- 50) Kunimatsu K, Ozaki Y, Aoki Y, Kato I: Possible roles of medullasin in nifedipine-induced human gingival overgrowth. Arch Oral Biol, 41: 111-115, 1996.
- 51) Subramani T, Rathnavelu V, Alitheen NB, Padmanabhan P: Cellular crosstalk mechanism of Toll-like receptors in gingival overgrowth (review). Int J Mol Med, 35: 1151-1158, 2015.
- 52) 小林 雅美: ニフェジピンと歯肉増殖症の関連性に関する研究-cotton pellet肉芽腫に及ぼすニフェジピン投与の影響. 日歯周誌, 33: 270-279, 1991.
- 53) 尾崎 幸生, 阿部 嘉裕, 白石 千秋, 國松 和司, 原 宜興: ラット炎症モデル (コットンペレット肉芽腫) に及ぼすニフェジピン投与の影響. 日歯保誌, 46: 526-532, 2003.
- 54) Shimizu Y, Kataoka M, Seto H, Kido J, Nagata T: Nifedipine induces gingival epithelial hyperplasia in rats through inhibition of apoptosis. J Periodontol, 73: 861-867, 2002.
- 55) Sano M, Ohuchi N, Inoue T, Tono K, Tachikawa T, Kizawa Y, Murakami H: Proliferative response to phenytoin and nifedipine in gingival fibroblasts cultured from humans with gingival fibromatosis. Fundam Clin Pharmacol, 18: 465-470, 2004.
- 56) Fujimori Y, Maeda S, Saeki M, Morisaki I, Kamisaki Y: Inhibition by nifedipine of adherence- and activated macrophage-induced death of human gingival fibroblasts. Eur J Pharmacol, 415: 95-103, 2001.
- 57) Pernu HE, Oikarinen K, Hietanen J, Knuuttila M: Verapamil-induced gingival overgrowth: a clinical, histologic, and biochemic approach. J Oral Pathol Med, 18: 422-425, 1989.
- 58) Johnson RB, Zebrowski EJ, Dai X: Synergistic enhancement of collagenous protein synthesis by human gingival fibroblasts exposed to nifedipine and interleukin-1-beta in vitro. J Oral Pathol Med, 29: 8-12, 2000.
- 59) Lu HK, Tseng CC, Lee YH, Li CL, Wang LF: Flutamide inhibits nifedipine- and interleukin-1β-induced collagen overproduction in gingival fibroblasts. J Periodontal Res, 45: 451-457, 2010.
- 60) 吉岡 奈保, 佐藤 聡, 河村 博, 鴨井 久一: 高血圧自然発症ラット (SHR) を用いたニフェジピン歯肉増殖症の発症機序に関する研究. 日歯周誌, 45: 289-299, 2003.
- 61) McCulloch CA, Knowles GC: Deficiencies in collagen phagocytosis by human fibroblasts in vitro: a mechanism for fibrosis? J Cell Physiol, 155: 461-471, 1993.
- 62) Kataoka M, Shimizu Y, Kunikiyo K, Asahara Y, Azuma H, Sawa T, Kido J, Nagata T: Nifedipine induces gingival overgrowth in rats through a reduction in collagen phagocytosis by gingival fibroblasts. J Periodontol, 72: 1078-1083, 2001.
- 63) Nishimura F, Naruishi H, Naruishi K, Yamada T, Sasaki J, Peters C, Uchiyama Y, Murayama Y: Cathepsin-L, a key molecule in the pathogenesis of drug-induced and I-cell disease-mediated gingival overgrowth: a study with cathepsin-L-deficient mice. Am J Pathol, 161: 2047-2052, 2002.
- 64) 久保田 玲子: ニフェジピンによる歯肉増殖を伴う慢性歯周炎の一症例. 日歯周誌, 49: 55-60, 2007.
- 65) 武藤 昭紀, 窪川 恵太, 海瀬 聖仁, 高橋 弘太郎, 三木 学, 阪中 孝一郎, 大野 友三, 内田 啓一, 小松 寿, 吉成 伸夫: 歯周基本治療により改善が見られたカルシウム拮抗剤誘発性歯肉増殖の2症例. 日歯周誌, 55: 45-53, 2013.
- 66) Bharti V, Bansal C: Drug-induced gingival overgrowth: The nemesis of gingiva unravelled. J Indian Soc Periodontol, 17: 182-187, 2013.
- 67) Greenberg KV, Armitage GC, Shiboski CH: Gingival enlargement among renal transplant recipients in the era of new-generation immunosuppressants. J Periodontol, 79: 453-460, 2008.
- 68) Pilloni A, Camargo PM, Carere M, Carranza FA Jr: Surgical treatment of cyclosporine A- and nifedipine-induced gingival enlargement: gingivectomy versus periodontal flap. J Periodontol, 69: 791-797, 1998.
- 69) Mavrogiannis M, Ellis JS, Seymour RA, Thomason JM: The efficacy of three different surgical techniques in the management of drug-induced gingival overgrowth. J Clin Periodontol, 33: 677-682, 2006.

 間に著明な増殖を認める。
間に著明な増殖を認める。



