2021 Volume 107 Issue 11 Pages 915-922
2021 Volume 107 Issue 11 Pages 915-922
Fe plates with rust layers containing various MgCl2 amounts were prepared as specimens. Each specimen was subjected to dry−wet repeated cycle test beyond 50 cycles, and then subjected to electrochemical hydrogen absorption test under atmospheric corrosion in the air with controlled relative humidity (RH). For an MgCl2 amount of 39.8 g·m−2, a hydrogen absorption rate (iH) started to increase from an RH around 15%, steeply increased with an increase in RH up to about 30%, steeply decreased up to about 35%, gradually increased up to 65% and gradually decreased up to about 92%. A decrease in MgCl2 amount in the range between 0.514 and 39.8 g·m−2 induced a decrease in iH in the whole RH range. The maximum iH at an RH around 30% increased with an increase in MgCl2 amount in the rust layer. Besides, the RH where the maximum iH was obtained beyond an RH of 40% increased with a decrease in MgCl2 amount. From theoretical relationship between RH and thickness of MgCl2 solution film on the Fe plate without rust layer, it is found that the solution film thicknesses at the RHs were about 0.18 mm, almost independent of MgCl2 amount. In addition, thicknesses of the rust layers containing 25.7 and 39.8 g·m−2 MgCl2 were measured to be almost 0.18 mm each other. The trends of iH depending on MgCl2 amount were tried to be explained using nature of deliquescence for MgCl2.
高強度鋼はすでにボルトや自動車部品などに使用されており,今なお使用され続けている。また,近年の省資源,省エネルギーの観点から,さらに強度の高い鋼材の需要が高まっているために世界中で活発に開発されている。しかし,高強度鋼を水溶液中や大気中で使用すると,水素脆化(HE)を起こす場合があることが知られている1,2)。これまでに多くの研究者が高強度鋼のHE挙動を調査し,次のようなことが明らかにされている。水素原子は,鋼材の腐食に伴うカソード反応によって生成し,鋼材に侵入して鋼材の破壊を誘発する3,4)。鋼材のHE感受性は,鋼材強度5)と鋼中水素濃度の増加6)により上昇する。そのため,HEに関する研究の多くは,より多くの水素が侵入しても優れた耐HE性を発揮する鋼材を開発するために,鋼材の組成や組織に焦点を当てている7,8)。しかし,耐HE鋼を開発する上でのもう一つの重要な点は,鋼材への水素侵入をいかにして抑えるかということである。鋼材への水素侵入に及ぼす腐食電位や溶液のpHなどの環境因子の影響を検討した研究は多くないが,例えば,水素透過係数(水素透過速度と鋼材の厚さの積)の対数が,H2Sを含む中性水溶液中だけでなく,アルカリ性水溶液中でも電位の上昇とともにほぼ直線的に減少すること9–11),鋼材表面の水素濃度が,水素侵入条件を変化させた後に比較的短時間で定常値を示すこと,表面水素濃度の対数が,鋼材の硬さの増加および鋼中水素の拡散係数の逆数の増加に伴って直線的に増加すること,水素濃度は,カソード電位の上昇に伴い減少するが,アノード電位の上昇に伴いわずかに増加すること12,13)などがこれまでに明らかにされている。これらの研究を含め,水素侵入に関する多くの研究は,一般的に研磨された鋼材表面に水溶液を接触された条件で行われてきた。しかし,高強度鋼の水素脆化は大気腐食中に発生することが多く,温度や湿度などの気象条件に関連した水素侵入量の情報を蓄積することも重要である。例えば,研磨された鋼材を大気に曝露して大気腐食を起こし,その間の鋼材の水素透過速度を測定する研究が行われ,より高い温度と最適な湿度で水素侵入が促進されることを明らかにしている14–17)。一方,著者らの研究グループでは,塩を含むさび層を形成させた鋼材の大気腐食中における水素侵入に着目し,NaClまたはMgCl2を含むさび層を形成させたFe板に相対湿度(RH)を制御した大気を接触させて大気腐食を起こし,その間の水素透過速度を連続的に測定することによって,水素透過速度とRHとの関係を検討した。その結果,NaCl18)およびMgCl219)を含むさび層を形成させたFe板の水素透過速度が,制御したRHの範囲でそれぞれ1つおよび2つのピークを持つことが示された。本研究では,MgCl2を含むさび層を形成させたFe板の大気腐食に伴う水素透過速度とRHの関係に及ぼすさび層MgCl2含有量の影響を検討した。
供試材には厚さが2 mmの純Fe板(純度99.5 mass%)を用いた。この供試材を40 mm×40 mmの形状に加工し,1073 Kで1.8 ks加熱保持後炉冷した。SiC紙を用いて試料表面に#6/0(#800)まで機械研磨を行って酸化皮膜を除去した後,電解研磨により機械研磨で生じた加工層を除去した。電解研磨の反応槽にはPt対極, Ag/AgCl参照電極(飽和KCl,室温298 K)を設置し,試料とともにポテンシオスタット(東方技研製PS-07)に接続した。電解研磨液には,試薬特級H3PO4(和光純薬製,85 mass%)75 vol%と試薬特級H2SO4(和光純薬製,95 mass%)25 vol%を混合させた溶液を使用し,試料を浸漬させた後,+1.5 VAg/AgClの電位を試料に86.4 ks印加した。この電解研磨によって試料表面を50 µm溶解除去した。その後,つぎの方法で電解Niめっきを行った。電解研磨浴にはWatt浴(NiSO4·6H2O:250 kg·m-3,NiCl·6H2O:45 kg·m-3,H3BO3:40 kg·m-3)を333 Kで使用した。試料の片面をPolytetrafluoroethyleneテープで被覆した試料をポテンシオスタット(東方技研製Model 2000)に接続し,-10 A·m-2の電流密度を420 s印加した。この条件で行われたNiめっきの厚さは約15 nmであるとYoshizawaら20,21)によって報告されている。
Niめっきを行っていない試料表面には,つぎの手順によってさび層を形成させた。0.002 kmol·m-3から0.1 kmol·m-3のMgCl2水溶液を準備した。O-ring(直径31 mm)を用いて接液面積を限定し,そこにMgCl2水溶液を2.0×10-6 m3滴下した後,シリカゲルを入れた密閉容器に86.4 ks保持した。その後,2.0×10-6 m3の純水を滴下して乾燥させる操作を2回行うことによって表面に均一なさび層を形成した。形成したさび層内のMgCl2含有量は0.514 g·m-2,5.14 g·m-2,25.7 g·m-2,39.8 g·m-2である。
2・2 電気化学的水素透過試験電気化学的水素透過試験では,改良したDevanathan-Stachursky型反応槽22,18)を用いた。実験装置の概略図をFig.1に示す。RH 5%以下の乾燥した大気を導入した箱の中に反応槽を設置した。2つの反応槽の間に試料を設置した。さび層側の反応槽は,RHを制御した大気が導入される水素侵入用反応槽である。Niめっき側の反応槽は,0.1 kmol·m-3のNaOH水溶液が導入される水素検出用反応槽であり,Ag/AgCl参照電極とPt対極が設置され,試料とともにポテンシオスタット(東方技研製Model 2090)に接続される。

Schematic illustration of the system for measurement of hydrogen absorption rate during atmospheric corrosion. (Online version in color.)
試験の手順はつぎの通りである。試料を2つの反応槽の間に設置し,水素侵入用反応槽に乾燥大気を導入した。その後,水素検出用反応槽にNaOH水溶液を導入し,水溶液がNiめっき面に完全に接触した後,0 VAg/AgClの不働態保持電位を印加した。不働態アノード電流密度がほぼ定常値である0.2 mA·m-2に到達した後,つぎに示す方法で乾湿繰り返し試験を行った。乾燥した大気とRHを制御した大気をそれぞれ10.8 ksずつ水素侵入用反応槽に導入し,大気腐食を開始・停止させた。試験中には,水素侵入用反応槽内のRHと温度ならびに水素検出面(Niめっき面)のアノード電流密度を同時に記録した。乾湿繰り返しを50回以上行った試料のさび層の表面に,乾燥大気,RHを制御した湿潤大気,乾燥大気の順にそれぞれ約86.4 ks接触させた。また,試験中はRH,温度,アノード電流密度を同時に記録した。水素透過速度(iH)は,湿潤状態でのアノード電流密度の定常値と乾燥状態でのアノード電流密度の定常値の差として定義した。
2・3 水素侵入側の表面水素濃度の算出方法後述するように,湿潤大気が試料表面のさび層に接触すると水素検出面でのアノード電流密度が増加する。この現象は,大気腐食に伴うカソード反応で水素原子が生成され,水素侵入面から侵入し,試料内を拡散して水素検出側に到達して以下のように水素イオンに酸化すると説明されている。
| (1) |
また,大気腐食時に水素検出側のアノード電流密度が定常値になると,試料内の水素の拡散は定常状態になる。この状態はつぎに示すFickの第一法則を満たす。
| (2) |
ここで,Fはファラデー定数,Jは水素の流束,Dは試料内水素の拡散係数,C0は水素侵入側の表面水素濃度,Lは試料厚さである。Fは9.65×104 C·mol-1,Dは5.6×10-9 m2·s-1 12,13),Lは測定値であるため,定常状態のC0はiHから算出することができる。
異なる量のMgCl2を含むさび層を形成させた試料に乾湿繰り返し試験が実施され,試験中の水素検出側アノード電流密度が連続測定された。それぞれの試料に対する湿潤状態の平均RHと乾湿繰り返し総数をTable 1に示す。前報11)で報告されたように,各湿潤期間における水素検出側の最大アノード電流密度(水素透過速度に正の相関性を有する)は,乾湿繰り返し数の増加とともに減少し,さび層に25.7 g·m-2および39.8 g·m-2のMgCl2を含む試料では,40回以上乾湿を繰り返すとほぼ定常値を示した。この変化は,大気曝露された鋼材で観測されたiHの曝露日数に対する変化23)と同様であった。このことは,40回以上乾湿を繰り返すと,同じRHの湿潤状態をそれ以上繰り返し与えてもiHがほぼ再現されることを意味するため,この後に行ったRHとiHの関係を検討する試験は,40回以上乾湿繰り返しを行った試料に対して行った。
| Amount of MgCl2, WMgCl2 / g·m−2 | average RH (%) | End of cycle |
|---|---|---|
| 0.514 | 80 | 60 |
| 5.14 | 70 | 100 |
| 25.7 | 27 | 55 |
| 39.8 | 33 | 100 |
異なる量のMgCl2を含むさび層を形成させた試料に対するRHとiHの関係をFig.2に示す。MgCl2含有量が39.8 g·m-2の場合,iHはRH15%付近から増加し始め,約30%のRHで極大値を示した後に急激に減少した。RHが約35%を超えるとiHは再び増加し,約65%のRHで極大値を示した後に,RH92%まで徐々に減少した。このことより,iHはRHに対して2つのピークを持つことが示された。以下,低RH領域および高RH領域で発現したピークをそれぞれ第1ピークおよび第2ピークと定義する。MgCl2含有量に注目すると,MgCl2含有量の減少とともに,試験条件に設定されたRHの全範囲でiHが減少することがFig.2より確認された。とくに,第1ピークを発現させるRHは25~35%の比較的狭い範囲であり,MgCl2含有量にはほとんど依存しないが,第1ピークの最大iHはMgCl2含有量の減少とともに減少した。第1ピークの最大iHとMgCl2含有量との関係をFig.3に示す。この図より,最大iHはMgCl2含有量にほぼ比例していることが示された。一方,第2ピークについては,そのピークが観測されなかったMgCl2含有量が0.514 g·m-2の場合を除き,MgCl2含有量の減少とともに第2ピークの最大iHが減少するとともに,第2ピークを発現させるRHが増加することがFig.2で確認された。第2ピークを発現させるRHとMgCl2含有量の関係をFig.4に示す。この図より,RHはMgCl2含有量の減少とともにほぼ直線的に増加し,MgCl2量が0 g·m-2のときにRHが100%となることが示唆された。
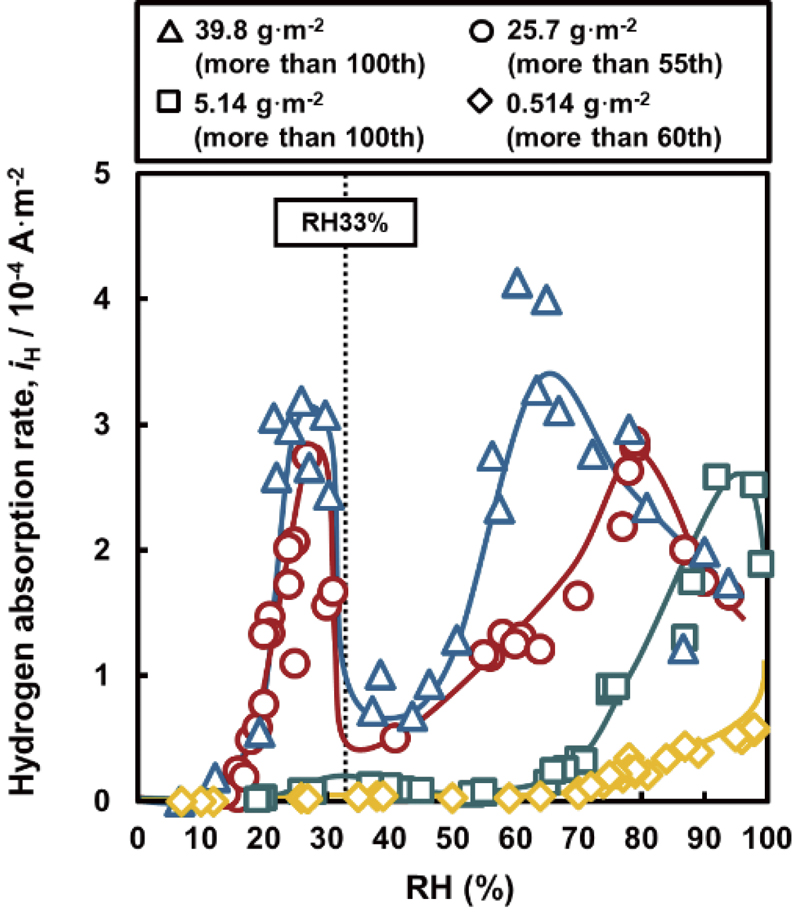
Effects of RH on hydrogen absorption rate as a function of amount of MgCl2 in the rust layer. (Online version in color.)

Effect of amount of MgCl2 on the maximum iH at the 1st peak.

Effect of amount of MgCl2 on the RH of the 2nd peak top.
iHがRHに対して2つのピークを示すことをFig.2に示した。ここでは第1ピークについて検討する。Fe板上のさび層に含まれる溶液粒子の模式図をFig.5に示す。前報11)では,第1ピークの発生について,飽和MgCl2水溶液の微小な粒子がFe板を腐食することで発生すると推察した。RH33%の空気中では,MgCl2の固体が飽和水溶液に変化する潮解が発生する。RH33%以下では,一般的にMgCl2の固体は潮解しないが,鉄さびのような多孔質の物質では,Fig.5の上段のように毛管凝縮による潮解が起こることが考えられる。式(3)に示すKelvinの式24)によると,大気中の水蒸気圧(p)が減少すると,水の凹面の曲率半径(r)は減少する。
| (3) |
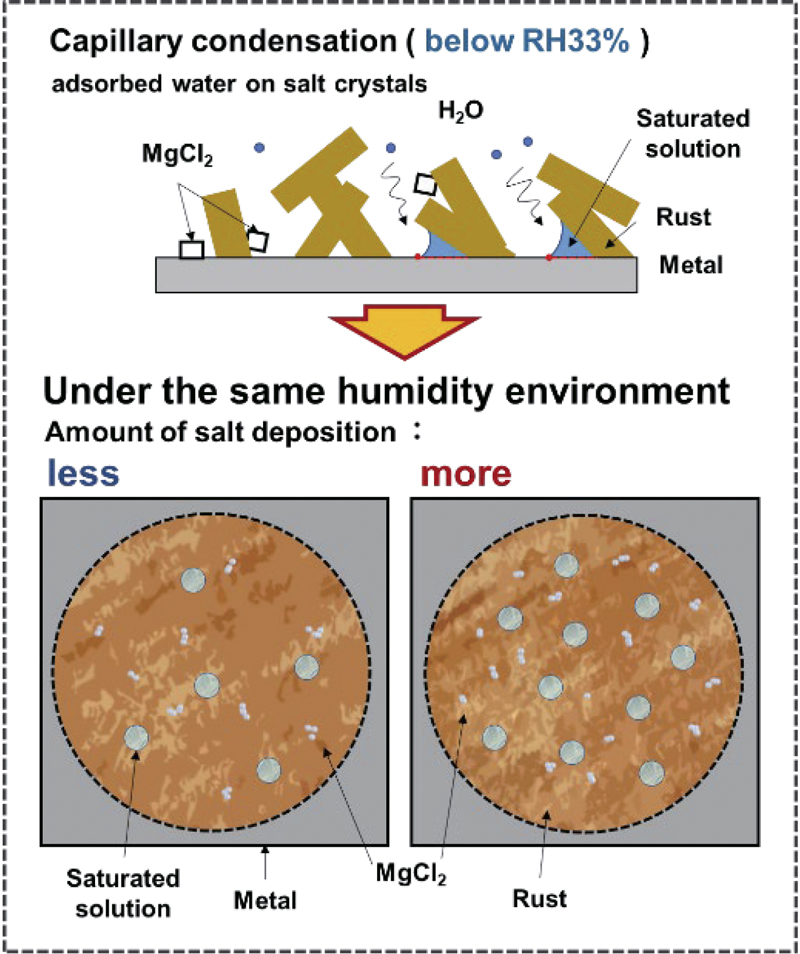
A proposed model of saturated MgCl2 solution particles in the rust layer on the Fe plate for the 1st peak in Fig.2.
ここで,p0は平坦な水面(r=∞)を持つ水と共存する水蒸気の圧力,γは水の表面張力,Vmは水のモル体積,Rは気体定数,Tは絶対温度である。RHはp0に対するpの割合であるため,さび層に接触する大気のRHが減少すると,さび層内に存在する凹状で曲率半径(r)の小さな水滴が存在することになるので,水滴の数と体積が減少し,水滴とFe板との総接触面積が減少することで,水素透過速度に対応する腐食速度が抑制される。Fig.3に示したように,第1ピークの最大iHは,MgCl2の潮解湿度である33%より低いRHで確認され,MgCl2含有量の減少とともに減少した。この挙動は,33%より低いRHでも式(3)に基づいたMgCl2飽和水溶液滴がさび層に形成されて大気腐食が発生すること,MgCl2含有量が少ないほど液滴の数や体積が減少することによって,Fig.5下段に示すように,Fe板との総接触面積が小さくなり,iHに対応する腐食速度が小さくなることによって起こると推察される。
一方,第1ピーク後半のRHの増加に伴うiHの減少は,前報11)において,つぎのように説明されている。大気中のRHが増加すると,液滴の数と体積が増加することによって大気腐食および水素侵入が促進されるが,さらにRHが増加すると液滴同士が結合してFe板上に飽和水溶液の液膜を形成する。飽和水溶液中の溶存酸素濃度は8.9 mmol·m-3 25,26)と,水の場合の約1/100であるため,液膜中ではiHに対応する腐食速度は抑制される。飽和MgCl2水溶液の濃度は4.90 kmol·m-3,MgCl2のモル質量は95.2 g·mol-1なので,さび層のない試料表面に39.8 g·m-2,25.7 g·m-2,5.14 g·m-2,0.514 g·m-2付着したMgCl2がRH33%の大気に接触して潮解した場合の飽和液膜厚さは,それぞれ0.0853 mm,0.0551 mm,0.0110 mm,0.0011 mmと算出された。Fig.2より,MgCl2含有量が39.8 g·m-2,25.7 g·m-2のときに第1ピークでiHが減少し始めるRHは33%以下であり,このRHでFe板表面に飽和液膜が形成され,この液膜が腐食を抑制したと考えられる。また,MgCl2含有量が5.14 g·m-2の場合には,MgCl2の潮解湿度に相当するRH33%で液膜が形成したと考えられる。一方,MgCl2含有量が0.514 g·m-2では,第1ピークが確認されなかったことから,RH33%の大気に接触させているにもかかわらず,さび層中には飽和液膜が形成されず,液滴だけが形成されていると考えられる。
4・2 第2ピーク第2ピークの形成について,前報11)では,33%以上のRHとMgCl2水溶液膜の濃度との関係に基づき,つぎのように推察されている。RHが33%以上になると,大気中の水蒸気と水溶液中の水の活量は等しいが,MgCl2含有量は不変であるため,RHの増加とともにMgCl2水溶液膜の濃度が減少する。MgCl2濃度が減少すると,水溶液に溶解する酸素濃度は増加する。したがって,RHの増加は,液膜の溶存酸素濃度の増加を引き起こす。一方,RHの増加とともに液膜体積が増加するので,液膜厚さも増加する。水溶液膜が接触した金属の腐食速度(icorr)が溶存酸素の拡散限界電流密度によって制御される場合,icorrは次式で表される。
| (4) |
ここで,Fはファラデー定数,DO2は液膜中溶存酸素の拡散係数,CO20は液膜の大気接触面の溶存酸素濃度,LSは液膜厚さである。DO2がCO20にほとんど依存しない場合,iHに対応するicorrは,CO20とLSに依存する。式(4)に基づくと,Fig.2に示された第2ピークの低湿度側で観測されたRHの増加に伴うiHの増加はCO20の増加に伴うicorrの増加が主要因であり,高湿度側で観測されたRHの増加に伴うiHの減少はLSの増加に伴うicorrの減少が主要因であることが推察される
所定の濃度のMgCl2水溶液を密閉容器に入れ,その容器の気相内のRHを測定した。Fig.6にMgCl2水溶液の濃度とRHの関係を示す。この図よりMgCl2濃度の増加とともにRHがほぼ直線的に減少することがわかった。この関係を利用して,各含有量のMgCl2をさび層のない試料表面に付着させた場合の液膜厚さとRHの関係をFig.7に示す。この図より,液膜厚さは,MgCl2量とRHの増加によって増加することが示された。Figs.4,7に示した関係から求めた,第2ピークを発現させるRHでの液膜厚さは約0.18 mmとなり,MgCl2含有量を5.14 g·m-2より大きくしてもほぼ同値を示した。すなわち,液膜厚さが約0.18 mmになると第2ピークのiHが最大値を示すことが示唆された。また,この関係から,MgCl2含有量が0.514 g·m-2の試料において第2ピークを発現させるRHは,液膜厚さが0.18 mmとなる99.4%と推定される。ところが,Fig.2を得るために設定したRHの測定範囲は0%~98%であったために,第2ピークを観測することができなかったと考えられる。ここで,MgCl2含有量が39.8 g·m-2と5.14 g·m-2のさび層の厚さを3D形状測定装置で測定したところ,いずれも平均値が約0.18 mmであった。このさび層の実測厚さである0.18 mmが前述した液膜厚さの推定値と類似しており,この関係がMgCl2含有量に影響を受けていないことは非常に興味深い。

Relationship between a MgCl2 solution concentration and an RH.
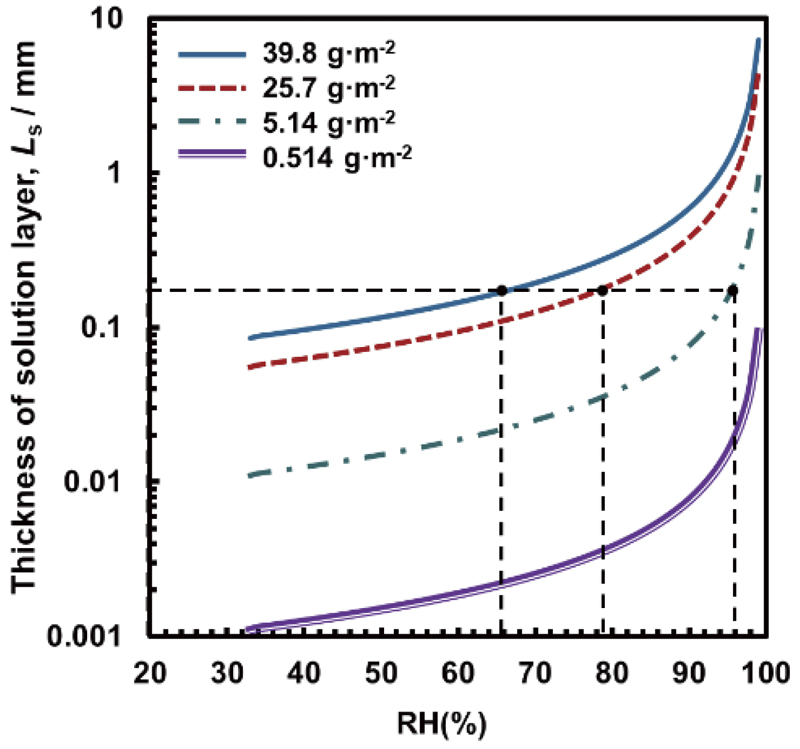
Effect of RH beyond 33% on thickness of MgCl2 solution film forming on flat surface. (Online version in color.)
Figs.2,7に示した関係から得られたiHと液膜厚さの関係をFig.8に示す。この図より,約0.18 mmまで液膜厚さが増加するとiHは増加し,約0.6 mmまで増加すると減少し,それ以上増加するとほぼ定常値を示すことがわかった。また,この関係に及ぼすMgCl2含有量の影響は明確ではない。この曲線の形状は,iHを腐食速度に置き換えると,Tomashov27)が提案した腐食速度と液膜厚さの関係に類似した。Tomashovはつぎの4つの領域に分けて曲線を説明した。領域I(乾き大気腐食)は,金属表面に吸着した水分子によって腐食が発生する(連続した膜の形成はない)。領域II(湿り大気腐食)は,電解質の極めて薄い膜の形成により腐食が促進される。領域III(濡れ大気腐食)は,酸素の拡散速度が液膜厚さの増加によって減少することによって腐食が抑制される。領域IV(水溶液浸漬腐食)は,溶存酸素に一定厚さの拡散層が形成されるため液膜厚さに依存しない腐食が発生する。Tomashovの説明に準じて,Fig.8の曲線をつぎのように推察した。液膜厚さが0.18 mmまでの領域は,Tomashovによる領域IとIIを組み合わせた領域である。Tomashovは0.001 mm程度の液膜厚さで腐食速度が最大になることを示し,Tsuruら28,29)は電気化学インピーダンス分光法により0.01 mm程度の液膜厚さであると報告した。一方,Fig.8の結果では,0.18 mmであり前述の値の10~100倍の厚さとなった。この違いは,前者がさび層のない試料から得られており,本研究で採用したさび層を形成させた試料とは異なる試料であることが原因の一つと考えられる。また,Tomashovは領域IVを酸素の拡散層厚さよりも厚い液膜厚さの領域として分類している。一般的に水溶液が静止しているときの拡散層厚さは0.4 mmとされているので,腐食速度が液膜厚さに対して一定値を示す領域IVは0.4 mmの液膜厚さから始まると考えられるが,Fig.8で示された,領域IVに相当する液膜厚さに依存しないiHを示す液膜厚さは約0.6 mmから始まっている。以上の検討結果に基づいて,Fig.9に示す腐食モデルを提案した。前述したように,さび層にいずれの量のMgCl2を含有させた試料においても,第2ピークを示すRHの場合には,Fe基板表面がMgCl2液膜に覆われているとする。その状態をFig.9(a)に示す。RHが増加すると液膜厚さも増加する。さび層が導電性を有するとき,Fig.9(b)に示すように,液膜厚さが増加すると溶存酸素のカソード反応領域が広がり,腐食速度が増加することによってiHが増加する。RHのさらなる増加に伴って液膜厚さがさび層厚さ(0.18 mm)を超えて増加すると,Fig.9(c)に示すように溶存酸素の拡散流束が減少し,腐食速度が抑制され,iHも抑制される。さび層を除いた液膜厚さが酸素の拡散層厚さ(0.4 mm)を超えたとき,すなわち液膜全体の厚さが約0.58 mmを超えたとき,Fig.8に示したように,腐食速度に関連するiHにが液膜厚さに依存しなくなる。

Effects of solution film thickness on hydrogen absorption rate and hydrogen concentration at hydrogen-absorption surface.

A proposed corrosion model for the 2nd peak in Fig.2.
式(2)に基づいて,iHからFe基板の水素侵入面における水素濃度(C0)を算出し,Fig.8の縦軸にC0を追加した。その結果,本実験での大気腐食条件下でのC0の範囲は0~0.15×10-3 ppmであることがわかった。前報13)では,高強度鋼(1500 MPa級)のC0がFeの約300倍であることを報告しており,大気腐食が高強度鋼への水素脆化を誘発することを指摘している。また,Tomashovモデルの領域IVは希薄水溶液での腐食状態を示しており,このときの腐食速度は0.2 A·m-2と推定される。この条件でのC0はFig.8より約0.075×10-3 ppmであり,前報12)で報告されている中性水溶液を用いた電気化学的水素透過試験で得られたアノード電流密度0.2 A·m-2でのFeの値と比較的一致した。
異なる量のMgCl2を含むさび層を形成させたFe板試料に,40回を超える乾湿繰り返し試験を行った後,相対湿度(RH)を制御した大気を接触させながら電気化学的水素透過試験を行った。その結果,以下の知見が得られた。
(1)MgCl2含有量が39.8 g·m-2の場合,定常水素透過速度(iH)はRHが15%程度から増加し始め,RH30%程度までRHの増加とともに急激に増加し,その後急激に減少した。さらにRHを増加させると,RH65%程度までは徐々に増加し,その後は徐々に減少した。また,MgCl2含有量を0.514 g·m-2~39.8 g·m-2の範囲で減少させると,試験を行ったRHの全範囲でiHが減少した。
(2)RH30%付近で確認されたiHの極大値は,MgCl2含有量の増加とともに増加した。この結果をつぎのように推察した。RH30%までは,飽和MgCl2水溶液の液滴がさび層内で凹状に存在し,Fe基板に接触して腐食する。したがって,MgCl2含有量の増加は,液滴の数と体積の増加,液滴とFe板の接触面積の増加,その結果としての腐食速度の増加に関連したiHの増加を引き起こす。
(3)RH40%以上のRH領域で確認されたiHの極大値が発現するRHは,MgCl2含有量の増加とともに減少した。RHとさび層のないFe基板上に形成されたMgCl2水溶液膜の厚さとの理論的関係から得られた,iHの極大値が発現するときの液膜厚さの推定値は約0.18 mmであり,MgCl2含有量にはほとんど依存しないことがわかった。また,MgCl2含有量が25.7 g·m-2および39.8 g·m-2のさび層の厚さを実測すると,いずれもほぼ0.18 mmであった。これらの結果から,RHの増加に伴うiHの増加は,液膜厚さの増加によりさび層内のカソード反応面積が増加したことに起因し,iHの減少は,さび層上の液膜厚さの増加に伴って溶存酸素の拡散流束が減少したことに起因すると考えられる。
本研究は,日本鉄鋼協会「革新的水素不働態表面構築の原理探求」研究会ならびに「鉄鋼材料への腐食誘起水素侵入」研究会から多数の有益な助言および経済的支援を頂いた。また科学研究費補助金(基盤研究C)(18K04784)ならびに関西大学学術研究員研究費からも経済的支援を頂いた。ここに謝意を表する。