2021 Volume 107 Issue 6 Pages 431-438
2021 Volume 107 Issue 6 Pages 431-438
In the sintering process of iron ores, coke breeze is utilized as a main agglomeration agent. Its replacement with iron-bearing materials such as metallic iron scraps and magnetite ore seem to be a promising way to reduce CO2 emissions. When using iron-bearing materials together with coke breeze, however, their oxidation reaction appears to be suppressed, since coke combustion tends to decrease in oxygen partial pressure. Therefore, it is necessary to understand the effect of oxygen pressure on the oxidation behavior of the iron-bearing materials. In this study, the oxidation experiments of metallic iron were carried out under the different oxygen partial pressure.
A thin plate sample of metallic iron was heated up to the holding temperature, 1200°C, under N2 atmosphere. Then, the atmosphere was changed to the oxygen partial pressure of 0.001 - 0.21 atm, which was controlled by using N2 or CO2 gas mixture. Oxidation ratio and the thickness of wustite layer formed through the oxidation of metallic iron follows a parabolic manner under PO2 = 0.21 atm. The thickness of wustite layer decreases after 300 s under PO2 = 0.21 atm, while the thicknesses of magnetite and hematite layers increase. It appears that the rate-controlling step changes when all metallic iron is oxidized to wustite. Under the condition of PO2 = 0.01 atm, only wustite layer is observed and the oxidation proceeds faster in CO2 base than in N2. It implies that O2 consumed by oxidation reaction is quickly supplied by the decomposition reaction of CO2 gas.
一貫製鉄プロセスにおける主要なエネルギー源および還元材は石炭およびコークスであるが,温室効果ガス排出抑制の見地からそれらの使用量低減が検討されている1)。製鉄プロセスにおける鉄鉱石焼結プロセスからも温室効果ガスであるCO2が排出されおり,主に凝結材である粉コークスの燃焼と副原料である石灰石の分解反応に由来する。そこで,金属鉄スクラップやウスタイト,マグネタイトなど鉄の低級酸化物の酸化熱を有効利用する鉄系凝結材を利用することができれば,粉コークスの一部代替が可能となり,CO2排出量の削減が期待できる。鉄系凝結材の候補として,具体的には原料であるマグネタイト精鉱や圧延工程から排出されるミルスケールなどが挙げられる。これらは酸化後に焼結鉱の構成鉱物となり高炉に装入されるため,製鉄所内副生物の有効活用にも繋がる。
鉄系凝結材の利用に関する検討は,これまでに複数報告されている。Takidairaらは金属鉄を多く含んだミルスケールを鉄系凝結材として用い,実機焼結機を用いてコークスレス操業を実施した2)。ミルスケール配合量を増加することによりコークス比が低減でき,30%配合でコークスレス操業が可能となるが,焼結鉱中のFeO濃度が上昇する。Button and Lundhはヘマタイト鉱石の一部をマグネタイト鉱石に置換した焼結試験を行い,マグネタイトの酸化発熱の影響を調査した3)。ヘマタイト鉱石のみを使用した場合に比較して,マグネタイト鉱石を30 mass%配合した条件では焼結層の最高温度が約60°C高くなると報告している。これは,添加コークス量の約5 mass%に相当するが,同時にFeO濃度の上昇を報告している。Fujinoらは金属鉄とウスタイトを鉄系凝結材として用い,微分型焼結シミュレータ4,5)を用いて酸化促進方法について検討した。金属鉄およびウスタイトの周囲にCaOを配置し,低温で溶融させることにより酸化反応が促進可能であることを報告している。一方,CaO添加率が10%を超えると融液生成と凝集が顕著になり,試料層の通気性の悪化が指摘されている。
以上のように,鉄系凝結材使用時の課題として焼結層の通気性悪化や焼結鉱中のFeO濃度の上昇が挙げられる。通気性の悪化は,鉄系凝結材では粉コークスと異なり酸化反応後も焼結層に残存し,さらに酸化後に体積膨張することにも起因している。また金属鉄は575°C以上においてウスタイト,マグネタイトを経てヘマタイトまで酸化する多段反応を呈し,鉄鉱石焼結プロセス中に鉄系凝結材がヘマタイトまで酸化が進行しないことがFeO濃度の上昇の要因であると考えられる。鉄系凝結材の酸化膨張による通気性の悪化およびFeO濃度の上昇を抑制するためには,各条件における酸化速度を把握し,通気性を損なわない粒度の検討などが重要であるが,本研究ではまず金属鉄の酸化挙動に着目した。これまでに鉄および低級酸化鉄の酸化挙動に関する研究が複数報告されている。Mishima and Sugiyamaは研磨により表面を平滑にしたアームコ鋼を酸化させ,酸化物層厚から放物線則に則った酸化速度定数を測定した6)。Schmahlらは金属鉄を大気雰囲気で酸化させ,各酸化物層が放物線則に則って成長することを示し放物線速度定数を求めた7)。Schmahlらは金属鉄を大気雰囲気で酸化させ,各酸化物層が放物線側に則って成長することを示し放物線速度定数を求めた7)。Paidassiは同様の調査に加えて,ウスタイトからマグネタイトおよびマグネタイトからヘマタイトへの酸化についても検討した8)。一方,Fujinoらは事前に調製したウスタイトを空気雰囲気で酸化させ,1200°Cにおける各酸化物層厚の変化を示した9)。これらは全て大気雰囲気で検討されているが,実際の焼結プロセスにおいては,大気雰囲気よりも低酸素分圧下で反応が進行すると考えられる。また,コークスの燃焼により充填層内は局所的にCO2とO2の共存雰囲気となり,N2とO2からなる大気雰囲気とは異なる酸化挙動を示すことが予想される。
そこで本研究では,鉄鉱石焼結プロセスにおける鉄系凝結材として金属鉄に着目し,その酸化反応に対する酸素分圧およびCO2共存の影響について検討した。まず,異なる酸素分圧下で金属鉄を酸化し,重量および生成する酸化物の層厚変化から酸化速度を導出した。さらに,酸化過程における試料表面の“その場”観察を行い,初期酸化挙動を考察した。
厚さ0.5 mmの金属鉄薄板(Fe: 99.9%)を4×4 mmに切断後,断面を研磨し試料とした。これをFig.1に示すように外径5.0 mm,高さ2.5 mmのAl2O3製セル内に縦に設置して電気炉内に装入した後,酸化実験前の反応を抑制するためにN2-3%H2流通下において1200°Cまで10°C/minで昇温した。1200°C到達後,流通ガスをN2ベースで酸素分圧0.21,0.01あるいは0.001 atm,またはCO2ベースで酸素分圧0.01 atmのいずれかに切り替え,重量変化を連続的に測定した。全圧は1atmとし,ガス流量は0.5 L/minで一定とした。所定時間経過後,N2ガスに切り替え,試料を冷却した。試料の酸化率は,重量変化データに基づき,以下の式により導出した。
| (1) |

Schematic cross section of sample and alumina cell.
また,切断,研磨後,Fig.1におけるAl2O3セルから露出した領域を断面観察した。生成した酸化物層の厚さは,試料の片面を選択し,試料中心部および左右に250, 500 µm離れた位置の計5点の測定値を平均して求めた。
さらに,赤外線加熱炉を備えた共焦点走査型レーザー顕微鏡により,金属鉄試料表面における初期酸化過程の微視的観察を行った。金属鉄薄板試料をアルミナ製セル内に装入後,赤外線加熱炉内に設置し,Ar流通下,1200°Cまで500°C/minで昇温した。1200°Cに到達後,流通ガスをN2ベースで酸素分圧0.21あるいは0.01 atmに切り替え,試料表面の酸化過程をレーザー顕微鏡により観察した。
Fig.2に各酸素分圧条件における試料の酸化率の時間変化を比較する。酸素分圧0.21 atmでは酸化率は放物線則にしたがって増加する。酸素分圧0.01 atmではCO2ベースの方がN2ベースよりも酸化率が高く,N2ベースでは直線的に増加している。また酸素分圧0.001 atmでは600 s後においても酸化率が約5%にとどまり,ほとんど酸化が進行しない。なお,酸素分圧0.21 atmとCO2ベースの酸素分圧0.01 atmの条件では,体積膨張により試料をアルミナ製セルから取り外すことができなかったが,N2ベースの酸素分圧0.01 atmと酸素分圧0.001 atmの条件では容易に取り外すことができた。

Changes in oxidation ratio of samples with time.
Fig.3(a)-(d)に各酸素分圧条件で600 s酸化後の試料断面写真を示す。試料中心の白色部分が金属鉄,その周囲にある濃い灰色のコントラストがウスタイトおよびマグネタイト,表面の薄い灰色部分がヘマタイトに相当する。酸素分圧0.21 atmの条件では均一な酸化物層が形成しているが,低酸素分圧の酸化条件では表面に激しい凹凸が認められる。また,酸素分圧の低下に伴い残留する金属鉄量が増加している。酸素分圧0.001 atmでは酸化物層がほとんど確認できない。Fig.4(a)-(c)にN2ベースの酸素分圧0.01 atmの条件で60, 180, 300 s酸化後の試料断面写真を示す。60 s酸化後の試料にはわずかな酸化物層の形成が認められるが,180 s後には表面に凹凸形状の酸化物層が生成する。300 s酸化後の酸化物層は厚くなるが凹凸形状は残存している。酸化層をより詳細に観察するため,Fig.5(a)-(d)に酸素分圧0.21 atmの条件で60, 300, 600 s酸化後の試料の酸化層断面組織を示す。Fig.5(a),(b)および(d)の下部に確認できる白色部が金属鉄でありFig.3およびFig.4で観察される試料の中央部に相当する。ウスタイトとマグネタイトが共存する層は,酸化により生成したウスタイトが冷却過程で一部マグネタイトに分解して形成されたものと考えられるため,本研究ではこれに類似する箇所はウスタイト層とみなす8)。酸素分圧0.21 atmで酸化した試料のウスタイト層厚は300 s までは増加するが,その後減少に転じる。一方,マグネタイト層は時間経過に伴って成長している。ヘマタイト層は酸化初期には観察されないが,300 sで試料表面に層厚10 µm程度のものが認められ,その後,時間経過に伴って成長する。Fig.5(d)に示すN2ベースの酸素分圧0.01 atmで酸化した試料では,60 sにおいてウスタイトの生成が認められるもののマグネタイトは観察されない。

Cross section of samples oxidized for 600 s at 1200°C under a) PO2 = 0.21 atm of N2 base, b) PO2 = 0.01 atm of CO2 base gas, c) PO2 = 0.01 atm and d) PO2 = 0.001 atm of N2 base gas. (Online version in color.)

Cross section of samples oxidized under PO2 = 0.01 atm of N2 base gas at 1200°C for a) 60 s, b) 180 s and c) 300 s. (Online version in color.)

Cross section of samples oxidized at 1200°C for a) 60 s, b) 300 s, c) 600 s under PO2 = 0.21 atm and d) 300 s under PO2 = 0.01 atm of N2 base gas. (Online version in color.)
Fig.6に各酸素分圧条件で酸化した試料のウスタイト層厚の時間変化を比較する。なお酸素分圧0.001 atmの条件ではウスタイト層厚の測定が困難であったため示していない。酸素分圧0.21 atmでは,300 sまでは放物線則に従って増加し,その後減少に転じておりFig.5の観察結果と整合する。酸素分圧の影響に着目すると,N2ベースにおけるウスタイト層厚は同時間において酸素分圧の低下に伴い小さくなる。金属鉄の酸化に伴うウスタイト層の成長は,ウスタイト中の鉄イオンの拡散が律速すると報告されており10),本研究では酸素分圧0.21 atmの条件が該当する。一方,Fig.1よりN2ベースで酸素分圧0.01 atmのとき,酸化率は直線的に増加している。酸化層は主にウスタイトからなるため,ウスタイト層厚が直線的に成長しているといえる。Fig.5(d)より300 sにおいてマグネタイトが観察されていないことから,ウスタイト/ガス境膜層における酸素の供給律速になっている可能性が考えられる。またFig.2およびFig.3からも認められるように,同一酸化時間で比較するとCO2ベースの方がN2ベースよりウスタイト層厚が大きい。これは酸化物/ガス界面におけるCO2ガスの分解によるものと考えられる。すなわち,CO2ベースではウスタイトの生成によって消費された酸素が,以下の反応により供給されたと考えられる。
| (2) |

Changes in thickness of wustite layer under PO2 = 0.21 and 0.01 atm of N2 base gas and PO2 = 0.01 atm of CO2 base gas with time.
Fig.7に酸素分圧0.21 atmで酸化した試料のマグネタイトおよびヘマタイト層厚の時間変化を示す。ヘマタイト層厚は300 s後から増加する。マグネタイト層厚は300 s までは放物線則に従って増加し,その後酸化速度が変化している。マグネタイト層の成長はFeイオンの拡散が律速しているが11),300 sでは金属鉄がほぼ全量酸化されているため,ウスタイト層からマグネタイトへ鉄イオンが供給されなくなり,酸化速度が変化したと考えられる12)。

Changes in thickness of magnetite and hematite layer under PO2 = 0.21 atm at 1200°C with time.
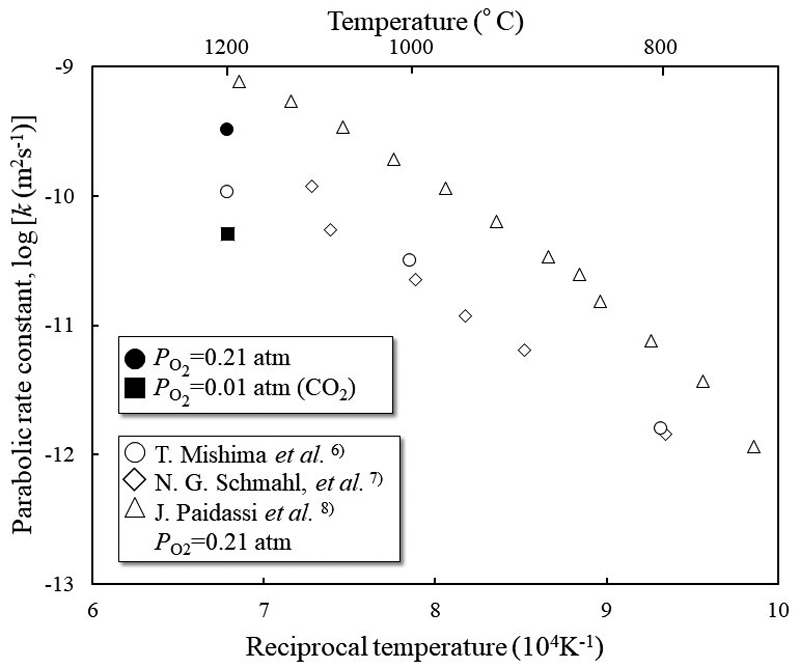
Fig.8に各酸素分圧下のウスタイト層厚の変化に対する放物線速度定数を示す。また,大気圧雰囲気下で測定した既報の放物線速度定数を併せて示す。酸素分圧0.21 atmで酸化した場合の放物線速度定数は既報と近い値を取る。Fig.9に酸素分圧0.21 atmの条件で酸化した試料のウスタイトからマグネタイトおよびマグネタイトからヘマタイトへの放物線速度定数を示す。Fig.9の凡例中のHはヘマタイト,MはマグネタイトおよびWはウスタイトを示し,各酸化層からの酸化反応に対する放物線速度定数を表す。”With Fe”は金属鉄が存在する300 sまで測定した放物線速度定数であり,”Without Fe”は金属鉄が全量酸化された300 s後から算出した放物線速度定数である。”With Fe”でのウスタイトからマグネタイトへの酸化過程における放物線速度定数は,本実験と同様に金属鉄から酸化させたPaidasshiの値8)に近い。”With Fe”と”Without Fe”と比較すると,ウスタイトからマグネタイトへの酸化に対する放物線速度定数は”Without Fe”の方が大きい。これはFig.7で行った考察と同様に,300 s後では異なる律速段階で酸化が進行したことが可能性として考えられる。またマグネタイトからヘマタイトへの酸化に対する放物線速度定数はFujinoらの報告値とほぼ一致する9)。本実験では,ヘマタイトが観察可能な厚さまで成長したのは金属鉄が共存しない300 s後であり,ウスタイト試料を酸化した場合の放物線速度定数9)に近くなったと考えられる。
Parabolic rate constants for high temperature oxidation from metallic iron to wustite.

Parabolic rate constants for high temperature oxidation from wustite to magnetite and magnetite to hematite.
Fig.10(a)-(c)に共焦点走査型レーザー顕微鏡による昇温中試料表面のその場観察像を示す。不活性雰囲気中で室温から昇温を開始すると,Fig.10(a)に示す初期試料表面に,950°C付近でFig.10(b)のようにα→γ変態による粒界が形成する。1200°C付近まで昇温すると気孔と微細な析出物が多数認められる組織になる(Fig.10(c))。これは雰囲気中に存在する微量の酸素や水蒸気によって,表面の一部が酸化したためと考えられる。昇温後,酸素分圧0.21 atmの雰囲気に切り替え酸化させた試料表面のその場観察像をFig.11(a),(b)に示す。酸化開始1 s後(Fig.11(a)),微細な凹凸のある酸化物の形成によりレーザー顕微鏡のピントがずれて,全体的に暗い像を呈する。微細な酸化物が多数形成されているが,写真の左上部は酸化の進行が遅い。酸化開始40 s(Fig.11(b))では酸化相が成長し,試料表面全体に均一な酸化物が形成されている。N2ベースで酸素分圧0.01 atmの条件で酸化した試料表面像をFig.12(a)-(c)に示す。酸化開始後5 s(Fig.12(a))には,多数の微細酸化物相の形成が確認できるが,上下部分では酸化の進行が遅い。酸化開始後30 s(Fig.12(b))および40 s(Fig.12(c))では,微細酸化物相の多くが肥大化する一方,酸化の進行が遅い領域には酸化物が生成していない。その場観察で得られた酸化層成長の不均一性は,Fig.3および4の酸化試料断面に認められた酸化物層の凹凸形状に対応するものと考えられる。これは,低酸素分圧条件において,試料の表面性状による酸化物の成長速度の差が顕著になり,酸化の進行が遅い領域を覆うように酸化が進行したためと考えられる。酸化物の成長速度の差は,FeOの核生成が酸素分圧の影響を受けた可能性が考えられる。N2ベースで酸素分圧0.01 atmのような低酸素分圧条件では試料表面への酸素の供給量が少なくFeOの核生成に不均一性が生じ,Fig.12(a)で観察されたような酸化の進行が遅い領域が形成されたと考えられる。その後,核生成したFeOが雰囲気中の酸素と反応して成長を続け,最終的に凹凸状の酸化層を形成したと考えられる。

Sample surfaces during preheating stage at a) 26°C, b) 950°C and c) 1200°C in N2 atmosphere.

Sample surfaces oxidized under PO2 = 0.21 atm at 1200°C for a) 1 s and b) 40 s.

Sample surfaces oxidized under PO2 = 0.01 atm of N2 base gas at 1200°C for a) 5 s, b) 30 s and c) 40 s.
本研究では鉄鉱石焼結プロセスにおける鉄系凝結材として金属鉄に着目し,1200°Cにおける酸化反応に対する酸素分圧およびCO2共存の影響について調査した。以下に得られた知見を示す。
(1)酸素分圧0.21 atmで酸化させた試料の酸化率およびウスタイト層厚は放物線則にしたがって増加する。一方,N2ベースの酸素分圧0.01 atmでは酸化率およびウスタイト層厚は直線的に増加しており,いずれも酸素分圧0.21atmで酸化させた試料よりも小さい。またCO2ベースで酸化した試料はN2ベースより酸化が促進される。これはCO2の分解反応に伴う酸化物/ガス界面における酸素供給量によるものと考えられる。
(2)ウスタイトからマグネタイトへ酸化する際の放物線速度定数は,300 sまでは金属鉄からマグネタイトまで酸化させた条件の値に近い一方で,300 s後に大きくなる。またマグネタイトからヘマタイトへの酸化に対する放物線速度定数は,ウスタイト試料から酸化させた条件の値と近い。
(3)酸素分圧0.21 atmの雰囲気で酸化した試料では,一部酸化の進行が遅い領域が確認されるが,酸化物の一体化が進むことで試料表面全体に均一な酸化物層が形成される。一方,N2ベースの酸素分圧0.01 atmの雰囲気で酸化した試料では一部酸化の進行が遅い領域が残存し,凹凸状の酸化層を形成したと考えられる。
本研究の一部は(一社)日本鉄鋼協会の「資源環境調和型焼結技術創成研究会」の支援によることを記し,ここに謝意を表する。