2022 Volume 62 Issue 2 Pages 114-115
2022 Volume 62 Issue 2 Pages 114-115
ゾウリムシの細胞後端への機械刺激は,過分極による繊毛内cAMP濃度の上昇によって遊泳速度の増加を引き起こす.我々は,細胞膜と膜直下の骨格構造の間に局在するストマチン様タンパク質が機械刺激を受容し,繊毛基部のK+チャネル型アデニル酸シクラーゼを活性化するため,遊泳速度が増加することを見つけた.

ゾウリムシは体表に数千本の繊毛をもつ真核の単細胞生物であり,繊毛を巧みに動かすことで水中を自由自在に遊泳している.ゾウリムシの遊泳行動は,古くから観察されており,特に,光,温度,酸などの刺激に対する行動反応は100年以上も前から詳細に解析されている1).ゾウリムシの刺激に対する行動反応は,主に回避反応と逃走反応の2つである.回避反応は,刺激に対して後退遊泳によって後ずさり,回転することで元とは異なる方向へ遊泳する反応である.また逃走反応は,刺激に対して遊泳速度を上昇させて遠ざかる反応である.ゾウリムシの行動は膜電位応答と1対1に対応し,膜電位応答が簡単にみて取れることから「泳ぐ神経細胞」として,1970-80年代にかけて非常によく用いられたモデル生物である.現在では,ゲノム解析が終了しており,大腸菌を食べさせるだけでノックダウン(RNAi)ができるという利点があるため,データベースから検索したチャネルタンパク質の発現を最短数日でノックダウンすることも可能である.
ゾウリムシの繊毛運動は膜電位によって制御されることが明らかになっているだけでなく,除膜モデルを用いた先駆的な研究によって,繊毛打頻度はMg2+-ATP濃度依存的に,繊毛打方向は繊毛内Ca2+濃度依存的に調節されることも明らかとなっている2),3).また,様々な刺激に対する回避反応や逃走反応の仕組みについても多くの解析が行われている.たとえば,ゾウリムシの細胞前端への機械刺激は脱分極を引き起こし,その結果生じる膜電位依存性Ca2+チャネルの活性化による繊毛内Ca2+濃度の上昇が,繊毛打方向を逆転させるため後退遊泳が起こる(図1A).一方,細胞全体への振動刺激や細胞後端への機械刺激は,K+チャネルの活性化による過分極が繊毛内cAMP濃度を上昇させるため,繊毛打頻度が上昇し,前方への速い遊泳を引き起こす4),5).これらの研究から,ゾウリムシの細胞前端と後端では異なる受容体が存在すること,細胞後端の受容体は細胞前端の受容体よりも閾値が低いため,細胞全体への振動刺激では,細胞後端の受容体が活性化することが示唆されている.
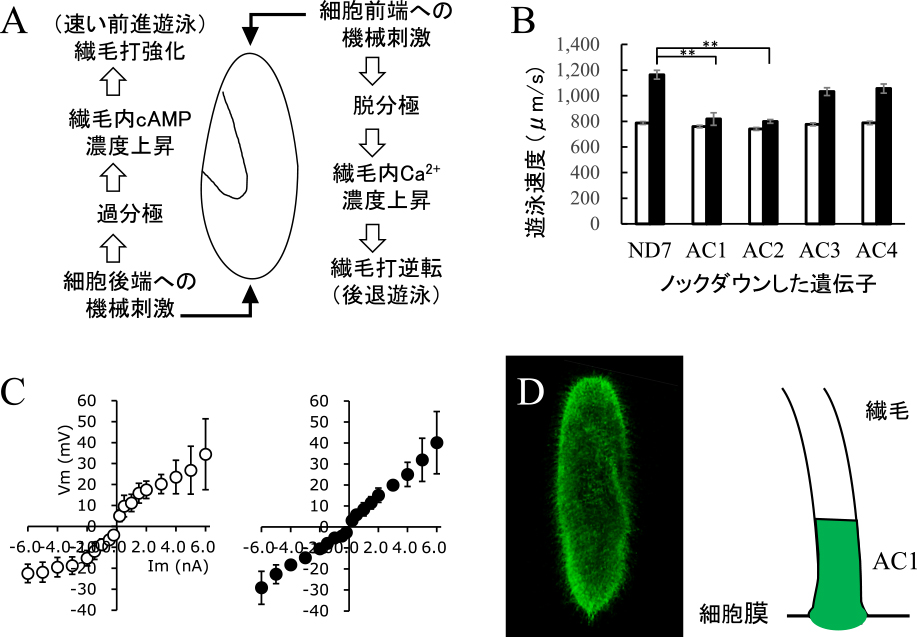
(A)機械刺激応答の模式図,(B)ノックダウン細胞の遊泳速度.白棒と黒棒は機械刺激前と後の遊泳速度.ND7はコントロール細胞.アステリスクは対応のないt検定でコントロールと有意差(P < 0.001)があったことを示す.(C)ノックダウン細胞の電流注入による膜電位.左:ND7,右:AC1ノックダウン細胞,(D)AC1-GFPの局在性,右:局在の模式図.
回避反応や逃走反応の仕組みは徐々に明らかになってきたが,様々な刺激に対する受容体や,それらと相互作用するイオンチャンネルの分子の実体は未だ明らかとなっていない.遺伝子情報などの解析から,原生生物では,cAMP産生酵素であるアデニル酸シクラーゼの一部が,イオンチャネル融合型酵素として機能することが示唆された6).ゾウリムシデータベースからはC末端にアデニル酸シクラーゼのモチーフをもつイオンチャネルが4種類検出される7).そこで,これら4つの遺伝子をAC1-AC4と名付け,RNAi法によってノックダウン細胞を作成した.図1Bに示すように,AC1やAC2をノックダウンした細胞は,どちらも振動刺激に対して遊泳速度の上昇を示さなくなった.しかし,これらのノックダウン細胞に膜透過性の8-Br-cAMPを加えると,遊泳速度は著しく上昇した.また,細胞外液のK+濃度を低下させ,人為的に過分極を誘導した場合も,遊泳速度が著しく上昇した.これらの結果は,振動刺激に応答して,AC1やAC2は過分極とcAMP産生を引き起こすことを示唆した8).そこで,AC1やAC2ノックダウン細胞の電流注入による膜電位変化を測定したところ,どちらの細胞も同じ応答を示し,コントロール細胞と比べて直線的な変化しか示さず,膜抵抗に異常を起こしていることがわかった(図1C).AC1とAC2は細胞全体の繊毛の基部に局在することから,これらはヘテロダイマーとしてK+チャネルを形成していると考えられる(図1D).一方,AC3やAC4をノックダウンした細胞では,振動刺激に対して正常な遊泳速度の上昇を示すこと,AC1やAC2とは細胞内局在性が異なることから,これらは振動刺激以外の刺激に対して活性化するイオンチャネル型アデニル酸シクラーゼであると推測される.
ゾウリムシではストマチン様タンパク質(SLP)が複数存在し,接触刺激の受容に関与する可能性が示されている9).そこで,SLPの1つであるSLP1をノックダウンし,振動刺激の受容に関与するかどうかを調べた.その結果,SLP1をノックダウンした細胞では,振動刺激に対して遊泳速度の上昇を起こさなくなった(図2A).しかし,SLP1をノックダウンした細胞でも,人為的な過分極や8-Br-cAMPの添加によって遊泳速度の著しい上昇が起こった.また,SLP1は細胞膜直下に局在し,繊毛基部に局在するAC1やAC2と極めて近い位置関係にあることがわかった(図2B).これらの結果は,SLP1は振動刺激の受容に関与し,AC1やAC2の活性化に関与することを示唆する.一方で,細胞膜直下の骨格構造ICLの変異体やコレステロール除去剤であるMBCDで処理した野生型細胞は,SLP1の局在が異常となり,振動刺激に対して逃走反応を示さなくなる(図2A).SLP1の局在を考慮すれば,SLPは細胞膜直下のICLと細胞膜の間に局在し,振動による膜の収縮を感受することで,AC1やAC2の活性化を制御しているものと考えられる.今後は,SLPによるACsの活性化の仕組みをより詳細に調べていきたいと考えている.
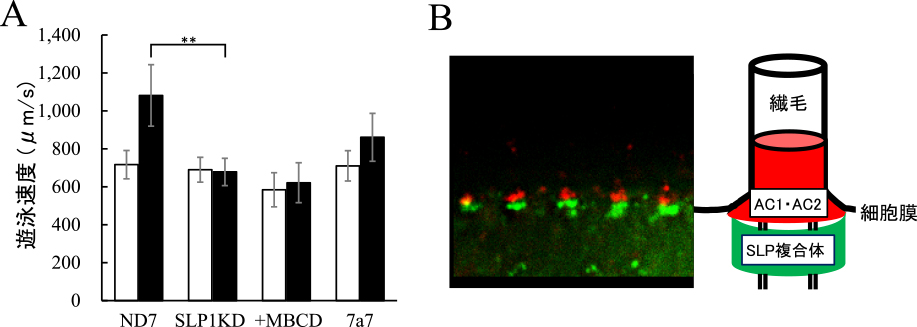
(A)振動刺激による遊泳速度の変化.白棒と黒棒は機械刺激前と後の遊泳速度.ND7:コントロール細胞,SLP1KD:SLP1ノックダウン細胞,+MBCD:MBCD処理細胞,7a7:ICL変異体.アステリスクはt検定での有意な差(P < 0.001)を示す.(B)左:SLP1-GFPの繊毛基部での局在,赤はAC2抗体の局在を示す.右:模式図.