2022 Volume 62 Issue 2 Pages 125-127
2022 Volume 62 Issue 2 Pages 125-127
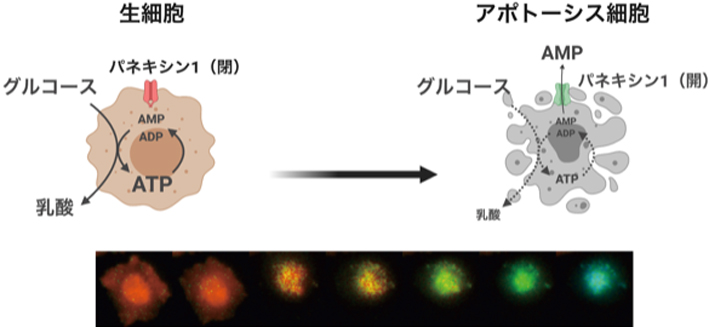
細胞内のエネルギー運搬体であるATPは,細胞がアポトーシスで死ぬとパネキシン-1チャネルの働きで細胞から消失することがわかった.細胞内にATPを残存させると死んだはずの細胞も活動を続けたことから,死細胞からのATPの消失は細胞が活動を停止して完全に死ぬために必要なプロセスであることが明らかとなった.
細胞は,細胞内輸送,膜輸送,タンパク質の合成と分解,代謝反応など様々なプロセスを駆動するために多大なエネルギーを必要とする.アデノシン5ʹ-三リン酸(ATP)は,細胞内の主要なエネルギー運搬体としてこれらのプロセスにエネルギーを供給している極めて重要な物質である.一般的に,生きている細胞は数mM程度の高いATP濃度を保持している一方で,死んだ細胞にはATPはほとんど残っていない.しかし,細胞が死ぬ過程でATPが失われる時間スケールや仕組み,そして死細胞がATPを失うことの生物学的意義については,これまでよく調べられていなかった.最近,私たちは細胞死の一形態であるアポトーシスにおけるATP動態の詳細を明らかにしたので,その概要を紹介したい1).
アポトーシスは,発生や組織形態の維持などに重要な遺伝的にプログラムされた細胞死であり,カスパーゼと呼ばれる一連のシステインプロテアーゼが活性化され,最終的には細胞内に存在する様々な標的タンパク質が分解されて細胞が死に至る2).
アポトーシスにおけるATPのダイナミクスを解析するため,以前に私たちが開発したフェルスター共鳴エネルギー移動(FRET)型の蛍光ATPバイオセンサーATeam3)を利用した.ATeamは,枯草菌のFoF1-ATP合成酵素の調節サブユニットであるεをCFPとYFPで挟んだ構成となっており,εにATPが結合することによって生じる構造変化によってCFPとYFPの間のFRET効率が変化するという仕掛けとなっている(図1A).ATeamを細胞に発現させることで,単一細胞内のATP濃度をリアルタイムにイメージングすることが可能になる.オリジナルのATeamはカスパーゼによって分解を受けることが判明したため,カスパーゼに切断されないATeam(ATeamCR)を新たに作製してイメージングをおこなった.抗FAS抗体によってHeLa細胞を刺激してアポトーシスを誘導したところ,刺激後しばらくはATP濃度に顕著な変化は起こらないものの,細胞の収縮のタイミングと前後してATP濃度が低下し始めることがわかった.一方で,カスパーゼ阻害剤を添加した条件では,ATP濃度の低下はほとんど観察されなかったことから,ATP濃度の低下がカスパーゼ依存的に起こる現象であることも確認された(図1B).

(A)ATPバイオセンサー(左)とカスパーゼ3活性バイオセンサー(右).(B)アポトーシスにおける細胞ごとのATPダイナミクス.1本の横線が一つの細胞のデータを示す.カスパーゼ阻害剤なし(上)とあり(下)の条件で測定.(C)ATP濃度とカスパーゼ3活性の同時イメージング.文献1より改変.
細胞ごとにカスパーゼが活性化するタイミングが異なるため,ATP低下が始まるタイミングは個々の細胞で大きく異なっていた.そこで,実行型カスパーゼの一つであるカスパーゼ3の活性をモニターするFRET型バイオセンサーO-DEVD-FRを新たに開発した.このバイオセンサーは,オレンジ色蛍光タンパク質mKOκと遠赤色蛍光タンパク質mKate2をカスパーゼ3の認識配列を含むペプチドで連結したものであり,カスパーゼ3が活性化して切断が起こると,mKOκとmKate2の間のFRETが解消されるという仕掛けである(図1A).ATeamとO-DEVD-FRは蛍光スペクトルが大きく重ならないため,干渉なしに双方の蛍光バイオセンサーのシグナルを取得することができる.すなわち,一つの細胞でカスパーゼ3の活性とATP濃度の双方をイメージングすることが可能となる(図1C).この系を用いることで,アポトーシス細胞における細胞内ATP濃度の減少はカスパーゼ3活性化直後から始まり,多くの場合30分~2時間ほどでATPが枯渇することが明らかとなった.
以上の結果から,カスパーゼ3の標的タンパク質が細胞内ATPの減少に関与している可能性が高いと考え,私たちが着目したのが細胞膜に局在するパネキシン-1チャネルである(図2A).パネキシン-1は7量体として機能する4回膜貫通タンパク質であり,自己阻害ドメインであるC末端領域がカスパーゼによって切り離されると活性化してヌクレオチドを放出し,死細胞を貪食するマクロファージを誘引することが報告されていた4).そこで,パネキシン-1遺伝子をノックアウトしたHeLa細胞を作成してアポトーシス時におけるATPのダイナミクスを調べたところ,ATPの減少が強く抑制され,カスパーゼ3活性化後10時間以上にわたってATPを保持する細胞も多数観察された(図2B).アポトーシスした細胞ではカスパーゼが活性化した後,ミオシンの過剰活性化によってblebbingと呼ばれる膜の収縮運動が起こるが,通常は1時間程度で収束する.しかし,パネキシン-1ノックアウト細胞では,長時間にわたりblebbingが持続した.続いて,野生型の細胞にカスパーゼで切断されない変異型パネキシン-1を過剰発現させアポトーシスを誘導した.この条件ではパネキシン-1チャネルの大部分は野生型と変異型のヘテロ7量体となるため,カスパーゼ活性化後も一部の阻害ドメインが切られずに残る.予想したとおり,変異型パネキシン-1を過剰発現させた細胞では,パネキシン-1ノックアウト細胞と同様にカスパーゼ3活性化後のATP減少が著しく抑えられた(図2C).以上の一連の結果は,カスパーゼによる切断で活性化されたパネキシン-1チャネルからのアデニンヌクレオチドの漏出が細胞内ATP濃度の減少に中心的な役割を担っていることを示している.アポトーシスの際にパネキシン-1チャネルを通じて放出されるATPの量は僅かであり,AMPの方がより多く放出されるという報告がある5).実際,培地中にAMPを添加しておくと有意にアポトーシス細胞のATP濃度の減少に遅れが観察された一方,ADPやATPでは効果は小さかった.このことから,アポトーシス時には,パネキシン-1を通じて主にAMPが放出されることによって細胞内のアデニンヌクレオチドのプールが減少し,その結果として細胞内ATP濃度が低下すると考えられた.

(A)パネキシン-1チャネルの立体構造.(B)アポトーシスにおける野生型細胞(上)とパネキシン-1ノックアウト細胞(下)のATPダイナミクス.(C)ベクター(上)およびカスパーゼ耐性パネキシン-1遺伝子(下)を導入した細胞のアポトーシス時のATPダイナミクス.B,Cは文献1から改変.
生きた細胞では,ATPが加水分解されて生じるADPは速やかにATPに再生される.動物細胞では,細胞質における解糖系とミトコンドリアにおける酸化的リン酸化がATPの再生を担っている.アポトーシスした細胞では,もはやATPを再生する能力が失われているのではないかと思われるかもしれない.しかし,パネキシン-1ノックアウト細胞では,ATPaseであるミオシンが駆動する細胞膜のblebbingが長時間継続するなど,少なくとも一部のATP加水分解マシナリーは働いているにも関わらず長時間にわたってATP濃度が高いまま保持されている.そこで,カスパーゼ3の活性化後に解糖系,あるいは酸化的リン酸化を阻害して細胞内ATP濃度の変化を調べたところ,酸化的リン酸化阻害剤による処理は細胞内ATP濃度に大きな影響を与えなかった一方,解糖系阻害剤による処理は速やかに細胞内ATPを枯渇させた(図3A).すなわち,アポトーシスした細胞にも解糖系でATPを再生する能力が残されており,パネキシン-1ノックアウト細胞のように細胞内ATP濃度が十分に保たれていれば,カスパーゼ活性化後もATP分解マシナリーによるATPの分解と解糖系によるATPの再生のサイクルが長時間継続する.
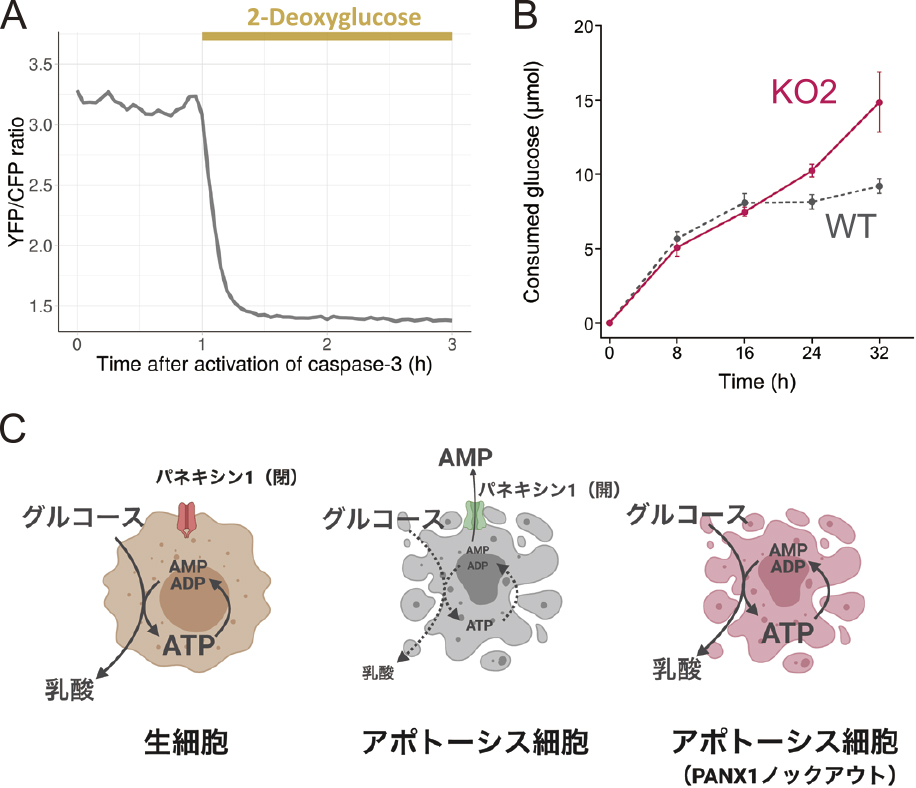
(A)カスパーゼ3活性化後に解糖系阻害剤(2-デオキシグルコース)で処理した際の細胞内ATP濃度の変化.(B)アポトーシス誘導後のグルコース消費量.(C)パネキシン-1に依存したATP濃度とグルコース消費の制御.A,Bは文献1から改変,CはBioRender.comを用いて作成.
アポトーシスが起こっても解糖系を使ってATPを再生し続けるということは,解糖系の基質であるグルコースを消費し続けるということを意味している.実際,アポトーシスを誘導した細胞のグルコースの消費量を調べたところ,野生型細胞ではアポトーシス誘導後16時間以内にグルコースの消費が停止したのに対し,パネキシン-1ノックアウト細胞では32時間経過してもグルコース消費が止まらないことが明らかとなった(図3B).すなわち,パネキシン-1によってアポトーシス細胞のATPを減少させることは,死んだ細胞の代謝を適切に停止させるために必要なのである(図3C).
今回,細胞膜チャネルであるパネキシン-1がアポトーシス細胞のATP減少に中心的な役割を果たしていることが明らかとなった.ただし,パネキシン-1をノックアウトしてもアポトーシス細胞のATP減少は完全には止まらなかったため,おそらく別の仕組みも存在するはずである.興味深いことに,パネキシン-1をノックアウトしたアポトーシス細胞では,ATP濃度が約1時間程度のゆっくりとした周期で振動する様子がしばしば観察された1).ATP濃度の変化を検出してフィードバックする仕組みが背後にあると考えられるが,こちらも現時点ではその実態は不明である.
アポトーシス細胞でATPの減少が抑えられると,長時間にわたって細胞はATP分解マシナリーを駆動し続け,ATP再生のためにグルコースを消費し続けるという,「死んでいるはずなのに死にきれない」ゾンビのような状態に陥ることがわかった.周囲の生きている細胞にとって,死んだはずの細胞が貴重な栄養を消費して動き続ければ迷惑この上ないだろう.細胞が活動を停止して完全に死んだ状態となるためには,細胞内ATPを枯渇させることが必要なのである.
本研究を進めるにあたり,多くの方々のご協力をいただいた.深く感謝申し上げたい.