2022 Volume 62 Issue 2 Pages 137-139
2022 Volume 62 Issue 2 Pages 137-139
筋肉は分子レベルから階層的に組み上げられた精巧な分子システムである.我々は工学的なアプローチで筋肉の人工合成(人工筋肉)とメカニズムの解明を目指している.本稿では,遺伝子工学的に改変したモータータンパク質を用いて,光照射した特定の部位に人工筋肉を自発的に形成させる手法と,その応用例について解説する.
教科書や論文に載っている骨格筋の写真を見たときに,サルコメアが規則正しく並んだ構造に機械のような印象をもたれた方も多いのではないだろうか?実際,筋肉は,単位質量当たりの出力が大きく,昆虫からクジラといった様々なサイズの物体を駆動できるなど,アクチュエータとして優れた特性を有している1).機械工学では,人工筋肉と呼ばれる,筋肉のように軽くて柔軟性のあるアクチュエータの開発が長年試みられている.
一方,これまでにモータータンパク質によって人工物を駆動する研究が20年以上前からなされてきたが2),ミリメートルスケールなどの大きな物体を駆動することはできていなかった.モータータンパク質を利用する際に問題となるのは,モータータンパク質1分子が発生させる力が数ピコニュートンと非常に小さいことである.このため,大きな物体を駆動するためには,何らかの方法でモータータンパク質の変位や力をスケールアップする必要があるものの,これまで有効な手段は存在しなかった.モータータンパク質などの分子機械の変位や力をスケールアップして有益な仕事を行わせることは分子機械研究の大きな課題である3).
今回我々は,改変したモータータンパク質と足場タンパク質を用いて,光照射により自由な形状に形成でき,ミリメートルスケールの物体を駆動できる収縮性のファイバ(以下,人工筋肉)を形成する分子システムを設計・開発したので報告する4).
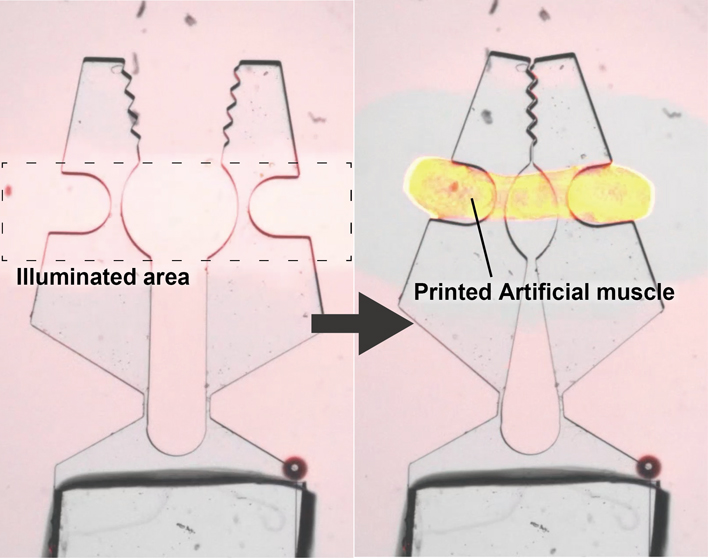
この人工筋肉はモータータンパク質キネシンを含む3つの主要なタンパク質によって構成され,人工筋肉が形成・収縮するために階層構造を形成するように設計されている(図1).骨格筋サルコメア内のミオシンフィラメント形成に主要な働きをするライトメロミオシン(LMM)とカルモジュリン(CaM)の融合タンパク質CaMLMMを作製し,フィラメントを形成させる.このCaMLMMフィラメントを足場として,キネシンとカルモジュリン結合ペプチド(m13)の融合タンパク質K465m13を固定する.このときケージドカルシウムに光照射することによりカルシウムイオンを放出させ,K465m13のCaMLMMフィラメントへの結合が光照射をトリガーとして起こるように設計した.足場となるCaMLMMフィラメントに固定されたK465m13はキネシンフィラメントを形成する.キネシンフィラメントは複数の微小管と結合し,相対的な滑り運動を起こすことで,人工筋肉を収縮させる.図2aは円形チャンバー内での人工筋肉の収縮の様子である.光照射を空間的なパターン領域に行うことにより,様々な形状の人工筋肉が作製可能である.実際に様々な形状の人工筋肉が生成・収縮するかを確認するため,星形やスマイルマークの形状に光を照射すると,そのパターンの人工筋肉が形成され,収縮を開始した(図2b).これにより光照射により任意の形状の人工筋肉を生成し,収縮させられることがわかった.
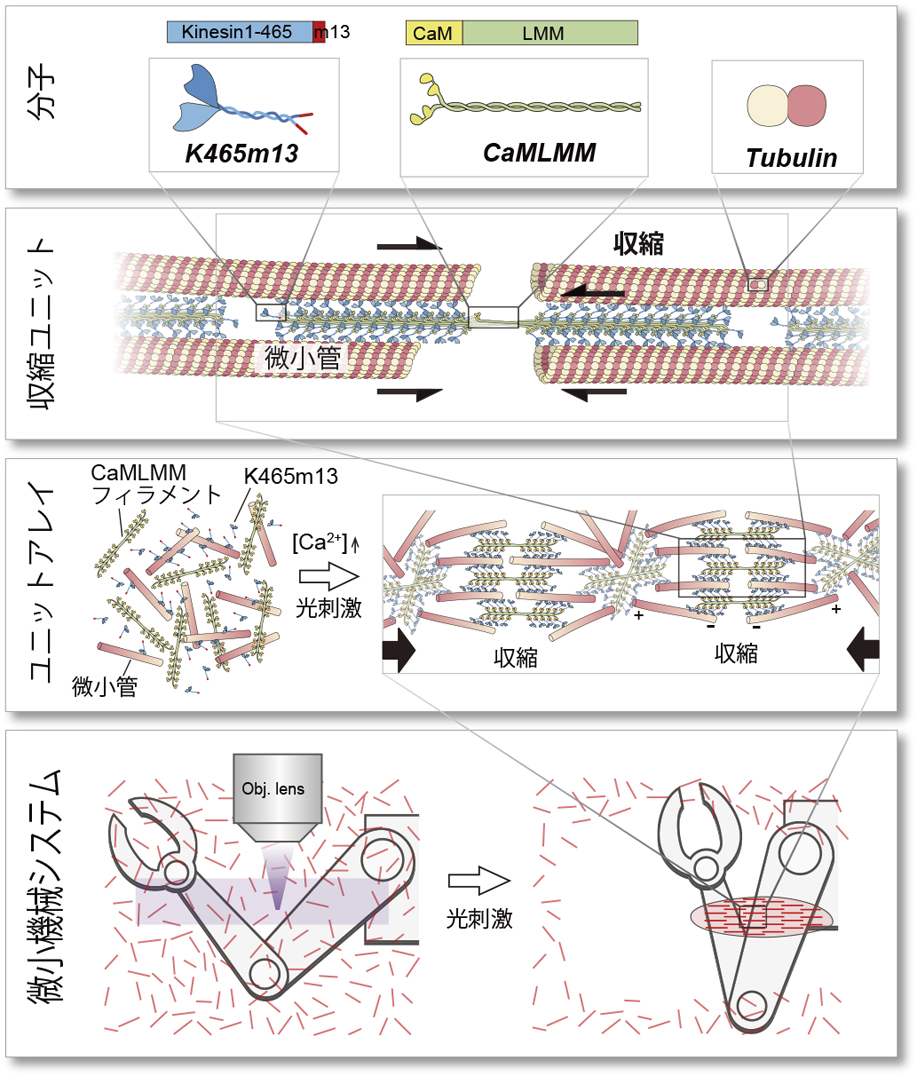
人工筋肉の概念図.分子レベルから微小機械システムレベルまでの各階層での概念図を示す.文献4より引用・改変.

収縮と光造形の確認.(a)円形チャンバー内に封入された人工筋肉を全面光照射し,収縮させた.(b)星形およびスマイルマークにパターン化した光照射によって星形およびスマイルマーク型の人工筋肉を形成・収縮させた.スケールバー:0.5 mm.文献4より引用・改変.
人工筋肉の収縮のメカニズムを調べた.人工筋肉の収縮は微小管濃度に依存し,ある臨界濃度以上でパーコレーションを起こし人工筋肉が収縮することを見出した.次に,人工筋肉の内部構造を観察した.ただし,収縮が起こる微小管濃度では内部構造の観察が難しいため,微小管濃度を臨界濃度より低くして行った.光照射を行うと微小管が局所的に集合し,アスター構造を形成することがわかった(図3a).また極性ラベルした微小管を用いた実験から,アスターの外側にマイナス端(赤色)があることがわかった(図3a).このことから収縮のメカニズムとして,隣り合うアスター間をキネシンフィラメントが架橋し,両アスターが手繰り寄せられることにより人工筋肉全体が収縮することが示唆される(図3b).このようなアスター同士の融合は類似の系でも観察されている5),6).図3bのように筋肉のサルコメアに類似した収縮機構が自発的に形成される点が興味深い.

人工筋肉収縮のメカニズム.(a)高倍率で観察した微小管アスター構造.スケールバー:10 μm.(b)アスター形成および収縮メカニズムの模式図.文献4より引用・改変.
この人工筋肉を微細加工により作製した構造体のまわりで収縮させることで,構造体と物理的に結合させる(引っ掛ける)ことが可能である.この性質を利用し,かつ微細構造の形状を工夫することにより,大きさ2 mmのマイクログリッパを駆動できた(図4a).またロボットへの実装へ向けて,昆虫型構造周辺に時間・空間的に制御した光照射を行い,左側の足を駆動した後,右側の足を駆動することで,昆虫型構造に歩行的な運動をさせるデモンストレーションをした(図4b).さらに,この人工筋肉を微小パーツの組み立てに利用する可能性を示すために,歯車パーツの微小マニュピレーションを行い,直径0.5 mmの歯車を嚙合わせた(図4c).またスタート地点とゴール地点にピラーを立てた迷路内で人工筋肉を収縮させると,人工筋肉がピラーに引っ掛かり,スタートからゴールまで接続された経路が残ることで迷路を解くことができた.

応用へ向けたデモンストレーション例.(a)マイクログリッパの駆動.(b)昆虫型ロボットの歩行.(c)機械部品の組み立て.(d)迷路解き.スケールバー:0.5 mm.文献4より引用・改変.
アスター同士の融合による人工筋肉収縮のメカニズムに基づいて,人工筋肉の収縮を再現するコンピュータシミュレーションを作成した(図5).このシミュレーションによると,人工筋肉の両端をアンカーして収縮させると張力が増大し,人工筋肉が破断する.人工筋肉が発生する最大張力は破断直前に得られ,人工筋肉を構成するアスターの分布が疎な部分から破断が始まることがわかった.同様の結果は実験でも得られている.この観察に基づき,疎な部分をなくすために,アスターを正方格子状に配置した人工筋肉の張力を調べたところ,破断に対して強くなり,最大張力が増した.この結果は人工筋肉の改良指針を示唆している.さらには,動物の骨格筋が規則正しい構造をしているのは,自らの発生する張力によって破断が起こることを防ぐためではないかと考えられる.
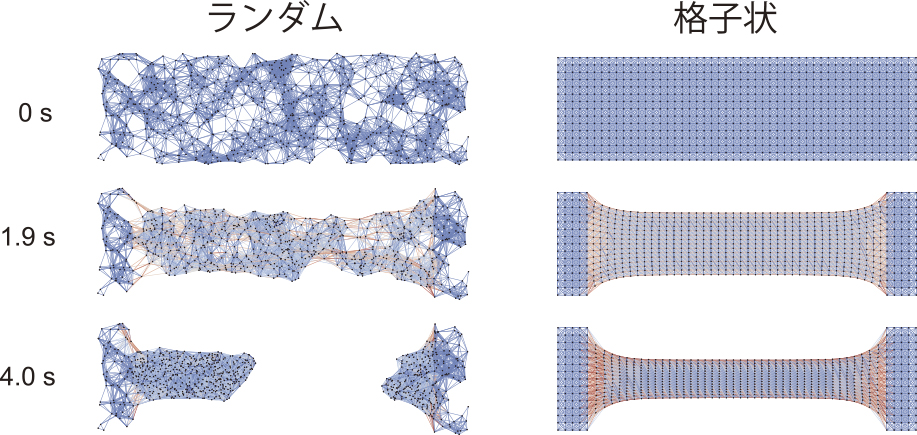
コンピュータシミュレーション.ランダムにアスターを配置した人工筋肉(左)と格子状にアスターを配置した人工筋肉(右)の収縮の比較.文献4より引用・改変.
今回,我々は生体の運動素子であるモータータンパク質分子をミリメートルスケールの組織に構築し,生物の筋肉に似た機能・性質をもつ人工筋肉の製造を可能とした.特に光照射により人工筋肉の形成を開始可能なことから,たとえば光造形型の3Dプリンタに組み込めば人工筋肉の光造形などが可能になることが将来期待でき,生体材料で駆動するマイクロロボットを3Dプリントする技術の基盤技術となる可能性が高いと考えている.
本研究で開発された人工筋肉は,現時点では形成・収縮が同時に起こり,かつ収縮は一回のみのため用途が限定される.今後,制御用の分子システムを開発することにより,可逆または振動可能な人工筋肉を開発しマイクロロボットへの実装を目指している.たとえば昆虫の飛翔筋や微生物の鞭毛の振動運動はモータータンパク質とその周辺の構造体によって引き起こされる.今後,この自律振動機構を本システムに導入することを考えている.我々はこの人工筋肉をより高度な機能を有する分子システムに発展させたいと考えている.