2022 Volume 62 Issue 4 Pages 215-218
2022 Volume 62 Issue 4 Pages 215-218
近年,分子夾雑環境下での生体分子の挙動に関心が集まっている.本稿では,ATPの持つ第二の役割,タンパク質凝集体に対する溶解効果の微視的メカニズム解明を端緒として行った研究と,その深化のために開発した生化学反応およびタンパク質多量体複合体解離過程の実効的シミュレーション手法について紹介する.

It has been elucidated that ATP can nonspecifically dissolve protein aggregates. We examined the microscopic mechanisms by using atomistic simulations and proposed that ATP adenosines-proteins backbone atom interactions destabilize aggregated protein. This mechanism is worthwhile for verification due to universal nature, while it is difficult to directly test it by conventional approaches due to rare-event nature for simulations with machine power of today. To overcome the computational difficulty, we newly developed simulation techniques to effectively treat multimeric protein disassembly and biochemical reactions within realistic computational time.
細胞内のタンパク質は,その周りに他のタンパク質や基質,さらにはその代謝物がひしめき合っており,精製単離された試験管内とは全く異なった,「分子夾雑環境」に置かれている.
Mintonの総説1)で述べられているように,分子の混み合い・閉じ込めという「非特異的相互作用」は,タンパク質や核酸の構造安定性,酵素活性等に大きく影響する.また,溶質分子の混み合い度合いの指標である実効濃度の解析から,細胞内において生体分子が均一に分散しているのではなく,凝集して存在することが示唆される.例えば,赤血球細胞中には平均して300 g/lのヘモグロビンが存在するが,その実効濃度は約100倍である.
このような分子夾雑環境下で,生体分子凝集体の形成はどのように制御されているのだろうか.2009年,Anthony HymannとClifford Brangwynneは線虫の卵細胞のタンパク質-核酸凝集体(P顆粒)の挙動を解析し,ずり変形や顆粒同士の融合という液体的性質を持つことを突き止め,さらに細胞内P顆粒の飽和濃度により顆粒形成が制御されることから,「細胞内液液相分離」を提案した2).固体的凝集体・アミロイド線維の形成や3),遺伝子転写・翻訳やシグナル伝達などの非アミロイド型生体分子凝集体,いずれについても,離合集散の制御メカニズムを理解する上での普遍的な概念として興味を集めている.この細胞内液液相分離の研究文脈の中で,2017年にAnthony Hymannらの研究グループは,ATPがタンパク質凝集体を溶解する機能を持つことを発見した4).
ATPは細胞中において,化学反応に必要な量の10倍以上も存在することは長らく議論となっていたが,このATPの第二の役割は生理濃度下で現れることから,長年の問題に一つの答えを与えたと言える.興味深いことに,Hymannらの用いたタンパク質の凝集体は,ATP加水分解反応を必要とせず,ATPとの非結合相互作用のみで溶解する.また,水溶液中に分散するタンパク質凝集体はもちろん,アミロイド線維までもがATPにより溶解する.では,ATPはどのようにして様々なタンパク質凝集体を溶解できるのか.そして,既存の研究手法はどの程度,その微視的なメカニズムに迫ることができるのか.
我々はHymannらが上記の研究4)で用いたamyloid β(1-42)(Aβ42)に注目し,Aβ42オリゴマー2量体の解離過程をAβ42アミロイド線維溶解のモデルとして,全原子分子動力学シミュレーションを用いてATPによるAβ42溶解の微視的メカニズムを調査した5).
まず,タンパク質にATPが配位し,複合体間の相互作用に摂動的に働くことで,その安定性を低下させるのではないかと予想した.実際,Aβ42オリゴマー2量体へのATPの配位を確認することはできた(図1A).しかしながら,オリゴマー2量体解離過程の自由エネルギープロファイルを調べたところ,ATPを添加することによる解離の活性化障壁の低下はみられなかった(図1B).つまり,ATPにはAβ42オリゴマー2量体形成を直接的に不安定化する効果は無いと考えられる.
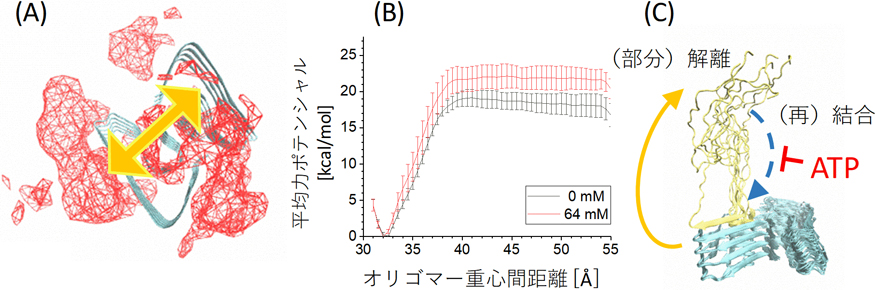
ATP溶存下でのアミロイドβ42オリゴマー2量体(青色リボン).(A)ATP(赤網目)の配位.(B)オリゴマー解離の平均力ポテンシャル(黒線:ATP無し;赤線:ATPあり).(C)(部分)解離したモノマー(黄色リボン)に対するATPの作用メカニズム.(A)中のオレンジ色矢印は解離方向を表す.
そこでATPが,解離促進ではなくAβ42モノマーとオリゴマーの会合阻害に働く可能性を考えた.ATPはこのオリゴマー2量体の成長軸索の主鎖部分,また(部分)解離したAβ42モノマーの主鎖にも配位することが分かった.ATPは溶媒に露出したタンパク質主鎖と非特異的に相互作用することで,様々なタンパク質に対して溶解作用を持つことが示唆される.
一方,Aβ42主鎖と接触するのはATP分子中の三リン酸ではなくアデノシンであった.Hymannらによれば三リン酸自体に溶解能力は無いことから4),我々の得た観測は彼らの実験結果と整合している.上記の観察から,ATPはAβ42分子間の相互作用と競合することで,オリゴマー形成を阻害することが示唆される(図1C).以上の考察から,ATPの働きはAβ42系の熱平衡を凝集状態から溶解状態へと遷移させることであると推測される.
自然な流れとして,この仮説の検証を試みたいと思うのだが,これはそう簡単ではない.Aβ42オリゴマーの分解経路をシミュレートする必要があるからだ.一般に,タンパク質2量体の解離ですらミリ秒以上の時間を要する.一方,生体系のような巨大原子系を扱う場合,現在の計算機資源でシミュレートできるのは数十マイクロ秒程度であり,多量体タンパク質の解離過程を追跡することは現実的に難しい.そこでまず,分子シミュレーションの中では「起こりにくい」多量体複合体の解離過程を実効的に取り扱う方法を検討することにした.
リボソームなどの生体分子の多量体複合体は細胞内生化学反応の物理化学的実体であり,サブ複合体の分布および形成順序の解明は機能発現メカニズムの理解に直結する.近年では,質量分析法や多タンパク質ドッキングシミュレーションが多量体複合体形成の主要な研究手法として広く用いられている6),7).
さらに,自由エネルギー計算などの理論解析を行えば,より詳細な形成過程の物理化学性質を明らかにできる.しかし,質量分析法等では,ATPなどの共溶質分子や,結合していないタンパク質の配置を原子レベルで余さずに観測することはできないため,そのまま上記のような解析に進むことはできない.
そこで,混合モンテカルロ/分子動力学法(hybrid Monte Carlo/molecular dynamics: hMC/MD method)を基に,実験観測と整合する解離経路を与え,系中の完全な原子座標情報を取得する方法の開発を試みた8).
シミュレーション中に起こりにくいタンパク質複合体解離は,外力を加えて系の変形を加速する,いわゆるsteered MDシミュレーションで取り扱う.一方,steered MDで不自然な構造変化が生じる可能性を考慮し,メトロポリス法を用いたMCシミュレーションで解離後構造の採用・棄却判定を行った.
このhMC/MD法を用いて,質量分析法のベンチマークとして広く用いられている血清アミロイドPタンパク質5量体を複数回シミュレートした.
まず,いずれの場合も100 ns以内に5量体が単量体5分子に解離することを観測した.次に,このシミュレーションで進行する解離過程に注目したところ,二つのサブ複合体形成過程(4量体と3量体)を観測できた(図2参照).これは質量分析法に基づき推定された解離経路6)と整合する結果である.

混合モンテカルロ/分子動力学法を用いた血清アミロイドPタンパク質のホモ5量体解離過程のシミュレーション.
さらに解離過程の分子運動トラジェクトリーを解析したところ,新たなプレ解離過程(開環)を見出すことができた.開環過程の自由エネルギープロファイルを計算から見積もった反応時間は数時間程度であることから,この過程の有無を原子間力顕微鏡などで検証することは可能と考える.
以上の成果から,hMC/MDシミュレーションは多タンパク質ドッキングシミュレーションと質量分析法を補完する,第三の多量体複合体の物理化学メカニズムの解析手法になりうると期待している.
さて,Hymannらの研究によれば,ATPは加水分解と無関係にタンパク質凝集体を溶解する.しかし,その後の研究で,ATP加水分解が必須となるタンパク質凝集体の溶解も存在することが報告された9).より一般にATPの凝集体溶解作用を理解するには,多量体解離に加え,生体分子の化学変化も取り扱う必要がある.
ところが,化学反応も通常ミリ秒以上を要するため,分子シミュレーションの時間スケールに比べて長く,直接観測は難しい.従って,このような「レア・イベント」もやはり,分子シミュレーションの中で実効的に取り扱う必要がある.レア・イベントを扱う手法の選び方は一つではないが,もしそれが生体高分子に関する問題解決に利用できるものであれば,その手法は物理化学的に妥当で,研究に用いる際の選択の優先順位も高くなると考えた.
生化学において,タンパク質によるATPおよびGTPの加水分解反応は,細胞運動や細胞内シグナル伝達などを駆動する力学的仕事の供給源として働くことはよく知られている一方,その仕組みは原子運動レベルではまだよく分かっていない.そこでJohn Rossが加水分解反応直後の分子ダイナミクスを念頭に提案した仮説10):「反応生成物であるADP/GDPと無機リン酸(Pi)の間に働く斥力相互作用が方向を持つ運動エネルギーに変換されて仕事に利用される」に注目し,その妥当性を分子シミュレーションで検討した11).
ここで,化学変化を実効的に扱うために力場切り替え法に注目した.高柳らはこの手法を用いて,ミオグロビンのヘムからCOが解離する過程における振動エネルギーの緩和経路を原子レベルで解明している12).
彼らの研究では,ヘム-CO間の共有結合の切断のみを考えている一方,ATP/GTP加水分解では化学結合の切断と生成の両方が起こる.そこで,反応物中の原子を再配置して生成物の構造をモデリングする際に,量子化学計算で構造最適化を行い,自然な原子配置を発生させるよう工夫した.
この手法を,低分子量GTP加水分解酵素であるRasに適用し,加水分解に伴う運動エネルギーの生成およびタンパク質構造への影響を解析した.まず,加水分解後のGDP + Piのエネルギー緩和を解析した(図3参照).数ピコ秒以内に,GDPとPiの位置が緩和し,またGDPとPi間に働くクーロン斥力が運動エネルギーに変換されることが分かった.しかしながら,これらの分子の速度角度相関を解析したところ,1ピコ秒以内に相関を失い,熱化することが明らかとなった.

力場切り替え法を用いたGTP加水分解シミュレーション.(A)分子間斥力による方向性運動エネルギー生成機構.(B)GTP加水分解に伴うGDP+無機リン酸(Pi)のエネルギーダイナミクス(赤:運動エネルギー;黒:結合エネルギー;青:非結合エネルギー).
つまり,上記の仮説10)に反して,加水分解反応によって生じるGDP-Pi運動エネルギーは,タンパク質の構造変化や解離など,マイクロ秒以上を要する「遅い」分子過程については力学的仕事として利用できないことが分かった.
次に,GTP加水分解のRasタンパク質に対する影響を調べたところ,リン酸結合ループ(P-loop)のエネルギー増加が確認された.この変化は5 kcal/mol程度である一方,ATP/GTP加水分解の自由エネルギー変化は8~10 kcal/mol程度であることが知られている.この観測から,加水分解のエネルギーの一部は,反応直後ではP-loopに保持されることが示唆される.
P-loopはATP/GTP加水分解タンパク質に共通してみられるモチーフであるため,Ras以外のタンパク質でも,同様の変化が起こることが期待される.興味深いことに,このP-loopの変化は,加水分解による運動エネルギーの生成を抑制しても同様に観測された.つまり,加水分解の役割は,Rossが考えた方向性を持つ運動エネルギーの生成ではなく,GTPの化学変化に伴う生体分子間相互作用の変化自体であり,Rasとその相互作用タンパク質の複合体形成への影響が示唆される.
ATP/GTP加水分解の生成熱が力学的仕事の発生に関わるという観測は,近年シミュレーションや実験からも再検討がなされており13),14),本研究は,特にGTP加水分解の初期過程を微視的に解析したことで,この化学過程の理解の進展に貢献できたと考える.
なお,この力場切り替え法は,原理的にはどのような化学結合の切り替えにも適用可能である.低計算コストで実効的に化学反応の効果を扱う際の汎用的な手法となりうると考えている.
ATPによるタンパク質凝集体溶解に対するメカニズムの検証を端緒として,生化学反応と分子認識過程(主に解離過程)を実効的に取り扱うシミュレーション手法を開発した.これらの手法は生体高分子に関する問題に適用でき,かつ生物物理化学的な知見を与えるものであることから,微視的な生体系シミュレーションに特に適していると考える.今後はこれら手法を,長岡らの提案したRedMoon法15)の枠組みに実装することで,Aβ42線維の溶解や,細胞内で逐次的かつ並行して進行する生化学反応群の動態など,様々な研究対象に適用して行きたい.
RedMoon法はこれまで主に電池,機能性高分子などの材料研究に応用され,注目され始めている.この方法の真骨頂は,所与の反応規則(もしくは化学的秩序)セットの下で未知の複雑化学過程をシミュレートできる点にある.細胞内における化学的秩序の基本単位はタンパク質や核酸の間の分子認識や生化学反応である.そこで,RedMoon法を用いた分子シミュレーションを用いて,生命現象を再現しうる最小の反応規則セットを明らかにできるのではないかと期待する.
シュレディンガーは「生命とは何か」16)の中で,デルブリュックの遺伝子突然変異の物理模型から考察を進め,生命の本質は基本的な秩序がより高次の秩序を生み出すことにあると考え,それを時計仕掛けと表現した.「生体情報とエントロピー」17)での鈴木英雄先生らの言葉を借りれば,「当世風の表現ではバイオロジカル・タイミングの機構」となる.これら先人の示した観念的生命像を,分子シミュレーションによるボトムアップ・アプローチで検証することで,生命の実体である分子夾雑系の設計原理を物理化学の概念に基づき理解して行けるのではないかと考えている.
本研究は下記の助成・支援の下に行われました:文部科学省科学研究費助成事業・新学術領域研究「分子夾雑の生命化学」(課題番号:JP17H06353);光・量子飛躍フラッグシッププログラム(Q-LEAP)量子計測・センシング技術領域「量子生命技術の創製と医学・生命科学の革新」(課題番号:JPMXS0120330644);分子科学研究所共同利用研究(課題番号:21-IMS-C013).