2022 Volume 62 Issue 4 Pages 232-234
2022 Volume 62 Issue 4 Pages 232-234
クマムシは,水分を失うと乾眠と呼ばれる状態に移行して生命活動を一時停止し,極限環境耐性を獲得する.最近の研究により,クマムシの細胞内に豊富に存在するタンパク質が,水分消失に伴って繊維状の集合体を自発的に形成することで,すぐさま脱水状況に対応できる仕組みを兼ね備えていることを見出した.

クマムシは生育環境から水がなくなると「乾眠」と呼ばれるすべての代謝が停止した状態となることで,乾燥した環境において数十年にもわたって生き延び,給水すると乾眠状態から復帰して代謝を再開する能力を持っている(図1a).乾眠状態のクマムシは乾燥耐性に加えて,極度の高温・低温,圧力,また放射線などによる様々な環境ストレスに対しても強い耐性を示す1),2)ことから,しばしば“地上最強生物”と呼ばれる.なかでも陸生のクマムシの一種であるRamazzottius varieornatus(ヨコヅナクマムシ)は,高い乾燥耐性を示すことが知られている.ヨコヅナクマムシは,水分を消失した状態においても細胞を保護するために,いくつかのクマムシ固有のタンパク質を恒常的に発現し,細胞内に常備していると考えられている2)-4).しかしながら,乾燥耐性におけるそれらのタンパク質の役割はほとんど明らかとされていなかった.

(a)クマムシは脱水に伴って乾眠状態に移行する.(b)クマムシに豊富に存在するタンパク質CAHS1は,水分消失に伴って濃度が高くなると,自然に集合して(c)ファイバーや(d)ゲルを形成し,濃度が低くなると元の状態に戻ること,および乾燥状態においても(e)繊維構造を保持していることを見出した.文献5より引用・改変.クマムシの画像は荒川和晴博士より提供.
本稿では,ヨコヅナクマムシの細胞内に豊富に存在する熱可溶性タンパク質の1つであるcytosolic abundant heat-soluble(CAHS)タンパク質3)に着目して,そのアイソフォームの1つであるCAHS1を対象に,その構造と機能を調べた成果を紹介する5).
まず,脱水条件におけるCAHS1タンパク質の構造を調べるため,カーボングリッド上で乾燥させたCAHS1タンパク質を透過型電子顕微鏡(TEM)で観察したところ,繊維構造が形成されていることがわかった(図1e).赤外分光分析から,脱水したCAHS1タンパク質はαヘリックス構造をとっており,この構造は水和によって可逆的に消失することがわかった.これらの結果から,CAHS1タンパク質は乾燥条件下において,αヘリックス構造の形成と同時に繊維化することが示唆された.一方,クマムシは乾燥によって体が縮み,最終的には脱水状態で5分の1程度の大きさになることから(図1a),この過程でタンパク質濃度が数倍上昇すると予想された.実際,中性pH領域では,CAHS1タンパク質の濃度が0.3 mMを超えると急激に溶液の濁度が上昇し,最終的に高濃度(0.6 mM以上)でゲル化し(図1d),希釈すると可逆的に溶液に変化した.すなわち,CAHS1タンパク質は濃度の上昇に応じて可逆的にゾル-ゲル転移を起こすことが明らかとなった.そこで,高速原子間力顕微鏡を用いて,このゾル-ゲル転移現象をリアルタイムで観察した.その結果,希薄な条件下ではCAHS1タンパク質は球状領域および柔軟な天然変性領域からなる単量体であり(図1b),高濃度条件下ではCAHS1タンパク質が自発的に集合し繊維状の構造体を形成していく様子を捉えることができた(図1c).CAHS1が繊維構造を形成した後に50 mM KClを添加したところ,その繊維構造が完全に消失したことから,CAHS1タンパク質の繊維構造は主に静電相互作用によって可逆的に形成されることが確認された.
CAHS1タンパク質は237アミノ酸残基からなるが,そのN末端領域(1-96残基)はランダム構造をとり,C末端領域(97-237残基)はαヘリックス構造をとることがアミノ酸配列より予測されていた3).核磁気共鳴法(NMR)により,CAHS1タンパク質のC末端領域は,実際はモルテングロビュール状態にあり,緩いαヘリックス構造をとっていることが判明した.CAHS1タンパク質の濃度を上げると,C末端のαヘリックスに由来するNMRピークが消失し,N末端の天然変性領域に由来するピークのみが観測されたことから,CAHS1タンパク質はC末端のαヘリックス領域を介して会合し,N末端領域は会合状態においてもフレキシブルであることがわかった.実際,CAHS1タンパク質のC末端領域のみでも繊維化するが,N末端領域のみでは繊維化しないことを高速原子間力顕微鏡を用いて確認した.
CAHS1タンパク質が細胞内の分子クラウディング条件下において繊維構造を形成する可能性を検討した.遺伝子組み換えタンパク質としてCAHS1タンパク質を大腸菌に過剰発現させ,TEM 観察に供したところ,CAHS1タンパク質が乾燥状態の大腸菌の細胞内においても繊維構造を形成することが確認された(図2).
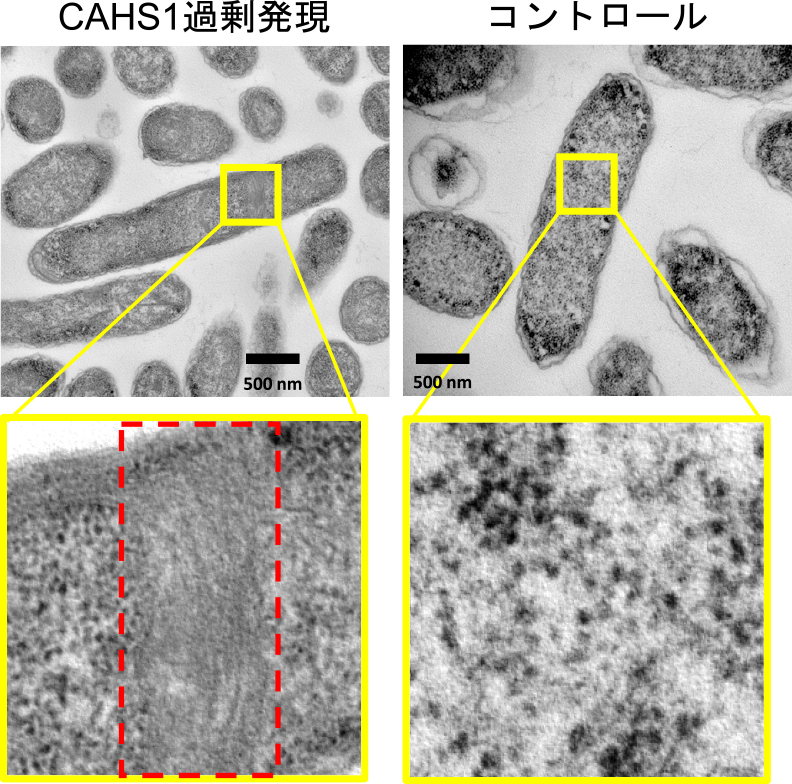
大腸菌にCAHS1タンパク質を過剰発現させると,細胞内に繊維状の構造体(赤枠)の形成が見られた.文献5より引用・改変.
さらに,蛍光タンパク質を融合したCAHS1タンパク質(CAHS1-mEGFP)をヒト由来の培養細胞に過剰発現し,蛍光顕微鏡を用いたライブイメージングにより,その挙動を観察した.CAHS1-mEGFPは細胞質全体に均一に分布していたが,乾燥に伴う脱水状態を模して細胞に高浸透圧ストレスをかけると,細胞質および核においてすぐさま集まって粒子状の集合体を形成し,ストレスがなくなるとこうした集合体は消失して元の状態に戻ることが観察された(図3).
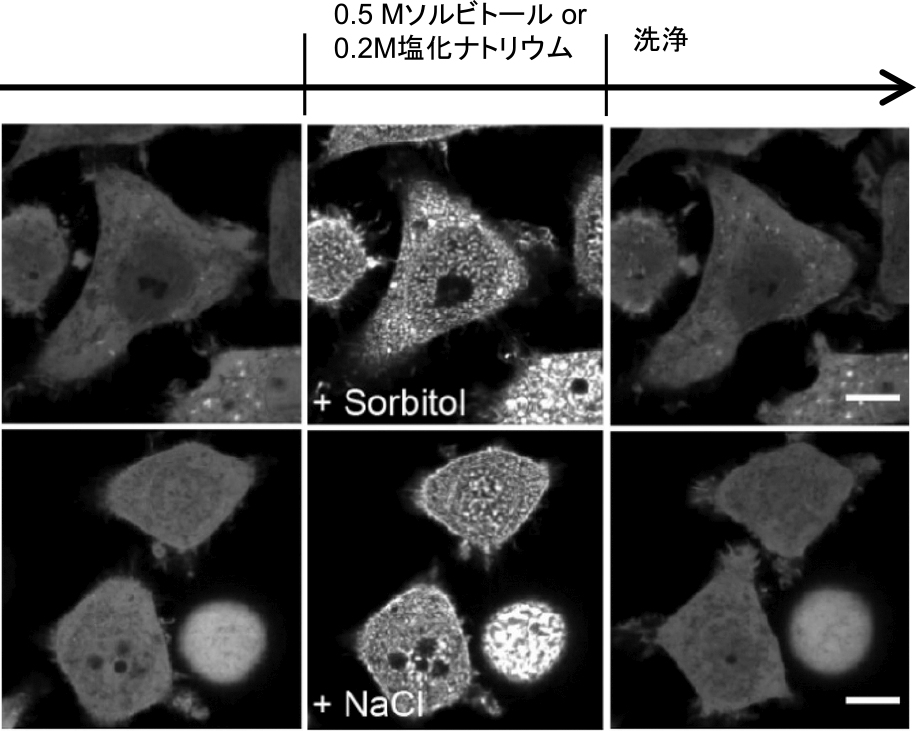
HeLa細胞に蛍光タンパク質を融合したCAHS1タンパク質を発現し,0.5 Mソルビトールもしくは0.2 M塩化ナトリウムによる高浸透圧ストレスをかけると,細胞内に粒子状の集合体を形成した.洗浄により高浸透圧ストレスを取り除くと,集合体は速やかに消失した.文献5より引用・改変.
以上のin vitroおよびin vivo実験のデータから,クマムシの細胞内に豊富に存在するタンパク質CAHS1は,脱水が引き金となってC末端領域のαヘリックス構造を介して自発的に集合して繊維構造や巨大な集合体を形成し,最終的にハイドロゲルの形成に至ること,さらに,そのような繊維状の構造体は乾燥状態においても保持され,給水に伴って解離して単量体に戻ることが明らかとなった5).
このようなCAHS1タンパク質の段階的な構造転移は,本タンパク質が乾燥に至る各ステップにおいて,多面的な役割を担っている可能性を示唆する.脱水過程において,CAHS1タンパク質の集合体が細胞質でコアセルベート様の液滴を形成し,脱水ストレスから他の生体分子を保護するための可逆的な“保護区画”を形成し,乾燥耐性に寄与している可能性がある.さらに,CAHS1タンパク質はハイドロゲル化することにより水分を保持し,代謝などの生命システムが強制終了しないように,緩やかに乾眠に誘導するのに役立っていることが想定される.一方,乾燥状態においては,CAHS1タンパク質の網目状の繊維構造体は,緩衝材のように細胞内に張り巡らされた状態で細胞の構造維持に役立っているとともに,“ドライシャペロン”として乾燥に弱いタンパク質を変性から保護したり,オルガネラ機能の完全性の維持に関与している可能性がある.さらに,給水過程においては,繊維構造体からハイドロゲルを経て単量体に解離していくことで,生命活動の再開を適切に調整しているのかもしれない.
クマムシ以外にも,線虫,ネムリユスリカ,アルテミアなどの生物は,極度の乾燥耐性を有することが知られている6).これらの生物は,CAHSタンパク質を持っておらず,乾燥条件下において細胞内に高濃度のトレハロースを蓄積し,これが水分保持やガラス化を通じて細胞を保護しているとされている6).これに対して,ヨコヅナクマムシで見出されたCAHS1タンパク質の繊維状のネットワーク構造体の形成は,トレハロースのガラス化とは全く異なる乾燥耐性メカニズムの存在を示している.最近,アルテミアの一種であるA. franciscana由来のLEAタンパク質を発現した昆虫細胞が脱水条件下において液滴を形成し,そこに正電荷に富む蛍光タンパク質を内包することが報告された7).このように,特異なタンパク質の分子集合を伴う細胞内の相分離が,生物の乾燥耐性に共通した分子機構である可能性が見えてきた.
本稿ではCAHS1を対象とした研究成果を紹介したが,実際ヨコヅナクマムシは少なくとも16種類のCAHSタンパク質アイソフォームを発現している2),3),8).加えて,MAHSおよびRvLEAMと呼ばれる熱可溶性タンパク質がミトコンドリアの保護分子として同定されている4).これらの一連のタンパク質は,CAHS1とは異なる集合体としての特性を持ち,乾眠過程において異なる役割を協調的に担っている可能性が考えられる.さらに最近,ヨコヅナクマムシとは異なる綱に属するEchiniscus testudo(トゲクマムシ)のマルチオミクス研究により,2つの新規熱可溶性タンパク質ファミリーが同定された9).これらのタンパク質は,CAHSとはアミノ酸配列の相同性はないものの,CAHSタンパク質と類似の構造的特徴を有していることが明らかとなっている.現在,これらのタンパク質の包括的な構造機能解析が進行している.
本稿で紹介した成果は,クマムシの乾眠機構の解明を促すだけでなく,生命の環境適応の分子戦略を理解するうえで重要なてがかりを与えるものと期待される.さらに,この発見は,「生きているとは何か」の謎に迫るとともに,ワクチンをはじめバイオ医薬品の保護基材としてなど,医療やバイオテクノロジーへの応用研究の推進に繋がるものと期待される.
本トピックスで紹介した研究成果は,青木一洋教授(ExCELLS/基礎生物学研究所),村田和義特任教授(ExCELLS/生理学研究所),内橋貴之教授(ExCELLS/名古屋大学),荒川和晴教授(ExCELLS/慶應義塾大学),古谷祐詞准教授(分子科学研究所/現名古屋工業大学)およびそのグループメンバーと共同で行ったものである.筆者らのグループ(ExCELLS/名市大)のメンバーおよび共同研究者の方々にこの場を借りて感謝申し上げる.