2024 Volume 64 Issue 3 Pages 151-154
2024 Volume 64 Issue 3 Pages 151-154
発生期マウス大脳皮質で見られる特徴的な血管構造の形成には,細胞挙動を制御するガイダンス分子が関与していると考えられるが,そのメカニズムは明らかになっていない.ガイダンス制御がどのように血管パターンを規定しうるか,数理モデルを用いて検討した研究を紹介する.

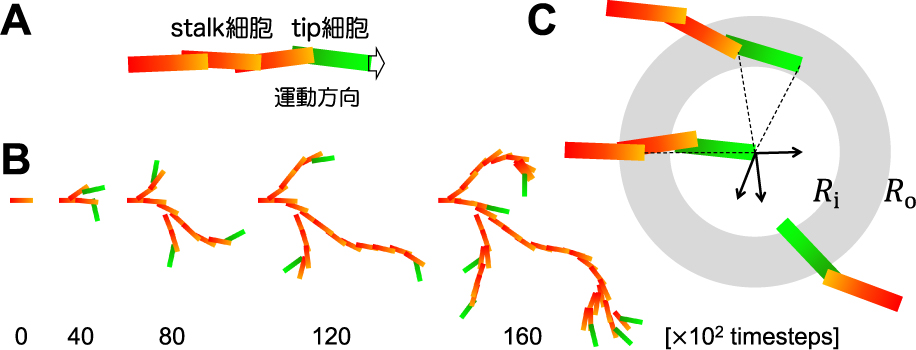
血管新生は,血管内皮細胞の集団運動による構造形成過程と捉えることができる.血管内皮細胞を培養すると,細長く伸びた細胞が接着しあいながら遊走と増殖を繰り返し,おおよそランダムな分岐構造を形成する(図1A).一方で生体内では,各組織に特徴的な血管構造がみられる(図1B)1).血管網の発達は組織形成と同時に進行することから,組織を構成する細胞の分化・遊走と協働していると考えられる.血管内皮細胞の中でも,伸長する血管の先端に位置するtip細胞は,仮足を生じて,血管内皮細胞増殖因子(vascular endothelial growth factor, VEGF)をはじめとする種々のガイダンス分子の制御を受けながら,後続するstalk細胞を先導する.ガイダンス制御は組織と血管の協働をつなぐものと考えられるが,分子機構には未解明な点も多く,どのように組織特異的な血管パターン形成ダイナミクスが規定されるのか明らかになっていない.
そこで我々は理論的アプローチとして,様々な血管パターンの形成条件を調べることで構造決定機構を理解したいと考えた.tip細胞とstalk細胞では機能が異なることから,細胞レベルの挙動と相互作用に焦点をあて,これを表現する数理モデルを構築した.血管パターンとしては,発生期マウス大脳皮質でみられる特徴的な血管構造1)を取り上げることとした(図1B).本稿では我々の最新の研究成果を紹介する2).
大脳皮質実質に形成される脳室周囲血管は,胎生期に神経組織が成長するに伴い,規則的な発生過程をみせる.神戸学院大学の水谷健一特命教授らは,皮質板(CP)では直線状に伸びた血管が並び,サブプレート(SP)を境界として,中間帯(IZ)と脳室下帯(SVZ)では密度の異なる蜂巣状の血管網が生じることを見出した(図1B)1).このような特徴的構造は発生期にのみ現れるが,同様の現象がフェレットやカメでも観察されることから1),脊椎動物に共通した神経-血管ワイヤリングの存在が強く示唆される.そういった発生生物学上の重要性に加え,隣り合った組織で多様な血管パターンが形成されるという点は興味深い.
大脳発生では神経軸索ガイダンスとしてNetrin,Semaphorin,Ephrinといった分子群が働いているが,これらはtip細胞ガイダンスにも関わっており,大脳に特徴的な血管構造の鍵を握ると考えられる3).また我々はVEGFが胎生13.5日マウスの脳室帯(VZ)を中心にIZに至るまで高発現していることを確認しており,CPではVEGFの濃度勾配が存在すると推測している.ガイダンス制御は誘引性(VEGFなど)と反発性(Semaphorinなど)に分類されるが,これらの働きが組み合わさることで,CPとIZ/SVZでみられるような血管パターンの多様性を生じうるのか,tip細胞の挙動に基づく血管新生の数理モデルを構築して検討することとした.
今回のモデルは,血管内皮細胞に特徴的な細長い形状と協調的な運動から,血管新生と分岐形成を説明できるのではないかという着想に基づいている.簡単のため2次元の系とし,全ての細胞を同一の長方形と見立てて,その挙動を記述するというagent-based approachを採った(図2A).隣接する細胞との接着によって,運動方向が揃い速度制御が働くと仮定することで,枝状の細胞集団を形成させた.ここで確率的な増殖と運動方向ノイズを加えると,細胞自律的な分岐形成が表現できた(図2B).生体内では,ここにtip細胞ガイダンスが働くことで特定の血管構造を実現していると考えられる.それではどのような誘引性・反発性ガイダンスの働きを仮定すれば,発生期大脳皮質の血管パターンを再現できるのか検討した.
CPでは,軟膜側から血管が侵入し,一定の間隔を保って血管が平行に並ぶ(図1B).そこでVEGF濃度勾配への走化性(誘引性ガイダンス)を想定して,細胞運動が軟膜側からSP側へ誘導されるという仮定を組み込んだところ,分岐のない直線状の血管形成が再現できた(図3A).一方でこのような方向制御を仮定しない場合は,ランダムに分岐・湾曲した血管となった(図3B).血管間隔については,細胞間反発的相互作用(反発性ガイダンス)を仮定することで制御できた(図3C,図2C,詳細は後述).

大脳血管の再現2).(A)平行直線パターン(CP)の再現.初期状態として,成長領域(点線)の上端に,細胞をランダムに配置した(上パネル).成長領域の外に細胞は出ず,折り返して運動する.細胞長2,幅0.4に対してRi = 4,Ro = 5とした.(B)誘引性ガイダンスがない場合.(C)反発性ガイダンスがない場合.(D)メッシュワークパターン(IZ/SVZ)の再現.Ri = 4,Ro = 5.(E, F)反発領域サイズによる血管密度の制御.(E)Ri = 2,Ro = 3.(F)Ri = 6,Ro = 7.
IZとSVZでは,SPと後脳側から血管が侵入し蜂巣状の血管が形成される(図1B).この領域ではVEGF発現レベルが高く,一定方向の走化性が働くとは考えにくいため,誘引性ガイダンスは仮定しない.IZとSVZの血管密度の差を表現するために,反発性ガイダンスにあたる細胞間反発を仮定した.
反発的な細胞間相互作用は,tip細胞が自分の近傍にある他の細胞から受ける斥力として導入した(図2C).メッシュワークの形成には血管の連結が必要であるため,ごく近傍の細胞からは斥力を受けずに,一定の距離にある細胞からのみ斥力を受けると仮定した.このような遠距離の抑制的作用は,周期構造を生み出す原理となりうることが,パターン形成の理論研究で知られている4).遠距離の細胞間相互作用は拡散性因子を想定した仮定であり,シグナル応答におけるtip細胞とstalk細胞の挙動の差や,直接接触している細胞間で生じる相互作用など,未解明の知見と将来関連付けられる可能性があるとみている.
IZ/SVZのメッシュワークは,このような反発性ガイダンスの働きと,細胞運動の散発的な反転という仮定により再現され(図3D),血管密度は反発を生じる距離により調節できることも分かった(図3E, F).
本研究は平行直線パターンとメッシュワークパターンの双方を再現した(図3).誘引性・反発性ガイダンスの組み合わせが多様なパターンを生み出すのである.改めて1細胞を初期条件として血管形成過程の数値計算を行い,ガイダンス制御の仮定がもたらすものを確認したい.
誘引性・反発性ガイダンスそれぞれの強さを変化させた場合の血管パターンを示す(図4).走化性がより強く働く場合には,分岐が抑制され直線状の血管ができた.逆に反発が強いほど,走化性による方向制御は打ち消されて,分岐が促進された.細胞間反発による分岐はspace-filling patternを成しており,ガイダンスを仮定しない分岐パターン(図2B)と定性的に異なる.

tip細胞ガイダンスの組み合わせによる血管パターンの制御2).ここでの走化性はtip細胞を右向きに誘導している.
細胞間反発の導入は,血管間隔の制御を意図したものだったが,これが分岐促進にも働くことになった.このことを理解するため,ひとつの血管の上での細胞間反発の働きを考えた(図5).stalk細胞がノイズにより逸脱して新たにtip細胞になった際,斥力はtip細胞と血管との角度を拡大するように働く(図5A).しかし逸脱が血管先端で起きた場合には,斥力がtip細胞を血管方向に均すように働き,分岐を抑制する(図5B).このことを数値計算により確認すると,新しいtip細胞と血管との角度が大きいほど,斥力が分岐を促進する方向に働き,小さいほど抑制することが分かった.先端から離れたところでは小さい角度でも分岐が促進され,先端付近では大きな角度変化でも分岐が抑制される(図5C).促進と抑制が切り替わる角度は,逸脱の位置に依存しており,これらの関係は反発領域サイズによって変化する.つまり反発領域サイズによって分岐間隔が調節されており,これが血管密度の制御につながっていた.

細胞間反発の仮定による分岐制御.直線状の血管を仮定し,そこから逸脱したtip細胞に働く斥力の合力(矢印)の方向を考える.(A)先端から離れたところでは分岐を促進するトルクが生じる.(B)先端付近では分岐を抑制するトルクになる.(C)tip細胞と斥力の角度が等しくなる条件をプロットした.白丸が示す境界で分岐促進か分岐抑制か分かれる.Ri = 3,Ro = 4.
これまでに,血管形成の数理モデル研究では,VEGFによる腫瘍への密な血管浸潤や分岐条件など,多様な解析が行われてきた5),6).メッシュワーク形成は,vasculogenesisのモデルが多く知られるものの7),8),angiogenesisにおける検討は十分ではなかった.本研究ではangiogenicな過程としてメッシュワークの形成と血管密度の調節を表現することができた.メッシュワーク形態は分岐角と分岐間隔で左右されるが,本研究ではこれらを長距離の細胞間反発によって制御できることを示した.一方で,この仮定は細胞間相互作用を高度に抽象化しており,実際の生物学的なプロセスを反映しているのか検証と改良が必要である.数理モデルから得られる知見が,細胞という単位に起因する構造形成原理を理解する作業仮説として,血管パターン形成に対する新しい視点を提供することになると期待する.
今村寿子(いまむら ひさこ)
九州大学学術研究・産学官連携本部研究推進専門員(URA)
平野才人(ひらの さいと)
八幡厚生病院
水谷健一(みずたに けんいち)
神戸学院大学大学院薬学研究科特命教授