2021 Volume 61 Issue 5 Pages 319-324
2021 Volume 61 Issue 5 Pages 319-324
症例は61歳の男性.橋右側,右被殻の脳梗塞のため当院へ紹介となった.血液検査で好酸球増加があり,造影CTで深部静脈に血栓あり抗凝固療法を開始した.心内血栓や右左シャントはなく,胃粘膜生検で好酸球浸潤をみとめた.特発性好酸球増加症候群(idiopathic hypereosinophilic syndrome,以下idiopathic HESと略記)による多発穿通枝梗塞と診断し,発症第10日目よりプレドニゾロンを開始した.発症第19日目に左被殻に新規梗塞を再発したが,プレドニゾロンで速やかに好酸球は減少し以降脳梗塞の再発はなかった.idiopathic HESでは穿通枝領域に限局した多発梗塞の報告は稀である.本例は脳梗塞巣が穿通枝領域にある場合でもidiopathic HESを鑑別疾患として念頭におく必要があることを示した.
A 61-year-old man was admitted to our hospital due to cerebral infarction in the pons and the right putamen. On admission (day 3 from symptom onset), laboratory testing showed a white blood cell count of 13,100/μl with hypereosinophilia of 3,734/μl. As deep vein thrombosis was detected on contrast-enhanced CT, we started anticoagulation therapy. There were no cardio-embolic sources, including right-to-left shunt, but eosinophil infiltration was found in biopsy specimens of the gastric mucosa. These findings allowed us to diagnose multiple perforator infarction due to idiopathic hypereosinophilic syndrome (idiopathic HES). After the administration of oral prednisolone was started on day 10, his hypereosinophilia rapidly improved, and no recurrence of deep perforator infarction occurred other than a symptomatic infarction in the left putamen at day 19. There are a few reports of idiopathic HES with multiple infarctions developing in deep perforator regions. The current case suggests that idiopathic HES could cause multiple cerebral infarction restricted to deep perforator areas.
特発性好酸球増加症候群(idiopathic hypereosinophilic syndrome,以下idiopathic HESと略記)はその合併症として分水嶺領域に散在する脳梗塞を起こすことが知られている1).今回我々は穿通枝領域にのみ多発した好酸球増加症(hypereosinophilia,以下HEと略記)による脳梗塞を経験したので報告する.
患者:61歳,男性
主訴:頭痛,発熱
既往歴:高血圧症,胆石症.
家族歴:特記事項なし.
生活歴:過去に季節性アレルギー性鼻炎を疑う病歴はあるが,食物・薬物に対してのアレルギー歴なし.飲酒なし.喫煙歴なし.海外渡航歴なし.薬剤暴露歴なし.ペットに犬を飼育.
現病歴:2019年9月某日より頭痛と発熱が出現した(発症第1日目).発症第3日目に近医を受診した際に施行された頭部MRI拡散強調画像で橋右側,右基底核に高信号,血液検査で好酸球増加をみとめ,同日に精査加療目的に当院へ入院となった.
入院時現症:身長174 cm.体重91.7 kg.血圧153/97 mmHg.脈拍96/分・整.体温37.1°C.四肢の掻痒感の訴えはあったが体表に皮疹や粘膜疹はなく,リンパ節腫大もなし.その他の一般身体所見に異常をみとめなかった.神経学的には意識清明で,頭痛をみとめたが項部硬直やJolt accentuation of headache,Kernig徴候,Brudzinski徴候は陰性であった.その他の脳神経,運動系,感覚系,協調運動,自律神経系は正常所見であった.来院時のNational Institutes of Health Stroke Scale(NIHSS)は0であった.
検査所見:血液検査では,白血球は13,100/μl,好酸球3,734/μl(28.5%:正常0~5.6%)と好酸球増多をみとめた.血小板は8.0 × 104/μlと低下していた.CRP 6.11 mg/dlと上昇をみとめたが,その他の一般生化学検査には異常がなかった.凝固系ではD-dimer 12.28 μg/ml(正常0~1.00 μg/ml),plasmin-α2 plasmin inhibitor complex 1.54 μg/ml(正常0~0.80 μg/ml),thrombin antithrombin III complex 12.5 μg/ml(正常 <0.3 ng/ml)と上昇を認めた.プロテインS,プロテインCには異常はなかった.可溶性インターロイキン2レセプターは3,294 U/ml(正常121~613 U/ml)と上昇しており,IgE 502 IU/ml(正常0~100 IU/ml)と上昇をみとめた.甲状腺機能,副腎機能には異常をみとめず,ACEには上昇をみとめなかった.抗核抗体,PR3-ANCA,MPO-ANCA,リウマチ因子,SS-A・SS-B抗体,ループスアンチコアグラント,抗CL-β2GPI抗体,クリオグロブリンは正常範囲内であった.HBV,HCV,HTLV-1,HIV,EBV,CMV,梅毒,結核,カンジダ,クリプトコッカス,アスペルギルスなど,感染に対する抗体や抗原は陰性であり,β-Dグルカンも陰性であった.寄生虫血清免疫学的検査を施行したが,イヌ糸状虫,イヌ回虫,ブタ回虫,アニサキス,顎口虫,糞線虫,ウエステルマン肺吸虫,宮崎肺吸虫,肝蛭,肝吸虫,マンソン弧虫,有鉤囊虫に対する抗体は全て陰性であった.骨髄生検では好酸球系が34%であったが,腫瘍性病変はなく染色体・遺伝子異常もみとめなかった.頭部MRI拡散強調画像(発症第3日目)では前医で指摘されていた橋右側,右基底核に急性期脳梗塞をみとめたほか,fluid-attenuated inversion-recovery画像では右視床に陳旧性梗塞巣をみとめた(Fig. 1A, B).MRAでは明らかな閉塞血管はみとめなかった(Fig. 1C).明らかな造影効果はなかった.胸腹部造影CTでは右肺動脈,左総腸骨静脈内,門脈内に血栓をみとめた(Fig. 2).経胸壁心エコーでは左室壁の運動障害や壁在血栓は見られず,経食道心エコーにおいても心腔内血栓や右左シャントはみとめなかった.上部消化管内視鏡では胃体部中心に斑状の発赤とびらんをみとめ,発赤した胃粘膜生検では粘膜固有層に好酸球の浸潤をみとめた(Fig. 3).
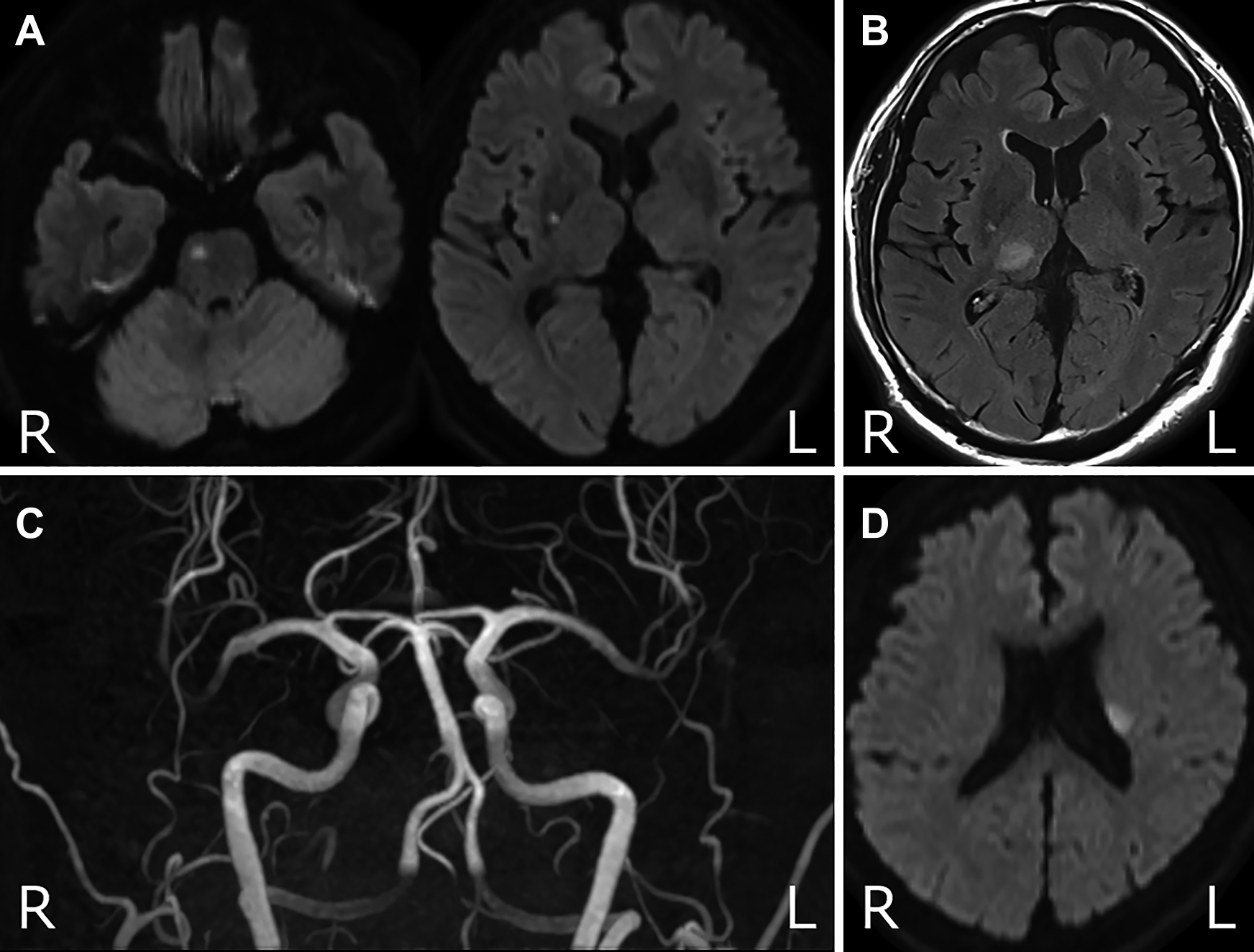
Initial MRI and MR angiography obtained on admission (Day 1). A) Diffusion-weighted imaging (3 T; TR 7,930 msec; TE 57.0 msec) shows small infarctions in the right basal ganglia and right side of the pons. B) Fluid-attenuated inversion-recovery imaging shows an old infarction in the right thalamus. C) MR angiography reveals no stenosis or obstructed lesions. D) Diffusion-weighted imaging (3 T; TR 5,000 msec; TE 56 msec) on Day 15 reveals small infarctions in the left corona radiata.
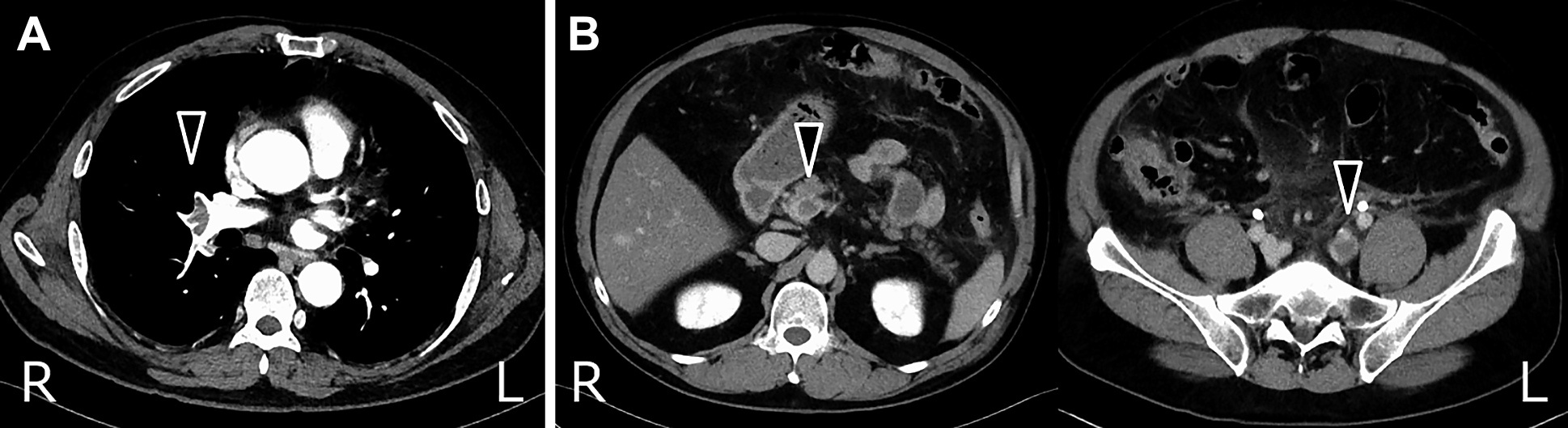
Enhanced CT scan images show an embolism of right pulmonary artery in arterial phase (A), and thrombosis of the portal vein, left common iliac vein and left internal vein in equilibrium phase (B).
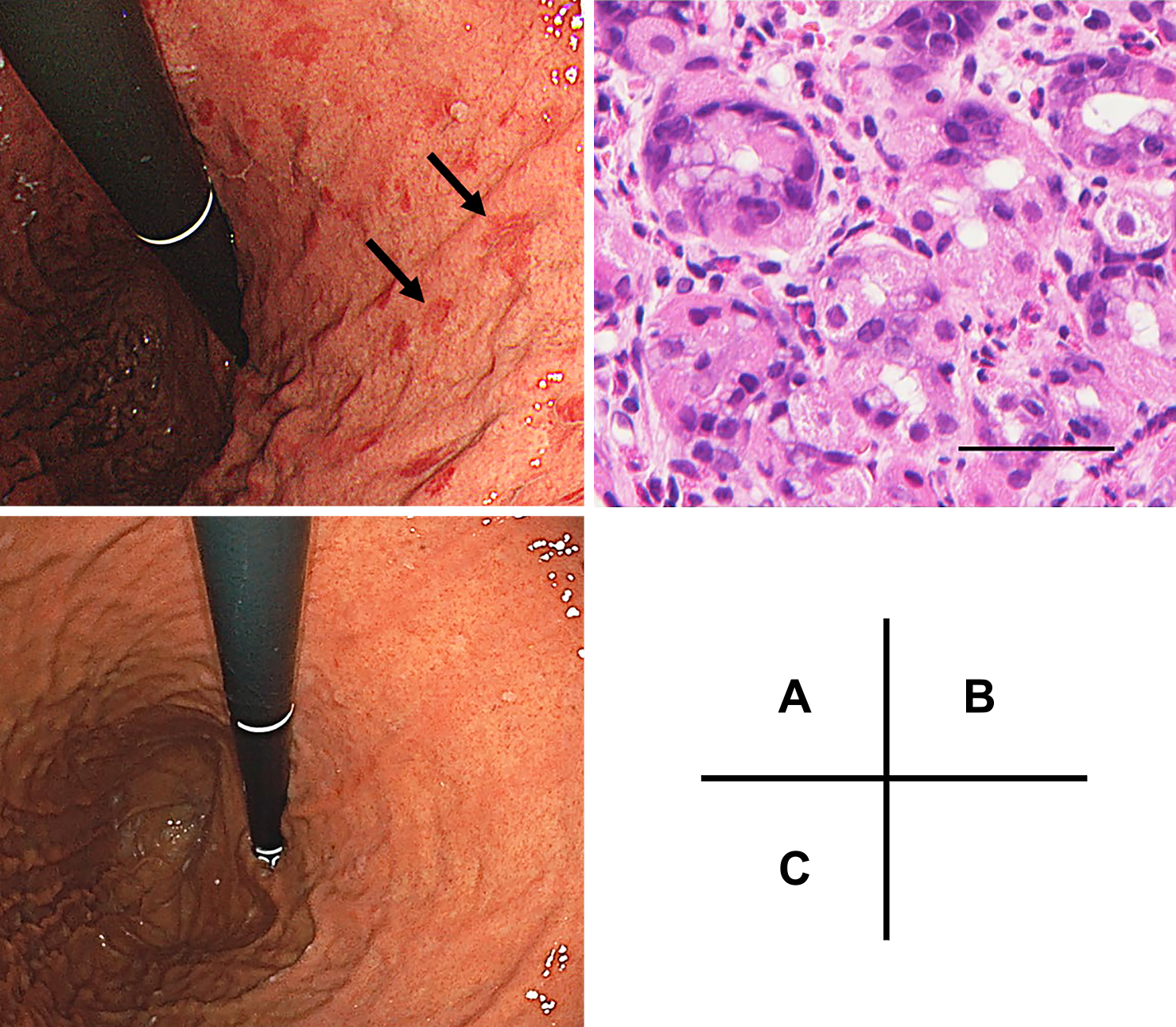
A) Patchy erosions are evident on the initial gastroscopy performed on Day 10 (arrows). B) A specimen obtained from the area of erosion shows eosinophilic infiltration (≥20 eosinophils per high-power field; hematoxylin and eosin staining, bar = 50 μm). C) No erosions are seen on follow-up gastroscopy performed on Day 167.
臨床経過(Fig. 4):脳梗塞に対して入院後からヘパリンとアスピリン200 mg/日を開始した.発症第7日目に好酸球6,270/μlに増加し,D-dimerも77.37 μg/mlに上昇した.同日に胸腹部造影CTで多発静脈血栓があったことから凝固亢進が考えられ,ヘパリン,アスピリンの併用からアピキサバン20 mg/日に変更した.発症第10日目に好酸球8,856/μlとさらに上昇した.各種感染症が否定的であったためHEにともなう凝固異常症,脳血管障害の可能性を想定し同日から経口プレドニゾロン45 mg/日(0.5 mg/kg/日)を開始し,漸減した.発症第16日目には好酸球4,336/μl,D-dimer 7.66 μg/mlまで改善した.発症第19日目に右上下肢の軽度の麻痺が出現し(NIHSS 1),同日撮像された頭部MRI 拡散強調画像では左被殻の新規脳梗塞をみとめた(Fig. 1D).プレドニゾロン,アピキサバン併用下で穿通枝梗塞が再発したことから血管内皮障害も想定されアスピリン200 mg/日を内服開始とした.その後プレドニゾロン,アピキサバン,アスピリンの併用で症状の増悪なく経過したが好酸球,IgEの上昇は持続していた.四肢の掻痒感の訴えもあったことからアレルギー性皮膚炎の関与も考え,発症第34日目に抗アレルギー薬であるトシル酸スプラタスト300 mg/日を内服開始したところ,好酸球数,IgEは徐々に減少し正常化した.プレドニゾロンは30 mg/日まで漸減し,発症第46日目に退院した.退院後にプレドニゾロン5 mg/日まで漸減を行ったが好酸球,IgEともに上昇なく経過し,肺動脈内の血栓の消失と胃粘膜病変の消失を確認した(Fig. 3).以上の各所見,経過,治療反応性,及び後述する診断基準に基づき本症例はidiopathic HESによる穿通枝脳梗塞と診断した.
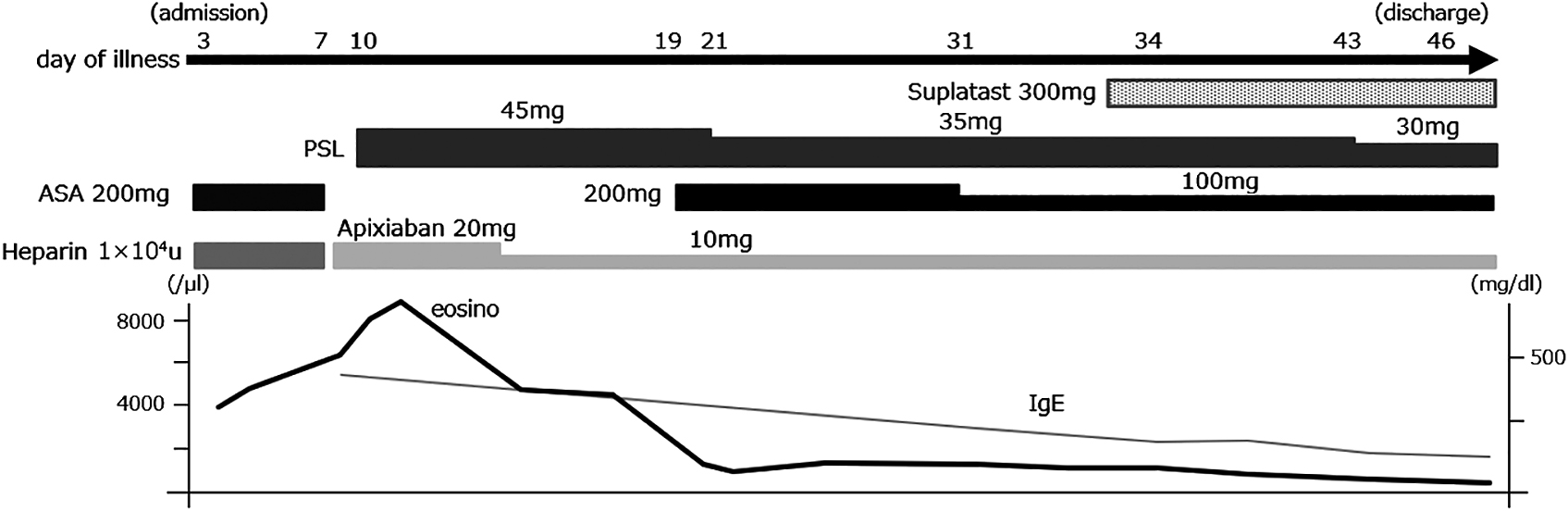
Abbreviations: PSL, prednisolone; ASA, acetylsalicylic acid. After admission, number of eosinophils gradually increased. From day 10, oral prednisolone was started at 45 mg daily and gradually decreased. The number of eosinophils and serum IgE rapidly decreased after treatment with steroids.
HESは1975年にChusidらにより①6か月以上好酸球増加1,500/μlが続く,②寄生虫感染やアレルギー,悪性腫瘍などの好酸球増加を来す他の原因が除外できる,③臓器障害がみられる,の三項目を満たすものと定義された2).HESでは皮膚障害,肺障害,消化管障害,心機能障害,神経障害など多岐にわたる臓器障害を引き起こす3).実臨床ではその臓器障害の治療のためプレドニゾロン投与などを発症6か月未満の段階で必要とすることが多く,「6か月以上の好酸球増加」という基準は実用的ではなかった.そういった状況をふまえ,2012年に新たな定義が提唱され4).その基準では,少なくとも1か月以上の期間をかけて好酸球数が1,500/μlをこえている,あるいは組織での好酸球増加をみとめるものについてHEと定義された.組織での好酸球増加とは骨髄での好酸球が有核細胞中20%を上回る,病理学的に広範囲な好酸球浸潤がある,または好酸球による組織浸潤の有無にかかわらず好酸球顆粒蛋白の著明な沈着があることのうち1項目を満たすこととされている.またこの新定義ではHEの基準を満たしたもののうち,好酸球の組織浸潤による臓器障害や機能不全があり,その臓器障害が他の疾患や病態で説明できないものをHESとしている.HESはさらに骨髄増殖性疾患やクローン性の異常リンパ球による好酸球増加を来すPrimary (neoplastic) HES,好酸球が他疾患により反応性に増加するSecondary (reactive) HES,原因が不明なidiopathic HESに分類される.好酸球増加を合併する血液腫瘍性疾患には急性骨髄性白血病などを含め様々なものがあるが5),本症例では染色体異常や遺伝子異常を含めて血液腫瘍性疾患の可能性は除外された.またアレルギーや薬剤,感染症,悪性腫瘍,自己免疫疾患などの反応性に好酸球が増加する疾患6)についても,基礎疾患や寄生虫感染を疑う所見もみとめなかった.さらに骨髄での好酸球増加や胃粘膜への好酸球浸潤にもみとめていることから,本症例は最新診断基準上のidiopathic HESと診断することができた.
HESによる神経障害には脳梗塞,脳症,末梢神経障害,てんかんなどが報告されている7).その背景には炎症部位に浸潤した好酸球の細胞内顆粒中のmajor basic protein(MBP)やeosinophil peroxidase(EPO)などの塩基性蛋白の放出が関与していると考えられている.脳梗塞発症の機序については完全に解明されてはいない.その原因の一つとして凝固亢進があげられる.凝固亢進については好酸球からの組織因子による凝固カスケードの開始8),MBPによる血管内皮トロンボモジュリンの阻害9),およびMBPとEPOによる血小板機能の亢進の関与が考えられている10).またHESに起因した心筋障害(Löffler心内膜心筋炎)による左室壁在血栓からの塞栓症の関与11)を示唆する報告もあり,心原性脳塞栓症を発症することも知られている1)11)~12).特にHESに特徴的な両側の分水嶺領域に散在・多発する微小梗塞1)13)~14)を来す機序としては,分水嶺領域における解剖学的な要因による還流圧低下に加え,好酸球増多により粘稠度があがり微小塞栓のクリアランス低下の要因が考えられている13).好酸球浸潤による直接的あるいは細胞内顆粒蛋白を介した内皮障害における血栓形成の関与も考えられている15)16).このようにHESでは多様な原因による脳梗塞が発症すると考えられるが,穿通枝領域にのみに発症した脳梗塞の報告は非常に少なく,これまでに2例の報告にとどまる(Table 1)16)17).いずれの症例も脳梗塞を起こしうる好酸球数の上昇以外の明らかな原因はなく,脳梗塞のために早期にプレドニゾロン内服を開始され好酸球数の減少,再発の抑制効果をえられている.本症例では既往に高血圧があることから,細動脈硬化によるラクナ梗塞が鑑別に上がる.しかし再発性の穿通枝梗塞が,治療に伴う好酸球数減少により鎮静化された経過,同時に胃粘膜所見も改善していた点からはidiopathic HESによる脳梗塞が示唆された.
| Reference | Age/Sex | MRI lesion (1st infarction) |
MRI lesion (2nd infarction) |
Eosinophilis (/μl) |
Interval to recurence |
|---|---|---|---|---|---|
| Chang WL, et al. 200816) | 43/M | left thalamus and centrum semiovale |
right midbrain right occipital cortex right thalamus bilateral subcortical white matter |
1,134 | 3 weeks |
| Noureen N, et al. 200817) | 6/F | left internal capsule left basal ganglia |
none | 27,468 | none |
| Current case | 61/M | right basal ganglia left side of the pons |
left corona radiata | 8,856 | 17 days |
塞栓性機序による梗塞も否定できない.しかしながら,本症例で使用したトシル酸スプラタストはTh2細胞からのIL-5を含んだサイトカインの放出を抑える効果があり,プレドニゾロンの追加や本剤投与後に脳梗塞再発がない経過からは,細動脈閉塞の機序に炎症が関与していた可能性が示唆された.過去にはシクロスポリン,トシル酸スプラタスト,プレドニゾロンの併用がHESの治療に効果的であった報告もある18).IL-5は好酸球の増殖・分化・活性化に関与しており,本症例でも病態の形成に寄与したと考えられた.近年idiopathic HESに対しては抗IL-5モノクローナル抗体であるメポリズマブの有効性も示唆されている7).本症例ではアレルギー性皮膚炎を考える症状があったためトシル酸スプラタストの使用を行ったが,本邦ではidiopathic HESに対してのトシル酸スプラタストやメポリズマブは保険適応外使用でありその投与は慎重に判断が必要である.本症例では前者の効果が示唆されたが,idiopathic HES自体への効果,および本例で示されたような脳梗塞の再発予防効果については知見の蓄積が必要である.
穿通枝梗塞の治療においては通常抗血小板薬の使用が想定されるが,血液疾患に関連する細動脈障害は,炎症性に惹起されて立て続けに引き起こされる例がある19).本症例のように好酸球増加を伴い脳梗塞が再発するような状況では抗凝固薬や抗血小板薬の使用に加えて,プレドニゾロンの内服や好酸球の機能抑制を狙った治療が必要となる.
idiopathic HESによる再発性穿通枝脳梗塞の1例を報告した.穿通枝梗塞であっても本症候群の可能性やその病態にIgEの上昇などの免疫学的な機序が考えられた場合には,好酸球の機能抑制を想定し,プレドニゾロン併用などを踏まえた適切な再発予防が必要であることが示唆された.
本報告の要旨は,第228回日本神経学会九州地方会で発表し,会長推薦演題に選ばれた.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.