2023 Volume 63 Issue 10 Pages 665-671
2023 Volume 63 Issue 10 Pages 665-671
症例は35歳,男性.34歳頃より車の事故を繰り返すようになり,部屋の片付けが困難,言語障害・歩行障害が出現した.初診時は小声,つぎ足歩行拙劣だったが会話,独歩可能でMini-Mental State Examination(MMSE)23点と軽度認知障害を認めた.3ヶ月後に神経学的所見では発語不能,右優位に反復拮抗運動,指タップ拙劣,指鼻試験・踵膝試験拙劣,起立・歩行不能と亜急性に進行した.頭部MRIで小脳萎縮を認めた.Seizure-related 6 homolog like 2(Sez6l2)抗体が陽性でありSez6l2抗体関連自己免疫性小脳失調症と診断した.免疫療法にて症状の進行は停止し若干の改善を認めた.亜急性に進行する原因不明の小脳失調症ではSez6l2抗体測定と免疫療法が必要と考えられた.
A 35-year-old male patient had been repeatedly involved in car accidents since the age of 34 years, had difficulty in tidying his room, and developed speech and gait disorders. At the first examination, he had a hypophonia and poor gait, but he could talk and walk by himself. His Mini-Mental State Examination (MMSE) score was 23 and mild cognitive impairment was observed. Three months later, neurological findings showed subacute progression to loss of speech, and poor right dominant diadochokinesia and finger tapping, poor finger-nose test and heel-knee test, and loss of ability to stand and walk. Cerebellar atrophy was observed on head MRI, and the patient was positive for Seizure-related 6 homolog like 2 (Sez6l2) antibody, leading to a diagnosis of Sez6l2 antibody-associated autoimmune cerebellar ataxia. Immunotherapy halted the progression of symptoms, and the patient showed slight improvement. Sez6l2 antibody measurement and immunotherapy were considered necessary for subacute progressive cerebellar ataxia of unknown cause.
小脳失調症の原因は多岐に渡り,多系統萎縮症・皮質性小脳萎縮症などの変性疾患,遺伝性運動失調,橋本脳症・傍腫瘍症候群・glutamic acid decarboxylase antibodies(GAD)抗体陽性小脳失調症などの自己免疫性小脳失調症,その他ビタミン欠乏症,アルコール障害による二次性小脳失調症などが考えられる.その中で注目されるのは治療可能な自己免疫性小脳失調症である.最近,亜急性に進行する原因不明な小脳失調症の中に既存の抗神経抗体が陰性であるが,seizure-related 6 homolog like 2(Sez6l2)抗体が陽性の症例が報告されている1)~8).Sez6l2抗体はYaguchiらが2014年に原因不明の小脳失調症の患者より初めて同定した自己抗体である1).Sez6l2は細胞表面に存在し9)10),動物実験では脳,特に海馬と小脳皮質に高度発現し,Sez6l2とそのファミリータンパク質のトリプルノックアウトマウスは運動失調症を呈する9)とされている.Yaguchiらは2018年にSez6l2抗体がSez6l2とグルタミン酸受容体1(Glutamate Receptor,以下GluR1と略記)の結合を阻害することにより病原性を呈すると分子生物学的に証明11)12)した.今回我々は34歳の若年男性で亜急性に進行する小脳失調症を主徴に,軽度認知障害(mild cognitive impairment: MCI)やパーキンソンニズム,不随意運動を伴ったSez6l2抗体陽性の症例を経験した.免疫療法にて症状の進行は停止,軽度改善を認めたので報告する.
症例:35歳,男性,右利き
主訴:しゃべりにくい,歩きにくい
既往歴:特記事項なし.
家族歴:特記事項なし.
教育歴:高校卒,大学中退.
現病歴:元来健康で大学中退後,コンビニで店長として働いていた.34歳5ヶ月頃より度々車のミラーを壁にぶつけるなど車の事故を起こした.その3ヶ月後に電気代の滞納・部屋の片付けが困難になり,4ヶ月後には商品の注文が不能になるなど仕事に支障をきたした.5ヶ月後に言語障害,書字困難,歩行時ふらつきが出現,6ヶ月後に自転車走行中に転倒し頭部・顔面打撲で当科初診した.初診時の神経学的所見では小声と,つぎ足歩行軽度拙劣を認めたが,聞き取りは問題なく会話も成立し,歩行も自力で可能であった.改訂長谷川式簡易知能評価スケール(Hasegawa dementia rating scale-revised,以下HDS-Rと略記)25/30点,Mini-Mental State Examination(MMSE)23/30点,日本語版Montreal Cognitive Assessment(MoCA-J)20/30点と軽度認知機能低下を認めた.若年性MCI疑いにて経過観察していたが,その後外来を受診するたびに言語障害,歩行障害が急激に進行したため発症8ヶ月後に入院となった.
入院時所見:身長169.3 cm,体重61.8 kg,体温36.6°C,脈74/min,臥位で血圧104/56 mmHg.
神経学的所見:意識清明,脳神経では眼振は明らかでなく,衝動性眼球運動,小声,構音障害を認めた.頸部の軽度筋固縮,協調系では右優位に反復拮抗運動,指タップ拙劣,両側指鼻試験,指追い試験拙劣であった.両側膝踵試験,膝叩き試験,膝屈曲試験拙劣であった.体幹失調が高度であり自力での起立・歩行は不能であった.血圧は臥位で104/56 mmHg,立位1分後で124/62 mmHgと起立性低血圧は認めなかった.頻尿,便秘など自律神経障害は認めなかった.
検査所見:血算正常,生化学では耐糖能機能,甲状腺機能,ビタミンB1は正常であった.ビタミン12が155 pg/ml,葉酸3.8 ng/mlと軽度低下を認めた.血清TPHA,HIVは陰性,血清抗核抗体,DNA抗体,ds-DNA抗体,Sm抗体,SS-A,SS-B,MPO-ANCA,PR3-ANCA,ARS抗体陰性,血清TPO抗体,サイログロブリン抗体も陰性であった.
脳脊髄液検査では細胞数5/μl,蛋白26.6 mg/mlと正常,IgG index 0.51,オリゴクローナルバンド(Oligoclonal bands,以下OCBと略記)は陰性であった.脳脊髄液細胞診で悪性所見は認めなかった.
脳波では9~10 Hzのα波を認めた.てんかん性放電は認めなかった.
神経心理学的評価では初診時HDS-R 25/30点(見当識−2点,逆唱−2点,視覚記憶−1点),MMSE 23/30点(見当識−1点,計算−3点,遅延再生−1点,視覚記憶−2点),MoCA-J 20/30点(視空間/実行系−4点,注意−1点,語想起−1点,抽象概念−2点,遅延再生−1点,見当識−1点)と軽度認知機能低下を認めた.Frontal Assessment Battery(FAB)score 14/18点(30歳代平均17.0 ± 0.8),その内訳は類似性−1点,語の流暢性−1点,葛藤指示−1点,抑制コントロール−1点であった.Trail Making Test(TMT)-A,Bは上肢失調が強く検査できなかった.また病識欠如,無関心や些細なことに怒るなど社会的認知障害も認めた.入院時HDS-Rは19/30点とさらに低下した.
頭部単純MRIでは小脳半球の萎縮が軽度見られた(Fig. 1).頸部MRIでは頸髄の萎縮は認めなかった.ドパミントランスポーターシンチ,MIBG心筋シンチは正常であった.脳血流シンチでは両側小脳での血流低下を認めた.全身造影CTで悪性腫瘍は認めなかった.

A, B: T2 weighted image (Axial, 3.0 T; TR 5, 000 ms, TE 87 ms). C, D: Fluid-attenuated inversion recovery (FLAIR) image (Axial, 3.0 T; TR 2, 410 ms, TE 33 ms). MRI findings showing atrophy of the cerebellum. E: Decreased cerebral blood flow in the bilateral cerebellum.
臨床経過:小脳失調症の原因として変性疾患や遺伝性運動失調,橋本脳症・傍腫瘍性神経症候群を含む自己免疫性小脳失調症などを考え検索を行った.頭部MRIでhot cross bun signや中小脳脚サイン,橋萎縮は認めず,自律神経障害も認めなかったことより多系統萎縮症(MSA-C)は否定的であった.遺伝子解析検査を行ったがSCA1,SCA2,SCA3(MJD),SCA6,SCA8,SCA17,DRPLAすべて正常であり,遺伝性運動失調症は否定的であった.血清TPO抗体,サイログロブリン抗体は陰性であり,抗NAE抗体は測定しておらず橋本脳症は否定しきれてない.傍腫瘍性神経症候群関連抗体であるAMPH,CV2,PNMA2,Ri,Yo,Hu,recoverin,SOX1,titin,zic4,GAD65,Tr(DNER)もすべて陰性であった.入院後も症状は進行し,入院1ヶ月後(発症9ヶ月後)のピーク時には発語不能になり,食事,トイレなどはすべて介助で日中はほぼ寝たきり状態になった.Scale for the assessment and rating of ataxia(SARA)スコアは初診時5点から入院時17.5点,ピーク時は29点と増悪,modifed Rankin Scale(mRS)も初診時1から入院時4,ピーク時は5と悪化した.また,頭部MRIなど検査施行時に安静が保てず,経過中に左下肢優位に,たえずゆっくりとくねるような持続的な不随意運動がみられた.症状が亜急性に進行していることから自己免疫疾患の可能性を疑い抗神経抗体を測定した.血清グリアジン抗体,血清mGLuR1抗体は陰性であったが,血清Sez6l2抗体が陽性で(Fig. 2),Sez6l2抗体関連自己免疫性小脳失調症と診断した.治療として入院1ヶ月(発症9ヶ月後)にステロイドパルス療法(intravenous methylprednisolone,以下IVMPと略記,1 g/day,3 days)を施行,その後プレドニゾロン(prednisolone,以下PSLと略記)5 mg/day経口投与を継続した.血清Sez6l2抗体が陽性と判明後は,治療として血漿浄化療法(plasma pheresis,以下PPと略記)を8回,免疫グロブリン大量療法(intravenous immunoglobulin,以下IVIGと略記,0.4 g/kg/day,5 days)を,IVMPを3日間施行した.タクロリムス(tacrolimus,以下TACと略記)3 mg/day内服も追加した.その後6ヶ月間,上記の免疫療法を繰り返し行った(Fig. 3).免疫療法にて症状の進行は停止し,主な症状である構音障害,歩行障害はピーク時の発語不能・歩行不能から単語・短文レベルでの発語可能,室内伝い歩き,歩行器での歩行も可能になった.SARAスコアはピーク時の29点から18~20点と改善,その後は増悪なく経過した.mRSもピーク時5から4と改善,認知機能障害もHDS-R19点から30点と改善した(Fig. 3).随伴症状としてのパーキンソンニズム,下肢の不随意運動はほぼ消失した.初診後1年経過した現在は入浴,洗顔は軽度介助が必要であるが,食事は自立,トイレ動作は自力で可能な状態になり自宅で暮らしている.

FLAG-tagged Sez6l2 protein was transiently overexpressed in HEK293T cells, and FLAG antibody (Red) and patient serum (Green) were used as primary antibodies to examine whether patient serum recognizes Sez6l2 protein. Sez6l2 protein-expressing cells were recognized and co-localized by FLAG antibody and patient serum (arrow), while cells not expressing Sez6l2 protein were not recognized by either FLAG antibody or patient serum (arrowhead). The serum was diluted 200x. Scale bar = 20 μm.
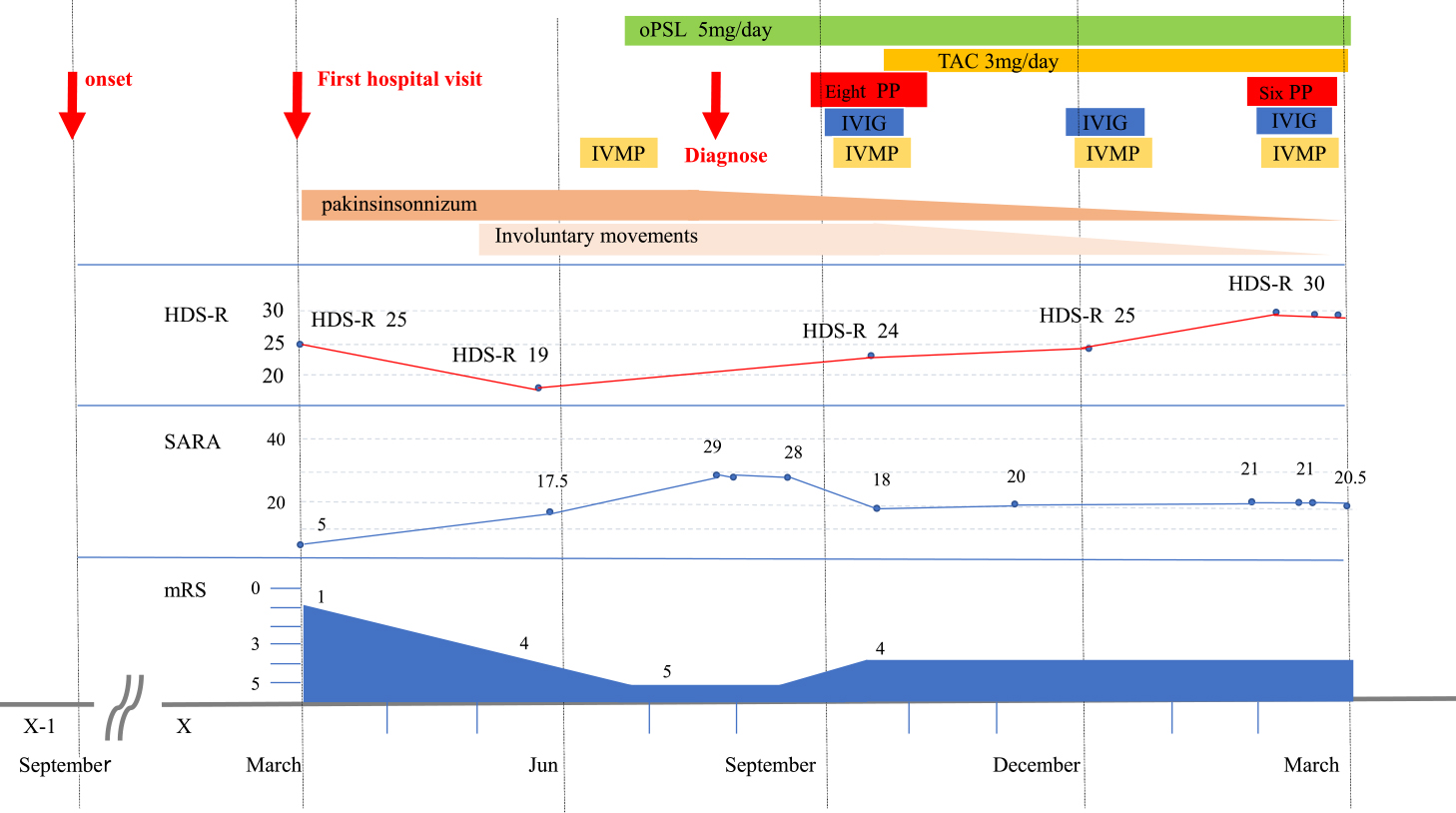
Three months after the initial visit, the patient’s symptoms rapidly worsened, and at the peak, the patient was almost bedridden during the day with a Hasegawa dementia rating scale-revised (HDS-R) score of 19, scale for the assessment and rating of ataxia (SARA) score of 29, and modifed rankin scale (mRS) of 5. After immunotherapy, the progression of symptoms stopped, and improvement was observed with SARA score of 20, mRS of 4, and HDS-R of 30. Parkinsonism and involuntary movements of the lower limbs almost disappeared.
Sez6l2抗体関連自己免疫性小脳失調症は極めて稀な疾患であり論文での報告は12例1)~8)のみである.その特徴をTable 1にまとめた1)~8).本邦では,本例を含め4例1)7)が報告されている.
Published cases of seizure-related 6 homolog like 2 (Sez6l2) antibody-associated autoimmune cerebellar ataxia.
| Author/year | Case Sex/Age |
Progression | Main symptoms | Other symptoms | CSF Finding | brain MRI | Treatment | response |
|---|---|---|---|---|---|---|---|---|
| Yaguchi H, et al1)/ 2014 |
(1)60/F | Subacute | Severe ataxia | Cognition: nomal Parkinsonism: No Other symptoms: Retinopathy |
Normal | Cerebellar atrophy after 2 year | IVMP IVIG PP TAC |
Mild improvement (Prevented recurrence for 2 year) |
| Borsche M, et al2)/ 2019 |
(2)55/F | Subacute | Gait atxia, Slurred speech |
Cognition: Psychomotor slowing Parkinsonism: Bradykinesia Other symptoms: Nausea, weight loss |
Normal OCB (−) |
Cerebellar atrophy | IVIG RTX |
mild improvement (stable for 12 months after RTX) |
| Landa J, et al3)/ 2021 |
(3)69/M | Subacute | Gait ataxia, Dysarthria |
Cognition: Bradypsychia, echolalia Parkinsonism: Bradykinesia, hypophonia Other symptoms: Frequent falls |
Pleocytosis (90/μl) OCB (−) |
Normal | IVMP IVIG RTX CTX |
No |
| (4)55/F | Subacute | Gaita ataxia, Dysarthria, |
Cognition: Mild deficits in executive function, language, memory Parkinsonism: Mild unilateral parkinsonism Other symptoms: Dizziness, nystagmus |
Normal | Cerebellar atrophy | IVMP IVIG |
No (Death after 4 year from ovarian cancer) | |
| (5)54/M | Subacute | Dysarthria and gait ataxia |
Cognition: Mild deficits in executive function, language, memory Parkinsonism: Mild bradykinesia Other symptoms: Saccadic, nystagmus |
Normal | Cerebellar atrophy | IVMP PP |
No | |
| (6)69/F | Subacute | Gait ataxia and dysarthria |
Cognition: Mild memory complaints Parkinsonism: No Other symptoms: Nystagmus |
Normal | Cerebellar atrophy | Prednisone CTX |
No | |
| Mehdiyeva A, et al4)/ 2022 |
(7)73/F | Subacute | Severe truncal ataxia Dysarthria |
Cognition: Mild cognitive impairment Parkinsonism: Bradykinesia, hypophonia Other symptoms: Nausea, nystagmus |
None noted | Cerebellar atrophy | IVMP IVIG RTX CTX |
Marked improvement |
| Reis Carneiro D, et al5)/ 2022 |
(8)62/F | Subacute | Gait ataxia | Cognition: Anterograde memory loss, time and space
disorientation Parkinsonism: No Other symptoms: Small-cell lung cancer |
Hygh protein (87 mg/dl) |
Hippocampal atrophy | IVMP IVIG Cancer treatment |
Death after 5 months |
| Kather A, et al6)/ 2022 |
(9)70/F | Subacute | Gait atxia, Dysarthria |
Cognition: Nomal Parkinsonism: No Other symptoms: Breast carcinoma, depression |
Normal OCB (+) |
Cerebellar atrophy | IVIG, RTX Cancer treatment |
Improvement after mastectomy |
| Abe M, et al7)/ 2023 |
(10)55/M | Subacute | Gait ataxia, Dysarthria |
Cognition: No Parkinsonism: No Other symptoms: Fever and headache |
Mildly elevated cell count and protein OCB (−) |
Normal | IVMP, oPSL, PE IVIG |
Slightly improved by IVMP and oPSL, PE, IVIG no effective |
| (11)65/M | Subacute | Gait ataxia Dysarthria |
Cognition: No Parkinsonism: No Other symptoms: Depressed mood |
Normal | Mild Cerebellar atrophy | IVMP | IVMP no effective | |
| Shen D, et al8)/ 2023 |
(12)67/F | Subacute | Dysarthria Cerebellar ataxia |
Cognition: Mild deficits in executive function, acalculia,
and memory dysfunction Parkinsonism: Facial masking, bradykinesia, and rigidity Other symptoms: Autonomic nervous dysfunction (low-grade fever, constipation, urination Retention, orthostatic hypotension), Depression |
Pleocytosis (8*106/l) OCB (−) |
Cerebellar and medial temporal lobes atrophy | IVMP IVIG |
Ccerebellar symptoms and memory gradually Mild improvement |
| This case | 35/M | Subacute | Ataxic gait, Dysarthria, |
Cognition: Mild cognitive impairment Parkinsonism: Mild bradykinesia, cervical rigidity, hypophonia Other symptoms: Mild Involuntary movements |
Normal OCB (−) |
Cerebellar atrophy | IVMP, oPSL PP, IVIG, TAC, |
Mild improvement |
Abbreviations: M = male, F = female, CSF = cerebrospinal fluid, OCB = oligoclonal bands, IVMP = IV methylprednisolone, IVIG = IV immunoglobulin, PP = plasmapheresis, TAC = tacrolimus, RTX = rituximab, CTX = cyclophosphamide, oPSL = oral prednisolone.
本症例の重要な点としては,次の3点が挙げられる.第1には,これまでに報告されていない若年発症例であったこと,第2には,海外からの報告では重要な所見とされるも本邦では報告されていないパーキンソンニズムを伴っていたこと,第3には,免疫療法が効果を呈したことである.
発症年齢においては,既報告例では平均60歳前後であり性差は認めていない.本症例は発症時34歳であり,既報告ではみられなかった若年発症の亜急性小脳失調症であった.本症例から若年発症の亜急性小脳失調症においてもSez6l2抗体を測定することが重要であることが示唆される.またSez6l2抗体関連自己免疫性小脳失調症発症の原因は未だ不明であり,その点も含め今後の症例蓄積が望まれる.
臨床症状においてはSez6l2抗体関連自己免疫性小脳失調症の既報告12例1)~8)は亜急性の経過で,主な症状は全例で構音障害と失調性歩行など小脳障害が主体である.さらに,欧米では認知機能低下やパーキンソンニズムを呈することが特徴ともされる.本症例も初診時はごく軽度の小脳失調を認めるものの会話可能,自力歩行も可能であった.初診から2~3ヶ月で亜急性に増悪しピーク時は発語不能,起立・歩行不能で寝たきりとなった.動物実験9)でSez6l2は小脳皮質に高度発現するとされており,小脳がこの病態の主な責任病巣と考えられた.全症例は小脳失調症に加え12例中6例が認知機能障害3)~5)8),6例2)~4)8)がパーキンソンニズムを軽度伴っていた.認知機能障害の6例中Landaら3)の3例の認知機能障害の内訳は記憶力低下が3例,実行機能低下が2例,言語障害が2例であった.詳細な神経心理学的評価を行われたのはMehdiyevaら4)の症例のみであった.最近報告されたShenら8)の症例も記憶障害,実行機能障害を認めた.本症例は神経心理学評価で注意障害,判断力を含めた実行機能障害,および記憶障害や言語障害を認めた.また病識欠如,無関心,些細なことに怒るなど社会的認知障害を認めた.認知機能障害の発症の機序として,一つはSez6l2の分布と関連があると考えられた.Sez6l2は細胞表面に存在し9)10),マウスの動物実験3)9)では小脳皮質のみでなく,海馬にも高度発現すると報告され,Sez6l2とそのファミリーたんぱく質であるSez6とSez6lのトリプルノックアウトマウスにおいては,運動機能低下に加え認知機能低下を示すことが報告されている13).これらの基礎実験よりSez6l2は認知機能維持に重要なたんぱく質であることが示唆されている.またSez6l2はGluR1と直接結合し12),Sez6l2抗体関連自己免疫性小脳失調症患者血清は,その直接結合を阻害することが報告されている11).さらにSez6l2抗体はIgGサブクラスとしてIgG1とIgG4を有することが複数例で確認されている3)7).このことより,Sez6l2抗体は認知機能低下に関連する可能性が高いと考えられている.認知機能障害を引き起こすもう一つの機序として小脳と前頭葉に強い連絡があることが考えられる.Middletonら14)の研究により小脳と前頭・頭頂連合野との間には視床,橋核を介した強い連絡があることが明らかにされた.小脳の障害により前頭葉,頭頂連合野を含め大脳皮質機能まで障害され,認知機能障害を引き起こす可能性が推測される.
パーキンソンニズムを伴った6例2)~4)8)中,寡動を呈したのは5例2)~4)8),小声を認めたのは2例3)4)であった.Shenら8)は最近,パーキンソニズムと起立性低血圧,便秘,排尿障害など自律神経障害を呈したSez6l2抗体関連自己免疫性小脳失調症を報告した.同症例では,亜急性の経過,髄液細胞数の増多,免疫治療への反応性からSez6l2抗体関連自己免疫性小脳失調症と診断されている.本症例のパーキンソンニズムは軽度の頸部筋固縮,寡動及び小声であった.その他,左下肢優位に,たえずゆっくりとくねるような持続的な不随意運動がみられた.パーキンソニズムの機序について既報告では言及されておらず今のところ不明である.その機序として小脳の入力系の障害が考えられる.小脳の入力系には脊髄小脳路,大脳小脳路,前庭脊髄路が存在する.そのなかで大脳小脳路は大脳橋核を介して,橋核で対側に移動し中小脳脚を通して小脳半球皮質へ情報を伝える.この大脳小脳路に主な障害があるとされているのがパーキンソニズムも呈しているMSA-Cである15).本症例も小脳障害によりその入力系の大脳小脳路にも障害が及びパーキンソンニズムを生じた可能性を推測した.不随意運動の発症機序についても,小脳の入力系の大脳小脳路の障害及び小脳-大脳-基底核のループの障害が考えられる.Middletonら14)は大脳皮質には基底核や小脳の神経細胞が投射しているとされている.脳血流シンチで基底核,大脳皮質の明らかな血流低下を認めなかったものの,小脳障害により小脳の神経細胞の投射先である大脳皮質,及び小脳-大脳-基底核のループに障害が波及し随意運動が制御できず不随意運動が生じた可能性があるかと推測した.
髄液所見では3例3)5)8)に細胞数増多を認めた.5例でOCBが検査され2)3)6)~8),1例のみ陽性であった6).頭部MRIでは2例は3)7)正常であったが,その他の9例1)~4)6)~8)では小脳萎縮を,1例5)では海馬萎縮,1例では内側側頭葉萎縮8)を認めた.本症例は髄液検査では異常を認めず,OCB陰性,頭部MRIでは小脳萎縮を軽度認めるのみであった.
Sez6l2抗体は,報告12例中5例1)2)6)7)が血清のSez6l2抗体陽性で,髄液での検討はなされていないか,もしくは髄液での検査結果が明示されていなかった.他の7例3)~5)8)では血清・脳脊髄液ともにSez6l2抗体が陽性であった.本症例は血清のSez6l2抗体が陽性であった.髄液のSez6l2抗体は測定できず,血清のSez6l2抗体のIgGサブクラスの測定は行っていない.
報告された全例12中10例1)~4)7)8)は診断時悪性腫瘍を認めなかったが,その後の経過観察で1例3)が小脳失調症の発現から4年後に腫瘍随伴性機序を示唆する悪性腫瘍(卵巣がん)が明らかとなった3).本症例は安静を保てず18F FDG-PET-CTを施行することを断念したが,胸腹部造影CTでは悪性腫瘍は認めなかった.最近,肺癌5)と乳癌6)を合併したSez6l2抗体関連自己免疫性小脳失調症の症例が2例報告された5)6).これらのことからSez6l2抗体関連自己免疫性小脳失調の症例では診断時と,その後の定期的な悪性腫瘍の有無の確認が必要であると考えられた.
治療として全症例でIVMP,IVIG,PP,rituximab(RTX),cyclophosphamide(CTX)などの免疫療法が単独あるいは組み合わせて行われた1)~8).治療反応は12例中6例が全く効果を認めず3)5)7),5例が軽度改善1)2)6)~8),1例は著明な改善4)を認めた.それぞれの免疫療法の効果に有意差は認めなかった.免疫療法を開始した時期は1例1)は不明だったが,その他の診断時悪性腫瘍を認めなかった10症例1)~4)7)8)では1ヶ月~23ヶ月と平均6.1ヶ月であった.免疫療法を開始した時期と治療反応との関連も明らかでなかった.本症例は入院1ヶ月後(発症9ヶ月)に免疫療法を開始,その後診断が確定されてから6ヶ月間にわたり,PP,IVIG,IVMPを繰り返し行った.これにより症状の進行は停止,SARAスコア,mRS,HDS-Rも軽度改善を認めた.
Sez6l2抗体関連自己免疫性小脳失調症は,報告が少なく治療法に関する知見が不充分である.Landaら3)のSez6l2抗体陽性の4例のIgGサブクラスはIgG1とIgG4であり,IgGのサブクラスによって治療法及び治療効果が異なる可能性が示唆された.免疫療法にて完全な回復には至らないものの,本症例のように症状の進行が停止,若干の改善を認めていることから免疫療法の意義は大きいと思われた.
原因不明の亜急性に進行する小脳失調症で認知機能障害やパーキンソンニズム,不随意運動などを伴っている場合,自己免疫性小脳失調症を病因の一つとして考え,Sez6l2抗体を含めた抗神経抗体の測定が必要であると同時に,免疫療法の介入が必要であると思われた.
謝辞:mGLuR1抗体を測定していただいた岐阜大学大学院医学系研究科脳神経内科学分野木村暁夫先生に深く感謝いたします.
本報告の要旨は,第237回日本神経学会九州地方会で発表し,会長推薦演題に選ばれた.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.