2023 Volume 63 Issue 10 Pages 672-675
2023 Volume 63 Issue 10 Pages 672-675
症例は57歳女性.16年前より全身性強化症と間質性肺炎に対してアザチオプリン(AZP)を内服していた.某日,右不全麻痺としびれ感が出現した.症状は短時間で消失したが,頭部MRI拡散強調画像とADCマップで右前頭葉に高信号病変を指摘され入院した.病変は,対側前頭頭頂葉と小脳に広がり,経過と画像所見からposterior reversible encephalopathy syndrome(PRES)を疑いAZPを中止したところ,病変は速やかに消失した.AZPによるPRESは,投与1か月以内に発症すると報告されているが,長期内服後にも発症しうることは,鑑別疾患を考えるうえで重要である.
A 57-year-old woman, who had been taking azathioprine (AZP) for systemic sclerosis and interstitial pneumonia over 16 years, presented with right hemiparesis and paresthesia. On admission, brain MRI diffusion-weighted imaging (DWI) demonstrated high-signal-intensity lesions in the right frontal lobe. Although the symptoms had disappeared quickly, brain MRI on the 7th day revealed that these lesions had spread to the left cerebellar hemisphere and the right fronto-parietal lobes, appearing as high signal intensity lesions on ADC map. On the basis of the MRI imaging and clinical courses, posterior reversible encephalopathy syndrome (PRES) caused by AZP was suspected, and brain MRI revealed the immediate improvement of the lesions after the AZP discontinuation. There have been a few reports of PRES caused by AZP, all of which occurred within one month after administration. It is noteworthy in considering differential diagnosis that PRES can also occur during long-term administration of AZP.
Posterior reversible encephalopathy syndrome(PRES)は,脳血流の自動調節能不全や血管内皮細胞の障害で,血液脳関門が破綻して生じる血管原性浮腫と考えられている.悪性高血圧や輸血,重症感染症,電解質異常などで見られるが,免疫抑制剤などの薬剤の関与も知られている1).シクロスポリンやタクロリムスでの報告が多いが,アザチオプリン(AZP)も4例の報告がある2)~5).今回,16年前からAZPを内服していた間質性肺炎(interstitial pneumonia,以下IPと略記)合併の全身性強皮症(systemic sclerosis,以下SScと略記)の患者がPRESを発症したと考えられた症例を経験した.内服中止のみで完治する可能性があり,鑑別上重要と考え報告する.
症例:57歳,女性
主訴:右手の動かしにくさとしびれ感
既往歴:36歳時にSScとIPを発症した.46歳時にIPが悪化し,AZP 50 mgが開始され,プレドニゾロン2 mgとともに継続投与されていた.55歳時,IPの悪化に対してニンテダニブが投与され,在宅酸素が導入された.誤嚥性肺炎などで入退院を繰り返していたが,日常生活は自立していた.
現病歴:57歳時の某日,突然,右上肢の動かしにくさとしびれ感を自覚し救急搬送された.搬送中に症状は改善したが,頭部MRIで右前頭葉病変を認め,精査目的に入院した.
入院時現症:身長156 cm,体重32 kg,BMI 13.1,体温37.4°C,血圧123/81 mmHg,脈拍103回/分・整.両下肺に捻髪音が聴取され,酸素飽和度は98%(3 l酸素吸入下)だった.顔面・四肢・体幹の皮膚硬化は著明で,左拇指に潰瘍を認めた.四肢に浮腫はなかった.神経学的には,意識清明で,軽度の頭痛があった.高次機能や脳神経系に異常はなかった.右上肢に上肢挙上試験で軽度に回内する程度の麻痺を認めたが,下肢に麻痺はなかった.四肢の腱反射は正常で,病的反射は陰性だった.右手のしびれ感は,入院時には消失していた.
検査所見:血液検査では白血球9,330/μl,CRP 1.69 mg/dlと軽度の炎症所見を認めた.KL-6 409 U/mlと高値で,胸部X線では両下肺に網状陰影を認めたが,増悪はなかった.肝機能,腎機能,電解質異常を認めなかった.抗MOG抗体は陰性であった.脳脊髄液では,細胞増多はなく,髄液蛋白は137 mg/dlと上昇していた.オリゴクロナールバンドは陰性で,IgG indexは0.48であった.
入院後経過:入院後も頭痛は持続していたが,新たな巣症状の出現はなかった.入院時(第1病日)のMRIでは,核酸強調画像(DWI)で右大脳前頭葉に高信号病変を認めたが(Fig. 1A),磁気共鳴血管造影法(MRA)で主要血管の狭窄は認めなかった.第2病日には,MRI DWI高信号の病変が対側前頭葉と左小脳半球内側にも出現した(Fig. 1B).第7病日,両側前頭葉の高信号病変は明瞭化し,左頭頂葉にも病変が出現した.同部位はADCマップで高信号であった(Fig. 1C~E).ガドリニウム造影では両側前頭葉に一部増強効果を認めた.画像所見と経過からPRESを鑑別疾患に挙げ,第14病日よりAZPを中止した.AZP中止後6日目(第20病日)のMRIでは両側前頭葉にわずかな信号変化を残し,病変はほぼ消失していた(Fig. 1F).第27病日,後遺症なく自宅退院した.
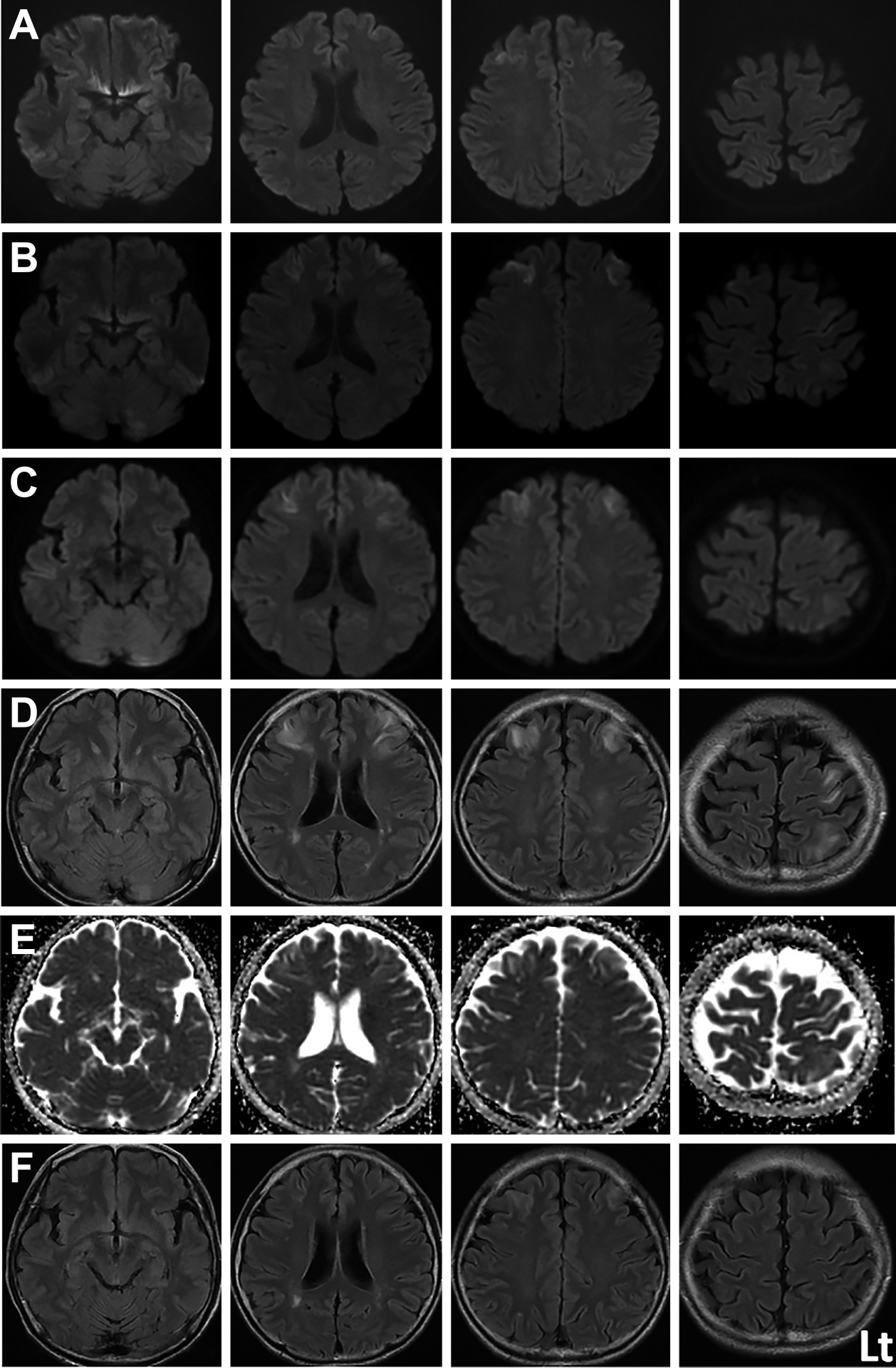
MRI diffusion-weighted imaging (DWI: 1.5 T; TR 3,500 ms, TE 96 ms) on the 1st day of the illness shows the high signal intensity lesion in the right frontal lobe (A). On the 2nd day, the high-signal-intensity lesion have spread to the left cerebellar hemisphere and the left front-parietal lobe (B). MRI DWI (C), and fluid-attenuated inversion recovery (FLAIR) imaging (1.5 T; TR 9,000 ms, TE 143 ms) (D) reveal that the high-signal-intensity lesions have become clearly, appearing as high signal intensity lesions on ADC map (1.5 T; TR 5,500 ms, TE 88 ms) (E). MRI FLAIR imaging on the 20th day reveals that the high-signal-intensity lesions have been reduced (F).
本例は,長年のSScの経過中に頭部MRIで異常所見が出現し,急速に拡大した症例である.免疫疾患が背景にあり,神経免疫疾患も鑑別に挙がったが,画像所見からは血管原性の浮腫性病変が考えられ,被疑薬と考えたAZPを中止したところ,すみやかに病変は消失した.
薬剤によるPRESは,免疫抑制剤であるシクロスポリンやタクロリムスでの報告例が多く,AZPによるPRESの既報は4例にとどまる2)~5).本例を含めて全例で後頭葉・小脳などの後方循環系が病変部位に含まれているが,前頭葉や側頭葉,頭頂葉などの前方循環系にも信号変化が出現しているのが特徴である3)4).
PRESの病変の分布は,①大脳半球の分水嶺,②上前頭溝周囲,③頭頂後頭葉,④これらの3領域の病変が部分的に混在して出現するパターン,の四つに分けられる.頭頂後頭葉病変では重度高血圧の患者が多い傾向がある.一方免疫抑制剤によるPRESでは前述の④のパターンが多く6),本例の初回のMRI所見のように,典型的な後頭葉病変がない場合にはPRESの診断に難渋する可能性がある.
PRESは,血液脳関門の機能不全による血管原性浮腫が病態と考えられている.悪性高血圧症などでは,血圧の自動調節能が未熟であるために後方循環系の障害が主体となると考えられるが7),薬剤による血管内皮の障害で生じるPRESでは前方循環系にも病変が認められることは,神経免疫系の疾患と鑑別するうえで重要である.
既報の4例の背景疾患は,全身性エリテマトーデス,潰瘍性大腸炎,混合性結合組織病で,本例はSScを背景としていた.PRES患者の約半数に自己免疫疾患の病歴があるとされており1),本例も慢性的なサイトカインの放出とそれによる血管内皮細胞の活性化が発症に寄与したかもしれない.また,SScでは血管攣縮により組織の虚血と再灌流が繰り返されることや,血管内皮前駆細胞の減少など,複数の機序による血管内皮障害が生じるとされており8),これにAZPによる血管内皮障害が加わりPRESを発症した可能性がある.
本例では,AZP開始からPRES発症までが16年間で,既報の3日から1か月に比べてはるかに長期間であった点が特異的であった.他の自己免疫疾患でもこれほど長期間の薬剤投与によるPRESの報告はない.長年の血管内皮の障害に加えて何らかの外因子が加わるとPRESの病態が引き起こされる可能性があることを示唆する貴重な症例と考えられた.
PRESは,原因を明らかにできれば侵襲なく治療できる疾患である.自己免疫疾患を背景として,頭部MRIで前方循環を含む多発病変が短期間で拡大する場合は,薬剤性のPRESも鑑別疾患として考え,長期投与や低用量に関わらず薬歴を詳細に調査することが大切である.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.