2023 Volume 63 Issue 11 Pages 748-753
2023 Volume 63 Issue 11 Pages 748-753
HIV感染症でHighly Active Antiretroviral Therapy(HAART)を行っていた58歳男性.急性に左上肢,右下肢麻痺をきたした.MRIで頸髄に異常信号があり,血清抗アクアポリン4抗体陽性で,視神経脊髄炎関連疾患(neuromyelitis optica spectrum disorder,以下NMOSDと略記)と診断した.ステロイドパルス療法,単純血漿交換の効果は限定的でrituximab投与で四肢麻痺が改善した.本邦でHIV感染症後NMOSDにrituximabを投与した報告はない.HIV感染症後NMOSDの難治例にはrituximab投与を検討すべきである.
The patient was a 58-year-old Japanese man. At age 52 years, he was diagnosed with human immunodeficiency virus (HIV) infection and had been receiving highly active antiretroviral therapy (HAART). He presented to the emergency department with acute upper left and right lower extremity paralysis. Spinal cord magnetic resonance imaging showed intramedullary signal changes over three vertebral bodies in the cervical spinal cord. Anti-aquaporin-4 antibody was positive in serum, and neuromyelitis optica spectrum disorder (NMOSD) was diagnosed. Steroid pulse therapy and plasma exchange were performed but had limited effects. In Japan, there is no report of NMOSD after HIV infection treated with rituximab. Rituximab administration should be considered in refractory cases of NMOSD after HIV infection.
視神経脊髄炎関連疾患(neuromyelitis optica spectrum disorder,以下NMOSDと略記)は視神経炎と脊髄炎を主徴とする炎症性中枢神経疾患である1).NMOSDは15~25%の症例に先行感染を認める2)3).HIV感染症後にHighly Active Antiretroviral Therapy(HAART)が施行され,経過でNMOSDを発症し,rituximab投与で四肢麻痺が改善した1例を報告する.
症例:58歳,男性
主訴:左上肢,右下肢不全麻痺,四肢感覚障害
既往歴:同性愛者で48歳時に梅毒,52歳時にHIV感染症が判明し,HAART(ラルテグラビルカリウム1,200 mg/日,エムトリシタビン200 mg/日,テノホビルアラフェナミドフマル酸塩28 mg/日)が行われた.その他に50歳,52歳時に帯状疱疹,53歳時に細菌性赤痢,54歳時に急性A型肝炎の既往あり.
現病歴:発症2週間前に左上肢尺側に皮疹が出現した.近医皮膚科を受診し帯状疱疹が疑われアメナメビル400 mg/日が内服開始された.症状が改善しないため発症1週間前に当院皮膚科を受診し,メチコバール1,500 μg/日が追加処方された.経過で両上肢の異常感覚が出現し増悪した.起床時に右下肢全体の感覚障害,麻痺が出現したため当院受診し,精査加療目的に入院した.
入院時身体所見:身長171 cm,体重67 kg,体温36.0°C,血圧114/82 mmHg,脈拍65回/分・整,SpO2 98%(室内気),心音・呼吸音に異常はなく,腹部に圧痛はなかった.左上肢尺側に痂疲化した皮疹あり.神経学的には意識清明で,脳神経では異常は認めなかった.Barré徴候,Mingazzini徴候は左で陽性,徒手筋力試験で両側上肢遠位筋左優位に4程度の筋力低下があり,左下肢に4程度の筋力低下を認めた.協調運動は正常であった.四肢腱反射は亢進しており,Babinski反射,Chaddock反射は両側陰性であった.右手指DIP関節以遠や左上肢尺側,右臍上部以下,左膝下以遠外側に温痛覚低下を認めた(Fig. 1).振動覚は下肢内果で右0秒,左9秒と低下を認めた.歩行は痙性のため,右下肢を引きずりながら自力で可能で,膀胱直腸障害は認めなかった.

At day 1, the patient had thermal hypoalgesia in the area shown in the figure.
検査所見:血液検査では白血球5,600/μl,Hb 12.7/μl,血小板25.5×104/μl,直近のCD4陽性細胞数は418/μlであった.生化学検査では肝胆道系酵素,電解質,腎機能,甲状腺機能は正常で,ビタミンB12,葉酸欠乏は認めなかった.抗核抗体は40倍未満で,抗SS-A抗体404.1 U/mlと陽性であり,抗SS-B抗体,MPO-ANCA,PR3-ANCAは陰性であった.アンジオテンシンI変換酵素(ACE)の上昇は認めなかった.血清抗アクアポリン4(AQP4)抗体は陽性であった(ELISA法40.0 U/ml以上,CBA法陽性).感染症はATL(PA法)陰性,血清RPR陰性,血清TP抗体陽性で,梅毒は既感染パターンであった.血清HIV-1 RNA定量は検出感度以下であった.サイトメガロウイルス抗原C7-HRPは陰性であった.髄液は無色透明で,初圧9 cmH2O,終圧6 cmH2O,細胞数36/μl(単核球35/μl,多形核球1/μl),蛋白55 mg/dl,糖52 mg/dl(同時血糖90 mg/dl),IgG Index 0.51,オリゴクローナルバンドは認めなかった.髄液HIV-RNA,髄液HSV-1DNA,髄液VZV-DNA,髄液EBV-DNA,髄液FTA-ABSは陰性であった.髄液クリプトコッカス抗原,髄液細菌培養,抗酸菌培養は陰性であった.髄液細胞診で異型細胞は認めなかった.頸椎MRIでは,T2強調画像で長大な髄内信号変化を認めた(Fig. 2A).頭部MRIで異常はなかった.眼科受診で視神経炎を示唆する所見は認めなかった.抗SS-A抗体が陽性であったが,ガム試験陰性,口唇腺生検で陽性所見は無く,シルマー試験は涙液分泌量低下がみられたが蛍光色素試験は陰性で,シェーグレン症候群の診断基準は満たさなかった4).
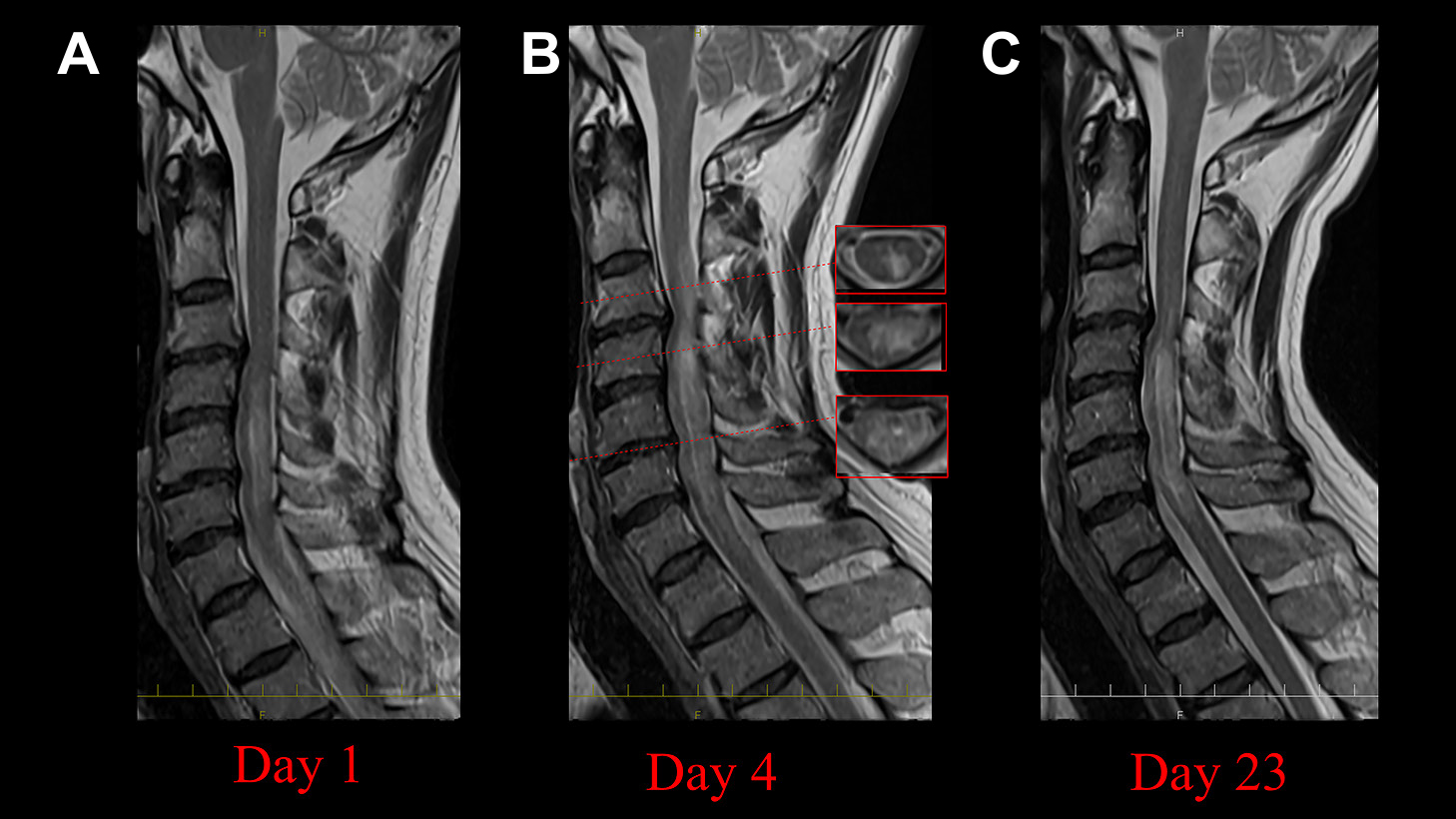
(A) At day 1, T2-weighted image (sagittal) shows a high-intensity lesion extending longitudinally in the cervical cord. (B) At day 4, expanded cervical spinal cord lesion is observed on T2-weighted images. (C) At day 23 posttreatment, reduced cervical spinal cord lesion is observed on T2-weighted images.
経過:当初,帯状疱疹性脊髄炎を疑いアシクロビル1,875 mg/日を開始した.しかし,麻痺や感覚障害の範囲は増大し,第4病日の頸椎MRIで病変の増大があり,軸位断で脊髄中心部に病変を認め(Fig. 2B),NMOSDが疑われ,ステロイドパルス療法(メチルプレドニゾロン1,000 mg/日×3日)を開始した.翌日から左上肢麻痺が出現し,単純血漿交換も追加した.その後,左上肢麻痺と右下肢感覚障害は軽度改善した.第8病日で髄液HSV-1DNAとVZV-DNAの陰性が判明し,アシクロビル投与は中止した.第10病日に血清抗AQP4抗体陽性が判明し,NMOSDと診断した.第12病日に左下肢麻痺が出現し,増悪した.単純血漿交換を4回施行したが,両下肢は完全麻痺となり,症状が進行したため,第15病日からrituximab(375 mg/m2,1週間隔で4回)を追加した.第20病日から介助にて両側膝立て保持が可能となり,第23病日の頸椎MRIで病変の縮小を認めた(Fig. 2C).第33病日に膝立て保持が可能となった.第38病日に介助で立位可能となった.第53病日に左上肢と右下肢に間欠的に30秒程度の疼痛,異常感覚が出現した.有痛性強直性筋痙攣と考え,クロナゼパム1 mg/日を内服し,経過で消失した.第91病日に歩行器歩行が可能となり,第107病日に見守りで歩行可能となった.経過で抗AQP4抗体価は低下し,髄液細胞数は減少した(Table 1).第59病日に発熱があり,精査でサイトメガロウイルス肺炎を認め,ガンシクロビル300 mg/日投与にて第82病日に改善した.最終的に治療として,ステロイドパルス6回,単純血漿交換7回,rituximab 4回を投与した.治療に伴いIgG低値がみられ,免疫グロブリンを補充した.プレドニゾロン20 mg/日とアザチオプリン50 mg/日の内服を継続し,第110病日にリハビリテーション病院へ転院した(Fig. 3).本例はステロイドパルスや血漿交換で疾患の進行抑制が困難で,NMOSDの急性期にrituximabを使用し,当院倫理委員会で承認された(承認番号第64-170番,承認日2023年7月21日).今後,初回投与から6か月後にrituximabを投与予定である.
Antibody titer and cerebrospinal fluid findings.
| Laboratory test | Day 1 | Day 15 | Day 22 | Day 25 | Day 29 | Day 32 | Day 38 | Day 45 | Day 64 | Day 93 |
|---|---|---|---|---|---|---|---|---|---|---|
| AQP4 antibody (U/ml) (serum) | >40 | 5.1 | 2.7 | 3.3 | 2 | <1.5 | <1.5 | <1.5 | ||
| SS-A antibody (U/ml) (serum) | 404.1 | 12.4 | 20.8 | 25.4 | 22.3 | 14 | 11.3 | |||
| IL-6 (pg/ml) (serum) | <1.5 | <1.5 | 7.7 | 6.1 | ||||||
| CSF cell (/μl) | 36 | 27 | 7 | 14 | 13 | |||||
| mononuclear leukocyte (/μl) | 35 | 26 | 7 | 14 | 13 | |||||
| polymorphonuclear leukocyte (/μl) | 1 | 1 | 0 | 0 | 0 | |||||
| protein (mg/dl) | 55 | 65 | 86 | 50 | 89 | |||||
| IgG index | 0.51 | 0.35 | 0.46 | 0.38 | 0.52 | |||||
| Oligoclonal bands | negative | negative | negative | negative | negative | |||||
| IL-6 (pg/ml) (CSF) | 5.1 | 6.7 | 20.1 | 10.9 |
AQP4; aquaporin-4, CSF; cerebrospinal fluid.
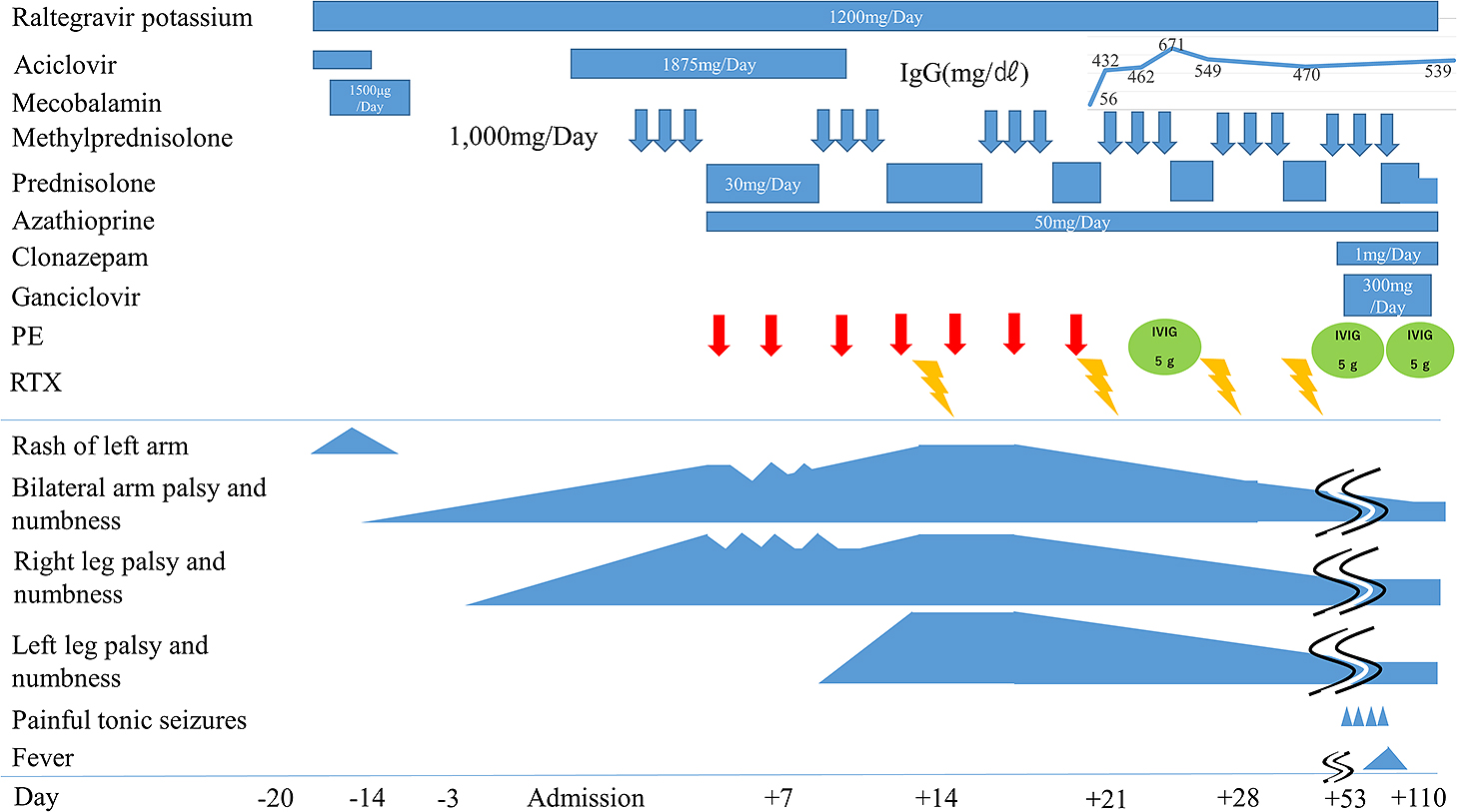
After rituximab therapy (375 mg/m2, four times at one week interval), the symptoms gradually improved. PE; plasma exchange, RTX; rituximab, IVIG; intravenous immunoglobulin.
本例はHIV感染症の治療開始6年後に四肢麻痺,感覚障害をきたし,MRI画像で頸髄に脊髄炎を認め,抗AQP4抗体陽性のNMOSD症例である.NMOSDでは先行感染が存在する.病原体は,帯状疱疹ウイルス,A型肝炎ウイルス,サイトメガロウイルス,EBV,HIV等の報告があるが5),不明な点が多い.
本例は今回の神経症状が出現する約1週間前に帯状疱疹が疑われる皮疹が左上肢に出現したが,当科受診時には皮疹は瘢痕のみであり,血液学的検査や髄液検査では帯状疱疹ウイルスの活動性は証明できず,帯状疱疹ウイルスによるものと断定できなかった.本例は背景にHIV感染症があり,免疫異常をきたす素因があった.HIV感染症は関節リウマチやSLE,サルコイドーシスなどの自己免疫疾患をきたすことがある6).HIV感染症の免疫抑制の程度は自己免疫疾患の発症に関与し,CD4陽性細胞数により4段階に分類される7).Stage IがHIV感染症の初期でCD4陽性細胞数が高値の時期(>500/μl),Stage IIはCD4陽性細胞数が減少する時期(200~499/μl),Stage IIIはCD4陽性細胞数が更に減少し,明らかな免疫不全の状態(<200/μl),Stage IVはHAARTが開始されCD4陽性細胞数が改善してくる状態(>500/μl)である7).CD4陽性細胞数が多いStage IとIVでは自己免疫疾患が出現する可能性がある8).本例はHAARTがなされ,CD4陽性細胞数が500/μl付近であり,Stage IVに相当し,自己免疫疾患が発症しやすい時期だったと考える(Fig. 4).HIV感染症にNMOSDを合併した報告は,本例を含め8例あり(Table 2)9)~14),その中で,HIV感染から数年経過し,HAARTが施行されていた5例を検討した10)11)14).年齢は32~58歳で,性別は男性3例,女性2例であった.HIV罹病期間は5~15年経過と長期であった.HIVウイルス量は検出限界以下から41,000 copies/mlと幅広く,CD4陽性細胞数は290~1,029/μlであった.血清抗AQP4抗体は5例中4例で陽性であった.脳脊髄液検査では5例中2例で髄液細胞数増多があり,オリゴクローナルバンドは検査がなされた4例中全例で陰性であった.臨床症状は視神経炎や脊髄炎で,一般的なNMOSDと変わりなかった.治療は,急性期にステロイドパルスや血液浄化療法がなされた例が大半であった.Rituximabを投与したのは2例であった.5例中2例は四肢麻痺や視力障害の重篤な後遺症を残し,3例は免疫加療に反応性を認めた.HIV罹病期間が長期に渡り,HAART療法が施行された例では,CD4陽性T細胞数が増加してくる時期にHIV感染後NMOSDが発生しやすい可能性が考えられた.
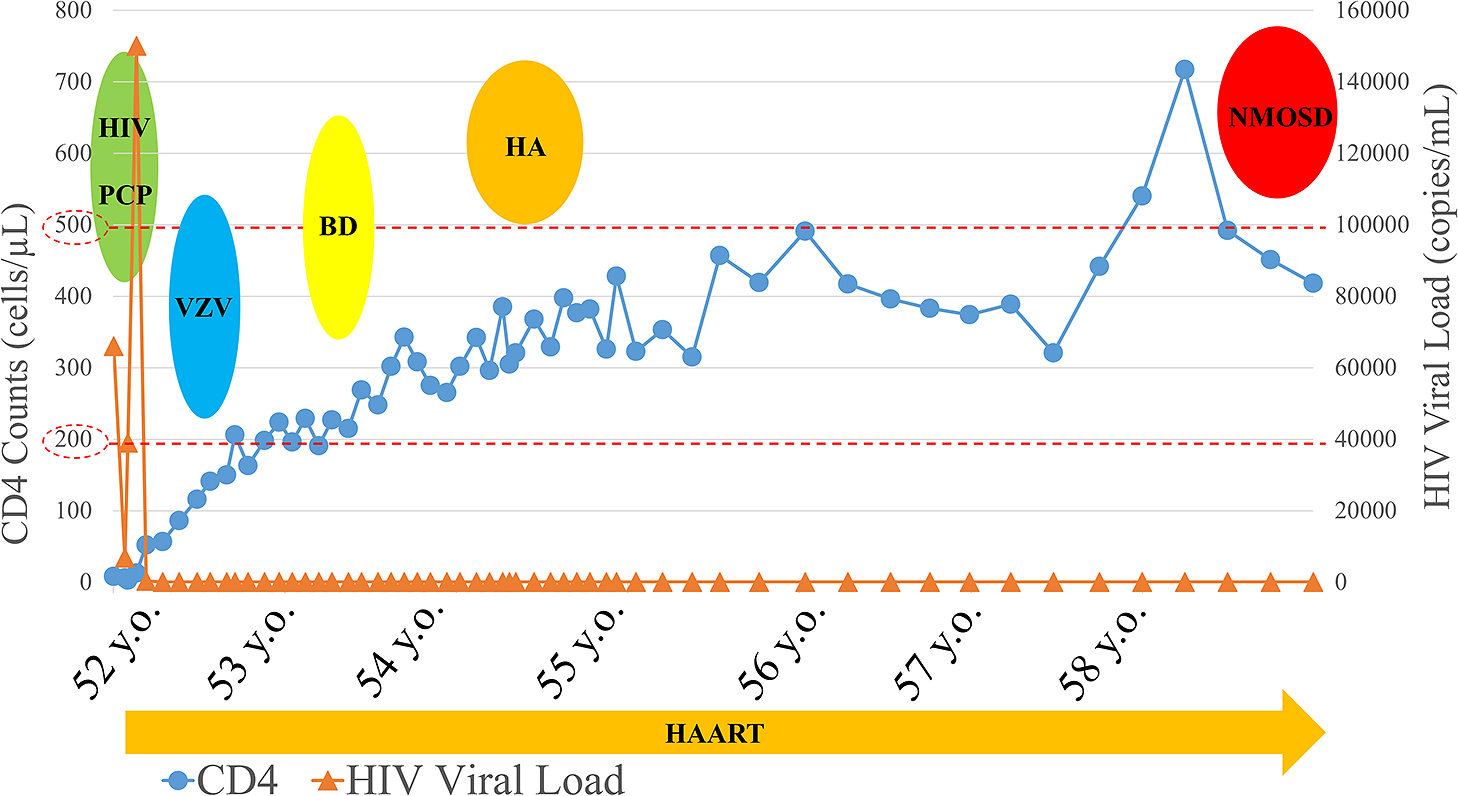
Six years after starting HAART, NMOSD developed as the CD4 cell count approached 500 cells/μl. y.o.; years old, PCP; pneumocystis pneumonia, VZV; varicella-zoster virus, BD; bacillary dysentery, HA; hepatitis A, NMOSD; neuromyelitis optica spectrum disorders, HAART; highly active antiretroviral therapy.
Clinical course of HIV infection-associated neuromyelitis optica spectrum disorder (NMOSD) cases from literature.
| Age | Sex | Duration of HIV | HAART | Viral Load (copies/ml) |
CD4 count (cells/μl) |
AQP4 antibody | CSF findings | Clinical features | Acute treatment | DMT | Response to treatment | Study |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 41 | F | 11 years | Not | 1,150 | 499 | Not done | Pleocytosis, OCB − | ON, Myelitis | MP | Steroids | Good | 9) |
| 46 | M | 12 years | On HAART | 41,000 | 1,029 | + | WBC normal, OCB − | Myelitis | None | Azathioprine | Good | 10) |
| 32 | M | 5 years | On HAART | <3,000 | >350 | − | WBC normal, OCB − | ON, Myelitis | MP, PE | Rituximab | No recovery | 11) |
| 49 | F | 15 years | On HAART | <3,000 | >350 | + | Pleocytosis, OCB − | ON, Myelitis | MP, PE | Mycophenolate Mofetil | No recovery | 11) |
| 45 | M | New | Not | 583,451 | 109 | − | Pleocytosis, OCB + | ON, Myelitis | MP | HAART | No recovery | 12) |
| 8 | M | New | Not | 430,000 | 1,134 | − | Pleocytosis | ON, Myelitis | MP, PE, IVIG | Rituximab and HAART | No recovery | 13) |
| 37 | F | 11 years | On HAART | <40 | 290 | + | Normal | ON, Myelitis | MP | Steroids | Good | 14) |
| 58 | M | 6 years | On HAART | <20 | 418 | + | Pleocytosis, OCB − | Myelitis | MP, PE | Rituximab | Paraplegia improved significantly | our case |
The table based on Reference No. 14. Reprinted from HIV infection associated neuromyelitis optica disorder: Clinical features, imaging findings, management and outcomes, Vol 27, Thomas Mathew, Multiple sclerosis and related disorders, 289–293, 2019, with permission from Elsevier. M; man, F; woman, HAART; highly active antiretroviral therapy, AQP4; aquaporin-4, CSF; cerebrospinal fluid, OCB; Oligoclonal bands, DMT; disease modifying therapy, ON; optic neuritis, MP; methylprednisolone pulse, PE; plasma exchange, IVIG; intravenous immunoglobulin.
HIV感染後NMOSDの病態は不明な点が多いが,HIV感染症によるT細胞制御障害のためにB細胞が活性化されるために発生すると考えられている14).HIV感染症におけるT細胞制御障害は多クローン性グロブリン血症の結果としてIL-6,IL-10といったサイトカインの増加を引き起こす11).IL-6は末梢血において抗AQP4抗体を産生するプラズマブラストの活性化や生存に重要な役割を担っており15),HIV感染によるサイトカイン増加などの免疫学的異常が抗AQP4抗体の出現に関与した可能性を考えた.一方で,HIV感染後NMOSDの病態としてHIVがアストロサイトへ感染し16),結果としてアストロサイトが障害されるという説もある11).本例ではHIV感染症治療中で,髄液中のウイルス量は検出感度以下で,免疫加療で症状の改善がみられたことから,HIVウイルスが直接脊髄感染をきたしている可能性は低いと考えた.HIV感染後でT細胞調節機能不全によるB細胞の過剰活性化が背景にあり,NMOSDに至ったと考えた.本例は急性期にrituximabを使用した.維持療法はステロイド,アザチオプリンの併用が有効とされており17),それらを使用しつつ,rituximab投与を予定した.Rituximabの治療効果については,rituximabはCD20蛋白に対するモノクローナル抗体製剤であり,末梢血やリンパ組織中,中枢神経内のB細胞を除去する18).本例はB細胞の過剰活性化が想定され,B細胞を除去することで,抗体産生を抑え,中枢神経内の自己免疫反応を抑制したと考えた.使用により抗AQP4抗体価の低下や疾患の進行抑制が可能であった点でrituximabは有効であったと考えた.本例はIgG低値やサイトメガロウイルス感染症を併発し,rituximab使用の際はIgG値の確認や感染症に注意が必要である.
HIV感染症に対してHAART開始6年後にNMOSDを発症した1例を経験した.HIV感染症治療中に脊髄炎をきたした場合は,NMOSDを鑑別に挙げ,難治例にはrituximabの使用も考慮すべきである.
謝辞:本症例に対し,血液浄化療法を行っていただいた同院腎臓内科 山森 文敬先生,牧石 祥平先生へ深謝致します.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.