2023 Volume 63 Issue 12 Pages 799-805
2023 Volume 63 Issue 12 Pages 799-805
生物学的相分離とは細胞内でタンパク質などの生体分子が液-液相分離する現象を示す.これまでに相分離性タンパク質の持つ低複雑性ドメインが相分離を駆動し,制御因子によって厳密に相分離が制御されることが分かっている.また,遺伝子異常が原因で相分離を破綻させる因子も見つかっている.以前から多くの神経筋疾患は原因タンパク質が異常な凝集体として蓄積することが知られていた.そして近年,神経筋疾患には相分離性のタンパク質が関わっており,それらの相分離制御に異常が起こることで凝集体を形成することが分かってきた.生物学的相分離はこれまで解明できなかった神経筋疾患の病態発症メカニズムを徐々に明らかにしつつある.
Biological phase separation refers to the liquid-liquid phase separation of biomolecules such as proteins in cells. Phase separation is driven by low-complexity domains of phase-separating proteins and strictly controlled by regulatory factors. Phase separation has also been found to be disrupted by genetic abnormalities. Abnormal aggregates of causative proteins accumulate in many neuromuscular diseases. In recent years, it has become clear that phase separating proteins are associated with neuromuscular diseases, and that abnormalities in the regulation of phase separation leads to the formation of aggregates. Gains in our knowledge of biological phase separation is gradually elucidating the pathogenesis of neuromuscular diseases.
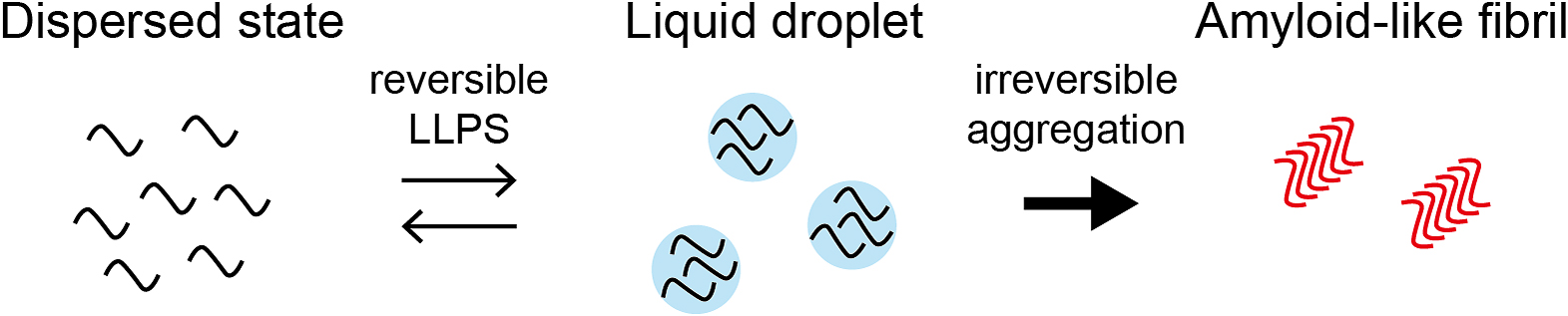
近年,液-液相分離と呼ばれる現象が注目を集め,盛んに研究されている.液-液相分離とは二つの液体が混ざり合わずに二相に分離する現象のことを指し,例えば,サラダドレッシングが水と油に分離する現象である.このように相分離現象は日常の色々な場面で見ることができる身近な現象であり,古くから物理学や化学の分野で研究が進められてきた.そして近年,この現象が細胞内でも起こっていることが分かり,さまざまな分野で盛んに研究されるようになってきた.細胞内で起こる相分離現象は古典的な物理化学分野における相分離と区別して生物学的相分離と呼ばれ,核酸やタンパク質などの生体分子が濃い相と薄い相の二相の液体に分離する現象である.この生物学的相分離という概念によって,これまで良く知られていたさまざまな生命現象が再解釈され,今まで説明できなかった生命現象を理解できるようになってきた.このように生物学的相分離はゲーム・チェンジャーとしてこれまでの常識や既成概念を覆し始めており,今後も多くの未解決課題への貢献が期待される.それには神経筋疾患も含まれており,これまで解明できなかった神経筋疾患の発症メカニズムが生物学的相分離の観点から,徐々に解明されつつある.近年,筋萎縮性側索硬化症(amyotrophic lateral sclerosis,以下ALSと略記)などの神経変性疾患には相分離性のタンパク質が関わっており,それらのタンパク質の液-液相分離の制御に異常が起こることでアミロイド様線維を形成することが分かってきた(Fig. 1).本稿では生物学的相分離の視点から神経筋疾患について解説する.
古くから細胞内では膜によって囲まれていないオルガネラ(非膜オルガネラ)の存在が知られていた.例えば,核内のカハール体や核小体,核スペックル,パラスペックルなど,細胞質に見られるストレス顆粒やプロセシング顆粒,生殖顆粒,神経顆粒などである.これらの非膜オルガネラは内部と外部を空間的に仕切る膜がないにもかかわらず,構造体として存在している.ところが,非膜オルガネラが構造体として,その存在を保てている理由は長年,謎のままであった.しかし近年,これら非膜オルガネラの構造基盤が核酸やタンパク質といった構成分子の液-液相分離によるものであるということが明らかになってきた1)2).
生物学的相分離が注目されるきっかけとなったのは,2009年のHymanらによる細胞内での相分離液滴の発見である3).さらに2012年にはMcKnightらとRosenらの二つのグループによって,天然に構造をとらない領域(天然変性領域)を持つタンパク質(天然変性タンパク質)が生物学的相分離に重要な役割を持つことが報告された4)5).それ以降,世界中のあらゆる分野で相分離による生命現象の解釈が行われるようになり,盛んに研究が進められている.これまでに細胞内の恒常性維持のさまざまな過程において,相分離の制御が重要な役割を担っているということが分かってきた6)~9).
タンパク質はアミノ酸配列によって決められた正しい構造に折りたたまれることで機能することが知られている.1990年代には構造生物学の台頭によって,タンパク質の立体構造が次々と明らかになり,タンパク質の構造から機能を説明できるようになっていった.その一方,転写因子の核酸認識部位などの天然変性領域の存在は以前から知られていたが10)~13),天然変性領域は構造解析が非常に困難なことからもそれほど脚光を浴びていなかった.しかし,1999年にWrightとDysonによって天然変性タンパク質の持つ生命活動に重要な機能が報告されたことで,天然変性タンパク質の重要性は再認識されるようになった14).これまでにヒトの全タンパク質の中で天然変性領域を持つタンパク質は30%以上も存在することが予測され15)~18),さまざまな疾患に関連するタンパク質には天然変性領域が多くみられることも明らかとなっている19).
これまでの研究から相分離性タンパク質は分子内に構造を持たない低複雑性(low-complexity,以下LCと略記)ドメインを持ち,このLCドメインが相分離を駆動することが分かってきた20)~24).LCドメインとは天然変性領域の中でもグリシン,セリン,グルタミン,チロシンなどの限られた数種類のアミノ酸が大部分を占める特徴的なドメインである.例えば,fused in sarcoma(FUS)は全長526残基のうち,残基番号2-214がLCドメインであるが,N末端の165残基はSYGQ-richドメインと呼ばれており,セリン,チロシン,グリシン,グルタミンが配列の8割を占めている(Fig. 2).ヒトの持つ全てのタンパク質の10%にLCドメインが含まれており25)26),その多くがRNAやDNA結合タンパク質である27).LCドメインを持つタンパク質として,FUSの他にTDP-43,hnRNP A1,hnRNP A2/B1,hnRNP DL,TIA-1などが知られている.これまでにLCドメインを持つ相分離性タンパク質の多くが神経筋疾患にかかわることが分かってきた(Table 1)28)~30).多くの神経筋疾患では原因となるタンパク質が異常な構造へ変化した凝集体の蓄積が見られることが知られている.アルツハイマー病ではアミロイドβやタウの蓄積が,ALSではTDP-43やSOD1の蓄積が見られる.また,遺伝性封入体ミオパチー(hereditary inclusion body myopathy)ではhnRNPA1やhnRNPA2などの蓄積が見られる.病原性アミロイド線維として知られるアミロイドβはその構造が非常に安定であるが31)32),アミロイド様線維であるLCドメインのcross-βポリマーは動的かつ可逆的な構造であることが分かってきた(Fig. 3)33)34).
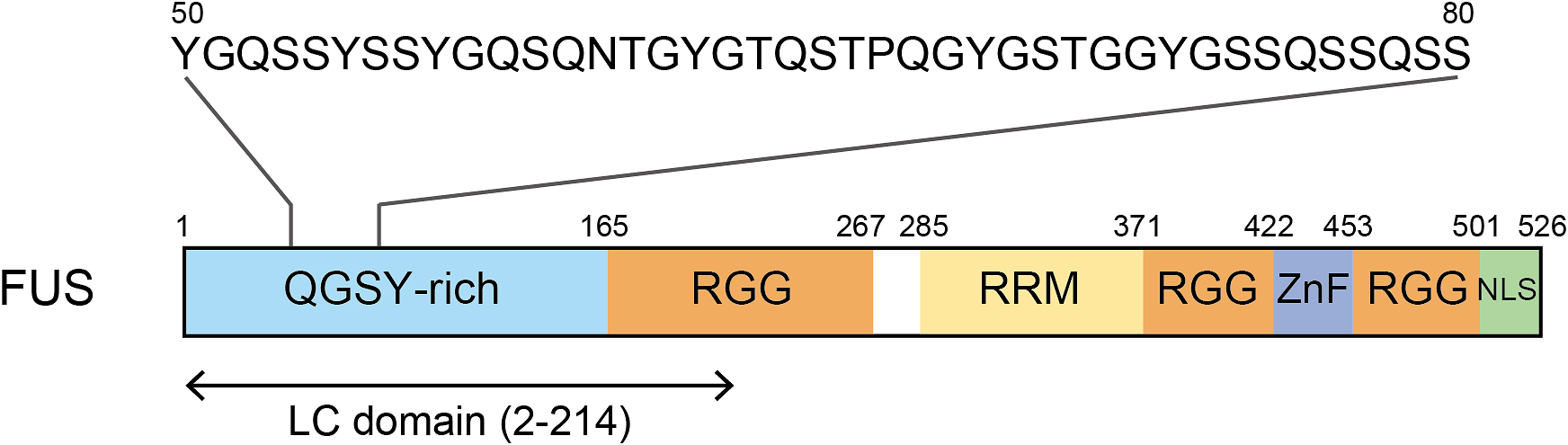
FUS has a low-complexity (LC) domain on the N-terminal side, residues 2 to 214. QGSY-rich: glutamine, glycine, serine, and tyrosine-rich, RGG: arginine-glycine-glycine (RGG) repeat, RRM: RNA recognition motif, ZnF: zinc finger domain, NLS: nuclear localization signal.
Human proteins with LC domain driving liquid-liquid phase separation.
| Protein name* | Gene symbol | UniProt ID** | Related diseases*** |
|---|---|---|---|
| FUS | FUS | P35637 | ALS/FTD |
| hnRNPA2/B1 | HNRNPA2B1 | P22626 | MSP |
| Matrin-3 | MATR3 | P43243 | ALS |
| p62 | SQSTM1 | Q13501 | PDB, FTD/ALS |
| Tau | MAPT | P10636 | FTD, PSP, PD, AD |
| TDP-43 | TARDBP | Q13148 | ALS/FTD |
| TIA1 | TIA1 | P31483 | WDM, ALS/FTD |
| UBQLN2 | UBQLN2 | Q9UHD9 | ALS/FTD |
FUS: fused in sarcoma, ALS: amyotrophic lateral sclerosis, FTD: frontotemporal dementia, MSP: multisystem proteinopathy, PDB: Paget’s disease of bone, PSP: progressive supranuclear palsy, PD: Parkinson disease, AD: Alzheimer disease, WDM: Welander distal myopathy. *PhaSePro (https://phasepro.elte.hu/). **UniProt (https://www.uniprot.org/). ***OMIM (https://www.omim.org/).
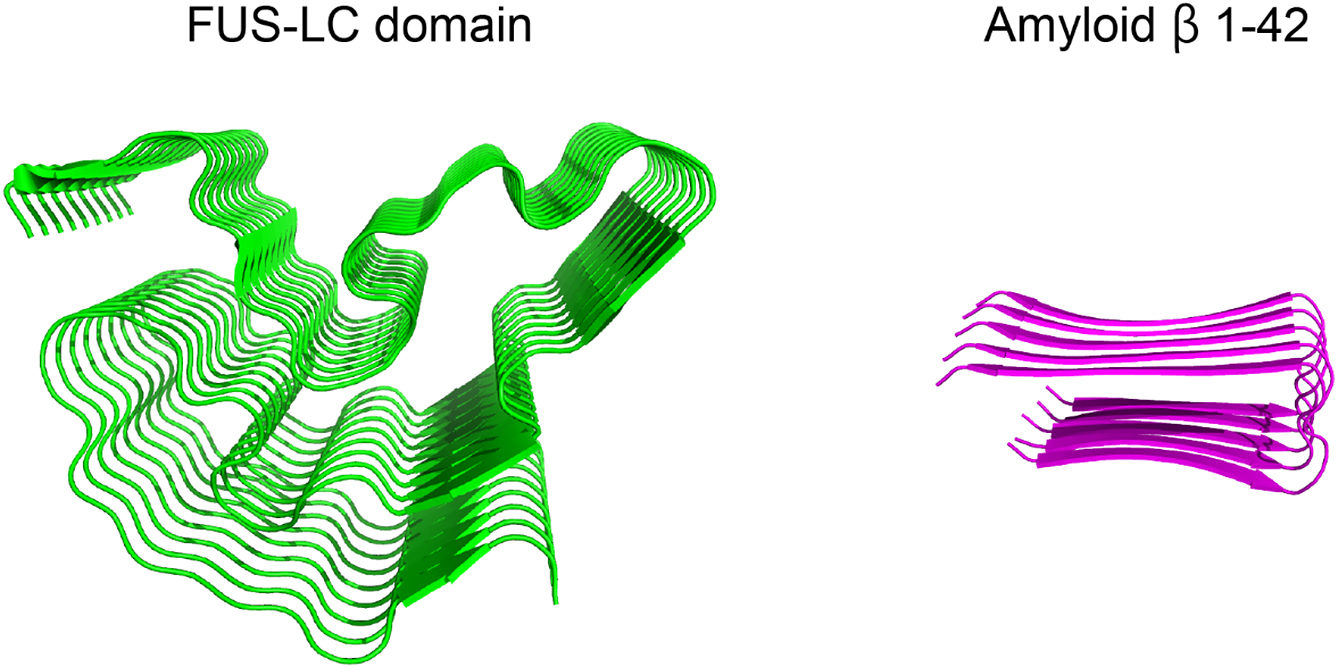
LC domain (2-214) of FUS (PDB ID: 5W3N, left panel) and amyloid β (1-42) (PDB ID: 2BEG, right panel) are shown as ribbon diagrams.
RNA結合タンパク質であるFUSは,最も良く知られた相分離性タンパク質の一つであり,液-液相分離研究におけるモデルタンパク質として盛んに研究が行われている.FUSは転写やスプライシング,DNA修復,軸索形成などのさまざまな場面で機能しており,その相分離性によって液滴中に関連分子を密に集めていると考えられている.FUSは家族性ALSの原因遺伝子として知られ35)36),日本ではSOD1に次いで頻度が高い37).近年の研究から,FUSの相分離異常が神経変性疾患と関係することが徐々に明らかとなってきた.
LCドメインを持つ相分離性タンパク質は液滴状態が続くと,アミロイド様線維であるcross-βポリマーを形成することが報告されている38).そのため,生体内には相分離性タンパク質の液-液相分離を厳密に制御する相分離制御因子が備わっている.相分離シャペロンと呼ばれる相分離制御因子は相分離性タンパク質の相分離やアミロイド様線維の形成を抑制する機能を持つ.相分離シャペロンは相分離制御因子として注目される前から,タンパク質のフォールディング制御因子である分子シャペロンとして知られていた.近年の生物学的相分離の観点から,その機能が再解釈された分子群である.核内輸送受容体であるKapβ2は相分離シャペロンとしての役割を持ち,FUSの液-液相分離を抑制することが分かっている39).Kapβ2はFUSの持つKapβ2特異的な核移行シグナル配列と強く結合すると同時に,FUSの別のさまざまな領域と弱く相互作用することでFUSの液-液相分離を抑制している.
また,相分離制御因子とは逆の働きをする相分離破綻因子の存在も明らかとなっている.プロリンとアルギニンの繰り返しペプチド(PRポリペプチド)やグリシンとアルギニンの繰り返しペプチド(GRポリペプチド)はC9orf72遺伝子由来の異常な繰り返し配列であり40),LCドメインを標的とする相分離破綻因子として知られている41)~43).C9orf72は世界で最も多い家族性ALSの原因遺伝子であり44)45),産生される5種類のポリペプチドの中でもアルギニンを持つPRポリペプチドとGRポリペプチドは強い細胞毒性を持つ.この原因として,PR/GRポリペプチドだけが持つ正電荷のアルギニンが考えられているが,明確な理由は分かっていない.交互に繰り返すアルギニン配列は負電荷を持つタンパク質と弱く多点的に相互作用できることから,PRポリペプチドを含む相分離の液滴に酸性モチーフを持つタンパク質が取り込まれるモデルが提案されている46).PR/GRポリペプチドは非膜オルガネラの構成因子や中間径フィラメントなどのさまざまなタンパク質と結合することから,細胞の構造変化や遺伝子発現の経路などの多様な機能障害が細胞毒性の原因と考えられている47).
最近,PRポリペプチドは相分離性タンパク質のLCドメインと結合することで相分離破綻させるだけでなく,相分離シャペロンと結合することでその相分離制御を破綻させることも分かってきた.PRポリペプチドは核内輸送受容体と結合することで,TDP-43との結合が抑制されることが知られている48)49).我々は核内輸送受容体の一つで相分離シャペロンでもあるKapβ2に対し,PRポリペプチドが与える毒性メカニズムの解明に成功した50).まず,液滴観察やヒドロゲル結合実験によってPRポリペプチドがKapβ2の相分離制御を阻害すること,プルダウン実験によって直接的にPRポリペプチドがKapβ2と結合することを明らかにした.さらにPRポリペプチドはKapβ2と1:1で結合し,その結合はFUSとの結合よりも強いことを突き止めた.これらの結果から,PRポリペプチドがKapβ2と直接的に結合することでKapβ2の相分離シャペロンとしての機能を阻害することが明らかとなった.また,核磁気共鳴法(NMR)によって,PRポリペプチドがKapβ2の核移行シグナル(nuclear localization signal,以下NLSと略記)結合部位を標的としていることを突き止めた.分子動力学法による構造予測とプルダウン実験を組み合わせて,PRポリペプチドとKapβ2との結合はFUS-NLSとKapβ2との結合と競合することを明らかにした.我々はこれらの知見から,相分離シャペロンであるKapβ2はFUSなどのNLSに結合して相分離を制御するが,PRポリペプチドがKapβ2のNLS結合部位を標的とすることでその相分離制御を破綻させることを提唱している(Fig. 4).
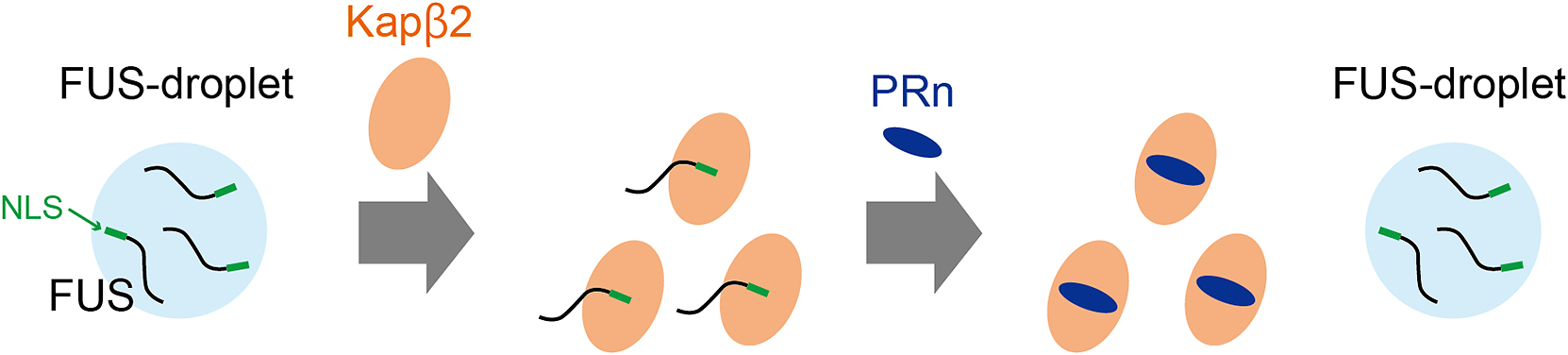
Binding of Kapβ2 to the nuclear localization signal (NLS) of FUS inhibits the phase separation of FUS. Binding of PR polypeptide (PRn) to Kapβ2 leads to the disruption of the regulation of phase separation and formation of FUS droplets.
FUSやTDP-43,hnRNPA2/B1などのLCドメインを持つRNA結合タンパク質の遺伝子異常がALSや前頭側頭型認知症(frontotemporal dementia,以下FTDと略記),ミオパチーの原因として知られている28)51).家族性ALSではFUSやTDP-43のLCドメインに遺伝子変異が集中しており52)53),LCドメインの変異による相分離の制御の破綻が病態発症につながることが示唆されている28).神経筋疾患に関係する変異がFUSやhnRNPA2などのLCドメインに入ることで,線維形成が促進されることから20)54)55),この相分離異常が神経筋疾患における共通の発症メカニズムとして注目されている.ここでは最近明らかになってきた最新の知見について幾つか紹介したい.
最近,半化学的な合成で主鎖のアミド結合の窒素原子をメチル化したLCドメインを用いて,LCドメインの相分離における主鎖の水素結合の重要性が検証された56).プロリン残基は主鎖のアミドプロトンを持たないため,この部分で水素結合をすることができない.しかし,他のアミノ酸へ変異することで主鎖に余分な水素結合が形成され,それがLCドメインの可逆的な平衡を壊して自己会合を促進する可能性が示唆された.さらにTDP-43や中間径フィラメントの構成タンパク質の一つであるニューロフィラメント軽鎖(NFL),タウ,hnRNPA2において疾患の原因となるプロリン残基の変異体の主鎖をメチル化することによって,変異によって形成されたアミノ酸主鎖の水素結合がなくなり,LCドメインの持つ本来の機能が回復することが分かっている.したがって,これがシャルコー・マリー・トゥース病,FTD,アルツハイマー病などに関係するプロリン残基の変異において,相分離が破綻するメカニズムと考えられる.
ALSの初期において,運動ニューロン(motor neuron,以下MNと略記)の長い軸索が損傷を受けることが知られている.最近の研究で,FUS変異のヒト誘導多能性幹細胞(human induced pluripotent stem cell,以下hiPSC略記)由来のMNの解析から,MNの軸索の異常な分岐が増加する新規フェノタイプが見つかっている.このhiPSCを用いた解析から,FUS変異体の軸索分岐の重要な調節因子がFos-Bであることが明らかとなった57).しかし,このFUSの変異は液-液相分離を駆動するLCドメインではないことから,このFUS変異が起因するALS発症メカニズムと相分離との関係性は不透明のままである.同様の試みはTDP-43でも行われている58).TDP-43変異(G376D)hiPSC由来のMNの解析から,TDP-43変異体におけるPHOX2Bの発現低下が明らかとなった.この発現減少がALSにおけるMNの選択的な変性メカニズムの一端を担うことが推測されている.ALSにおけるMNの損傷と相分離の関係については,今後の研究で明らかになることが期待される.
生物学的相分離が注目されて始めてから10~15年でさまざまな相分離研究が盛んに行われ,相分離メカニズムや神経筋疾患との関係が徐々に明らかとなってきた.遺伝子異常や相分離性タンパク質のミスフォールドによって相分離制御が破綻すると,異常な凝集体としてアミロイド様線維が蓄積していく.多くの神経筋疾患において,この異常な凝集体が細胞毒性を持つことで病態発症につながると考えられている.このように生物学的相分離はゲーム・チェンジャーとして,神経筋疾患の病態解明に大きく貢献しているが,まだその全容は解明できていない.新たに相分離性タンパク質だけではなく,その相分離の制御や破綻を担う因子も見つかっており,細胞内の相分離環境は非常に複雑である.このように生物学的相分離は神経筋疾患と密接に関わっており,相分離の制御が神経筋疾患の治療に向けた一つの鍵になることは間違いない.今後も相分離に関する新たな知見が次々と報告され,神経筋疾患の治療・予防につながることを期待する.
※本論文に関連し,開示すべきCOI状態にある企業・組織や団体
○開示すべきCOI状態がある者
森 英一朗:株主の利益:モルミル株式会社(創業者・代表取締役社長として総株式の約半数を保有),奨学(奨励)寄付などの総額:住友重機械工業株式会社,企業などが提供する寄付講座:V-iCliniX講座(中谷医工計測技術振興財団)
○開示すべきCOI状態がない者
五十棲 規嘉,杉江 和馬
本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.